哈蟆油蛋白酶解物氨基酸组成和安全性研究
2017-11-10魏星华张鹤庞博潘黛安齐滨白雪媛赵雨赵大庆
魏星华,张鹤,庞博,潘黛安,齐滨,白雪媛,赵雨,赵大庆,*
(1.吉林省科普服务中心,吉林长春130021;2.长春中医药大学附属医院实验中心,吉林长春130021;3.长春中医药大学中医药与生物工程研发中心,吉林长春130117)
哈蟆油蛋白酶解物氨基酸组成和安全性研究
魏星华1,张鹤2,3,*,庞博3,潘黛安3,齐滨3,白雪媛3,赵雨3,赵大庆3,*
(1.吉林省科普服务中心,吉林长春130021;2.长春中医药大学附属医院实验中心,吉林长春130021;3.长春中医药大学中医药与生物工程研发中心,吉林长春130117)
研究哈蟆油蛋白酶解物的氨基酸组成,通过急毒试验和30 d喂养试验对其安全性进行评价。采用柱前衍生化法测定哈蟆油蛋白酶解物中的氨基酸的相对含量;急性毒性试验以动物最大耐受剂量灌胃给药,观察急性毒性反应和死亡情况;30 d喂养试验按临床给药剂量的100倍、75倍、50倍灌胃给药,观察大鼠的一般行为情况、体质量、血液学指标、血清生化指标、各脏器重量及脏器比,检查大鼠各脏器病理组织。哈蟆油蛋白酶解物氨基酸组成的结果为必需氨基酸的相对含量高达45.87%,半必需氨基酸14.78%。急毒试验结果为哈蟆油蛋白酶解物以临床剂量的127倍灌胃给药,未发现毒性反应。30 d喂养试验结果,与对照组相比,哈蟆油蛋白酶解物各剂量组大鼠一般情况、体质量、血液学指标、血清生化指标、脏器重量及脏体比、病理组织学检查均无显著性差异。综上判定哈蟆油蛋白酶解物对大鼠的生长、发育、代谢及脏器无急性不良影响,并可为机体提供大量必需氨基酸。
哈蟆油蛋白酶解物;氨基酸;急毒试验;30 d喂养试验;安全性评价
哈蟆油(Oviductus Ranae)系蛙科动物中国林蛙雌蛙的输卵管,具有补肾益精,健脾益胃、滋阴补肾、润肺生津等功效[1-2]。哈蟆油含有多种生物活性物质,包括蛋白质、氨基酸、不饱和脂肪酸类、磷脂化合物、糖类、维生素 A、B、C、D,激素及多种微量元素[3],其中主要成分为蛋白质,占哈蟆油总重的50%以上[4]。人体摄食蛋白质或多肽可在机体内水解生成氨基酸,而必需氨基酸和半必需氨基酸是机体日常所需的重要成分。由于哈蟆油中蛋白质相对分子量较大、水溶性较差,因此不易被人体吸收利用,且腥味较重,不易被大多数人所接受。因此近年来很多学者采用蛋白酶酶解的方法降低哈蟆油蛋白的分子量[5-7],改善其口味,开发保健食品。目前,对于哈蟆油蛋白酶解物的毒性、不良反应报道较少。因此,笔者参照《保健食品检验与评价技术规范(2003版)》中急性毒性试验、30 d喂养试验的方法对哈蟆油蛋白酶解物进行毒理研究,作出安全性评价;同时对哈蟆油中的氨基酸组成进行分析,为保健品的开发提供试验依据。
1 材料与仪器
1.1 动物
SPF级ICR小鼠(20.0±2.0)g,SPF级 Wistar大鼠(70±10)g雌、雄兼用,由吉林大学基础医学院动物实验中心提供(SCXK-吉-2012-0001)。
1.2 试剂与仪器
哈蟆油:吉林省白山市北亚药业;17种氨基酸对照品(天冬氨酸Asp、谷氨酸Glu、丝氨酸Ser、甘氨酸 Gly、组氨酸His、苏氨酸Thr、精氨酸 Arg、丙氨酸Ala、脯氨酸 Pro、酪氨酸 Tyr、缬氨酸 Val、甲硫氨酸Met、异亮氨酸Ile、亮氨酸 Leu、苯丙氨酸Phe、赖氨酸Lys、色氨酸Try):中国药品生物制品检定所提供;胃蛋白酶(10 000 U/mg):Sigma Aldrich公司;胰蛋白酶(250 U/mg):北京鼎国生物技术有限责任公司;生化试剂盒:深圳迈瑞生物医疗电子股份有限公司;乙腈:Sigma Aldrich公司;异硫氰酸苯酯、正己烷:天津市光复精细化工研究所;其它为分析纯。
安捷伦1100高效液相色谱仪:美国Aglient公司;SYSMEX-XT1800i型全自动血液分析仪:日本希森美康医用电子有限公司;TBA-120FR型全自动生化分析仪:日本东芝公司;AB135-S电子天平(d=0.000 1 g)、pHS-25数显酸度计:梅特勒-托利多仪器有限公司;Sartorius-BL610电子天平(d=0.01 g):德国IKA有限公司;Wondasil-C18色谱柱(4.6 mm×150 mm,5 μm):岛津GL公司。
1.3 受试药物
哈蟆油蛋白酶解物制备,哈蟆油干粉按料液比1∶100(g/mL)加入pH4.50的柠檬酸,浸泡36 h后匀浆,水煎煮2 h,冷却,调pH至3.0±0.2,按酶与底物比1∶2 000(g/g)加入胃蛋白酶,37℃酶解2 h,酶解后样品煮沸15 min,灭酶活,调pH至10.0±0.2,按酶与底物比1 ∶100(g/g)加入碱性蛋白酶,55 ℃酶解 6 h,酶解后样品煮沸 15 min,灭酶活,调 pH7.0±0.2,0.22 μm 滤膜过滤,滤液冻干,此冻干粉为哈蟆油蛋白酶解物[8],哈蟆油蛋白酶解物的提取率为63%。
1.4 溶液配制
1.4.1 衍生试剂的配制
异硫氰酸苯酯乙腈溶液:异硫氰酸苯酯60 μL与乙腈 4 940 μL。
三乙胺乙腈溶液:三乙胺675 μL与乙腈4 325 μL混匀。
1.4.2 对照品溶液配制
精密称取 17 种氨基酸(Asp、Glu、Ser、Gly、His、Thr、Arg、Ala、Pro、Tyr、Val、Met、Ile、Leu、Phe、Lys、Try)对照品各10 mg,置50 mL容量瓶中,加0.1 mol/L盐酸溶液定容至刻度。
1.4.3 供试品溶液配制[9]
精密称取哈蟆油蛋白粉80 mg,置水解管中,加6 mol/L盐酸溶液15 mL,110℃烘箱中水解24 h,将水解物倒入蒸发皿中,用水充分洗涤,蒸干,残渣用水溶解,过滤,滤液定容至100 mL。
2 实验方法
2.1 哈蟆油蛋白酶解物的氨基酸组成分析
精密称取对照品(供试品)溶液0.5 mL,加异硫氰酸苯酯乙腈0.25 mL,加三乙胺乙腈溶液0.25 mL;室温放置1 h,加正己烷0.5 mL,充分混匀,放置10 min,取下层溶液,0.22 μm滤膜过滤,滤液注入高效液相色谱仪。记录色谱峰的保留时间(RT)和峰面积百分比(%),根据对照品确定样品中各氨基酸色谱峰的保留时间。
色谱条件,流动相A:乙腈;流动相B:水;流动相C:0.1 mol/L醋酸钠缓冲溶液(取醋酸钠39.78 g,加水至4 850 mL,用36%醋酸调至pH6.5)。柱温:35℃;检测波长:254 nm;进样量:20 μL。梯度洗脱程序见表1。
2.2 急性毒性试验
药物给药剂量采用最大耐受剂量法,药物的最大浓度为0.5 g/mL,给药量为20 g/(kg·BW)。取SPF级ICR小鼠,雌雄各20只,禁食(不禁水)16 h后随机分4组,每组10只,一日内灌胃给药两次,每隔6小时一次,空白对照组给予蒸馏水,连续观察14 d,记录小鼠有无改变躯体运动姿势、叫声、运动失调、流涎、流泪、流鼻涕、潮式呼吸、气胀、腹泻或便秘等异常情况和时间。如果动物有死亡,记录死亡数、死亡时间,对全部动物做大体解剖。

表1 梯度洗脱程序Table 1 Gradient elution program
2.3 30 d喂养试验
取SPF级Wistar大鼠,雌雄各40只随机分为4组,即对照组和高、中、低3个剂量组,给药剂量为临床剂量的100倍、75倍、50倍(哈蟆油蛋白酶解物给药量分别为15.75 g/(kg·BW),11.81 g/(kg·BW),7.87 g/(kg·BW),对照组给予等量的蒸馏水。各剂量组和对照组均按2.5 mL/(100 g·BW)灌胃,连续给药30 d。期间记录大鼠进食量、体质量,观察一般行为;禁食16 h后,于试验第31天称重,用1%戊巴比妥钠生理盐水溶液腹腔注射麻醉后,下腔静脉采血,检测血液学指标和血液生化指标,包括白细胞(white blood cell,WBC)、红细胞 (red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、谷丙转氨酶(alanine aminotransferase,ALT)、谷 草 转 氨 酶 (aspartate transaminase,AST)、尿素(Urea)、肌酐(creatinine,Cr)、血糖(blood glucose,Glu)、总蛋白(total protein,TP)、白蛋白(albumin,Alb)、胆固醇(total cholesterol,TC)、甘油三脂(triglyceride,TG)。各组大鼠解剖,取脏器,称量脏器重量和计算相对重量(脏/体比值)、进行组织病理检查(肝、肾、脾、胃、十二指肠、睾丸或卵巢)。
2.4 统计学方法
采用SPSS13.0统计软件进行单因素方差分析,试验结果表示为(±s),a=0.05作为检验标准。
3 结果与分析
3.1 哈蟆油蛋白酶解物的氨基酸组成分析结果
采用柱前衍生化测定哈蟆油蛋白酶解物中的氨基酸含量,结果见表2。

表2 哈蟆油蛋白酶解物的氨基酸组成分析Table 2 Analysis result of amino acid composition of ORPH
含量较高的前3种氨基酸Thr和Lys是必需氨基酸(总必需氨基酸的相对含量为45.87%),Arg是半必需氨基酸(总半必需氨基酸的相对含量为14.78%)。其中色氨酸在6 mol/L盐酸水解中结构被破坏未检出。结果表明摄食哈蟆油蛋白酶解物可为人体补充大量的必需氨基酸和半必需氨基酸。
3.2 急性毒性试验结果
试验期间各剂量组小鼠外观、行为、进食及大小便正常,解剖未发现病理组织,动物死亡数为0只(结果见表3。
表3 小鼠急性毒性试验结果(n=10,±s)Table 3 The results of acute toxicity test(n=10,±s)
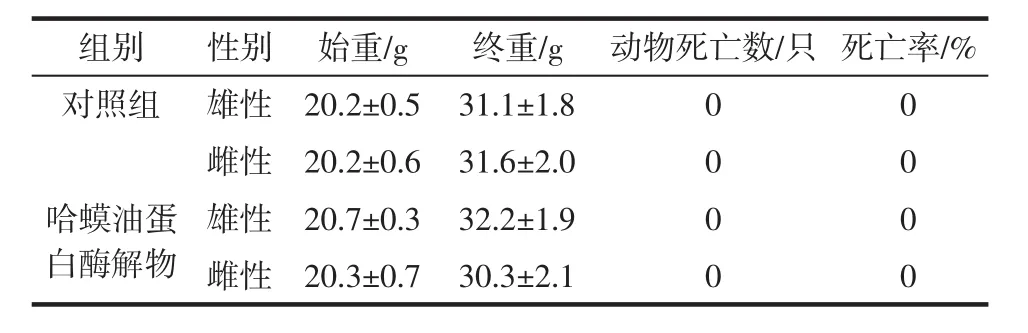
表3 小鼠急性毒性试验结果(n=10,±s)Table 3 The results of acute toxicity test(n=10,±s)
组别 性别 始重/g 终重/g 动物死亡数/只 死亡率/%对照组 雄性 20.2±0.5 31.1±1.8 0 0雌性 20.2±0.6 31.6±2.0 0 0哈蟆油蛋白酶解物雄性 20.7±0.3 32.2±1.9 0 0雌性 20.3±0.7 30.3±2.1 0 0
各组小鼠体质量均有增加,与对照组比较无显著性差异。以上结果表明小鼠急性经口LD50大于20 g/(kg·BW),因此判定哈蟆油蛋白酶解物属于无毒级。
3.3 30 d喂养试验结果
3.3.1 哈蟆油蛋白酶解物对大鼠一般情况及体质量的影响
哈蟆油蛋白酶解物对大鼠一般情况及体质量的影响,见表4。
表4 哈蟆油蛋白酶解物对大鼠体质量的影响(n=10,±s)Table 4 Effects of ORPH on body weight of rats(n=10,±s)

表4 哈蟆油蛋白酶解物对大鼠体质量的影响(n=10,±s)Table 4 Effects of ORPH on body weight of rats(n=10,±s)
第4周体质量/g对照组 雄性 74.2±2.2 142.1±7.1 185.3±8.2 237.0±14.8 268.5±13.7高剂量组 雄性 75.0±2.1 140.3±6.1 188.7±9.8 249.1±12.9 276.7±15.5中剂量组 雄性 74.8±2.5 139.2±7.5 187.1±8.9 244.8±12.5 270.4±14.2低剂量组 雄性 73.9±2.8 145.8±6.7 189.2±8.6 236.1±13.6 271.0±15.0对照组 雌性 72.5±1.9 125.5±4.9 158.8±8.3 199.5±10.2 223.9±11.4高剂量组 雌性 72.9±1.3 130.2±5.6 163.1±9.2 209.8±8.8 232.5±12.7中剂量组 雌性 73.0±1.8 133.9±3.3 159.2±7.9 208.4±11.5 230.1±12.6低剂量组 雌性 72.8±1.8 129.8±6.8 161.8±9.8 201.2±9.4 231.6±13.0组别 性别 初始质量/g第1周体质量/g第2周体质量/g第3周体质量/g
给药期间各剂量组大鼠均无死亡,动物毛发光泽,黏膜红润,活动自如,进食、大小便未见异常,发育良好,体质量正常增长,与对照组比较,组间体质量无统计学差异(p>0.05),且无剂量反应关系。
3.3.2 哈蟆油蛋白酶解物对大鼠血常规指标的影响
哈蟆油蛋白酶解物对大鼠血常规指标的影响见表5。
表5 哈蟆油蛋白酶解物对大鼠血常规指标的影响(n=10,±s)Table 5 Effects of ORPH on routine blood indexes of rats(n=10,±s)

表5 哈蟆油蛋白酶解物对大鼠血常规指标的影响(n=10,±s)Table 5 Effects of ORPH on routine blood indexes of rats(n=10,±s)
组别性别WBC/(109/L)RBC/(1012/L)HGB/(g/L)对照组 雄性 5.66±1.37 7.56±1.65 141.54±6.51高剂量组 雄性 5.68±1.41 7.37±1.63 142.79±5.60中剂量组 雄性 5.74±1.31 7.73±1.90 140.47±4.84低剂量组 雄性 5.88±1.20 7.64±1.49 142.36±5.81对照组 雌性 6.17±1.85 7.23±1.18 139.98±6.59高剂量组 雌性 6.21±1.38 6.91±1.23 140.17±6.07中剂量组 雌性 6.14±1.90 6.90±1.30 134.86±6.98低剂量组 雌性 6.19±1.75 7.23±1.09 136.54±7.14
表5结果显示,各剂量组大鼠血液中白细胞(WBC)、红细胞(RBC)和血红蛋白(HGB)与对照组比较,均未见明显差异(p>0.05)。由此得出,哈蟆油蛋白酶解物未造成大鼠血液中各指标的异常改变,且无剂量反应关系。
3.3.3 哈蟆油蛋白酶解物对大鼠血清生化指标的影响
哈蟆油蛋白酶解物对大鼠血清生化指标的影响见表6。
表6 哈蟆油蛋白酶解物对大鼠血清生化指标的影响(n=10,±s)Table 6 Effects of ORPH on serum biochemical markers of rats(n=10,±s)

表6 哈蟆油蛋白酶解物对大鼠血清生化指标的影响(n=10,±s)Table 6 Effects of ORPH on serum biochemical markers of rats(n=10,±s)
TG/(mmol/.L)对照组 雄性 28.8±3.2 88.9±9.8 5.37±0.63 54.2±4.1 5.78±0.72 56.6±3.7 32.7±1.3 1.83±0.11 0.61±0.08高剂量组 雄性 27.9±3.7 89.1±8.9 5.19±0.51 54.3±5.4 6.02±0.75 56.8±3.4 31.6±1.0 1.85±0.19 0.63±0.11中剂量组 雄性 25.7±3.1 86.3±7.6 5.32±0.49 55.1±3.8 5.96±0.60 57.3±3.9 32.1±1.4 1.88±0.22 0.60±0.10低剂量组 雄性 28.9±2.6 89.4±10.5 5.43±0.58 54.8±4.3 6.17±0.66 57.1±4.1 32.5±1.2 1.80±0.25 0.65±0.09对照组 雌性 27.8±3.9 86.8±10.6 5.32±0.71 53.9±4.5 5.67±0.73 55.3±2.7 32.5±1.5 1.79±0.14 0.54±0.08高剂量组 雌性 27.3±3.7 90.5±8.5 5.37±0.62 54.1±3.4 5.43±0.85 54.1±2.9 31.9±1.2 1.82±0.17 0.49±0.10中剂量组 雌性 25.2±4.8 87.2±9.5 5.50±0.59 53.1±2.9 5.95±0.87 55.9±2.3 32.0±1.5 1.71±0.15 0.51±0.10低剂量组 雌性 26.4±3.4 90.0±9.9 5.25±0.78 53.7±4.0 5.85±0.76 53.8±4.1 33.3±2.2 1.76±0.10 0.55±0.09组别性别ALT/(U/L)AST/(U/L)BUN/(mmol/L)Cr/(μmol/L)(mmol./L)TP/(g/L)Alb/(g/L)TC/(mmol/L)Glu/
表6结果显示,各剂量组大鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(Cr)、血糖(Glu)、总蛋白(TP)、白蛋白(Alb)、胆固醇(TC)、甘油三脂(TG)与对照组比较差异无显著性(p>0.05)。由此得出,哈蟆油蛋白酶解物对大鼠血清生化指标无影响,且无剂量反应关系。
3.3.4 哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响
哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响见表7。
表7 哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响(n=10,±s)Table 7 Effects of ORPH on organ weight and organ/body weight ratio of rats(n=10,±s)

表7 哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响(n=10,±s)Table 7 Effects of ORPH on organ weight and organ/body weight ratio of rats(n=10,±s)
组别 性别 肝重量/g 肝体比/% 脾重量/g 脾体比/% 肾重量/g 肾体比/% 睾丸(卵巢)重量/g 睾丸(卵巢)体比/%对照组 雄性 9.20±0.37 3.56±0.13 0.69±0.06 0.27±0.05 2.19±0.12 0.85±0.07 2.85±0.33 1.10±0.14高剂量组 雄性 8.91±0.79 3.58±0.14 0.66±0.05 0.26±0.04 2.11±0.16 0.85±0.03 2.69±0.21 1.08±0.11中剂量组 雄性 9.14±0.51 3.63±0.10 0.65±0.05 0.26±0.03 2.17±0.12 0.86±0.06 2.72±0.23 1.08±0.15低剂量组 雄性 9.04±0.42 3.58±0.18 0.68±0.08 0.27±0.05 2.07±0.11 0.82±0.08 2.78±0.30 1.10±0.12
续表7 哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响(n=10,±s)Continue table 7 Effects of ORPH on organ weight and organ/body weight ratio of rats(n=10,±s)
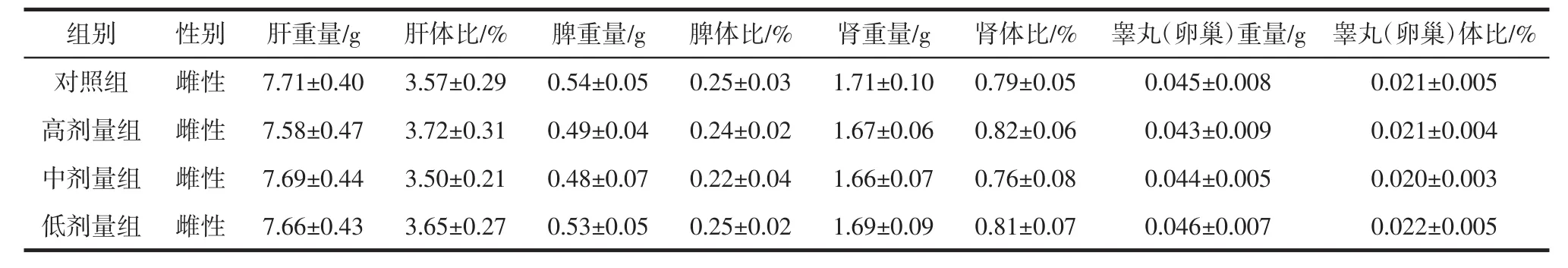
续表7 哈蟆油蛋白酶解物对大鼠脏器重量及脏体比的影响(n=10,±s)Continue table 7 Effects of ORPH on organ weight and organ/body weight ratio of rats(n=10,±s)
组别 性别 肝重量/g 肝体比/% 脾重量/g 脾体比/% 肾重量/g 肾体比/% 睾丸(卵巢)重量/g 睾丸(卵巢)体比/%对照组 雌性 7.71±0.40 3.57±0.29 0.54±0.05 0.25±0.03 1.71±0.10 0.79±0.05 0.045±0.008 0.021±0.005高剂量组 雌性 7.58±0.47 3.72±0.31 0.49±0.04 0.24±0.02 1.67±0.06 0.82±0.06 0.043±0.009 0.021±0.004中剂量组 雌性 7.69±0.44 3.50±0.21 0.48±0.07 0.22±0.04 1.66±0.07 0.76±0.08 0.044±0.005 0.020±0.003低剂量组 雌性 7.66±0.43 3.65±0.27 0.53±0.05 0.25±0.02 1.69±0.09 0.81±0.07 0.046±0.007 0.022±0.005
表7结果显示,各剂量组大鼠肝重量、脾重量、肾重量、睾丸(卵巢)重量与对照组比较差异无显著性(p>0.05);各剂量组肝/体比、脾/体比、肾/体比、睾丸(卵巢)/体比与对照组差异无显著性(p>0.05)。以上结果表明哈蟆油蛋白酶解物对大鼠各脏器均未见异常影响。
3.3.5 哈蟆油蛋白酶解物对大鼠肝、肾、脾、胃等组织病理学的影响
解剖观察各组实验动物脏器,各剂量组与对照组大鼠的肝、肾、脾、胃、十二指肠、性腺(睾丸或卵巢)经病理学检查均未见与受试物相关的病理改变。高剂量组大鼠肝、肾试验数据结果见表8、表9,(中低剂量组结果略,脾脏、胃、十二指肠、睾丸、卵巢病理学检查结果略)。

表8 哈蟆油蛋白酶解物对大鼠肝脏的影响Table 8 Effects of ORPH on liver tissue of rats
表8结果显示,肝脏镜下观察:对照组雌性2例,雄性1例,高剂量组雌性2例,雄性2例可见肝小叶炎细胞浸润;对照组雌性2例,雄性1例,高剂量组雌性1例,雄性2例可见汇管区炎细胞浸润;其余被膜完整,未见增厚。肝细胞未见脂肪变性、出血和坏死改变。汇管区三管无明显异常病理改变。以上结果表明高剂量组肝脏组织与对照组相比差异无显著性(p>0.05)。
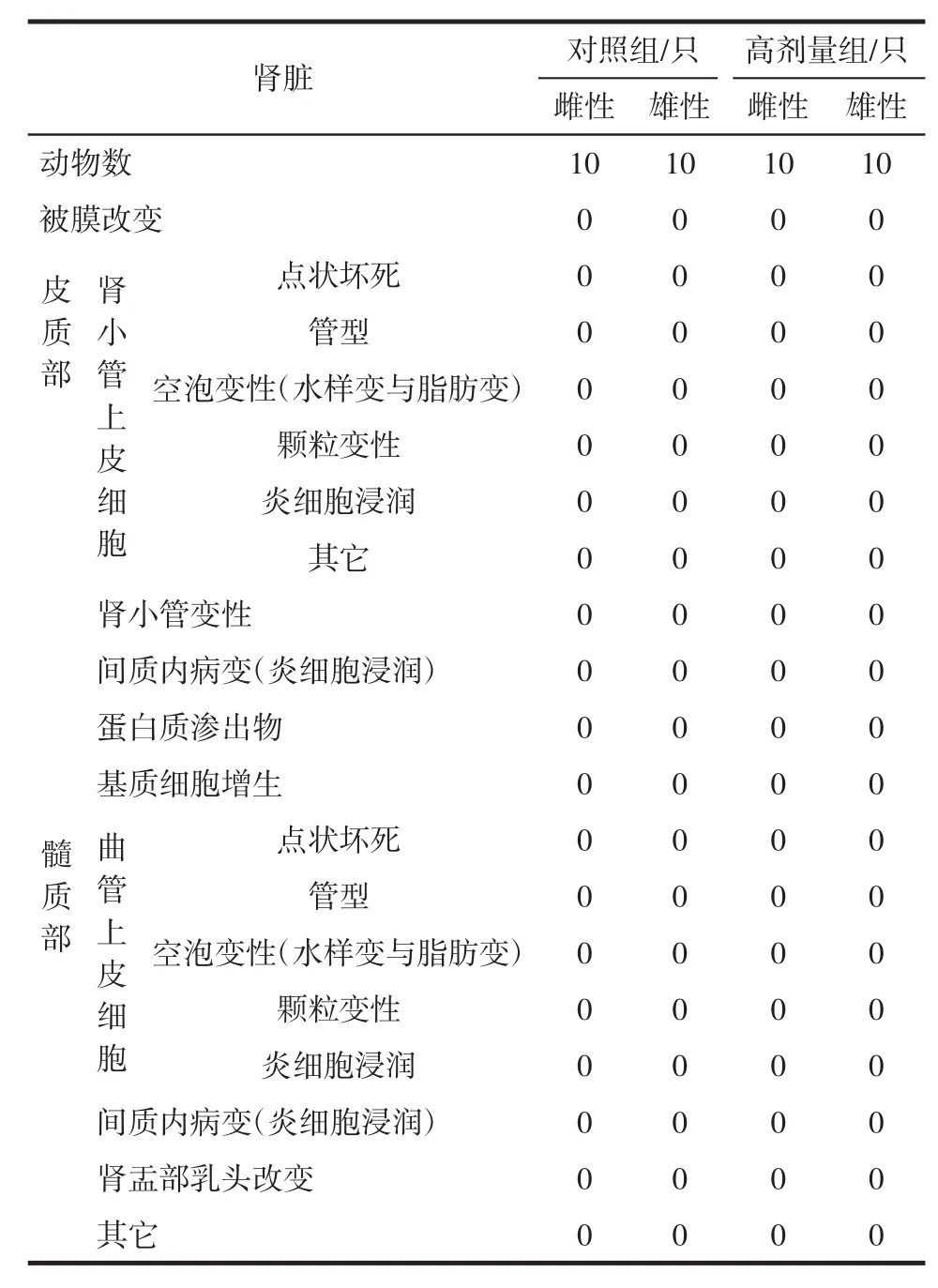
表9 哈蟆油蛋白酶解物对大鼠肾脏组织的影响Table 9 Effects of ORPH on kidney of rats
表9结果显示,肾脏镜下观察:肾小球未见明显增大或萎缩、纤维化、变性等,毛细血管袢未见坏死,肾小球毛细血管未见扩张充血、管壁未见增厚。小管上皮完好,间质无炎细胞浸润。以上结果表明高剂量组大鼠肾脏与对照组相比无显著性差异(p>0.05)。
4 讨论
《中国药典》中哈蟆油具有补肾益精,养阴润肺的功效,用于病后体弱,神疲乏力,心悸失眠,盗汗,痨嗽咳血等症。规定内服用量为5 g~15 g,用水浸泡、炖服或作丸剂服。哈蟆油中主要成分为蛋白质,含量占50%以上,在机体内,蛋白质多数被水解成氨基酸作为合成蛋白质的重要原料,同时作为活性物质参与机体的代谢,以维持机体正常的生理功能。而必需氨基酸是机体本身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸。本实验采用柱前衍生化的方法检测哈蟆油蛋白酶解物中氨基酸含量,结果其含有必需氨基酸7种,包括赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸,相对含量占到45.87%,其中苏氨酸为16.48%,赖氨酸11.38%;半必需氨基酸共2种,为组氨酸和精氨酸,含量分别为0.52%和14.26%。苏氨酸可防止肝脏中脂肪的累积,促进抗体的产生,增强免疫系统等作用。赖氨酸可增加食欲,促进胃蛋白酶的分泌,增强免疫能力,改善发育迟缓,防止蛀牙,提高钙的吸收,促进骨骼生长,对儿童发育,增加体重和身高具有明显作用[10-11]。精氨酸具有重要的生理、代谢和营养作用,几乎机体中所有组织均利用精氨酸合成胞浆蛋白和核蛋白,精氨酸在促进肌肉蛋白质合成、增强机体的免疫力等作用[12-13]。现代药理学研究表明哈蟆油蛋白酶解物具有抗疲劳[14]、抗氧化[15]、耐缺氧[16]、增强免疫力[17]等功效。因此摄食哈蟆油蛋白酶解物,补充体内的必需氨基酸具有重要意义。
在急性毒性实验中,前期预实验中给予小鼠最大剂量灌胃,死亡0例,故无法测出该制剂的LD50。因此本试验采用最大耐受剂量法进行试验,灌胃给予受试药物20 g/(kg·BW),1 d内给药2次,连续给药14 d。根据实验结果得到,最大给药剂量20 g/(kg·BW)为人日服剂量的127倍,在此剂量下哈蟆油蛋白酶解物对小鼠无急性毒性反应,提示临床用药安全。
在30 d喂养试验中,哈蟆油蛋白酶解物给药量分别为15.75、11.81、7.87 g/(kg·BW),分别为人日服剂量的100倍、75倍和50倍。实验结果显示,与对照组比较,各剂量组大鼠外观体征、行为无异常变化,大鼠体质量、血液学指标、血液生化学指标、脏器重量、脏/体比、脏器组织病理检查均未见异常。以上结果表明,在本实验剂量范围内,哈蟆油蛋白酶解物对受试动物是安全、无毒副作用。
[1] 万德光,吴家荣.药用动物学[M].上海:上海科技出版社,1993
[2] 吴庆平,吴英俊,吴景时.哈士蟆油药理作用实验研究[J].中国林副特产,2005(4):25-26
[3] 胡鑫,刘成柏,陈晓平,等.林蛙油中主要营养保健成分含量的研究[J].吉林农业大学学报,2003(2):218-220
[4] 袁文彬,李宜平,王淑敏.林蛙油不同干燥处理方法蛋白质含量测定[J].吉林中医药,2011(2):163-164
[5] 周光新,张鹤,董颖,等.胰蛋白酶酶解法制备蛤蟆油蛋白工艺的研究[J].食品科技,2013,38(10):236-240
[6]吴恒杰.正交试验法优选哈蟆油酶解制剂工艺[J].黑龙江医药,2009,22(3):321-323
[7] 李秋萌,董颖,张鹤,等.双酶法制备哈蟆油蛋白多肽的研究[J].食品工业,2014,35(6):165-168
[8] 董颖,张鹤,周光新,等.正交试验优化哈蟆油蛋白双酶法水解工艺[J].食品科学,2014,35(6):36-39
[9] 姜雯,王棘.柱前衍生化-反相高效液相色谱法测定蛋白粉中氨基酸的含量[J].中国卫生检验杂志,2008,18(2):280-282
[10]周俊,宋代军.赖氨酸营养研究进展[J].饲料工业,2006,27(8):48-50
[11]赵春蓉.赖氨酸对幼建鲤消化能力和免疫功能的影响[D].雅安:四川农业大学,2005
[12]吴信,印遇龙,伍国耀.功能性氨基酸——精氨酸和精氨酸生素在猪生产中的研究与应用进展[J].饲料与畜牧:新饲料,2009(8):8-11
[13]孙红暖,杨海明,王志跃,等.精氨酸对动物的营养生理及免疫作用[J].动物营养学报,2014,26(1):54-62
[14]张梅,赵雨,李芸彤,等.哈蟆油非水溶性成分酶解物的抗疲劳作用[J].辽宁中医杂志,2011,38(9):1891-1892
[15]瞿新明,李芸彤,张惠,等.哈蟆油非水溶性成分及其酶解物的抗氧化功效研究[J].食品科技,2012,37(10):211-213
[16]张梅,赵雨,杨士慧,等.哈蟆油酶解前后耐缺氧活性比较研究[J].江苏中医药,2011,43(6):87-88
[17]Huang D,Yang L,Wang C,et al.Immunostimulatory Activity of Protein Hydrolysate from Oviductus Ranae on Macrophage In Vitro[J].Evidence-Based Complementary and Alternative Medicine,2014,2014:180234
Study on Amino Acid Composition and Safety Evaluation of Protein Hydrolysate of Oviductus Ranae
WEI Xing-hua1,ZHANG He2,3,*,PANG Bo3,PAN Dai-an3,QI Bin3,BAI Xue-yuan3,ZHAO Yu3,ZHAO Da-qing3,*
(1.Jilin Science Service Center,Changchun 130021,Jilin,China;2.Experiment Center,The Affiliated Hospital to Changchun University of Chinese Medicine,Changchun 130021,Jilin,China;3.Development Center of Traditional Chinese Medicine and Bioengineering,Changchun University of Chinese Medicine,Changchun 130117,Jilin,China)
To study amino acid composition of protein hydrolysate of Oviductus Ranae (ORPH),to make a safety evaluation according to the acute toxicity and 30-days feeding test.RP-HPLC coupling with precolumn derivatization for determination of amino acid of ORPH.Acute oxicity test of ORPH was carried out by giving mice maximum tolerance dose,to observed the toxic reactions and mortality rate.In the 30-days feeding tset of ORPH,the high,middle,and low dose group was 100 times,75 times,and 50 times of the clinical dosage in human,respectively,then to observed the general behaviors,body weight,blood routine indiexes,serum biochemical indexes,organ weight,organ coefficient and tissue pathological change of mice.The results of amino acid composition showed that content of total essential amino acids accounted for 45.87%,content of total semi-essential amino acid accounted for 14.78%.The results of acute toxicity test showed the ORPH did not have toxicity,when the maximum dosage was 127 times of the clinical dosage in humans.Compared with control group,the 30-days feeding test showed that all detected indexes were no significant difference in each does group.In conclusion,ORPH has no acute toxic effect and is a safe function food on mice's growth,development,metabolism and viscera organs,meanwhile ORPH provides plenty of essential amino acids for organism.
protein hydrolysate of Oviductus Ranae (ORPH);amino acid;acute toxicity test;30-daysfeeding test;safety evaluation
10.3969/j.issn.1005-6521.2017.22.003
国家自然科学基金青年科学基金项目(81503243);吉林省科技发展计划项目(20140204065YY、20150311031YY)
魏星华(1983—),男(汉),工程师,硕士,主要从事食品安全研究。
*通信作者:张鹤(1985—),女(汉),助理研究员,博士,主要从事中药有效成分研究;赵大庆(1963—),男(汉),研究员,博士,主要从事中药有效成分研究。
2017-03-28
