天冬氨酸氨基转移酶血小板比值可作为肝癌经肝动脉化疗栓塞术后的预后指标
2017-11-10苏子剑张剑华潘群雄王聪仁费洪江
苏子剑, 张剑华, 潘群雄, 王聪仁, 费洪江
天冬氨酸氨基转移酶血小板比值可作为肝癌经肝动脉化疗栓塞术后的预后指标
苏子剑, 张剑华, 潘群雄, 王聪仁, 费洪江
目的探讨天冬氨酸氨基转移酶血小板比值指数(APRI)与行经肝动脉化疗栓塞(TACE)治疗的肝癌患者的预后关系。方法回顾性分析388例肝癌患者的临床资料,根据TACE术前外周血APRI水平分为低APRI组(APRI<1.30,237例)和高APRI组(APRI≥1.30,151例),比较2组患者的1年及3年生存率。结果高APRI组的1年及3年生存率分别为25.5%和2.6%,低APRI组为71.2%和30.0%,2组间差别有统计学意义(P<0.001)。术前白蛋白及天冬氨酸氨基转移酶(AST)的水平、Child-Pugh分级、肿瘤大小、脉管癌栓、APRI、TACE次数是肝癌患者术后总生存时间的独立预后因素。经ROC曲线分析比较显示,APRI较其他临床预后因素有更大的ROC曲线下面积。结论APRI可作为判断行TACE治疗的肝癌患者预后有价值的指标。
肝肿瘤; 天冬氨酸氨基转移酶类; 血小板; 化学栓塞,治疗性
原发性肝癌是临床上发病率及死亡率较高的恶性肿瘤之一,>80%的原发性肝癌为原发性肝细胞癌(hepatocellular carcinoma, HCC)[1]。目前,我国肝癌患者约占全球的一半以上,在恶性肿瘤相关死亡中位居第2。手术是肝癌最有效的治疗方法,但肝癌的早期临床症状较隐匿,多数患者就诊时已是中晚期。这些患者常常由于慢性乙型肝炎背景、合并血管侵犯和肝内播散等特点而失去根治性手术的机会[2-3]。临床上,对于无法手术切除的HCC患者,首选的治疗方法是经肝动脉化疗栓塞(transarterial chemoembolization, TACE)。研究证明,TACE能有效改善中晚期HCC患者的生存期[4-5]。既往研究显示,术前甲胎蛋白(alpha-fetoprotein, AFP)水平、肿瘤大小及数量、肿瘤侵犯血管、是否伴腹水等因素均是影响HCC患者TACE治疗后生存预后的重要因素,但这些因素对预后的预测效果并不理想[6-7]。
研究显示,肝硬化不仅可促进肝癌的发生发展,并且与肝癌的预后密切相关[8-10]。天冬氨酸氨基转移酶血小板比值指数(aspartate transaminase and platelet ratio index, APRI)作为临床上广泛应用的非侵入性肝硬化诊断指标,在肝癌的相关研究中逐渐受到重视。研究显示,APRI与肝癌介入治疗后肝功能恶化、根治术后并发症及远期生存率相关[11-13]。本研究拟回顾性分析388例行TACE的肝癌患者的临床资料,探讨APRI在行TACE治疗的肝癌患者中的预后价值,现报道如下。
1 对象与方法
1.1对象 选择2010年1月-2015年12月因无法手术切除而接受TACE治疗且随访资料完整的肝癌患者共388例,男性336例,女性52例;年龄中位数53岁(51.54±12.76)岁。Child-Pugh分级A级326例,B级62例,无C级患者;乙肝抗原阳性346例,阴性42例。患者术后1,2,3年的总体生存率分别为54.4%,30.9%及15.9%,中位生存时间14月(0~49月)。所有患者术前均行血常规、肝肾功能、凝血功能、乙肝-DNA、AFP及腹部B超、CT或MRI(明确肿瘤数目、最大直径、是否侵犯血管)等检查。患者的临床基本资料见表1。本研究经医院伦理委员会批准,患者均知情同意。
1.2纳入及排除标准 纳入标准:(1)根据临床表现、AFP水平及腹部影像学检查(B超、CT或MRI)确诊为HCC,且无法行手术切除;(2)排除TACE治疗禁忌证并签署治疗同意书;(3)术前临床资料完整。排除标准:术前伴有远处转移;TACE前行手术、化疗、放疗及消融治疗;术前发现急性炎症或类风湿性关节炎等疾病;存在绝对手术禁忌证,如凝血功能障碍、肝功能评分Child-Pugh C级;伴有呼吸衰竭、心力衰竭、肾功能衰竭等其他严重疾病,有肝癌介入治疗禁忌证的患者。
1.3TACE治疗 采用Seldinger技术穿刺股动脉,导管选择至肝固有动脉进行造影,观察肿瘤大小、密度、供血、有无肝动脉-肝静脉瘘等。使用微导管超选肿瘤的直接供血动脉,使用碘油(10~30 mg)、洛铂(25~50 mg)及吡柔比星(20~50 mg)混合而成的乳化液栓塞肿瘤动脉。化疗药和碘油的量根据肿瘤直径、血供和肝功能进行调整。对于未达完全栓塞者加用明胶海绵颗粒。术后予保肝、止吐、抑酸、支持等治疗。根据肝功能及肿瘤的大小、位置、供血情况等,每间隔4~6周重复TACE治疗。

表1 肝癌患者的临床基本资料
AFP:甲胎蛋白;ALT:谷氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;TACE:经肝动脉化疗栓塞.
1.4随访 TACE术后3 d复查血常规、肝肾功能及电解质。出院后采用门诊、住院复查及电话随访等方法进行随访,以首次TACE术后1,3,6及12月为随访复查点。复查内容包括乙肝-DNA载量检测、总胆红素、白蛋白、谷氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate transaminase, AST)、凝血功能、血清AFP水平测定及一种或多种肝脏影像学检测(B超、CT或MRI),以此评估病情变化及预后。生存时间按月计算,起点为行TACE的日期,终点为患者死亡,所有患者随访至2017年3月1日,随访时间为18月(1~49月)。收集所有的临床病理学资料和随访资料,并输入计算机数据库,按以下公式计算APRI:
APRI=[(AST/ULN)/PLT计数(109L-1)]×100
(ULN=该实验室AST正常参考范围的上限)
1.5统计学处理 采用SPSS 19.0软件进行统计学分析。应用MedCalc15.2.2软件做ROC曲线。组间如果方差齐性采用独立样本t检验,如果方差不齐采用秩和检验,率的比较使用χ2检验,小样本率的比较采用Fisher精确概率法,多组计量资料采用One-way ANOVA分析。用Kaplan-Meier法计算肝癌切除术后的累积生存率,采用Log-rank检验比较各组的累积生存率的差异,多因素分析采用Cox比例风险模型,检验水准均为α=0.05。
2 结 果
2.1TACE术前APRI的计算及界值 根据APRI值绘制APRI受试者(ROC)曲线,确定APRI界值。ROC曲线分析结果:ROC曲线下面积为0.680,95%可信区间为0.603~0.756,通过Youden指数计算APRI的界值为1.30时,其灵敏度为0.422,特异度为0.851(图1)。患者分为术前低APRI组237例(APRI<1.30)及高APRI组151例(APRI≥1.30)。
2.2不同APRI组与肝癌患者临床基本因素的关系 不同APRI组间的年龄(P=0.067)、性别(P=0.145)、白蛋白(P=0.738)、肿瘤数量(P=0.594)、术前AFP(P=0.441)、ALT(P=0.245)、总胆红素(P=0.093)差别均无统计学意义。术前Child-Pugh分级(P=0.001)、乙肝抗原(P=0.014)、肿瘤大小(P<0.001)、是否伴有腹水(P<0.001)、脉管癌栓(P<0.001)、TACE次数(P<0.001)在不同APRI组间的差别均有统计学意义。APRI≥1.30组较APRI<1.30组术前肿瘤较大,更多患者伴有乙肝抗原阳性、腹水、脉管癌栓、肝功能分级为B级、行多次TACE治疗。而不同组间患者年龄、性别、肿瘤的数量及术前AFP、ALT、总胆红素、白蛋白差别均无统计学意义(表2)。

图1 APRI预测肝癌患者预后的ROC曲线Fig 1 Receiver operating characteristic curves for APRI to predict prognosis in patients with Live cancer
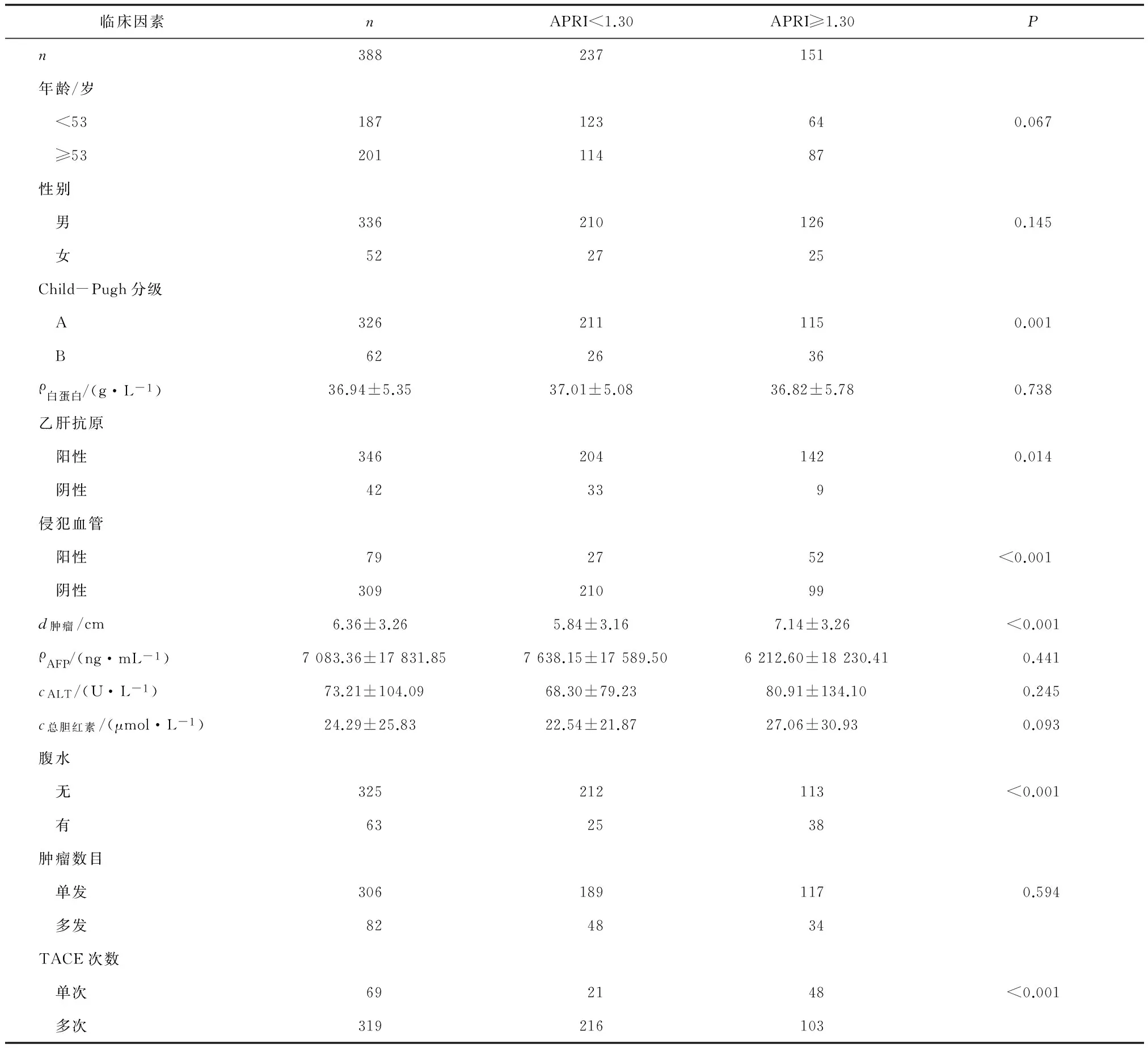
表2 APRI与肝癌患者临床因素的关系
AFP:甲胎蛋白;ALT:谷氨酸氨基转移酶;TACE:经肝动脉化疗栓塞;APRI:天冬氨酸氨基转移酶血小板比值.
2.3肝癌患者预后因素的单因素分析 肝癌患者APRI<1.30组的1年和3年生存率分别为71.2%和30.0%,APRI≥1.30组的1年和3年生存率分别为25.5%和2.6%。不同APRI组间的生存率差别有统计学意义(P<0.001,图2),APRI更高组的肝癌患者生存率明显低于APRI较低组。
单因素分析显示,术前白蛋白(P<0.001)、Child-Pugh 分级(P<0.001)、脉管癌栓(P<0.001)、肿瘤大小(P=0.001)、AST(P<0.001)、是否有腹水(P=0.023)、TACE次数(P<0.001)、APRI(P<0.001)与肝癌患者术后1年及3年生存率相关(表3)。
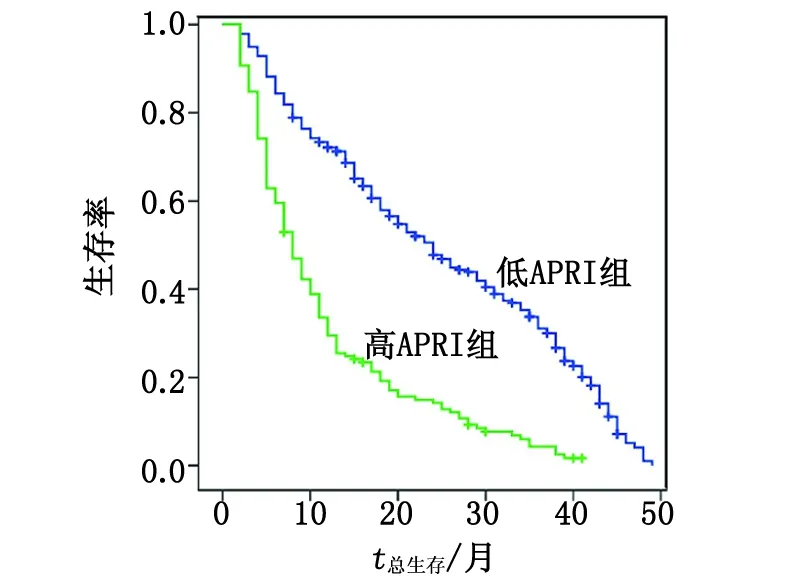
P<0.001.图2 肝癌患者TACE术后不同APRI组生存曲线比较Fig 2 Kaplan-Meier survival curves showing the relationship between APRI and survival after TACE in patients with live cancer
2.4影响预后的COX模型预后多因素分析 肝癌患者影响预后的COX多因素分析见表4。因为Child-Pugh分级由总胆红素、腹水、白蛋白等因素计算得出,因此放入不同的分析模型。分析结果表明,APRI、AST、Child-Pugh分级、肿瘤大小、脉管癌栓、TACE次数及白蛋白与死亡相关,是肝癌患者TACE术后预后的独立因素。在调整了年龄、性别、Child-Pugh分级、脉管癌栓、肿瘤大小、肿瘤数目、TACE次数、乙肝抗原、ALT、AFP等因素后,高APRI组较低APRI组患者死亡风险增加(HR:2.012;95%CI:1.567~2.584,P<0.001),差别有统计学意义。
2.5肝癌患者TACE术后各临床预后因素ROC分析 将多因素分析显示有独立预后价值的临床预后因素(白蛋白、Child-Pugh分级、肿瘤大小、脉管癌栓、TACE次数),行ROC曲线分析比较,结果显示,APRI表现突出(图3),较其他临床预后因素有更大的曲线下面积。可见APRI在预测肝癌介入术后的预后价值方面,优于临床上其他常用指标(表5~6)。
表3肝癌患者TACE术后生存期单因素分析
Tab3Univariate analyses of clinicopathologic factors in relation to outcome after TACE

临床因素n生存率/%1年3年P性别 男33653.119.0 女5255.622.3年龄/岁 <5318754.947.9 ≥5320152.119.8Child-Pugh分级 A32657.522.5 B6230.62.6ρ白蛋白/(g·L-1) <359141.77.4 ≥3529756.423.6乙肝抗原 阳性34652.119.5 阴性4261.926.4脉管癌栓 阳性7923.90 阴性30961.024.90.4790.744<0.001<0.0010.078<0.001肿瘤数目 130657.018.9 ≥28240.223.4d肿瘤/cm ≤514167.223.4 >524746.317.9ρAFP/(ng·mL-1) <40018253.120.0 ≥40020653.718.2cALT/(U·L-1) ≤4017656.719.9 >4021250.817.6cAST/(U·L-1) ≤403686.053.4 >4035249.814.2c总胆红素/(μmol·L-1) ≤17.118157.918.8 >17.120749.621.1腹水 无32556.521.3 有6336.39.4APRI <1.3023771.230.0 ≥1.3015125.52.6TACE 单次6915.60 多次31962.024.30.1400.0010.5750.353<0.0010.8420.023
AFP:甲胎蛋白;ALT:谷氨酸-丙酮酸转氨酶;AST:天冬氨酸转氨酶;TACE:经肝动脉化疗栓塞;APRI:天冬氨酸转氨酶血小板比值.

表4 COX模型预后多因素分析
AFP:甲胎蛋白;ALT:谷氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;TACE:经肝动脉化疗栓塞;APRI:天冬氨酸氨基转移酶血小板比值.

图3 各临床独立预后因素的ROC分析Fig 3 Comparison of the area under the ROC for outcome prediction between independent prognostic factor
3 讨 论
APRI是反应肝硬化的指标,最早由Wai等在2003年提出,用来预测丙型肝炎患者肝纤维化和肝硬化的发生[14]。而Walsh等的研究显示,APRI与乙型肝炎肝硬化程度亦明显相关[15]。近年来,APRI在肝癌患者的研究中逐渐受到重视。对行手术治疗的患者,王越等研究显示,APRI升高是HCC患者行肝切除术后发生并发症的危险因素,可作为一种简单易行的预测指标,且APRI与根治性手术肝癌患者的预后相关[11-12]。而对于行TACE治疗的肝癌患者,APRI对肝癌介入治疗后急性肝功能恶化具有预测作用[13]。在我国,大多数肝癌患者都有乙肝及肝硬化背景,且多数就诊时已是中晚期,因失去手术机会而选择TACE治疗。因此,有必要研究APRI判断行TACE治疗肝癌患者预后的价值。
表5各个临床独立预后因素曲线下面积分析
Tab5Comparison of the AUC between independent prognostic factor

临床预后因素AUC95%CISEAPRI0.6980.650~0.7440.0405AST0.6450.595~0.6930.0399白蛋白0.6100.560~0.6590.0352肿瘤大小0.6040.554~0.6530.0395Child-Pugh分级0.5420.491~0.5930.0426TACE次数0.5890.538~0.6380.0392脉管癌栓0.5550.504~0.6050.0421
AST:天冬氨酸氨基转移酶;TACE:经肝动脉化疗栓塞;APRI:天冬氨酸氨基转移酶血小板比值; AUC:曲线下面积.
表6APRI与其他临床独立预后因素曲线下面积比较
Tab6Comparison of the AUC between APRI and independent prognostic factor

临床预后因素面积间差异标准误差95%CIPAPRI~AST0.0530.0250.003~0.1030.036APRI~白蛋白0.0880.051-0.013~0.1890.088APRI~肿瘤大小0.0940.094-0.011~0.1990.080APRI~Child-Pugh分级0.1560.0570.043~0.2680.006APRI~TACE次数0.1090.0530.004~0.2140.041APRI~脉管癌栓0.1430.0520.042~0.2440.005
APRI:天冬氨酸氨基转移酶血小板比值; AST:天冬氨酸氨基转移酶;TACE:经肝动脉化疗栓塞.
本组资料分析临床因素与APRI的关系显示,患者是否伴有乙肝感染、肿瘤大小、腹水、脉管癌栓、肝功能分级等在不同APRI组之间的差别有统计学意义。临床医师常常采用这些因素来判断HCC患者术后的预后情况,并指导术后进一步治疗。提示APRI与行TACE治疗的肝癌患者的预后可能相关。在生存分析中,APRI与行TACE治疗的肝癌患者预后相关,APRI≥1.30组患者的生存率明显低于APRI<1.30组,进一步行多因素分析显示,APRI为肝癌患者TACE术后生存期的独立危险因素。
与既往的研究结果相类似,术前白蛋白、Child-Pugh分级、脉管癌栓、肿瘤大小、AST水平、是否有腹水、TACE次数等均与HCC患者的预后相关,且术前白蛋白及AST水平、Child-Pugh分级、肿瘤大小及脉管癌栓是肝癌患者预后的独立危险因素,而TACE次数则是保护因素。在进一步的ROC分析中,APRI表现突出,较其他临床预后因素有更大的ROC曲线下面积。可见在预测肝癌介入术后的预后价值方面,APRI优于临床上其他常用的指标。
关于APRI与TACE治疗肝癌患者预后相关的机制,一方面,行TACE时,化疗药物及血管栓塞剂损伤正常肝组织,肝脏代偿能力下降,加重肝硬化,甚至发生不可逆的肝损害或肝功能衰竭,导致患者近期急性死亡及远期疗效差[16-17]。既往已有多个研究表明,肝硬化是影响肝癌患者预后的重要因素之一[18-20]。此外,绝大多数肝癌患者存在因肝硬化引起的不同程度门静脉高压和脾功能亢进,导致大量的血小板滞留在肿大的脾脏并被破坏,因此部分肝癌患者血小板计数偏低。大量的动物实验和临床数据表明,血小板在肝细胞的再生过程中发挥关键作用[21-22],低血小板计数会导致肝功能再生障碍,不利于肝功能恢复,从而影响肝癌患者的预后。另一方面,近年来,炎症与肿瘤发生发展的关系不断受到重视,越来越多的证据表明,炎症是影响肿瘤预后的重要因素[23-24]。肝硬化患者中,血清AST水平是肝脏炎症活动敏感的生化指标[25]。在肝癌进展过程中,肝细胞不断被破坏,AST释放入血。因此监测血清AST水平可以反应肝癌的进展。已有研究显示,血清AST水平是肝癌术后重要的预后因素,术前AST增高的患者,预后较差[26-27]。本组资料分析显示,血清AST水平是行TACE治疗的肝癌患者的独立预后因素,但是联合血小板组成的APRI,有更好的预后价值。
综上所述,APRI作为一种简便无创、价格低廉的指标,由AST和血小板组成,能够综合反应肝癌患者的肝硬化程度及炎症反应,是肝癌患者的独立预后因素,其预后价值优于其他临床上常用的指标,可作为判断行TACE治疗肝癌患者预后的指标。
[1] Bosch F X, Ribes J, Clerics R,etal. Epidemiology of hepatocellular carcinoma [J].ClinLiverDis,2005,9(2):191-211.
[2] 李 征,米登海,杨克虎,等. 介入化疗栓塞术联合热疗治疗原发性肝癌的Meta分析[J].中国循证医学杂志,2012,12(6):672-678.
[3] Llovet J M, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008[J].JHepatol, 2008,48(1):S20-S37.
[4] Rougier P, Mitry E, Barbare J C,etal. Hepatocellular carcinoma(HCC): an update[J].SeminOncol, 2007,34(2):S12-S20.
[5] 王冠军,赫 捷. 肿瘤学概论[M]. 北京:人民卫生出版社, 2013:161.
[6] Tan C K, Law N M, Ng H S,etal. Simple clinical prognostic model for hepatocellular carcinoma in developing countries and its validation[J].JClinOncol,2003,21(12):2294-2298.
[7] Bruix J, Llovet J M. Prognostic prediction and treatment strategy in hepatocellular carcinoma[J].Hepatology, 2002,35(3):519-524.
[8] Park Y H, Kim B K, Kim J K,etal. Long term outcomes of chronic hepatitis B virus infection in the era of antiviral therapy in Korea[J].JGastroenterolHepatol,2014,29(5):1005-1011.
[9] Takayasu K, Nakanuma Y, Makuuchi M,etal.Report of the 17th nationwide followup survey of primary liver cancer in Japan[J].HepatolRes,2007,37(9):676-691.
[10] Murayama Y, Komatsu S, Shiozaki A,etal. Clinical analysis of anatomical resection for the treatment of hepatocellular carcinoma based on the stratification of liver function[J].WorldJSurg, 2014,38(5):1154-1163.
[11] 王 越,刘学民,王 博, 等. 术前天冬氨酸转氨酶血小板比值指数对肝细胞癌患者手术切除后并发症的预测价值[J]. 中华肝胆外科杂志, 2016,22(5):289-293.
[12] Shen S L, Fu S J, Chen B,etal. Preoperative aspartate aminotransferase to platelet ratio is an independent prognostic factor for hepatitis B-induced hepatocellular carcinoma after hepatic resection[J].AnnSurgOncol, 2014,21(12):3802.
[13] 宋裕萍,赵擎宇,李 松, 等. 非侵入性肝纤维化诊断模型对肝癌介入治疗后急性肝功能恶化的预测作用[J]. 中华医学杂志, 2016,96(9):716-719.
[14] Wai C T,Greenson J K,Fontana R J,etal. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic C[J].Hepatology,2003,38(2):518-526.
[15] Walsh N,Verster A,Rodolph M,etal. WHO guidance on the prevention of viral hepatitis B and C among people who injec drugs[J].IntJDrugPolicy, 2014,25(3):363-371.
[16] 周 霖, 王华明, 艾鼎伦,等.原发性肝癌患者肝动脉化疗栓塞术后肝功能失代偿的临床分析[J].解放军医学杂志, 2014,39(2):149-153.
[17] 刘金明, 张克勤, 李 涛. 肝癌多次TACE术后的肝硬化分级及预后因素分析[J].实用癌症杂志,2014,29(1):68-71.
[18] Zhou Y M, Sui C J, Zhang X F,etal. Influence of cirrhosis on long-term prognosis after surgery in patients with combined hepatocellular-cholangio carcinoma[J].BMCGastroenterol, 2017,17(1):25.
[19] Sasaki K, Shindoh J, Margonis G A,etal. Effect of background liver cirrhosis on outcomes of hepatectomy for hepatocellular carcinoma[J].JAMASurg, 2017,152(3):e165059.
[20] Pang Q, Zhang J Y, Xu X S,etal. The prognostic values of 12 cirrhosis relative noninvasive models in patients with hepatocellular carcinoma[J].ScandJClinLabInvest, 2015,75(1):73-84.
[21] Matsuo R, Nakano Y, Ohkohehi N.Platelet administration via the portal vein promotes liver regeneration in rats after 70% hepatectomy[J].AnnSurg, 2011,253:759-763.
[22] Surtel M, Graf R, Aleil B,etal. Platelet derived serotonin mediates liver regeneration[J].Seience, 2006,312(5770):104-107.
[23] Sonohara F, Inokawa Y, Kanda M,etal. Association of inflammasome components in background liver with poor prognosis after curatively-resected hepatocellular carcinoma[J].AnticancerRes, 2017,37(1):293-300.
[24] Argiles J M, Busquets S, Toledo M,etal. The role of cytokines in cancer cachexia[J].CurrOpinSupportPalliatCare, 2009,19(3):163-168.
[25] Tarao K, Takemiya S, Tamai S,etal. Relationship between the recurrence of hepatocellular carcinoma (HCC) and serum alanine aminotransferase levels in hepatectomized patients with hepatitis C virus-associated cirrhosis and HCC[J].Cancer, 1997,79(4):688-694.
[26] Ji F, Fu S, Guo Z,etal. Prognostic significance of preoperative aspartate aminotransferase to neutrophil ratio index in patients with hepatocellular carcinoma after hepatic resection[J].Oncotarget, 2016,7(44):72276-72289.
[27] Peng W, Li C, Wen T F,etal. Postoperative aspartate aminotransferase to platelet ratio index change predicts prognosis for hepatocellular carcinoma[J].Medicine(Baltimore), 2016,95(30):e4160.
AspartateTransaminaseandPlateletRatioIndexasaPrognosticFactorafterTransarterialChemoembolizationforHepatocellularCarcinoma
SUZijian,ZHANGJianhua,PANQunxiong,WANGCongren,FEIHongjiang
DepartmentofHepatobiliarySurgery,TheAffiliatedQuanzhouFirstHospitalofFujianMedicalUniversity,Quanzhou362000,China
Objective To explore whether aspartate transaminase and platelet ratio index (APRI) is an effective prognostic marker after transarterial chemoembolization for hepatocellular carcinoma.MethodsRetrospective analysis of clinical date in 388 patients with hepatocellular carcinoma. According to preoperative APRI,the patients were divided into the low APRI group (APRI<1.30,n=237) and the high APRI group (APRI≥1.30,n=151). The 1 or 3-year survival rates of the two groups were separately analyzed.ResultsThe 1-year and 3-year survival rates in the high APRI group were 37.3% and 19.0% respectively (P<0.01). In the low APRI group the survival rates were 57.6% and 38.2% respectively (P<0.01). The 1-year and 3-year recurrence rates in the high APRI group were 25.5% and 2.6% respectively (P<0.01). In the low APRI group they were 71.2% and 30.0% respectively (P<0.01). In multivariate analysis, albumin level, Child-Pugh class, tumor size, vascular invasion, number of APRI, and APRI were independent predictors of hepatocellular carcinoma survival. ROC curve analysis showed that APRI had larger area under the ROC curve compared to other clinical prognostic factors.ConclusionPreoperative APRI may be a prognostic marker in patients with hepatocellular carcinoma after transarterial chemoembolization.
liver neoplasms; aspartate aminotransferases; blood platelets; chemoembolization, therapeutic
R331.124; R345.51; R735.7
A
1672-4194(2017)05-0316-07
2017-05-22
福建医科大学 附属泉州第一医院肝胆外科,泉州 362000
苏子剑,男,主治医师,医学硕士. Email: 710262737@qq.com
(编辑:何佳凤)
