CXCR4拮抗剂普乐沙福的合成工艺改进
2017-11-10刘爱芹于胜海孙敬勇张平平吴忠玉
刘爱芹,于胜海,孙敬勇,孙 捷,张平平,吴忠玉*
(1.山东省医学科学院 药物研究所,山东 济南 250062; 2.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250062; 3.国家卫生部 生物技术药物重点实验室,山东 济南 250062; 4.山东省罕少见病重点实验室,山东 济南 250062)
CXCR4拮抗剂普乐沙福的合成工艺改进
刘爱芹1,2,3,4,于胜海1,2,3,4,孙敬勇1,2,3,4,孙 捷1,2,3,4,张平平1,2,3,4,吴忠玉1,2,3,4*
(1.山东省医学科学院 药物研究所,山东 济南 250062; 2.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250062; 3.国家卫生部 生物技术药物重点实验室,山东 济南 250062; 4.山东省罕少见病重点实验室,山东 济南 250062)
本文开发了普乐沙福的一种新合成工艺,以乙二胺、丙二酸二乙酯等常见试剂为起始原料, 经Michael加成、成环、与1, 4-二(卤代甲基)苯亲核取代,再利用I2-NaBH4还原体系替代文献报道的昂贵还原试剂制备普乐沙福. 与原工艺相比,能显著降低生产成本、副产物少、后处理操作简便、节能环保.
普乐沙福; CXCR4拮抗剂; 工艺改进; 还原反应
非霍奇金淋巴瘤、多发性骨髓瘤等血液系统肿瘤患者通常采用自体造血干细胞移植等方法进行造血系统的援救和再建. 最早用作自体移植的造血干细胞源自骨髓, 后因发现粒细胞集落刺激因子(G-CSF)具有动员造血干细胞自骨髓进入外周血循环的能力,故G-CSF单用或联用化疗药物便逐渐发展成为自体移植用造血干细胞动员的标准方案[1-2]. 趋化因子CXCL12又称基质细胞衍生因子-1 (SDF-1), 是趋化因子受体CXCR4的配体,在造血干细胞运输和循靶至骨髓的过程中发挥重要作用. 一旦进入骨髓, 干细胞CXCR4直接通过SDF-1, 或者诱导其他黏附分子帮助将这些细胞固定于骨髓基质, 由于SDF-1与CXCR4之间的相互作用使造血干细胞停留在骨髓内.影响或阻断CXCR4趋化因子受体配体结合, 可使黏附于骨髓基质的造血干细胞被释放至循环中, 从而调节造血干细胞的迁徙. 这对骨髓造血干细胞移植十分有用[3-4].
普乐沙福(Plerixafor)是美国Genzyme 公司研发的CXCR4专一性拮抗剂[5-6],其注射液已于2008年12月被美国FDA批准上市, 商品名为Mozobil.该药是一种造血干细胞激活剂,同时具有刺激造血干细胞增殖、分化进入血液循环的功能.由于非霍奇金淋巴瘤和多发性骨髓瘤大部分缓解病例和进展病例需进行末梢血自体造血干细胞移植, 而普乐沙福联合G-CSF能明显提高患者外周血中CD34+细胞的数量, 保证了非霍奇金淋巴瘤和多发性骨髓瘤患者自体造血干细胞移植的成功[7].临床研究表明, 普乐沙福能大幅度提高患者的白细胞数量并促进造血干细胞从骨髓向血液流动,与粒细胞集落刺激因子(G-CSF)有协同作用; 已用于多发性骨髓瘤与非霍奇金淋巴瘤患者干细胞移植的临床治疗.
普乐沙福(化合物1,图1), 化学名为1,1′-[1,4-亚苯基二(亚甲基)]-二-1,4,8,11-四氮杂环十四烷.关于普乐沙福的合成国内外都有一些文献报道[8-11], 通过对这些合成路线加以汇总分析,普乐沙福的合成主要包括以下几种方法:

图1 普乐沙福(化合物1)的结构式Fig.1 Structure of plerixafor (compound 1)
方法一: 以1, 4, 8, 11-四氮杂环十四烷为原料, 经过N1,N4,N8三保护, 与1,4-二(卤代甲基)苯进行桥连, 脱保护制得成品.反应路线如下, 其中R为对甲苯磺酰基,甲磺酰基, 三氟乙酰基,叔丁氧羰基等(图2).
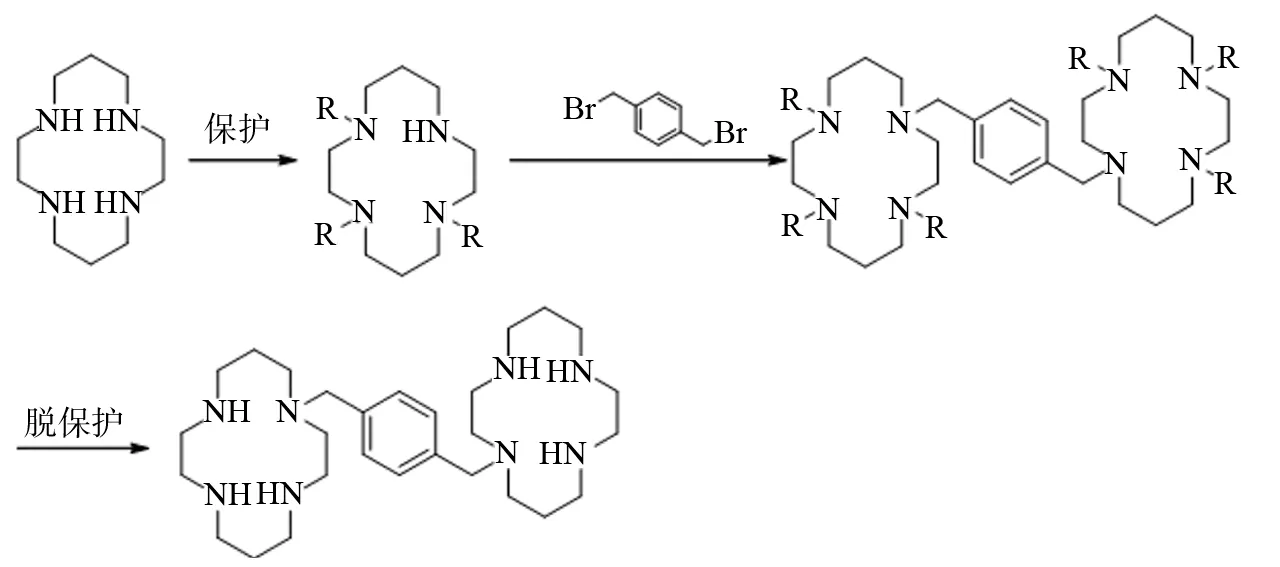
图2 普乐沙福合成路线一Fig.2 Synthetic route 1 of plerixafor
方法二: 以1, 4, 8, 11-四氮杂环十四烷为原料, 在无水、无氧条件下,经环内保护后与1, 4-二(卤代甲基)苯桥连,再经脱保护得到普乐沙福. 合成路线如下, 其中R 为P,Ni等(图3).

图3 普乐沙福合成路线二Fig.3 Synthetic route 2 of plerixafor
方法三:以丙烯酸甲酯和乙二胺为原料, 先进行Michael加成、环合, 再与1, 4-二(卤代甲基)苯桥连,再经还原反应得到普乐沙福(图4).
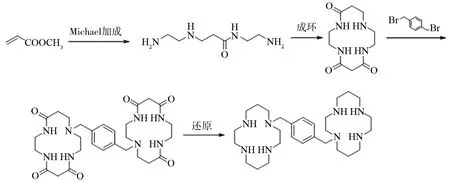
图4 普乐沙福合成方法三Fig.4 Synthetic route 3 of plerixafor
目前采用的这几种方法各有优缺点. 方法一虽然操作步骤少, 但使用三氟乙酸乙脂保护时, 由于三氟乙酰基的强极性,导致第四个未保护-NH的活性降低,通常后续反应不能完全反应, 从而进一步脱保护后引入了很难去除的杂质1, 4, 8, 11-四氮杂环十四烷.使用对甲苯磺基等其他保护剂进行反应时脱保护步骤为严格步骤,因为脱保护试剂(如氢溴酸/冰醋酸,浓硫酸等)常常会诱发副反应. 方法二与方法一同样以1, 4, 8, 11-四氮杂环十四烷为起始原料,该原料不易制备,若直接购买价格昂贵;且反应需要无水、无氧等操作, 不利于工业生产.方法三以丙烯酸甲酯、乙二胺等常见的原料或试剂进行制备, 成本低廉, 但最后一步还原反应以硼烷-二甲硫醚络合物作为还原剂,价格昂贵且容易产生危险, 反应溶剂需要严格无水处理并需要氩气保护.
本文作者对已有的工艺路线进行改进,采用乙二胺、丙二酸二乙酯等常见试剂为起始原料, 经Michael加成、成环先制备关键中间体与1, 4-二(卤代甲基)苯桥连, 再经I2-NaBH4还原体系还原得到普乐沙福.(图5)

a)乙二胺,60 ℃; b)丙二酸二乙酯,甲醇; c)α,α′-二溴对二甲苯,乙腈,回流; d)硼氢化钠,碘,四氢呋喃,盐酸.图5 普乐沙福的合成Fig.5 Synthesis of plerixafor
1 实验部分
1.1 仪器与试剂
WRR熔点仪(上海精密科学仪器有限公司), 集热式恒温加热磁力搅拌器DF101S(郑州长城科工贸有限公司), 旋转蒸发仪(上海申升科技有限公司), 低温恒温搅拌反应浴(郑州长城科工贸有限公司),Waters高效液相色谱仪(美国waters), 乙二胺、丙二酸二乙酯、N,N-二异丙基乙胺、α,α′-二溴对二甲苯、硼氢化钠(国药集团化学试剂有限公司), 叔丁醇钾(国药集团化学试剂有限公司).乙腈、甲醇、四氢呋喃、二氯甲烷等均为市售分析纯试剂.
1.2 合成步骤
1.2.1 化合物3的合成
7.1 mL丙烯酸甲酯(79 mmol, 1 eq)室温搅拌下缓慢滴加到乙二胺(85 mL, 1.3 mol, 16 eq)中. 反应轻微放热.室温放置过夜, 并与60 ℃搅拌4 h. 减压除去过量的乙二胺, 真空干燥过夜(室温过夜,70 ℃ 1 h)得13.3 g无色油状物(97%)MS(m/z): 478 [M+1]+.
1.2.2 化合物4的合成
11.6 mL丙二酸二乙酯(76 mmol)的甲醇溶液(40 mL)一次性加入到化合物2的甲醇溶液中(13.3 g, 76 mmol,溶于760 mL甲醇). 室温搅拌下反应2 d, 回流反应1 d. 溶液逐渐变为浅红色.反应完毕减压除去甲醇,柱层析分离得1.7 g白色固体(11.4%).
1.2.3 化合物5的合成
向化合物4(1.37 g,5.68 mmol, 1 eq)的乙腈混悬溶液(30 mL), 加入0.75 gα,α′-二溴对二甲苯(2.84 mmol, 0.5 eq), 6.5 mL N,N-二异丙基乙胺(DIEA, 39.3 mmol, 7 eq). 回流42 h(现象为升温5 min后溶液变澄清,然后逐渐出现白色浑浊). 停止加热后,冷却到室温,过滤,并用20 mL甲醇洗2次, 得1.30 g白色粉末(96%).
1.2.4 普乐沙福(化合物1)的合成
0.50 g化合物5,(0.85 mmol, 1 eq), 0.42 g硼氢化钠(12.24 mmol, 14.4 eq)投入三颈瓶中,加入无水四氢呋喃20 mL.冰浴且通氮气保护下滴加1.30 g碘(5.1mmol, 6 eq)的四氢呋喃溶液(40 mL). 滴加完毕后回流42 h, 反应液为白色浑浊.冰浴下滴加3 mol·L-1HCl 7 mL(有气泡产生), 变为黄色溶液(pH=1)并有少量白色絮状沉淀. 反应液回流2 h, 白色絮状消失.减压除去四氢呋喃得黄色水溶液(底部少量红色油状物), 用30 mL二氯甲烷萃取3次(水相无色,黄色二氯甲烷层), 冰浴下将水相用氢氧化钾固体调节pH到12,出现少量白色浑浊,用二氯甲烷萃取(30 mL×4), 重结晶得0.18 g类白色固体(42%). TLC显示自制品Rf值与对照品一致,m.p. 239~240 ℃(文献值:239~241 ℃),MS(m/z): 503 [M+1]+,1H-NMR (400 MHz,D2O)δ1.89 (br, 4H), 2.12 (br, 4H), 2.80~3.32 (br, m, 32H), 3.89 (s, 4H), 7.38 (s, 4H).
2 结果与讨论
酰胺类化合物相对稳定, 其还原反应不易发生,目前已有文献报道可采用LiBH4-Me3SiCl, NaBH4-TiCl4,NaBH4-MeSO2OH, 硼烷-二甲硫醚络合物等还原体系进行还原, 且存在反应不完全、副产物多、操作要求严格等缺点. 普乐沙福前体存在6个酰胺键需要被同时还原为氨基,原工艺文献使用硼烷-二甲硫醚络合物进行该步骤的还原反应. 硼烷[12-13]还原性较强, 但价格昂贵, 且本身毒性较大, 对操作要求严苛,具有一定危险性. 文献报道可利用I2-NaBH4体系还原酰胺用于胺的制备[14], 但使用I2-NaBH4体系同时还原6个酰胺键制备普乐沙福的新方法尚未见报道.
通过对试验摸索,确定6倍当量 I2和14.4当量的硼氢化钠作为还原剂还原效果与硼烷-二甲硫醚络合物接近. 产物杂质少, 重结晶可得纯品, 初次重结晶收率为42%, 后期利用母液回收套用、母液再次析晶等操作, 收率能进一步提高.本工艺能有效节约还原剂成本,且操作简便, 利于后期放大在车间进行生产.
3 结论
本文报道了利用I2-NaBH4还原体系制备普乐沙福的一种新工艺. 该工艺替代文献报道的昂贵还原试剂, 能显著降低生产成本,还原效果较好, 且副产物少、后处理操作简便、安全性好. 在工业化制备普乐沙福过程中有较好的应用价值.
[1] KAMATH M S, CHITTAWAR P B, KIRUBAKARAN R, et al. Use of granulocyte-colony stimulating factor in assisted reproductive technology: A systematic review and meta-analysis [J]. European Journal of Obstetrics Gynecology & Reproductive Biology, 2017, 214: 16-24.
[2] SIMMONS S, TJOA B M, ELGAMAL A, et al. GM-CSF as a systemic adjuvant in a phase II prostate cancer vaccine trial [J]. Prostate, 2015, 39(4): 291-297.
[3] IZUMI D, ISHIMOTO T, MIYAKE K, et al. CXCL12/CXCR4 activation by cancer-associated fibroblasts promotes integrinβ1 clustering and invasiveness in gastric cancer [J]. International Journal of Cancer, 2016, 138(5): 1207-1219.
[4] LIAO A, SHI R, JIANG Y, et al. SDF-1/CXCR4 axis regulates cell cycle progression and Epithelial-Mesenchymal transition via up-regulation of survivin in glioblastoma [J]. Molecular Neurobiology, 2016, 53(1): 210-215.
[5] DE C E. The bicyclam AMD3100 story [J]. Nature Reviews Drug Discovery, 2003, 2(7): 581-587.
[6] KIM J K, RAWLS S. CXCR4 antagonist plerixafor attenuates cue and cue/drug induced relapse to cocaine seeking and expression and development of cocaine-induced conditioned place preference [J]. Drug & Alcohol Dependence, 2017, 171: 102-103.
[7] 杨尚彦, 陈国华, 尹玲丽, 等. 普乐沙福的合成工艺改进[J]. 中国药物化学杂志, 2010, 20(6): 511-513.
YANG S Y, CHEN G H, YIN L L, et al. Improved synthesis of Plerixafor [J]. Chinese Journal of Medicinal Chemistry, 2010, 20(6): 511-513.
[8] 苏靖, 刘瑶, 郑志兵, 等. Plerixafor 的合成[J]. 中国医药工业杂志, 2007, 38(6): 398-400.
SU J, LIU Y, ZHENG Z B, et al. Synthesis of plerixafor [J]. Chinese Journal of Pharmaceuticals, 2007, 38(6): 398-400.
[9] 陈贝贝, 强斌, 卓广澜. 普乐沙福的合成工艺改进[J]. 合成化学, 2015, 23(8): 774-777.
CHEN B B, QIANG B, ZHUO G L. Process improvement on the synthesis of plerixafor [J]. Chinese Journal of Synthetic Chemistry, 2015, 23(8): 774-777.
[10] HELPS I, PARKER D, MORPHY J, et al. General routes for the synthesis of mono, di and tri-N-substituted derivatives of cyclam [J]. Tetrahedron, 1989, 20(21): 219-226.
[11] ACHMATOWICZ M, HEGEDUS L S. Direct synthesis of 1, 1′-[1, 4-phenylenebis (methylene)]-bis-1, 4, 8, 11-tetraazacyclotetradecane octahydrochloride (AMD 3100) without the use of protecting groups [J]. The Journal of Organic Chemistry, 2003, 68(16): 6435-6436.
[12] 樊建芬, 黄洁, 卢运祥, 等. 噁唑硼烷对苯甲酮不对称还原反应催化性能的理论计算[J]. 化学研究, 2005, 16(3): 58-61.
FAN J F, HUANG J, LU Y X, et al. Theoretical study on enantioselectivity of oxazaborolidine catalysts for reduction of phenyl methyl ketone [J]. Chemical Research, 2005, 16(3): 58-61.
[13] 沈宗旋, 李咏华, 秦宏兵, 等. 不对称硼烷还原合成手性氨基醇[J]. 化学研究, 2004, 15(3): 23-26.
SHEN Z X, LI Y H, QIN X B, et al. Synthesis of chiral amino alcohols by enantioselective borane reduction [J]. Chemical Research, 2004, 15(3): 23-26.
[14] HARISH V, PERIASAMY M. Enantiomerically pure piperazines via NaBH4/I2, reduction of cyclic amides [J]. Tetrahedron Asymmetry, 2016, 28(1): 175-180.
ProcessimprovementonsynthesisofCXCR4antagonistplerixafor
LIU Aiqin1,2,3,4, YU Shenghai1,2,3,4, SUN Jingyong1,2,3,4, SUN Jie1,2,3,4, ZHANG Pingping1,2,3,4, WU Zhongyu1,2,3,4*
(1.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,Shandong,China;2.SchoolofMedicineandLifeSciences,ShandongAcademyofMedicalSciences,UniversityofJinan,Jinan250062,Shandong,China; 3.KeyLab.ofRareandUncommonDiseasesofShandongProvince,Jinan250062,Shandong,China;4.KeyLaboratoryforRare&UncommonDiseasesofShandongProvince,Jinan250062,Shandong,China)
Using ethylenediamine and diethyl malonate as starting materials, a new synthetic process of Plerixafor was developed. With Michael addition, cyclization, nucleophilic substitution by 1, 4-bis(bromomethyl) benzene, and last redution using the I2-NaBH4instead of expensive reductant reported in literatures, plerixafor was successful prepared. Comparing with reported method, this new synthetic route can significantly reduce the production cost, has less by-products, is simple and energy-efficient.
plerixafor; CXCR4 antagonist; technological improvement; reduction reaction
O627
A
1008-1011(2017)05-0584-05
2017-01-17.
山东省自然科学基金资助项目(ZR2014YL035); 2014年度留学人员科技活动项目择优资助项目; 济南大学教研项目(J1447); 山东省医学科学院院级科技计划面上项目(2016-5); 山东省医学科学院医药卫生科技创新工程.
刘爱芹(1969-), 女, 副研究员, 研究方向为药物化学.*
, E-mail: wu_med@foxmail.com.
[责任编辑:张普玉]
