热处理对β-伴大豆球蛋白结构及免疫活性的影响
2017-11-10赵益菲布冠好陈复生
赵益菲,布冠好,陈复生
(河南工业大学 粮油食品学院,河南 郑州 450001)
热处理对β-伴大豆球蛋白结构及免疫活性的影响
赵益菲,布冠好*,陈复生
(河南工业大学 粮油食品学院,河南 郑州 450001)
以脱脂豆粉为原料,利用碱溶酸沉法分离提取β-伴大豆球蛋白,采用间接竞争ELISA法测定不同温度、加热时间、反应浓度下β-伴大豆球蛋白的抗原性变化,并对热处理后产物的溶解度、免疫原性及结构特性进行分析。结果表明:热处理能显著影响β-伴大豆球蛋白的抗原性。热处理后,样品蛋白的溶解度随温度升高呈先上升后下降的趋势。免疫印迹结果显示:热处理后β-伴大豆球蛋白的免疫原性有一定程度的降低,但不能完全消除。傅里叶红外光谱结果表明:热处理之后样品蛋白中的α-螺旋和β-折叠的含量减少,β-转角含量和无规则卷曲含量增加。
β-伴大豆球蛋白;热处理;抗原性;结构
0 前言
大豆是优质的植物蛋白资源之一,其营养成分丰富,含有人体难以合成的8种必需氨基酸。大豆蛋白消化率与动物蛋白相近,价格却明显低于动物蛋白,所以其需求量以每年10%~15%的速度递增[1-2]。在西方国家,以大豆为原料的食品因其营养丰富且健康已经得到普及[3]。然而,大豆是八大过敏食物原之一,约有0.5%的普通人群对大豆制品过敏[4]。目前已经有34种IgE介导的致敏性蛋白被发现[5],其中两种储藏蛋白(β-伴大豆球蛋白和大豆球蛋白)被认为是主要的致敏性蛋白[6-7]。β-伴大豆球蛋白是分子质量为180 kDa的糖蛋白,含糖量在 5%左右[8],由 α'(76 kDa)、α(72 kDa)和 β(53 kDa)3 种亚基构成,等电点分别为 4.9、5.18、5.66~6.00[9-10]。对大豆易过敏的消费者必须避免摄入大豆和其衍生产品,但是由于其用途广泛,避免摄入大豆及豆制品难度较大。因此,如何降低或消除大豆蛋白过敏原具有重要的实际意义。
热处理是一种常见的食品加工方式,在加热过程中蛋白质分子结构展开、交联或聚合,其中的二硫键断裂,从而在一定程度上使构象发生改变;另外,加热还会导致蛋白质之间的共价或非共价相互作用。蛋白质分子结构的改变可能会导致其抗原表位的暴露或掩盖,从而使蛋白质的抗原性及过敏原性发生改变。Kasera等[11]探讨了热处理对花生蛋白致敏性的影响,经煮沸,花生可溶性蛋白的特异性IgE结合降低了62%,不溶性蛋白组分的IgE结合降低了4%,从而得出热处理能够降低花生过敏蛋白的致敏性。史晓霞等[12]研究也发现,加热处理(70~100 ℃,20~120 min)使卵类黏蛋白的过敏原性降低,且随加热温度升高和加热时间的延长,其过敏原性不断下降。此外,该研究通过光谱分析表明卵类黏蛋白的构象改变导致其过敏原性变化。
目前,关于热处理对β-伴大豆球蛋白结构及免疫活性的影响研究较少。因此,作者以脱脂豆粉为原料,利用碱溶酸沉法提取β-伴大豆球蛋白。采用不同的温度和时间组合,对β-伴大豆球蛋白进行热处理,利用酶联免疫学方法及免疫印迹法对β-伴大豆球蛋白的免疫活性进行定性和定量分析,研究热处理对β-伴大豆球蛋白溶解度及结构特性的影响,以期为食品加工过程中选择合适的热处理条件来降低大豆蛋白致敏性提供重要的理论依据。
1 材料与方法
1.1 材料与仪器
脱脂大豆粉(蛋白含量52.36%):河南省鲲华生物技术有限公司;牛血清蛋白(BSA)、TMB单组分显色液:北京索莱宝科技有限公司;β-伴大豆球蛋白标准抗原(β-conglycinin,G3171)、酶标二抗(HRP标记的羊抗兔 IgG,A6154):Sigma公司;凝胶配制试剂盒:武汉博士德生物工程有限公司;其他试剂均为市售分析纯。
LGJ-18高速冷冻离心机:上海安亭科学仪器厂;pH计:意大利HANNA;ZW-A微量振荡器、HH-S6油浴锅:江苏省金坛市荣华仪器制造有限公司;DYY-6D型电泳仪:北京市六一仪器厂;Multiskan FC酶标仪:赛默飞世尔仪器有限公司。
1.2 方法
1.2.1 β-伴大豆球蛋白的提取
参考传统Thanh法[13]提取β-伴大豆球蛋白,再根据Liu等[14]和宋佳[15]的方法对其进行优化。室温下,脱脂大豆粉用pH 8.5的0.03 mol/L的Tris-HCl溶液浸提, 料液比为 1∶15,45℃下搅拌 1 h后,高速冷冻离心机控温4℃,10 000 r/min离心20 min,取上清液。然后上清液中加入0.01 mol/L NaHSO3,5 mmol/L CaCl2,调节 pH 至 6.4,4 ℃冷沉过夜。10 000 r/min离心20 min,将沉淀物和上清液分离。将上清液调到pH 5.5,搅拌1 h,10 000 r/min离心20 min,取上清液,两倍体积冰水稀释上清液,搅拌1 h,调pH 至4.8,10 000 r/min离心20 min,收集沉淀并溶于0.03 mol/L的Tris-HCl缓冲液中,调pH到7.0,得到β-伴大豆球蛋白,4℃透析2 d,每3 h换1次水,冷冻干燥保存备用。
1.2.2 β-伴大豆球蛋白的热处理
将提取的β-伴大豆球蛋白用磷酸盐缓冲液(pH 7.0)稀释至设定的蛋白质质量浓度,装入密封的安瓿瓶中。温度设置为40~140℃,其中40~80℃是在水浴锅中加热,100~140℃是在油浴锅中加热。热处理之后,分析β-伴大豆球蛋白的溶解度、免疫活性及结构。
1.2.3 β-伴大豆球蛋白溶解度的测定
参考Kato等[16]的方法并做一定改动。称取一定量热处理后的β-伴大豆球蛋白样品溶于pH 7.0的磷酸盐缓冲液中,质量浓度为5 mg/mL,对其进行热处理之后,取蛋白溶液5 mL,4℃下10 000 r/min离心20 min,取上清液,测其蛋白浓度,蛋白浓度以280 nm处的吸光度值表示。蛋白质的溶解度表示为上清液蛋白浓度占相应的总蛋白浓度的百分比。
1.2.4 间接竞争ELISA测定蛋白的抗原性
具体方法参考文献[17]。
1.2.5 β-伴大豆球蛋白的免疫原性的检测
采用Western-Blot分析大豆主要抗原蛋白的免疫原性。将热处理后的样品经SDS-PAGE电泳之后,用硝酸纤维素膜进行转膜,转膜完成后37℃下封闭1 h;漂洗干净后,4℃一抗孵育硝酸纤维素膜18 h,二抗室温孵育膜1 h,最后进行膜显色。观察显色情况,收集图像进行免疫原性的分析。
1.2.6 SDS聚丙烯酰胺凝胶电泳
将热处理后的蛋白质配制成2 mg/mL溶液,然后与上样缓冲液按1∶1的比例混合均匀。将样品液置于沸水浴中煮沸4 min,使蛋白变性。取标准分子质量蛋白10 μL,用微量进样器进样,样品进样量为10 μL。在电泳外槽中加入电极缓冲液,接通电源,进行电泳。
1.2.7 傅里叶红外光谱分析蛋白质二级结构
称取2 mg热处理样品,按照1∶100的比例加入溴化钾,研磨成均匀粉末,压成透明薄片。设定傅里叶红外光谱测定仪的测定波长范围为4 000~400 cm-1,分辨率为 4 cm-1,扫描次数为 32次[18]。最后利用peak fit 4.12软件分析蛋白质的二级结构。
1.2.8 数据统计与分析
采用SPSS16.0处理数据,每组数据重复3次,取平均值并进行显著性分析,P<0.05表示差异显著。采用OriginPro8.0绘图。
2 结果与讨论
2.1 β-伴大豆球蛋白的提取
经Tris-HCl浸提和碱溶酸沉法提取的β-伴大豆球蛋白电泳结果如图1所示,其中β-伴大豆球蛋白的蛋白含量为92.7%。从图1可以看出,β-伴大豆球蛋白各特征条带与SPI中的7S球蛋白部分相吻合,且α'、α、β条带清晰,提取纯度较高,经Gel-pro analyzer凝胶定量分析软件测定其蛋白纯度为72.68%。
2.2 加热条件对β-伴大豆球蛋白溶解度的影响
以溶解度为指标,不同热处理温度、时间以及质量浓度对β-伴大豆球蛋白溶解度的影响分别如图2—图4所示。由图2可知,80℃以上时β-伴大豆球蛋白的溶解度随温度的升高显著降低,说明高温导致了7S不溶性聚集体的产生,使其分散液变得浑浊甚至有沉淀产生。Iwabuchi等[19-20]对7S热变性研究发现,在加热过程中,随着温度的提高,7S各亚基不同程度地去折叠,形成了不同的结构;同时7S三聚体的结构发生解离,若再继续增加温度,以单体形式存在的亚基将会重新相互聚集,形成新的聚集体。由图3和图4可以看出,溶解度虽然呈现下降趋势,但仍保留在一个较高水平,表明在加热过程中7S仍能保留部分有序的空间结构。说明7S对热具有相对的稳定性[21]。
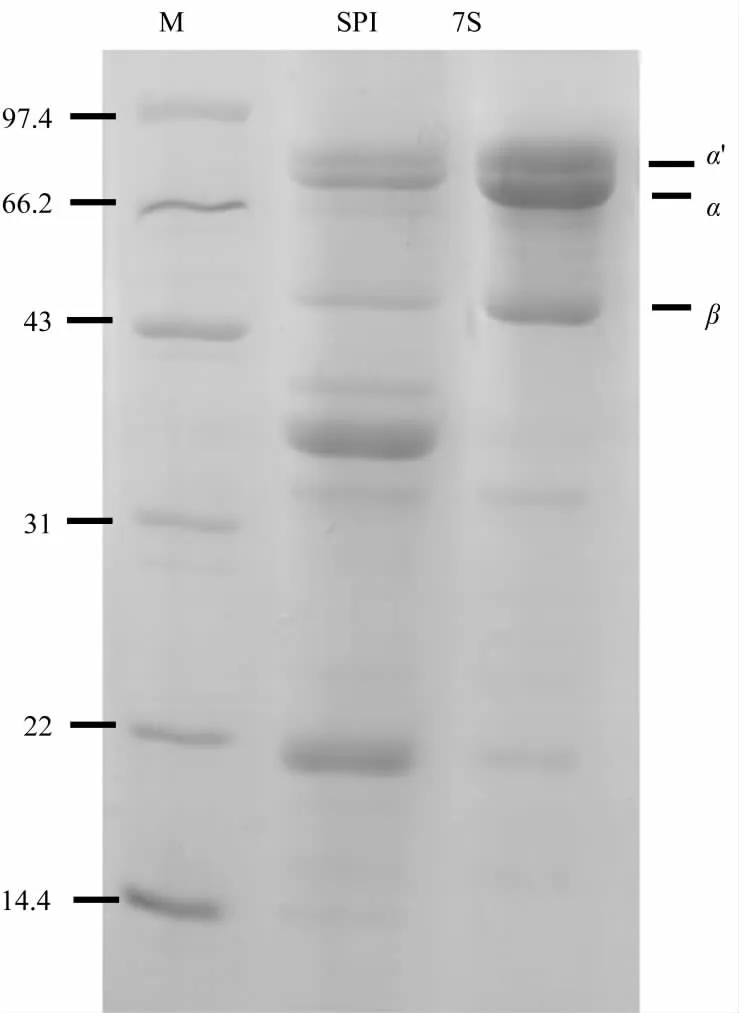
图1 β-伴大豆球蛋白的SDS-PAGE图谱Fig.1 SDS-PAGE of β-conglycinin
2.3 加热条件对β-伴大豆球蛋白抗原性的影响规律研究
不同加热温度、时间以及样品质量浓度对β-伴大豆球蛋白抗原性的影响如图5—图7所示。由图5可知,β-伴大豆球蛋白的抗原性随温度的增加逐渐降低;当加热温度为140℃时,β-伴大豆球蛋白的抗原性由无加热时的96.29%降低到60.78%,下降了35.51个百分点。由图6可知,当加热温度为90℃,处理时间为60 min时,抗原性下降了23.53个百分点。抗原性的下降可能是热处理导致β-伴大豆球蛋白发生聚集与交联,使存在于分子表面的构象表位被破坏或者掩盖,使其抗原性下降[22]。由图7可知,随着蛋白质量浓度的增加,β-伴大豆球蛋白的抗原性呈现先增加又降低的趋势,且浓度的变化对抗原性的影响并不大,只降低了5.96个百分点。总体来看,热处理对β-伴大豆球蛋白抗原性的影响较为显著,可以控制相应的温度和时间的组合来降低大豆蛋白抗原性。
2.4 加热条件对β-伴大豆球蛋白分子量及免疫原性的影响规律研究

图2 不同温度对β-伴大豆球蛋白溶解度的影响Fig.2 Effect of temperature on the solubility of βconglycinin

图3 不同处理时间对β-伴大豆球蛋白溶解度的影响Fig.3 Effect of time on the solubility of βconglycinin

图4 样品质量浓度对β-伴大豆球蛋白溶解度的影响Fig.4 Effect of concentration on the solubility of β-conglycinin
采用电泳及免疫印迹法对热处理后β-伴大豆球蛋白的分子量和免疫原性进行分析,以未经热处理的β-伴大豆球蛋白作为对照,结果如图8和图9所示。由图8可知,40℃加热的电泳条带与未加热的条带相比颜色深浅没有变化,而随着加热温度的增加,β-伴大豆球蛋白的各个亚基条带的密度逐渐加大,说明β-伴大豆球蛋白加热后发生了热聚集。图9是相应的免疫印迹图,可以看出,未经过热处理的β-伴大豆球蛋白在其亚基位置处的免疫条带较强,呈现较强的阳性反应,经过热处理的β-伴大豆球蛋白在其亚基处也均有免疫条带,40℃与60℃的免疫条带与未经过热处理的β-伴大豆球蛋白相比颜色深浅变化较小,80℃及以上温度处理后其条带的颜色均明显浅于未经热处理组,但条带并没有完全消失,说明热处理后β-伴大豆球蛋白免疫原性有一定程度的降低,但并不能完全消除。这与前面的间接竞争ELISA法测定结果相一致。

图5 不同温度对β-伴大豆球蛋白抗原性的影响Fig.5 Effect of temperature on the antigenicity of βconglycinin

图7 样品质量浓度对β-伴大豆球蛋白抗原性的影响Fig.7 Effect of concentration on the antigenicity of β-conglycinin

图8 不同温度处理后样品的SDS-PAGE图谱Fig.8 SDS-PAGE patterns of β-conglycinin treated at different temperatures
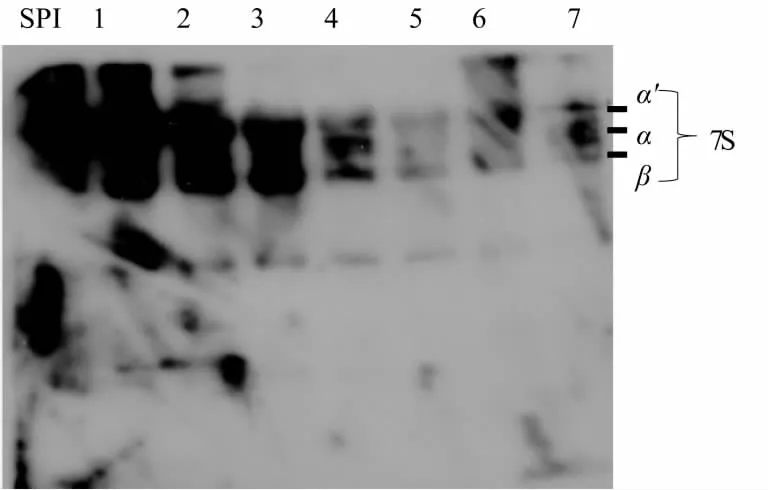
图9 不同温度处理后样品的免疫印迹图Fig.9 Western blot patterns of β-conglycinin treated at different temperatures
2.5 傅里叶红外光谱分析β-伴大豆球蛋白二级结构的变化
蛋白质的红外图谱一般有3组特征吸收带,分别是酰胺 I(1 600~1 700 cm-1)、酰胺 II(1 530~1 550 cm-1)和酰胺 III(1 260~1 330 cm-1)[23]。图 10 为热处理后β-伴大豆球蛋白的红外光谱图,热处理后的样品在酰胺I、II和III带的吸收峰强度增加,这说明热处理能引起C=O键、N—H和C—N键的伸缩振动增加,而其中酰胺II吸收峰的变化会引起蛋白质分子间或分子中的氢键变化,进而影响二级结构中的β-结构。红外图谱中位于1 600~1 700 cm-1之间的酰胺谱带I常用于蛋白质的二级结构分析。利用Peak fit 4.12对热处理产物的酰胺I带进行去卷积二阶导数拟合来计算蛋白二级结构含量的变化,样品的二级结构含量变化如表1所示,样品中蛋白的二级结构主要以β-折叠和β-转角为主,且热处理后主要改变了β-折叠和β-转角。与未经热处理的β-伴大豆球蛋白相比,热处理样品的二级结构中α-螺旋和β-折叠含量减少,β-转角和无序结构含量有所增加,说明热处理导致β-伴大豆球蛋白的二级结构发生了变化。其可能的原因是热处理使样品原有的刚性结构消失,肽链伸展,分子扩散开来,导致蛋白质的结构发生改变[24],部分α-螺旋和β-折叠结构在热处理后转变为无序结构。通过红外光谱分析发现热处理后的α-螺旋和β-折叠结构含量降低,这与Achouri等[25]的结果相一致。由图5可知,随着热处理温度的增加,β-伴大豆球蛋白的抗原性逐渐降低,其抗原性下降可能是由于二级结构中α-螺旋和β-折叠有序结构减少,而无序结构增加,空间结构发生改变导致了抗原表位的掩盖,进而使蛋白抗原性降低[26]。

图10 热处理β-伴大豆球蛋白的红外扫描图谱Fig.10 FTIR spectra of β-conglycinin after heat treatment

表1 热处理后β-伴大豆球蛋白的二级结构含量Table 1 Secondary structures content of β-conglycinin after heat treatment
3 结论
热处理作为一种常见的加工方式,能显著影响β-伴大豆球蛋白的抗原性。研究结果表明:不同温度、加热时间、样品质量浓度均对β-伴大豆球蛋白的抗原性有明显影响,可降低 β-伴大豆球蛋白的抗原性。热处理温度显著影响β-伴大豆球蛋白的抗原性,140℃时其抗原性降低了35.51个百分点。热处理后,β-伴大豆球蛋白的溶解度随温度增加呈先上升后下降的趋势,加热时间和样品质量浓度对溶解度的影响相对较小。免疫印迹结果表明:热处理后β-伴大豆球蛋白免疫原性有一定程度的降低,但是并不能完全消除。傅里叶红外光谱结果表明:热处理之后样品中α-螺旋和β-折叠的含量减少,β-转角和无序结构含量增加。该研究将为食品加工过程中选择合适的热处理条件来降低大豆蛋白致敏性提供重要的理论依据。关于热处理调控β-伴大豆球蛋白抗原性的机理还有待进一步研究与探讨。
[1]GRAHAM P H,VANCE C P.Legumes:-importance and constraints to greater use[J].Plant Physiology,2003,131(3):872-877.
[2]HAMMOND B G,JEZ J M.Impact of food processing on the safety assessment for proteins introduced into biotechnology-derived soybean and corn crops [J].Food and Chemical Toxicology,2011,49(4):711-721.
[3]KATZ Y,GUTIERREZ-CASTRELLON P,GO-NZÁLEZ M G,et al.A Comprehensive review ofsensitization and allergy to soy-based products [J].Clinical Reviews in Allergy and Immunology,2014,46(3):272-281.
[4]HUI Y,GAO J,YANG A,et al.Allergenicity characteristics of germinated soybean proteins in a BALB/c mouse model [J].Regulatory Toxicology and Pharmacology,2015,170(2):249-255.
[5]PLAIMEIN A,ELVIRAGONZALEZ D M.Purification,characterisation,and quantification of the soy allergen profilin (Gly m 3) in soy products [J].Food Chemistry,2010,119(4):1671-1680.
[6]HOLZHAUSER T,WACKERMANN O,BALLMER-WEBER B K,et al.Soybean (Glycine max)allergy in Europe:Gly m 5 (betaconglycinin) and Gly m 6 (glycinin) are potential diagnostic markers for severe allergic reactions to soy [J].Journal of Allergy and Clinical Immunology,2009,123(2):452-458.
[7]MIRYAM A B,VASILEIOSI A,PASQUALE F,et al.Carbohydrate moieties on the in vitro immunoreactivityofsoy β-conglycinin[J].Food Research International,2009,42 (7):819-825.
[8]KOSHIYAMA I,FUKUSHIMA D.Identification ofthe 7S globulin with β-conglycinin in soybean seeds [J].Phytochemistry,1976,15(15):157-159.
[9]BREITENEDER H,RADAUER C.Aclassifcation of plant food allergens [J].Journal of Allergy and Clinical Immunology,2004,113(5):821-830.
[10]PERRY T T,PESEK R D.Clinical manifestations of food allergy[J].Pediatric Annals,2013,42(6):96.
[11] KASERA R,SINGH A,KUMAR R,et al.Effect of thermal processing and γ-irradiation on allergenicity of legume proteins[J].Food and Chemical Toxicology,2012,50 (10):3456-3461.
[12]史晓霞,马美湖,王丽英,等.热处理对蛋清卵类粘蛋白过敏原性及构象的影响[J].光谱学与光谱分析,2012,32(9):2487-2491.
[13]THANH V H,SHIBASAKI K.Major proteins of soybean seeds. A straightforward fractionation and theircharacterization [J].Journal of Agricultural and Food Chemistry,1976,24(6):1117-1121.
[14]LIU C,WANG H,CUI Z,et al.Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J].Food Chemistry,2007,102(4):1310-1316.
[15]宋佳.大豆11S和7S球蛋白提取及其凝胶显微结构研究[D].天津:天津科技大学,2013.
[16]KATO A,SHIMOKAWA K,KOBAYASHI K.Improvement of the functional properties of insoluble gluten by Pronase digestion followed by dextran conjugation [J]. Journal of Agricultural and Food Chemistry,1991,39(6):1053-1056.
[17]张楠,布冠好,朱婷伟,等.糖基化反应对大豆蛋白-乳糖复合物抗原性及结构的影响[J].现代食品科技,2015,31(8):117-121.
[18]方佳茂,刘偲琪,庄楚周,等.复合酶水解蚕蛹蛋白制备功能性寡肽的工艺研究[J].现代食品科技,2012,28(3):323-328.
[19] IWABUCHI S,WATANABE H,YAMAUCHI F.Thermal denaturation of β-conglycinin.Kinetic resolution of reaction mechanism [J].Journal of Agricultural and Food Chemistry,2002,39(1):27-33.
[20] IWABUCHI S, WATANABE H, YAMAUCHI F.Observations on the dissociation of betaconglycinin into subunits by heat treatment[J]. Journal of Agricultural and Food Chemistry,2002,39(1):34-40.
[21]郭健.大豆蛋白热聚集行为控制及其结构表征的研究[D].广州:华南理工大学,2012.
[22]TONG P,GAO J,CHEN H,et al.Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin [J].Food Chemistry,2012,131(2):603-610.
[23]王治平.菜籽分离蛋白糖接枝改性及其功能、结构和消化吸收特性研究[D].镇江:江苏大学,2016.
[24]穆利霞.大豆蛋白-糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学,2010.
[25]ACHOURI A,BOYE J I.Thermal processing,salt and high pressure treatment effects on molecular structure and antigenicity of sesame protein isolate [J].Food Research International,2013,53(1):240-251.
[26] 李岩涛.热处理对大豆抗原蛋白结构影响与免疫活性的研究[D].长春:吉林农业大学,2013.
INFLUENCE OF HEAT TREATMENT ON THE IMMUNOACTIVITY AND STRUCTURES OF β-CONGLYCININ
ZHAO Yifei,BU Guanhao,CHEN Fusheng
(School of Food Science and Technology,Henan University of Technology,Zhengzhou450001,China)
Soybean protein is rich in nutrients,but is easy to lead allergic reactions. There are 34 kinds of IgE mediated allergenic protein have been found,of which two kinds of β-conglycinin and glycinin are considered to be the major allergenic protein. Heat treatment,as a common processing method,can significantly affect the antigenicity of β-conglycinin. β-conglycinin was isolated by alkali-soluble acid precipitation method in this study,and the anti-gencity changes of β-conglycinin under different conditions were determined by indirect competitive ELISA method. And the solubility,immunoactivity and the structural properties of the products after heat treatment were also studied. The results showed that heat treatment could effectively reduce the antigenicity of β-conglycinin. After heat treatment,the solubility of β-conglycinin increased firstly and then decreased with the increasing of temperature. The results of immunoblotting showed that the immunoreactivity of β-conglycinin decreased after heat treatment,but it was not completely removed. The results of Fourier transform infrared spectroscopy showed that the contents of α-helix and β-sheet decreased,β-corner and irregular structure contents increased after heat treatment. The increase of disordered structure and the change of space structure leaded to the epitope coverd, thereby the antigenicity of β-conglycinin was reduced. The study will provide an important theoretical basis for the selection of suitable heat treatment conditions to reduce the sensitization of soybean protein in food processing.
β-conglycinin;heat treatment;antigenicity;structure
TS 201.2 文献标志码:B
1673-2383(2017)05-0050-07
http://kns.cnki.net/kcms/detail/41.1378.N.20171030.0936.020.html
网络出版时间:2017-10-30 9:36:37
2017-04-15
国家自然科学基金项目(31201293);河南省教育厅科学技术研究重点项目(14B550013);河南工业大学省属高校基本科研业务费专项(2015RCJH02)
赵益菲(1992—),女,山西阳泉人,硕士研究生,研究方向为食品蛋白质资源开发与利用。
*通信作者
