树蝴蝶多糖的理化性质和抗氧化活性研究
2017-11-10耿佳欢申超群
耿佳欢,申超群,董 芳,陈 健
(华南理工大学 食品科学与工程学院,广东 广州 510640)
树蝴蝶多糖的理化性质和抗氧化活性研究
耿佳欢,申超群,董 芳,陈 健*
(华南理工大学 食品科学与工程学院,广东 广州 510640)
以树蝴蝶为原料,通过响应面分析获得超声辅助提取的最佳工艺。粗多糖通过脱色,除蛋白和DEAE-52柱层析得到LKY-I、LKY-II、LKY-III 3种纯化多糖;通过GPC结合SephadexG-100鉴定其分子质量及纯度,利用I2-KI、苯酚-硫酸、考马斯亮蓝G-250、硫酸-咔唑法测定其理化性质;通过测定DPPH、ABTS+自由基清除率及还原力评价LKY-I、LKY-II、LKY-III的抗氧化能力。根据响应面分析,得到多糖提取最佳工艺为:功率80 W、时间15 min、液料比25∶1,此时得率为 4.39%。 LKY-I、LKY-II、LKY-III分子质量分别为 61 598、122 495、697 243u; 总糖含量分别为88.91%、74.05%、59.18%;糖醛酸含量分别为:13.21%、15.12%、16.02%;蛋白含量分别为0.13%、0.46%、0.91%;3种多糖不含可溶性淀粉和核酸。研究表明,多糖样品在0.25~10 mg/mL范围内均具有较强的抗氧化活性,说明树蝴蝶纯化多糖具有一定的抗氧化活性。
树蝴蝶;多糖;理化性质;抗氧化活性
0 引言
地衣是由藻类和真菌共同形成的共生复合体,是一种独特的植物资源,广泛存在于大自然中,丰富的地衣型真菌以及其复杂多样的活性成分是天然产物目前的研究热点[1-2]。地衣多糖及异地衣多糖是地衣特有的主要出生代谢产物,研究表明,地衣多糖具有较强的抗氧化活性及抗肿瘤活性,并且能增强机体的免疫能力。树蝴蝶作为地衣资源,广泛分布在陕西省内,药食两用,在民间已有多年的历史,但至今对于树蝴蝶多糖的研究较少,且不够系统。
本课题组拟通过对树蝴蝶多糖进行提取、分离纯化,并且对纯化多糖的理化性质和抗氧化活性进行全面研究,为树蝴蝶多糖的开发利用做好前期的基础研究工作。树蝴蝶又称为老龙皮、老龙七、肺衣、癞肚皮、石花等[3],是一种典型的地衣型真菌。靳菊情等[4]对老龙皮多糖的初级结构进行研究,结果表明老龙皮多糖主要是通过α(l-4)、α(1-6)糖苷键连接的杂多糖。王晓梅等[5]研究发现,老龙皮粗多糖和总皂苷具有较强的还原能力和OH·清除能力。张红等[6]通过对老龙皮多糖提纯分离,获得5个组分,并进一步对含量较高的两个组分进行分离,确定其单糖组成。地衣多糖的抗氧化活性具有开发为药物的潜力,但是对于树蝴蝶多糖的理化性质和抗氧化活性的相关研究较少,为深入开发这一药用资源,作者对树蝴蝶多糖进行优化提取、分离纯化,得到 LKY-I、LKY-Ⅱ及LKY-Ⅲ3种纯化多糖。
本文主要研究了以超声提取和热水浸提结合的方式优化提取树蝴蝶多糖。在单因素试验的基础上,采用响应面分析优化了多糖的最佳提取工艺,并通过GPC结合葡聚糖凝胶SephadexG-100鉴定其分子质量及纯度,同时测定了3种纯化多糖LKY-I、LKY-Ⅱ及LKY-Ⅲ的总糖、蛋白质、糖醛酸和淀粉含量,通过体外清除DPPH、ABTS+自由基以及还原力测定评价了其抗氧化活性,为开发利用这一药用资源提供了有用的信息和数据支持。
1 材料与方法
1.1 材料与试剂
树蝴蝶购买于广州市清平药材市场,由广东药科大学药科学院王定勇教授鉴定。
DPPH、牛血清白蛋白、考马斯亮蓝、半乳糖醛酸、 葡聚糖标品(5 200、 11 600、 23 800、 48 600、148 000、273 000、410 000、668 000 u): 美国 Sigma公司;D354FD树脂:广州广联津化化工有限公司;刚果红、正丁醇、氯仿、苯酚、硫酸、水杨酸、FeSO4·7H2O、铁氰化钾、无水乙醇均为国产分析纯。
1.2 仪器与设备
722-P型可见分光光度计:上海天翔仪器有限公司;KQ5200DE超声波清洗机:昆山市超声仪器有限公司;1525型高效液相色谱仪:美国Waters公司;UV1800紫外可见分光光度计:上海元析仪器有限公司;扫描电子显微镜(Carl Zeiss Jena GmbH-EVO 18):德国卡尔·蔡司有限公司。
1.3 方法
1.3.1 树蝴蝶粗多糖的超声辅助热水浸提工艺优化
准确称取5.000 g树蝴蝶粉末,放入100 mL锥形瓶中,加入一定比例蒸馏水,按照设定的各种条件(超声功率、超声时间、液料比)进行超声处理,然后80℃恒温水浴3 h,过滤,取上清液,采用苯酚-硫酸法测定多糖含量,单因素试验条件见表1。在单因素试验的基础上,结合Box-Benhnken中心组合设计原理,选取最优水平为试验的零水平,设计三因素三水平的回归试验,因素编码见表2,以超声功率、超声时间和液料比为主要参考因子,确定超声辅助提取树蝴蝶多糖的最佳工艺参数。

表1 单因素试验水平Table 1 Factors and levels of single factor experiment
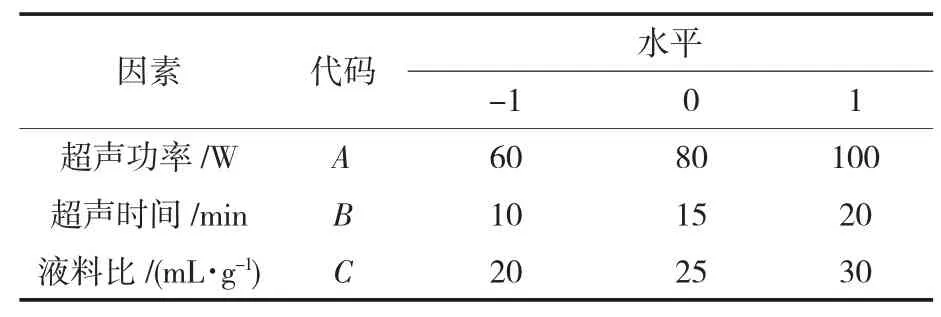
表2 响应面试验因素编码值Table 2 Factors and levels of the response surface design
1.3.2 树蝴蝶多糖的制备与纯化
树蝴蝶→粉碎过60目筛→最佳工艺条件下提取→抽滤、减压浓缩→D354FD树脂脱色→醇沉→离心(4 000 r/min,10 min)→烘干→蒸馏水复溶→Sevage法脱蛋白→醇沉、离心→50℃烘干(得树蝴蝶粗多糖)→样品溶解→DEAE-52离子交换柱层析→蒸馏水、0.1 mol/L NaCl、0.3 mol/L NaCl洗脱液洗脱→收集组分→减压浓缩、透析、冷冻干燥→得到LKY-I、LKY-Ⅱ及 LKY-Ⅲ 3种组分。
1.3.3 树蝴蝶纯化多糖的分子质量测定及纯度鉴定[7]
采用凝胶渗透色谱(Gel Permeation Chromatography,GPC) 法测定树蝴蝶纯化多糖LKY-I、LKY-Ⅱ及 LKY-Ⅲ的分子质量分布,色谱条件为TSK G-5000 PWXL column (7.8×300 mm) 和 TSK G-3000 PWXL column(7.8×300 mm)串联,流动相为0.02 mol/L的KH2PO4缓冲溶液,流速为0.6 mL/min,Waters 2414示差检测器,柱温35℃,运行时间为45 min。同时采用GPC与SephadexG-100柱层析结合的方法判定树蝴蝶精制多糖的纯度。
1.3.4 树蝴蝶纯化多糖的理化性质测定
紫外扫描:称取树蝴蝶纯化多糖LKY-I、LKY-Ⅱ及 LKY-Ⅲ各5 mg,将其配制成1 mg/mL的多糖溶液,以蒸馏水为对照,于190~500 nm处扫描。
总糖含量测定:采用苯酚-酸法。淀粉的测定:采用碘-碘化钾法[9]。糖醛酸的测定:采用硫酸-咔唑法[10]。蛋白质含量的测定:采用考马斯亮蓝G-250 法[11]。
1.3.5 树蝴蝶纯化多糖的扫描电镜分析
取树蝴蝶纯化多糖LLKY-I、LKY-Ⅱ及 LKY-Ⅲ样品少许黏着于样品台上,置于真空喷镀仪内镀上导电层,采用扫描电子显微镜观察其表面形貌,加速电压为10 kV。
1.3.6 树蝴蝶纯化多糖的抗氧化活性测定
1.3.6.1 DPPH自由基清除能力测定[12]
依次加 20 μL 不同质量浓度(0.25、0.50、1、2、4、6、8、10 mg/mL) 的 树 蝴 蝶 纯 化 多 糖 LKY-I、LKY-Ⅱ及 LKY-Ⅲ溶液和 180 μL 的 150 μmol/L DPPH溶液于96孔板中,517 nm处测吸光度值,空白对照组及阳性对照组分别用蒸馏水及Vc代替。DPPH·清除率(C)的计算公式如下:

式中:A0为空白对照孔的吸光度;A1为样品孔的吸光度。
1.3.6.2 ABTS法测总抗氧化能力[13]
将7 mmol/L的 ABTS水溶液及4.9 mmol/L的过硫酸钾水溶液按1∶1体积混合,得到ABTS母液,并将其用无水乙醇稀释至0.262 6 mmol/L。向96孔板中加入不同质量浓度的树蝴蝶纯化多糖LKY-I、LKY-Ⅱ及 LKY-Ⅲ 20 μL, 然后加入 180 μL的ABTS工作液,37℃避光振荡,反应6 min后在734 nm处测定吸光度值。空白对照组及阳性对照组分别用蒸馏水及Vc代替。ABTS自由基清除率(S)的计算公式如下:
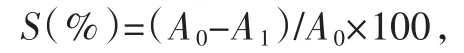
式中:A0为空白对照孔的吸光度;A1为样品孔的吸光度。
1.3.6.3 还原能力的测定[14]
FeSO4标准曲线绘制:于96孔板中依次加入不同浓度的 FeSO4标准溶液(0、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L)20 μL, 再加入 180 μL 的 0.83 mmol/L的TPTZ工作液,37℃避光振荡反应 10 min后,在最大吸收波长595 nm处测定吸光度值,以FeSO4的物质的量为横坐标,吸光度值为纵坐标,建立标准曲线。于96孔板中加不同质量浓度的树蝴蝶纯化多糖样品溶液20 μL,再依次加入180 μL TPTZ工作液,37℃避光振荡反应10 min后在595 nm处测定吸光度值。设置空白对照组及Vc阳性对照组。
2 结果与分析
2.1 单因素试验及响应面试验结果与分析
单因素试验和响应面试验结果见图1。如图1(A)所示,超声功率80 W,超声时间5 min,液料比25∶1时,多糖得率为最优水平。
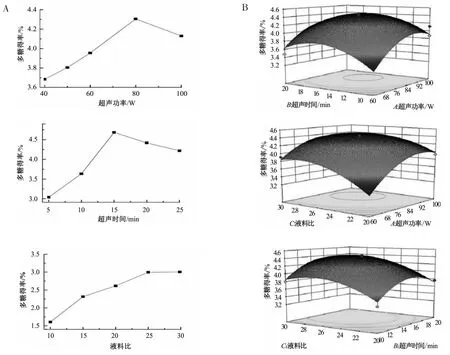
图1 单因素和响应面图Fig.1 Results of single factor and response surface experiments
如图1(B)所示,对多糖得率的影响因素的大小依次为:超声功率>液料比>超声时间。利用响应面预测模型和验证试验,得出最适提取工艺为:超声功率86.77 W,超声时间15.86 min,料液比26.61∶1,多糖得率为 4.48%。考虑到实际操作,将优化参数进行修正,即超声功率80 W、超声时间15 min、料液比为25∶1,得到树蝴蝶粗多糖的实际得率为4.39%。验证结果和理论预测结果吻合,表明试验拟合较好,因此利用响应面分析法得到的树蝴蝶多糖的提取工艺参数真实可靠,具有参考价值。
2.2 树蝴蝶多糖的离子交换层析
将粗多糖过DEAE-52阴离子交换柱,依次用蒸馏水,以及不同浓度的盐溶液洗脱,用苯酚-H2SO4法跟踪检测得到洗脱曲线,结果见图2。
如图2所示,可得到水洗多糖LKY-I、0.1 mol/L NaCl盐洗多糖LKY-Ⅱ及0.3 mol/L NaCl盐洗多糖LKY-Ⅲ,共3种多糖组分。
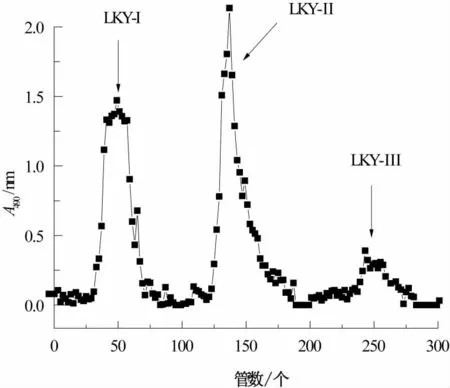
图2 离子交换柱层析洗脱曲线Fig.2 Elution curve of DEAE-52 column chromatography
2.3 树蝴蝶纯化多糖的分子质量测定及纯度鉴定
多糖的分子质量只代表相似链长的平均分布。采用凝胶渗透色谱法(GPC法)测定 LKY-I、LKY-Ⅱ及 LKY-Ⅲ的分子质量。
采用Breeze GPC软件得出葡聚糖相对分子质量分布标准曲线。葡聚糖标准品相对分子质量的对数(LogMw)对洗脱体积(V)回归处理的标准曲线为:LogMw=6.35e-1.22eV+9.51e-1V2-3.25e-2V3+3.91e-4V4。

图3 GPC图谱(A)和Sephadex-G100柱层析洗脱曲线(B)Fig.3 The GPC diagram(A) and elution curve on Sephadex G-100 chromatography(B)
图 3(A) 为 LKY-I、LKY-Ⅱ及 LKY-Ⅲ的GPC图谱,图 3(B)为其对应的 Sephadex-G100柱层析图。由图 3(A)和图 3(B)可知,LKY-I、 LKY-Ⅱ及 LKY-Ⅲ平均分子质量Mw分别为61 598、122 495、697 243 u;黏度平均分子质量Mn分别为:49 125、76 562、205 069 u; 峰位分子质量 Mp分别为:46 397、79 327、443 296 u,结果见表 3。由图3(A)可知多糖LKY-I、LKY-Ⅱ的GPC图谱分布均一,峰形相对对称,结合图3(B)所对应的Sephadex-G100柱层析图判定树蝴蝶纯化多糖LKY-I及LKY-Ⅱ为纯度较高的单一组分的杂多糖,而LKY-Ⅲ是一种分子质量相对较大且分布范围较广的杂多糖。
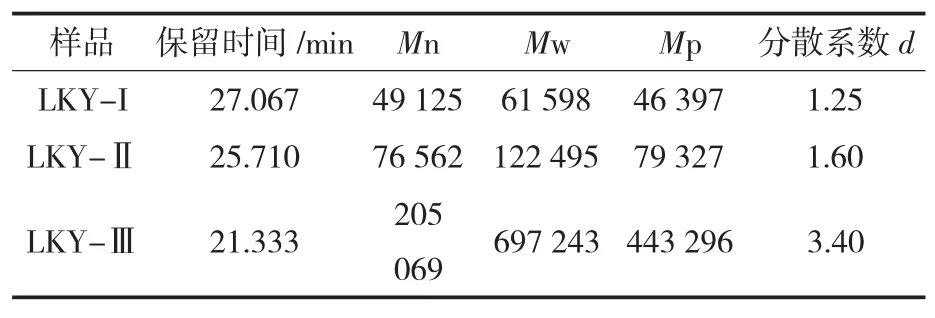
表3 树蝴蝶多糖的GPC结果Table 3 The GPC results of LKY-I,LKY-II and LKY-III
2.4 树蝴蝶纯化多糖的紫外光谱扫描
图4为LKY-I、LKY-Ⅱ及LKY-Ⅲ多糖的紫外扫描光谱图。由图4可知,LKY-I、LKY-Ⅱ及LKY-Ⅲ在260、280 nm处均没有明显特征吸收峰,说明LKY-I、LKY-Ⅱ及LKY-Ⅲ中不含蛋白质及核酸,或者两种组分含量很少。
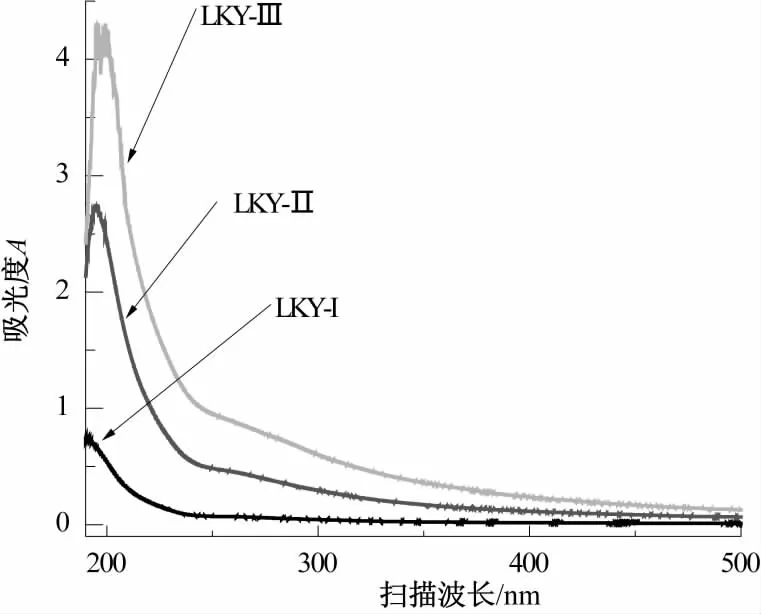
图4 树蝴蝶多糖的紫外扫描光谱图Fig.4 UV spectrum of LKY-I,LKY-II and LKY-III
2.5 树蝴蝶纯化多糖的理化性质
由表4可知,LKY-I、LKY-Ⅱ及 LKY-Ⅲ分别为白色、淡黄色、黄色棉絮状,不发生碘-碘化钾反应,属于非淀粉多糖;苯酚-硫酸法葡萄糖标准曲线为 y=8.207 3x-0.016 1,R2=0.999 3, 测得 3种纯化多糖的总糖含量分别为88.91%、74.05%、59.18%;考马斯亮蓝G-250标准曲线方程为y=8.837 1x+0.009 6,R2=0.996 3, 测得 LKY-I中蛋白质含量为0.13%,LKY-Ⅱ及 LKY-Ⅲ中的蛋白质含量分别为0.46%、0.91%;硫酸-咔唑法测定糖醛酸含量的标准曲线方程为y=4.449 4x-0.015 7,R2=0.997 3,LKY-I、LKY-Ⅱ及 LKY-Ⅲ反应均呈阳性,且测得糖醛酸含量分别为13.21%、15.12%、16.02%。

表4 树蝴蝶多糖的理化性质Table 4 Physiochemical properties of LKY-I,LKYII and LKY-III
2.6 树蝴蝶多糖的SEM分析
不同来源的多糖,尽管结构不同,但综合颗粒的各种外貌特征,可以分辨开来。因此,扫描电子显微镜技术也可以作为区别和鉴定不同类型多糖物质的一种快速而有效的手段。树蝴蝶多糖LKYI、LKY-Ⅱ及 LKY-Ⅲ的SEM图像如图5所示,从外观形貌上看,在扫描电镜图片下,树蝴蝶多糖呈不规则的片状、棒状、团状等不同形状,从表面的平整光洁程度来看,LKY-Ⅲ>LKY-I>LKY-Ⅱ,LKY-Ⅱ碎片较多。LKY-I、LKY-Ⅱ及 LKY-Ⅲ的表面形态具有较大的差异,可以作为区分和鉴别3种多糖的依据。
2.7 抗氧化活性
活性多糖是指具有某种特殊生理活性的多糖化合物,是一类广泛存在于植物、动物和微生物中的天然活性物质,大部分具有调节机体免疫力[15]、抗肿瘤[13]、抗氧化[7]等功效。抗氧化是多糖研究的重要领域之一,抗氧化多糖与其他外源性抗氧化剂相比,具有低毒、安全和来源广等优点。
通过测定DPPH·吸收强弱的程度,可间接评价该自由基清除剂的活性[16]。在树蝴蝶多糖清除DPPH·能力的测定中,Vc作为阳性对照。如图6所示,当 Vc质量浓度为 400 μg/mL时,对 DPPH·自由基的清除率达到86.71%,随着树蝴蝶多糖质量浓度的增大,清除自由基的能力就越强,10 mg/mL的LKY-I、LKY-Ⅱ及 LKY-Ⅲ对DPPH·自由基的清除率分别为44.12%、49.64%、52.39%,稍高于100 μg/mL 的 Vc(清除率为 43.89%),可以看出树蝴蝶纯化多糖均可以提供清除DPPH·自由基的氢供体且具有一定清除效果,且高浓度LKY-Ⅲ多糖对DPPH自由基的清除能力优于其他多糖组分。
ABTS+自由基和DPPH自由基类似,均为稳定的有机自由基,样品抗氧化能力越强,其提供电子的能力也就越强,因此可以通过测定反应液吸光度的变化,直接反映出样品还原能力的大小[17]。从图7可知,在0.25~10 mg/mL质量浓度范围内,树蝴蝶多糖对ABTS自由基的清除能力均随多糖的质量浓度增大而增加,当样品质量浓度为10 mg/mL时,ABTS自由基的清除力达到最大值,分别为24.74% 、19.95% 、17.2% , 与 100 μg/mL 的 Vc(24.56%)相当,说明树蝴蝶多糖有清除ABTS+自由基的能力,且对ABTS+自由基的清除能力的大小顺序为 LKY-I>LKY-Ⅱ>LKY-Ⅲ。

图5 树蝴蝶多糖的SEM图像Fig.5 SEM of LKY-I(A),LKY-II(B) and LKY-III(C)
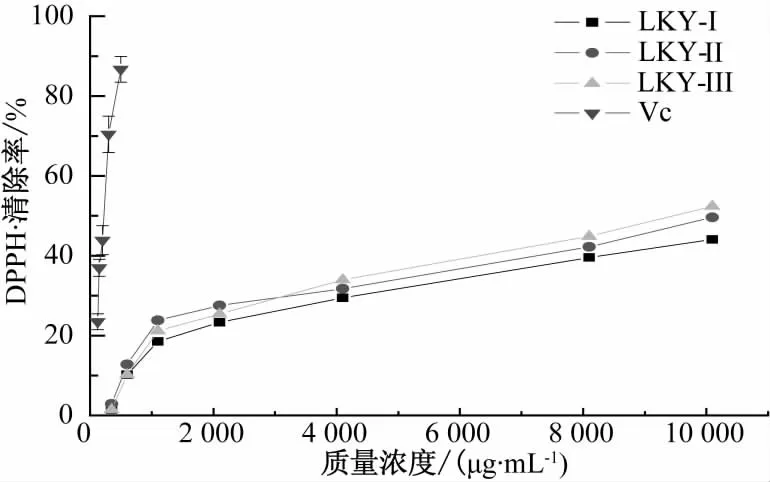
图6 不同多糖对DPPH·的清除活性Fig.6 DPPH free radical scavenging capability of LKY-I,LKY-II and LKY-III
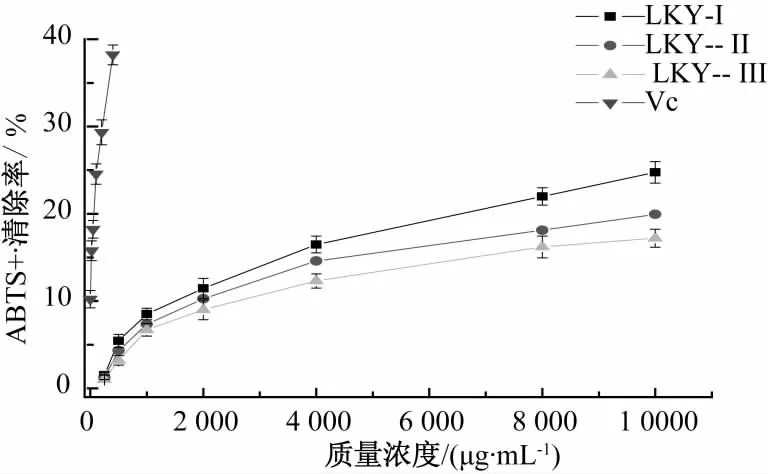
图7 不同多糖对ABTS+·的清除活性Fig.7 ABTS free radical scavenging capability of LKY-I,LKY-II and LKY-III
采用铁还原(FRAP)分析法评估树蝴蝶纯化多糖的抗氧化能力大小[18],结果见图8。由图8可以看出,LKY-I、LKY-Ⅱ及 LKY-Ⅲ多糖参照 Vc来看,都具有一定的抗氧化能力。FeSO4标准曲线为:Y=0.966X+0.023(R2=0.996 0),其中 X 是 FeSO4的浓度(mmol/L),Y 是对应的吸光值。其中,LKY-Ⅲ多糖抗氧化能力最强,显著高于LKY-Ⅱ及LKY-I多糖。在0.25~10 mg/mL范围内,树蝴蝶多糖还原能力随着质量浓度的增大而增大,当样品质量浓度为10 mg/mL时,LKY-I、LKY-Ⅱ及 LKY-Ⅲ多糖的FRAP值达到 0.071 17 mmol/L、0.113 591mmol/L、0.211 54mmol/L, 稍高于 100 μg/mL Vc (0.072 31 mmol/L),说明树蝴蝶纯化多糖具有还原三价铁离子的能力。由于Vc是高纯度阳性对照物,所以同质量浓度下树蝴蝶的抗氧化活性虽不及Vc,但10 mg/mL树蝴蝶多糖的抗氧化能力与微克级别的Vc相比,仍可作为抗氧化剂应用于食药工业。

图8 不同多糖样品的还原能力Fig.8 Reducing power of LKY-I,LKY-II and LKY-III
3 结论
通过单因素试验,运用响应面分析法确定了树蝴蝶多糖超声辅助提取工艺的影响因素。对多糖得率的影响大小依次为:超声功率>液料比>超声时间。利用响应面预测模型和验证试验,得出最适提取工艺为超声功率86.77 W、超声时间15.86 min、料液比为 26.61∶1,多糖得率为 4.48%。考虑到实际因素的局限性,将优化参数进行修正,即超声功率 80 W、超声时间 15 min、料液比为 25∶1,得到树蝴蝶粗多糖的实际得率为4.39%。采用最佳工艺制备树蝴蝶粗多糖,通过大孔树脂脱色,Sevage法除蛋白和DEAE-52柱层析分离纯化得到LKY-I、LKY-Ⅱ及LKY-Ⅲ;其平均分子质量Mw分别为61 598、122 495、697 243 u;3 种纯化多糖 LKY-I、LKY-Ⅱ及LKY-Ⅲ的多糖含量分别为88.91%、74.05%、59.18%;糖醛酸含量分别为 13.21%、15.12%、16.02%;蛋白质含量分别为 0.13%、0.46%、0.91%;3种多糖均不含可溶性淀粉和核酸。扫描电镜分析可得,树蝴蝶多糖呈不规则的片状、棒状、团状等不同形状,且表面结合较为紧密,但集聚体整体性不强,说明 LKY-I、LKY-Ⅱ及LKY-Ⅲ多糖为无定型结构。树蝴蝶多糖的抗氧化活性研究表明,各多糖样品在0.25~10 mg/mL的范围内均具有抗氧化活性,且与多糖质量浓度呈正相关。高质量浓度LKY-Ⅲ多糖对DPPH自由基的清除能力优于其他多糖组分;对ABTS+自由基的清除能力LKY-I优于其他多糖组分;对Fe3+的还原能力则是LKY-Ⅲ最强,高质量浓度LKY-Ⅲ的FRAP值可达到0.211 54 mmol/L,试验表明树蝴蝶纯化多糖具有一定的抗氧化活性。
[1]李世全.秦岭巴山天然药物志[M].西安:陕西科学技术出版社,1987.
[2]余传隆.中药辞海.第一卷[M].北京:中国医药科技出版社,1993:1899-1900.
[3]杜远东.老龙皮的药效物质及质量标准研究[D].咸阳:陕西中医学院,2012:1-2.
[4]靳菊情,丁东宁,边晓丽,等.老龙皮多糖的研究[J].中药材,1997(7):355-357.
[5]王晓梅,李健,李宗孝,等.老龙皮提取物的体外抗氧化活性研究[J].现代中医药,2010(5):79-80.
[6]张红,孙婷婷,王海峰,等.老龙皮多糖分离纯化及糖组成研究[J].中国药业,2016(13):40-43.
[7]HAN X,SHEN S,LIU T,et al.Characterization and antioxidant activities of the polysaccharides from Radix Cyathulae officinalis Kuan [J].International Journal of Biological Macromolecules,2015,72:544-552.
[8]AHMADIAN-MOGHADAM H ,ELEGADO F B,NAYVE R.Prediction of ethanol concentration in biofuel production using artificial neural networks [J].American Journal of Modeling and Optimization,2013,1(3):31-35.
[9]刘莹,赵杰.褐蘑菇多糖的理化性质初步研究[J].湖北农业科学,2012,51(5):981-982.
[10]YING L,HUANG L,TIAN G.An improved method for the quantitative determination of uronic acid[J].Chinese Traditional&Herbal Drugs,1999,30(11):817-819.
[11] BRADFORD M M.A rapidandsensitive method for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[12] CUMBY N,ZHONG Y,NACZK M,et al.Antioxidant activity and water-holding capacity ofcanola protein hydrolysates [J].Food Chemistry,2008,109(1):144-148.
[13]HE R,ZHAO Y,ZHAO R,et al.Antioxidant and antitumor activities in vitro of polysaccharides fromE.sipunculoides[J].International Journal of Biological Macromolecules,2015,78:56-61.
[14] VASCO C, RUALES J, KAMAL-ELDIN A.Total phenolic compounds and antioxidant capacities of major fruits from Ecuador[J].Food Chemistry,2009,111(4):816-823.
[15] YAO Y,ZHU Y,GAO Y,et al.Effect of ultrasonic treatment on immunological activities of polysaccharides from adlay [J].International Journal of Biological Macromolecules,2015,80:246-252.
[16]孙艳梅,徐雅琴,杨林.天然物质类黄酮的抗氧化活性的研究 [J].中国油脂,2003,28(3):54-57.
[17]YEN G C,DUH P D.Scavenging effect of methanolic extracts of peanut hulls on freeradical and active-oxygen species[J].Journal of Agricultural and Food Chemistry,1994,42(3):629-632.
[18]孟繁磊,陈瑞战,张敏,等.刺五加多糖的提取工艺及抗氧化活性研究[J].食品科学,2010(10):168-174.
PHYSICO-CHEMICAL PROPERITIES AND ANTIOXIDANT ACTIVITY OF POLYSACCHARIDES FROM LOBARIA KUROKAUAE YOSHIM
GENG Jiahuan,SHEN Chaoqun,DONG Fang,CHEN Jian
(School of Food Science and Engineering,South China University of Technology,Guangzhou510640,China)
The response surface method (RSM) was used to optimize the ultrosonic extraction process of polysaccharides fromLobaria kurokauaeYoshim. Crude polysaccarides were further processed by decoloration,deproteinization with sevage method and DEAE-52 ion-exchange column choromatography to obtain three components LKY-I,LKY-II and LKY-III. The molecular mass and purifity of the three components were identified by gel permeation chromatography and Sephadex G-100 gel column chromatography; the physico-chemical properties were also determined by iodine-potassiumiodide,phenol-sulphuric acid,coomassie brilliant blue G-250,and sulfuric acid-carbazole method; and the antioxidant activity of LKY-I,LKY- II and LKY- III were evaluated by determining the DPPH and ABTS+ free radicals scavenging rate as well as the reducing power. Results showed that the optimum polysaccharide extraction conditions were as follows: power 800 W,extraction time 15 minutes,and liquid-to-material ratio 25:1,and the polysaccharide yield reached 4.39%.The molecular masses of LKY-I,LKY- II and LKY- III were 61 598 Da,122 495 Da and 697 243 Da; the total sugar content were 88.91%,74.05% and 59.18%; the uronic acid content were 13.21%,15.12% and 16.02%,and the protein content were 0.13% ,0.46% and 0.91% ,respectivley; and the three kinds of polysaccarides LKY-I,LKY- II and LKY- III did not contain soluble starch and nucleic acid. Antioxidant activity tests showed that the polysaccaride samples had high antioxidant activity in 0.25 to 10 mg/mL.
Lobaria kurokauaeYoshim;polysaccharides;physico-chemical property;antioxidant activity
TS 201.2 文献标志码:B
1673-2383(2017)05-0068-08
http://kns.cnki.net/kcms/detail/41.1378.N.20171030.0936.026.html
网络出版时间:2017-10-30 9:36:38
2017-02-12
广东省自然科学基金项目(2014A030313242)
耿佳欢(1993—),女,河北邢台人,硕士研究生,研究方向为天然产物化学。
*通信作者
