外源GA3对毛竹实生苗茎秆生长及CesA基因表达的影响
2017-11-10胡尚连卢学琴
姜 勇 胡尚连* 曹 颖 卢学琴 黄 艳 徐 刚
(1.西南科技大学生命科学与工程学院植物细胞工程实验室,绵阳 621010; 2.四川省生物质资源利用与改性工程技术研究中心,绵阳 621010)
外源GA3对毛竹实生苗茎秆生长及CesA基因表达的影响
姜 勇1,2胡尚连1,2*曹 颖1,2卢学琴1,2黄 艳1,2徐 刚1,2
(1.西南科技大学生命科学与工程学院植物细胞工程实验室,绵阳 621010;2.四川省生物质资源利用与改性工程技术研究中心,绵阳 621010)
以毛竹实生苗为试验材料,研究不同浓度外源GA3(0,0.1,0.5,1 μmol·L-1)对毛竹生长及CesA基因表达的影响。结果表明,与未经GA3处理相比,施用外源GA3后,毛竹实生苗茎节间和纤维细胞显著伸长,初生壁纤维素合成相关基因PeCesA2和PeCesA6相对表达量明显上调,次生壁相关基因PeCESA4和PeCESA4-1显著下调,傅里叶红外光谱分析(FTIR),发现毛竹茎秆纤维素特征峰强度(1 060,1 160及1 373 cm-1)随着GA3浓度升高而逐渐增强,表明施用外源GA3能够影响毛竹茎秆CesA基因表达,PeCesA2和PeCesA6的表达与外源GA3促进纤维细胞伸长的过程存在一定联系。
毛竹实生苗;GA3;纤维细胞;CesA基因
纤维素是植物初生壁和次生壁的主要成分,是由CesA亚基构成的玫瑰花状蛋白复合体合成的,该蛋白质复合体由六个玫瑰状亚基组成一个较大的玫瑰花状蛋白复合体[1]。但参与初生和次生细胞壁纤维合成的CesA基因并不相同,拟南芥中与初生壁合成相关的是AtCesA1、AtCesA6和AtCesA3;次生壁相关的是AtCesA8、AtCesA7和AtCesA4[2]。高粱中,SbCesA1、SbCesA6和SbCesA3与初生壁合成有关;SbCesA4、SbCesA7和SbCesA8与次生壁合成相关[3]。水稻中,与初生壁相关的是OsCesA1、OsCesA3和OsCesA6;次生壁相关的是OsCesA4、OsCesA7和OsCesA9[4]。
赤霉素(GA3)是调节植物生长和发育的双萜植物激素,是在对水稻恶苗病的研究中首次发现的,当水稻感染Gibberellafujikuroi(一种病原霉菌)后,这种病原菌将会产生大量的GA3使得茎秆过度伸长[5~6]。研究表明,当高粱中GA20-氧化酶突变后,内源GA3缺失,与野生型相比,3种初生壁合成相关CesA基因(SbCesA1,3,6)表达下调,且株型矮小纤维含量降低,而这一突变可通过添加外源活性的GA3而得以恢复[3]。这暗示GA3与CesA基因之间可能存在一定关系。
毛竹(Phyllostachysedulis)纤维长宽比为115.8~172.5[7],高于杨树纤维的长宽比(45.3)[8],但比棉纤维的低(1 000~3 000)[9]。研究表明,外源喷施GA3后,新分蘖竹株秆高、节间长和纤维细胞长均有极显著增加,即外源GA3能显著改善毛竹实生苗新分蘖竹株的竹材纤维质量[10]。但关于毛竹CesA基因表达调控研究还未见报道。鉴于此,本文以不同浓度外源GA3诱导处理毛竹实生苗植株,研究其对毛竹实生苗茎秆生长、纤维素特征吸收峰及CesA基因表达的影响,为毛竹遗传改良提供理论依据。
1 材料与方法
1.1 供试材料
挑选约500粒饱满的毛竹种子于50℃温水中浸泡30 min[11],然后将其放置在加有滤纸的平皿中,在其中加入5 mL纯水,在25℃下培养2 d待其发芽,挑选200粒长势一致萌发的毛竹种子为参试材料(图1A),移至带滤纸的平皿中,每一平皿放置10粒种子,并向其中添加5 mL不同浓度的GA3(0,0.1,0.5,1 μmol·L-1),以上处理均放置于光照培养箱中(25℃,2 000 lx,8 h光周期)培养。每处理5个重复,每个重复10粒萌发种子,每天换一次液体,每次5 mL,连续处理23 d。23 d后测量50株毛竹实生苗高度、节间长度和节数。取每一处理50株实生苗基部第二节间,将其分成5份,每份10根茎段,选取其中3份将其切割成1 cm长的茎段并分别混匀,放置于液氮中并保存在-80℃冰箱中,以供纤维含量测定及RNA提取;剩下的两份将其切割成1 cm左右的茎段于离析液中离析,以供纤维细胞长度测定。
1.2 测定方法
1.2.1 纤维细胞长度测定
将各处理的毛竹第二节间切割成1 cm左右的小段,于离析液(10% HNO3,10% H2CrO4)中浸泡1 d左右,待其组织软化,用清水冲洗至中性。吸取100 μL液体于载玻片上,盖上盖玻片于Leica DMI3000倒置荧光显微镜观察纤维细胞并拍照,每个处理选择完整的200个纤维细胞,使用Image-Pro Plus 6.0软件处理图片并测量纤维细胞长度。
1.2.2 纤维素含量测定
采用傅里叶红外光谱分析法(Fourier transform infrared spectroscopy,FTIR)测量细胞壁中的纤维和木素含量,将茎秆由-80℃取出,加入液氮研磨至细粉状,再用低温的磷酸缓冲液(50 mmol·L-1,pH7.2)漂洗5次,用70%酒精在70℃条件下孵育1 h,连续两次。真空干燥后,将抽提出的细胞壁物质进行FTIR分析。
1.2.3 CesA基因系统发育树构建
从毛竹数据库(http://www.bamboogdb.org/page/download.jsp)搜索到毛竹CesA氨基酸序列(PeCesA4(PH01000746G0570),PeCesA4-1(PH01000018G0380),PeCesA5(PH01000040G0670),PeCesA6(PH01000204G0350)),从NCBI搜索到毛竹CesA氨基酸序列(PeCesA1(ACZ82296.1),PeCesA2(ACZ82297.1),PeCesA3(ACZ82298.1));水稻CesA氨基酸序列(OsCesA1(XP_015639380.1),OsCesA3(XP_015646807.1),OsCesA6(XP_015647044.1),OsCesA4(XP_015621242.1),OsCesA7(XP_015614140.1),OsCesA9(XP_015612279.1));高粱CesA氨基酸序列(SbCesA4(XP_002467109.1),SbCesA7(XP_002460229),SbCesA1(XP_002440694),SbCesA3(XP_002463687.1),SbCesA6(XP_002459635.1))。使用MEGA7.0软件以拟合的最优模型(JTT+G)[12~13],选用最大似然法(Maximum Likelihood,ML),Bootstrap值定为1 000进行系统发育树构建。
1.2.4 CesA基因表达水平测定
参照OMEGA Plant RNA Kit说明书,提取毛竹茎秆总RNA,0.8%琼脂糖凝胶电泳检测RNA质量。参照天根FastQuant RT Kit说明书,选取质优量高的RNA用于cDNA的合成。在毛竹数据库和GenBank数据库中搜索毛竹CesA基因和毛竹内参基因Tublin(PH01001724G0160),使用DNAMAN软件对搜索到的序列进行比对分析,并以高度可变区域为模板使用Primer Premier 5.0软件设计引物(表1),参照天根RealMasterMix(SYBR Green)说明书进行实时荧光定量分析。以内参基因Tubulin为对照,采用2-△△CT计算法计算其相对表达量。
1.2.5 数据分析
用SPSS 17.0软件对毛竹实生苗高度、节间长度、纤维细胞长度进行方差分析。
表1CesA基因实时荧光定量引物
Table1TheprimersofCesAforquantitativeReal-timePCR
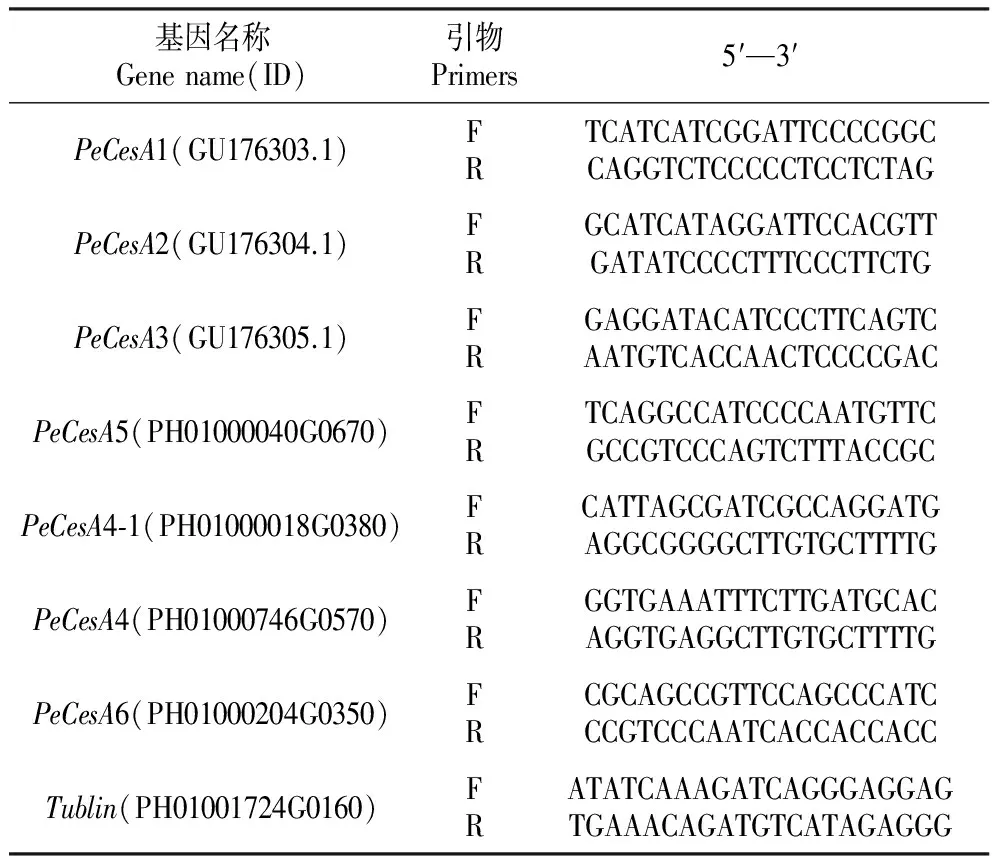
基因名称Genename(ID)引物Primers5′—3′PeCesA1(GU176303.1)FRTCATCATCGGATTCCCCGGCCAGGTCTCCCCCTCCTCTAGPeCesA2(GU176304.1)FRGCATCATAGGATTCCACGTTGATATCCCCTTTCCCTTCTGPeCesA3(GU176305.1)FRGAGGATACATCCCTTCAGTCAATGTCACCAACTCCCCGACPeCesA5(PH01000040G0670)FRTCAGGCCATCCCCAATGTTCGCCGTCCCAGTCTTTACCGCPeCesA4⁃1(PH01000018G0380)FRCATTAGCGATCGCCAGGATGAGGCGGGGCTTGTGCTTTTGPeCesA4(PH01000746G0570)FRGGTGAAATTTCTTGATGCACAGGTGAGGCTTGTGCTTTTGPeCesA6(PH01000204G0350)FRCGCAGCCGTTCCAGCCCATCCCGTCCCAATCACCACCACCTublin(PH01001724G0160)FRATATCAAAGATCAGGGAGGAGTGAAACAGATGTCATAGAGGG

图1 萌发的毛竹种子和不同浓度GA3处理毛竹实生苗生长状况 A.处理前萌发的毛竹种子;B~C.不同浓度GA3处理23 d后的毛竹幼苗Fig.1 The germinating seed of P.edulis and the growth status of P.edulis seedlings treated by the different concentration of GA3 A.The germinating seed of P.edulis before treatment; B,C.The P.edulis seedlings treated by the different concentration of GA3 for 23 days

GA3浓度ConcentrationofGA3(μmol·L-1)基部第一节间长度Thelengthoffirstinternodefromthebottom(cm)基部第二节间长度Thelengthofsecondinternodefromthebottom(cm)基部第三节间长度Thelengthofthirdinternodefromthebottom(cm)幼苗高度Theheightofseedings(cm)0.00.45±0.20D1.57±0.22C0.90±0.19B2.92±0.13C0.11.22±0.20C2.24±0.35B1.65±0.37A5.11±0.26B0.51.90±0.40B2.73±0.53B1.82±0.08A5.54±0.25B1.02.81±0.46A3.77±0.55A1.94±0.30A8.52±0.36A
注:表中数值为平均值±标准差 不同大写字母表示在0.01水平上差异显著(P<0.01),下同。
Note:Data are mean±SD.The different capital letters in the same group respect the significance at the 0. 01 level(P<0.01).The same as below.
2 结果与分析
2.1GA3对毛竹实生苗茎节间伸长的作用
每一处理实生苗的表型特征(图1:B~C)。与未经GA3处理相比,不同浓度外源GA3处理后,毛竹实生苗平均株高、平均节长都达到了差异极显著水平;经0.1、0.5、1.0 μmol·L-1外源GA3处理后,基部第一节间长度分别增加171%、322%、524%;基部第二节间长度分别增加43%、74%、140%;基部第三节间分别增加83%、102%、116%;株高分别增加75%、90%、192%(表2)。表明在毛竹实生苗生长期间施用GA3能显著促进毛竹实生苗株高的增加,而竹株高度的增加主要来自于各节间伸长。
2.2GA3对纤维细胞伸长和纤维素特征峰的影响
施用外源GA3后,毛竹实生苗茎秆纤维细胞长度显著增加(P<0.01),与未经GA3处理的相比,0.1、0.5、1.0 μmol·L-1处理分别伸长了48%、56%、82%(图2,图3A),表明GA3可促进纤维细胞伸长。

图2 不同浓度GA3处理毛竹实生苗茎杆纤维细胞 A. 0 μmol·L-1;B. 0.1 μmol·L-1;C. 0.5 μmol·L-1;D. 1 μmol·L-1Fig.2 The fiber cells of stem from the seedling in P.edulis treated by the different concentration of GA3 A. 0 μmol·L-1; B. 0.1 μmol·L-1; C. 0.5 μmol·L-1; D. 1μmol·L-1
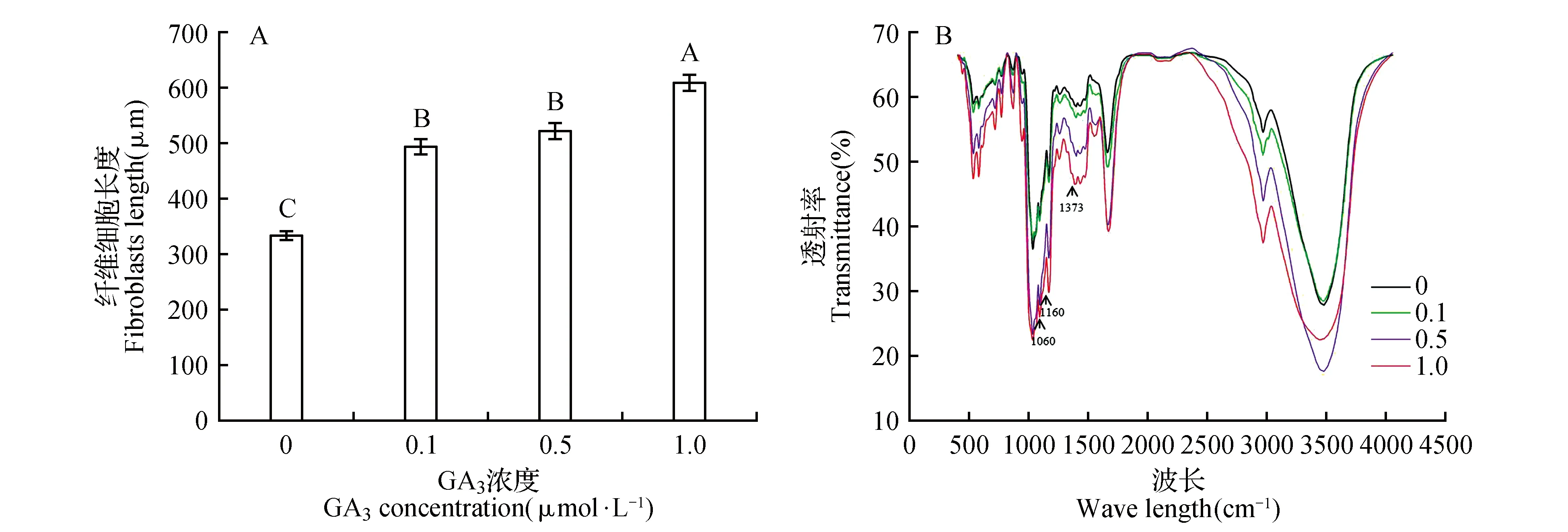
图3 不同浓度GA3处理纤维细胞长度(A)和毛竹茎秆细胞壁物质的傅里叶红外光谱分析(FTIR)(B) 箭头指示纤维素特征吸收峰。Fig.3 The length of fiber cell(A) and fourier transform infrared spectroscopy(FTIR) analysis of cell wall material(B) from the stem of seedling in P.edulis treated by the different concentration of GA3 The arrow indicates the characteristic absorption peak of cellulose.
孙柏玲等[14]采用红外光谱法和二维相关红外光谱分析技术对慈竹单根纤维进行研究,发现在1 248~1 032 cm-1,1 373 cm-1处存在纤维素特征吸收峰,分别代表C—O伸缩振动和C—H弯曲振动。采用傅里叶红外光谱分析技术对毛竹实生苗茎秆细胞壁物质进行分析,发现4种GA3处理的FTIR光谱中均出现纤维素的特征吸收峰(1 060,1 160及1 373 cm-1)。与未经GA3处理的相比,0.1、0.5、1.0 μmol·L-1GA3处理后,上述三个纤维素特征吸收峰的吸收强度逐渐增强(图3B)。
2.3 CesA基因系统发育树构建
施加GA3后毛竹实生苗纤维细胞伸长,研究表明,细胞的各向异性膨胀与初生壁纤维合成的纤维合酶基因(CesA)相关[15],同时水稻中次生壁纤维合成相关的CesA4突变后导致水稻矮化[16],由此表明,CesA可能参与GA3促进纤维细胞及茎节伸长的过程。
根据系统发育树(图4),PeCesA4、PeCesA4-1和OsCesA4聚为一个类群,有研究表明,OsCesA4,7,9、SbCesA4,7与次生壁纤维素合成相关[3~4],由此推断PeCesA4、PeCesA4-1可能与次生壁纤维素合成相关。PeCesA1、PeCesA2、SbCesA1、OsCesA1处于同一分支;PeCesA3、SbCesA3聚为一类;PeCesA6、OsCesA6、SbCesA6、PeCesA5处于同一支。PeCesA2、SbCesA1、PeCesA1和OsCesA1处于同一分支。研究表明,OsCesA1,3,6、SbCesA1,3,6与初生壁纤维素合成相关[3~4],由此推断PeCesA1,2,3,5,6可能与初生壁纤维素合成相关。

图4 毛竹、水稻及高粱CesA氨基酸系统发育树 ■.与次生壁纤维素合成相关;●.与初生壁纤维素合成相关Fig.4 The phylogenetic tree of CesA amino acid of P.edulis, rice and sorghum ■.Respects secondary wall cellulose biosynthesis; ●.Respects primary wall cellulose biosynthesis
2.4GA3对CesA基因表达的影响
与未经GA3处理相比,施用不同浓度GA3后,毛竹实生苗茎秆中PeCesA2和PeCesA6基因相对表达量显著上调,随着GA3浓度提高,其相对表达量逐渐增加;PeCesA3、PeCesA4、PeCesA4-1和PeCesA5基因相对表达量均显著下调,但不同浓度GA3处理间差异不明显;PeCesA1无明显变化(图5)。由系统发育树可以看出,PeCesA2、PeCesA6分别与SbCesA1、SbCesA6聚为一类,这与高粱内源GA3缺失造成SbCesA1,3,6基因表达下调一致[3],SbCesA1、SbCesA3还分别与PeCesA1、PeCesA3聚为一类,而PeCesA1在施用外源GA3后,其相对表达量无显著变化;PeCesA3基因表达显著下调。表明GA3能够促进毛竹实生苗茎秆特定CesA基因的上调(PeCesA2和PeCesA6)或下调(PeCesA3、PeCesA4、PeCesA4-1和PeCesA5)。

图5 不同浓度GA3处理毛竹茎秆CesA基因相对表达水平 *.与对照相比相对表达量2倍以上或0.5倍以下Fig.5 The relative expression level of CesA gene in stem of P.edulis treated by the different concentrations of GA3 *. Respects the relative expression level of 2-fold or more or 0.5-fold or less as compared with control
3 讨论
本研究结果表明,外源赤霉素(GA3)显著促进了毛竹实生苗株高和茎节间伸长,说明毛竹实生苗高度的变化主要是由节间伸长所致。江雪等[10]曾报道,在外源GA3作用下,毛竹新分蘖竹株节间伸长与茎部纤维细胞长度增加具有显著的相关性。有研究表明,当高粱GA20-氧化酶发生突变后,造成高粱内源活性GA3缺失,进而导致高粱矮化[3]。官凤英等[17]也曾报道,对绿竹施用矮状素后,明显抑制了绿竹株高生长,而矮状素的主要作用是抑制内源GA3生物合成。因此,这也证明GA3对于禾本科植物株高生长具有重要作用。另外,对毛竹实生苗茎秆节间长度进行测量发现,随着外源GA3浓度提高,基部第一节间伸长较明显,基部第二节间次之,说明外源GA3对同一植株不同节间伸长生长的影响存在差异。这可能与竹类植物特殊的生长方式有关。研究表明,笋在出土之前,其节间数已确定,其株高主要是由每一节间的伸长生长来决定,且每一节间的伸长都是一个相对独立的过程[18]。
此外,施用外源GA3显著促进毛竹实生苗茎秆纤维细胞伸长。研究表明,细胞伸长生长是在膨压的驱使下,初生壁纤维素发生重排,由垂直于生长轴到与生长轴平行,最终导致细胞伸长[15]。拟南芥CesA1基因磷酸化位点发生突变后,导致其根尖发生径向膨胀。表明,外源GA3可能影响到初生壁纤维素合成或重排,还有待进一步的研究证实。
采用qRT-PCR技术检测了毛竹实生苗茎秆中CesA基因的相对表达水平。与对照相比,施用外源GA3显著促进了毛竹实生苗初生壁纤维素合成相关的PeCesA2,6,显著抑制了次生壁纤维素合成相关的PeCesA4,4-1及初生壁相关基因PeCesA3,5,而PeCesA1没有明显变化,这与高粱中GA3正调控初生壁相关基因SbCesA1,3,6的研究结果一致[3],但毛竹实生苗茎秆中并不是所有初生壁相关CesA基因表达都上调,其原因可能是不同物种之间存在差异或初生壁相关CesA基因具有组织表达特异性且具有不同功能[19]。PeCesA2,6可能在毛竹实生苗茎秆纤维细胞伸长过程中具有重要作用,还有待进一步研究。此外,本试验表明,随着外源GA3浓度提高,纤维素特征吸收峰1 060,1 160及1 373 cm-1的吸收强度增加。CesA是纤维素合成的关键基因[20~21],通常纤维含量主要由次生壁纤维素含量决定。但是本研究表明,施用外源GA3后,次生壁纤维素合成相关基因PeCesA4,4-1显著下调,这可能是因为取样时毛竹实生苗还处于幼苗阶段,此时细胞可能还处于伸长生长阶段,茎秆中的纤维主要由初生壁纤维素提供。研究表明,在细胞膨胀过程中纤维素会不断合成并组装到初生壁中[22],说明在毛竹实生苗茎秆中初生壁纤维素合成可能主要由PeCesA2,6负责。关于这一点有待下一步更充分的研究证实。因此,外源GA3对毛竹CesA基因表达、茎节间长度、纤维细胞长度和纤维素合成起到了调控作用。CesA基因是纤维素合成及植物生长发育的关键基因,施用GA3可以调控CesA基因表达,对研究竹类植物CesA基因的调控机制提供了理论依据,为毛竹遗传改良研究提供理论依据。
1.Mcfarlane H E,Döring A,Persson S.The cell biology of cellulose synthesis[J].Annual Review of Plant Biology,2014,65:69-94.
2.Carpita N C.Update on mechanisms of plant cell wall biosynthesis:how plants make cellulose and other (1->4)-β-D-glycans[J].Plant Physiology,2011,155(1):171-184.
3.Carloalberto P,Ko H,Jozsef S,et al.Mapping of a cellulose-deficient mutant named dwarf1-1 in Sorghum bicolor to the ‘Green Revolution’ gene GA20-oxidase reveals a positive regulatory association between gibberellin and cellulose biosynthesis[J].Plant Physiology,2015,169(1):705-716.
4.Huang D B,Wang S G,Zhang B C,et al.A gibberellin-mediated DELLA-NAC signaling cascade regulates cellulose synthesis in rice[J].The Plant Cell,2015,27(6):1681-1696.
5.李如来.外源植物激素对甘草生长的影响研究[D].银川:宁夏大学,2013.
Li R L.The study of exogenous plant hormones on licorice growing[D].Yinchuan:Ningxia University,2013.
6.张国华,张艳洁,丛日晨,等.赤霉素作用机制研究进展[J].西北植物学报,2009,29(2):204-211.
Zhang G H,Zhang Y J,Cong R C,et al.Advances on gibberellins mechanism[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(2):204-211.
7.林金国,陈金明,王水英,等.不同种源毛竹材纤维形态和化学成分的变异[J].竹子研究汇刊,2010,29(1):54-57.
Lin J G,Chen J M,Wang S Y,et al.Variation of fiber morphology and chemical composition of moso bamboo from different provenances[J].Journal of Bamboo Research,2010,29(1):54-57.
8.吴登茹.沙柳、杨木、旱柳材纤维形态和性能的研究[D].呼和浩特:内蒙古农业大学,2013.
Wu D R.Study on fiber morphology and properties ofSalixmongolia,willow and Poplar[D].Hohhot:Inner Mongolia Agricultural University,2013.
9.王文淑.环保抗菌纤维—竹纤维[J].合成纤维工业,2003,26(6):42-43.
Wang W S.Environment-friendly antibacterial fiber-bamboo fiber[J].China Synthetic Fiber Industry,2003,26(6):42-43.
10.江雪,楼崇,袁娜,等.外源GA3对毛竹实生苗新分蘖竹株秆形与竹材纤维质量的影响[J].南京林业大学学报:自然科学版,2016,40(2):121-126.
Jiang X,Lou C,Yuan N,et al.Effects of exogenous GA3on culm form and culm fiber quality ofPhyllostachysedulisseedlings neonatal tiller[J].Journal of Nanjing Forestry University:Natural Science Edition,2016,40(2):121-126.
11.郭龙梅,姜仟坤,曹帮华,等.浸种温度与时间对毛竹种子发芽的影响研究[J].世界竹藤通讯,2016,14(2):19-22.
Guo L M,Jiang Q K,Cao B H,et al.Effects of soaking time and temperature on germination of moso bamboo seeds[J].World Bamboo and Rattan,2016,14(2):19-22.
12.Jones D T,Taylor W R,Thornton J M.The rapid generation of mutation data matrices from protein sequences[J].Computer Applications in the Biosciences,1992,8(3):275-282.
13.Kumar S,Stecher G,Tamura K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1870-1874.
14.孙柏玲,刘君良.慈竹竹原纤维与黄麻纤维红外及二维相关光谱分析[J].林业科学,2012,48(7):114-119.
Sun B L,Liu J L.Analysis of natural bamboo fiber and jute fiber with Fourier transform infrared spectroscopy and two-dimensional IR correlation spectroscopy[J].Scientia Silvae Sinicae,2012,48(7):114-119.
15.Anderson C T,Carroll A,Akhmetova L,et al.Real-time imaging of cellulose reorientation during cell wall expansion inArabidopsisroots[J].Plant Physiology,2010,152(2):787-796.
16.Zhang B C,Deng L W,Qian Q,et al.A missense mutation in the transmembrane domain of CESA4 affects protein abundance in the plasma membrane and results in abnormal cell wall biosynthesis in rice[J].Plant Molecular Biology,2009,71(4-5):509-524.
17.官凤英,范少辉,刘碧桃,等.矮壮素不同浓度及施用方法对绿竹的矮化效应[J].贵州农业科学,2010,38(8):30-32.
Guan F Y,Fan S H,Liu B T,et al.Dwarfing effect of different chlorcholine chloride concentrations and application methods onBambusaoldhami[J].Guizhou Agricultural Sciences,2010,38(8):30-32.
18.董丽娜.毛毛竹秆茎高生长的发育解剖研究[D].南京:南京林业大学,2007.
Dong L N.Studies on developmental anatomy of elongated growth about bamboo culms[D].Nanjing:Nanjing Forestry University,2007.
19.Persson S,Paredez A,Carroll A,et al.Genetic evidence for three unique components in primary cell-wall cellulose synthase complexes inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(39):15566-15571.
20.Watanabe Y,Meents M J,Mcdonnell L M,et al.Visualization of cellulose synthases inArabidopsissecondary cell walls[J].Science,2015,350(6257):198-203.
21.申婷婷,姜静,刘桂丰,等.白桦BpCesA基因的生物信息学及表达分析[J].植物研究,2016,36(6):909-916.
Shen T T,Jiang J,Liu G F,et al.Bioinformatics and expression analysis ofBpCesAgenes ofBetulaplatyphylla[J].Bulletin of Botanical Research,2016,36(6):909-916.
22.Somerville C,Bauer S,Brininstool G,et al.Toward a systems approach to understanding plant cell walls[J].Science,2004,306(5705):2206-2211.
National Natural Science Foundation of China(31400257,31400333);Breeding Program Fund project by the 13th Five-year plan of Sichuan province(2016NYZ0038);Fund of Engineering Research Center for Biomass Resource Utilization and Modification of Sichuan province(12zxsk07,13zxsk01);Graduate innovation fund of Southwest University of Science and Technology(16ycx068)
introduction:JIANG Yong(1991—),male,master,research mainly focus on plant genetics and variety improvement.
date:2017-02-21
EffectsofExogenousGA3ontheGrowthofStemandCesAGeneExpressioninPhyllostachysedulisSeedling
JIANG Yong1,2HU Shang-Lian1,2*CAO Ying1,2LU Xue-Qin1,2HUANG Yan1,2XU Gang1,2
(1.Lab of Plant Cell Engineering,School of life science and Engineering,Southwest University of Science and Technology,Mianyang 621010;2.Engineering Research Center for Biomass Resource Utilization and Modification of Sichuan Province,Mianyang 621010)
We studied the growth of stem andCesAgene expression from the seedling inPhyllostachysedulisunder the different concentration of exogenous GA3(0, 0.1, 0.5, 1 μmol·L-1). Compared with without GA3treatment, the internode and fiber cells of stem from the seedling elongated significantly, after treated by exogenous GA3. The relative expression of primary wall-relatedPeCesA2 andPeCesA6 genes were significantly up-regulated, while that of secondary wall-relatedPeCesA4 andPeCesA4-1 genes were significantly down-regulated. By Fourier transform infrared spectroscopy(FTIR), the absorption intensity of characteristic cellulose peak(1 060, 1 160 and 1 373 cm-1) from the stems enhanced with the increase of GA3concentration. Signifying the expression ofCesAgene could be affected by the exogenous GA3. The expression ofPeCesA2 andPeCesA6 genes could be related to the process of fiber cells elongation.
Phyllostachysedulisseedling;GA3;fiber cell;CesAgene
国家自然科学基金(31400257,31400333);四川省“十三五”重点公关项目(2016NYZ0038);四川省生物质资源利用与改性工程技术研究中心基金(12zxsk07,13zxsk01);西南科技大学研究生创新基金(16ycx068)
姜勇(1991—),男,硕士研究生,从事植物遗传与品种改良研究。
* 通信作者:E-mail:hushanglian@126.com
2017-02-21
* Corresponding author:E-mail:hushanglian@126.com
S795.9
A
10.7525/j.issn.1673-5102.2017.05.015
