金鱼造血器官坏死病毒实时荧光定量PCR检测方法的建立
2017-11-08景宏丽徐立蒲
张 旻,王 姝,王 娜,景宏丽,徐立蒲,吴 绍
(1.中国检验检疫科学研究院动物检疫研究所,北京 100176;2.北京市水产技术推广站,北京 100176)
金鱼造血器官坏死病毒实时荧光定量PCR检测方法的建立
张 旻1,王 姝2,王 娜1,景宏丽1,徐立蒲2,吴 绍1
(1.中国检验检疫科学研究院动物检疫研究所,北京 100176;2.北京市水产技术推广站,北京 100176)
金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus,GFHNV)是一种可感染金鱼等鲤科鱼类,并可导致其死亡的疱疹病毒。为了快速检测病原,本研究根据GFHNV的主要衣壳蛋白(Major captor protein,MCP)序列中的一段保守基因序列,设计引物和TaqMan探针,建立了GFHNV特异性的实时荧光定量PCR检测方法;并利用PCR反应扩增出的MCP基因,制备了pUC-GFHNV重组质粒作为阳性对照。经试验,该方法检测限最低可达10个拷贝数的目的基因,而且与锦鲤疱疹病毒(Koi herpesvirus,KHV)、甲鱼虹彩病毒(Softshell turtle iridovirus,STIV)、流行性造血器官坏死病毒(Epizootic haematopoietic necrosis,EHNV)、斑点叉尾鮰病毒(Channel catfish virus,CCV)以及白斑综合症病毒(White spot syndrome virus,WSSV)等5种水生动物病毒无交叉反应。该方法具有简便、快速、敏感、特异等优点,为该病的诊断与病原检测提供了一个重要手段。
鱼类病毒病;金鱼造血器官坏死病毒;主要衣壳蛋白;实时荧光定量PCR;TaqMan探针
金鱼造血器官坏死病毒(Goldfish haematopoietic necrosis virus,GFHNV)是第 2个分离自鲤科鱼类的疱疹病毒,为有囊膜的双链DNA病毒。其基因组大小约290.3 kb,外形呈二十面体,直径约120 nm[1]。国际病毒系统分类与命名委员会将其命名为鲤疱疹病毒2型(Cyprinid herpesvirus 2,CyHV 2),隶 属于 疱疹病毒目(Herpesvirales)异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)[2]。
GFHNV是金鱼造血器官坏死病(Goldfish haematopoietic necrosis,GFHN)的病原,可以感染金鱼、异育银鲫以及鲫鱼的其它变种,最适发病水温为15~25 ℃。该病一旦暴发,导致的死亡率可达80%以上[3]。患病鱼临床症状包括活动减弱,体表、下颌充血等。将病鱼解剖后可见肝脏、脾脏和肾脏肿大,有出血点,严重时鱼鳔中分布有大量出血点[4]。
目前,日本、美国、英国、澳大利亚等国家均有GFHNV流行[1,5]。近年来我国江苏省也发现存在GFHNV[3]。为有效防控流行,建立切实有效的GFHNV检测方法非常重要。目前,由于缺乏针对GFHNV的敏感细胞系和抗体,通常使用分子生物学方法来检测。
本研究综合前人的研究经验,建立了一种GFHNV特异性实时荧光定量PCR检测方法。该方法检测限可达10个拷贝数的目的基因,且不与其它病毒,特别是同为疱疹病毒的锦鲤疱疹病毒(KHV)发生交叉反应,是一种比较实用的检测方法。基于该方法,研制了金鱼造血器官坏死病毒检测试剂盒,并获国家发明专利(ZL201410773825.7)。
1 材料与方法
1.1 病毒DNA
GFHNV、 KHV、甲鱼虹彩病毒(Softshell turtle iridovirus,STIV)、流行性造血器官坏死病毒(Epizootic haematopoietic necrosis,EHNV)、斑点叉尾鮰病毒(Channel catfish virus,CCV)以及白斑综合症病毒(White spot syndrome virus,WSSV)等6种病毒DNA,由本实验室保存。
1.2 引物和探针的设计
根 据GenBank中GFHNV全 基 因 序列(NC_019495.1),在病毒主要衣壳蛋白(Major captor protein,MCP) 基 因 保 守 区 内选择一段158 bp的片段,使用DNAStar和Primer Primer 5.0软件,设计并合成实时荧光定量 PCR 的特 异性 Taqman 探针:Probe(5´-FAM-TTGGATCTGCTGCGCCCTGTTTGACAGT A M R A-3´) 和 1 对 引 物:F(5´-CAAACCCAGCACCGTCAG ATGGT-3´)和 R(5´- ATCCGGCACAGGTGGCGTGT-3´);探针的5´端用羧基荧光素(Carboxyf l uorescein,FAM)标记,3´端用羧基四甲基罗丹明(Carboxytetramethylrhodamine,TAMRA)标记。所有探针和引物均由上海生工有限公司合成、标记。
1.3 实时荧光定量PCR反应体系的建立与优化
以GFHNV基因组为模板,设立25 µL的初始反应体系(表1)和反应条件。反应条件为:95 ℃3 min(1个循环);95 ℃ 30 s,60 ℃ 30 s(40个循环)。

表1 GFHNV荧光定量PCR检测方法初始反应体系
1.3.1 退火温度的优化。将退火温度分别设置为:65.0、64.5、63.3、61.4、58.9、57.1 和 55.0 ℃,进行荧光定量PCR实验,选择Ct值最低的退火温度作为最终退火温度。
1.3.2 反应体系中的Mg2+浓度优化。将反应体系中Mg2+终浓度设置为1.5、2.5、3.5、4.5 mmol/mL,分别进行荧光定量PCR实验,选择Ct值最低的Mg2+浓度作为反应体系的最终Mg2+浓度。
1.4 标准品的制备
目的基因序列:

下划线部分为引物序列,方框内部分为探针序列。
目的基因由上海生工有限公司合成,并连接入载体pUC57。
1.5 实时荧光定量PCR检测方法标准曲线的制作及灵敏度检测
将重组质粒pUC/GFHNV进行10倍系列稀释,分别以 101、102、103、104、105、106、107、108拷贝数重组质粒标准品为模板,进行实时荧光定量PCR扩增,以空质粒样品为阴性对照。使用1.3节确立的反应体系和反应条件,用实时荧光定量PCR仪自带软件Bio-Rad iQ5 Optical System Software绘制标准曲线,以确定该检测方法的灵敏度。
1.6 实时荧光定量PCR检测方法的特异性试验
为了检查该方法与其它水生动物病毒之间是否存在交叉反应,分别以EHNV,STIV,WSSV,KHV,CCV DNA为模板,进行实时荧光定量PCR。体系及反应条件同1.5。
1.7 临床样品检测
利用本研究建立的GFHNV实时荧光定量PCR检测方法和通常使用的PCR方法,对从江苏省和北京市采集的10尾鲫鱼样品进行检测,并比对检测结果。
2 结果与分析
2.1 反应体系和反应条件的优化
2.1.1 退火温度的优化。使用Bio-Rad iQ5荧光定量PCR仪,将退火温度设置为65.0、64.5、63.3、61.4、58.9、57.1和55.0 ℃,分别进行荧光定量PCR实验。反应体系见1.3。结果如图1所示:退火温度为58.9 ℃时,Ct值最低,为24.15。因此,将该方法退火温度设置为59 ℃。
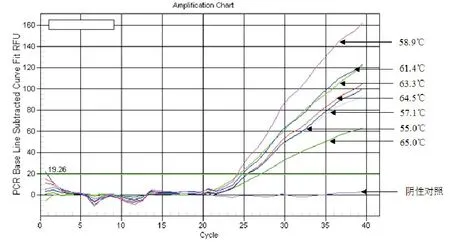
图1 GFHNV实时荧光定量PCR检测方法退火温度优化
2.1.2 反应体系中的Mg2+浓度优化。将反应体系中的Mg2+终浓度设置为1.5、2.5、3.5、4.5 mmol/mL,分别进行荧光定量PCR实验,相应调整水的体积,使反应体系保持25 µL,退火温度为59 ℃。结果如图2所示:Mg2+终浓度为3.5 mmol/mL时,Ct值最小,为18.80。因此,将反应体系中的Mg2+终浓度设置为3.5 mmol/mL。最终反应体系见表2。反应条件为:95℃ 3 min(1个循环);95 ℃ 30 s,59 ℃ 30 s(40个循环)。

图2 GFHNV实时荧光定量PCR检测方法Mg2+浓度优化

表2 GFHNV荧光定量PCR检测方法优化后反应体系
2.2 标准曲线制作及检测限
将10倍系列梯度稀释的标准品pUC-GFHNV溶液(101~108copies)作为绝对定量标准品,进行实时荧光定量PCR。用横坐标表示每个反应的拷贝数的对数值,纵坐标表示Ct值,制作标准曲线。反应在101~108拷贝浓度范围内有较好的线性关系,斜率为-2.173,相关系数为0.989,线形回归方程为Y=-2.173X+31.281;最低10 copies的模板样品有明显荧光信号,Ct值为29左右(图3)。因此,该定量方法最低可以定量检测至101拷贝/反应的目的基因。
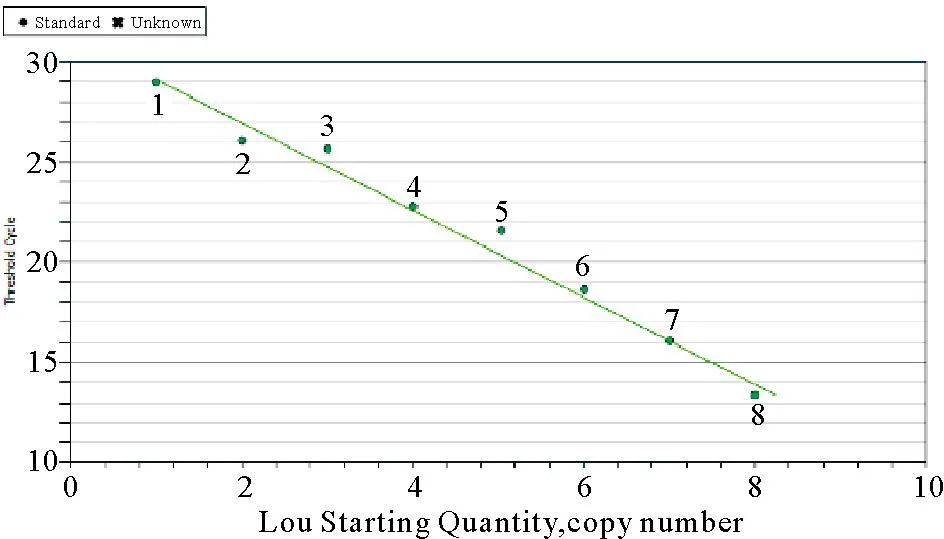
图3 GFHNV实时定量PCR检测限及标准曲线
2.3 检测方法特异性试验
以 GFHNV、EHNV、STIV、WSSV、KHV、CCV的DNA为模板,进行实时荧光定量PCR。体系及反应条件见2.1.2。结果显示,仅GFHNV模板有很明显的扩增曲线,其他模版均无明显荧光信号(图4)。结果表明,该方法与其它5种水生动物病毒无交叉反应。

图4 实时荧光定量PCR反应特异性检测结果
2.4 临床样品检测
对采集自江苏省和北京市的10尾疑似患病鲫鱼,提取肾脏组织DNA。以组织DNA作为检测样品,以浓度为1×107copies/µL的重组质粒和去离子水作为阳性对照和阴性对照,分别进行实时荧光定量PCR检测和PCR检测。按照2.1.2中的标准进行实时荧光定量PCR,按照Waltzek等[7]建立的方法进行PCR,将目的基因大小设为366 bp。实时荧光定量PCR结果显示,4号和8号样品为阳性(图5),Ct值分别为17.48和22.85,说明4号样品包含的病毒量大于8号;PCR结果显示,只有4号和8号样品扩增出目的基因(图6),4号样品DNA条带亮度大于8号,说明4号样品的模板浓度大于8号。2种检测方法的检测结果相同,都是4号和8号样品为阳性,其他8份样品均为阴性。这说明本研究建立的GFHNV实时荧光定量PCR检测方法效果等同于常规的PCR检测方法,可用于GFHNV的实际检测。

图5 实时荧光定量PCR临床检测结果
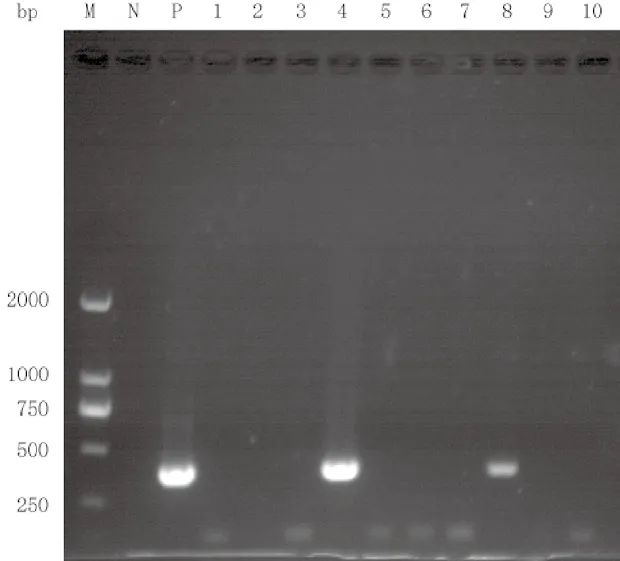
图6 PCR临床检测结果
3 讨论
GFHNV作为一种鱼类烈性病毒性传染病病原,国内外一直力求建立准确、高效的检测方法,用于该病的防控。当前,鱼类病毒的主要检测方法包括病原分离法、基于目的基因扩增的分子生物学检测方法和基于抗原抗体特异性反应的免疫学检测方法。由于一直没有稳定的,针对GFHNV敏感细胞系的推广应用,无法使用病原分离法分离GFHNV。目前,针对GFHNV免疫学检测方法的报道也较少。上海海洋大学制备了GFHNV VP72重组蛋白,并将其作为抗原,建立了检测GFHNV抗体的Western blot检测技术[6]。不过由于Western blot技术本身的实验特征,该方法不适合用于出入境检验检疫、国内疫病监测等大批量样品检测。
目前,国内外报道的针对GFHNV的检测方法主要为分子生物学检测方法,包括PCR方法[7-8]、实时荧光定量PCR方法[9-12]和环介导等温扩增法(LAMP)[13-14]等。其中,实时荧光定量PCR方法作为一种常用的经典分子生物学检测方法,已在水生动物疫病诊断中得到了广泛应用。本研究建立的GFHNV实时荧光定量PCR方法,通过扩增曲线和Ct值来判断样品阴/阳性,加样后因PCR管全封闭,不需电泳,因此节约了制胶和电泳的时间,全程约需1.5 h,比普通PCR减少了0.5~1 h,更加高效;由于不需要开盖电泳,也杜绝了LAMP方法产生的气溶胶污染问题。虽然已有针对GFHNV的荧光定量PCR检测方法的报道,但其检测限为20~83个拷贝数的病毒核酸[9-12]。而本研究建立方法的检测限可达10个拷贝数,且不与其它病毒,特别是同为疱疹病毒的KHV发生交叉反应,是一种更加灵敏的检测方法。作为阳性参考物质使用的pUC-GFHNV重组质粒,易于保存且制备方便。不仅如此,基于该方法研制的金鱼造血器官坏死病毒检测试剂盒,已获国家发明专利授权(ZL201410773825.7),可作为检测试剂提供给各检测实验室用于该病毒的研究和监控工作。
综上所述,根据GFHNV MCP保守基因设计引物、探针,建立的针对GFHNV的实时荧光定量PCR检测方法,最低可以检测到10个拷贝数的目的基因。特异性试验结果表明,该方法对EHNV、KHV等病毒的DNA无反应,具备良好的特异性。临床试验结果表明,该方法的准确性等同于通常的PCR方法,可以特异高效的检测GFHNV,适用于对GFHNV的检测和监控。
[1] 罗杨志,李莉娟,顾泽茂,等. 鲤疱疹病毒Ⅱ的分子特征及流行病学研究[C]// 中国水产学会鱼病专业委员会. 中国水产学会鱼病专业委员会2013年学术研讨会论文集. 海口:中国水产学会鱼病专业委员会,2013.
[2] 田飞焱,何俊强,王璐,等. 金鱼疱疹病毒性造血器官坏死病研究进展[J]. 中国动物检疫,2012,29(4):78-80.
[3] 洪徐鹏. 鲤、鲫疱疹病毒病的诊断与防治措施[J]. 河北渔业,2013(1):39-40.
[4] 林秀秀. 患鲤疱疹Ⅱ型病毒病异育银鲫(Carassius auratus gibelio)组织和血液病理的研究[D]. 苏州:苏州大学,2016.
[5] JEFFERY K R,BATEMAN K,BAYLEY A,et al.Isolation of a cyprinid herpesvirus 2 from goldfish,Carassius auratus(L),in the UK[J]. Journal of fish diseases,2007,30(11):649-656.
[6] 孔善云,姜有声,许丹,等. 一种基于Ⅱ型鲤疱疹病毒衣壳蛋白72的免疫学检测方法[J]. 中国水产科学,2016(2):328-335.
[7] WALTZEK T B,KUROBE T,GOODWIN A E,et al.Development of a polymerase chain reaction assay to detect cyprinid herpesvirus 2 in goldfish[J]. Journal of aquatic animal health,2009,21(1):60-67.
[8] 罗丹,梁利国,谢骏,等. 2型鲤疱疹病毒双重PCR快速检测方法的建立及应用[J]. 中国预防兽医学报,2014(5):379-382.
[9] GOODWIN A E,MERRY G E,SADLER J. Detection of the herpesviral hematopoietic necrosis disease agent(Cyprinid herpesvirus 2)in moribund and healthy goldfish:validation of a quantitative PCR diagnostic method[J]. Diseases of aquatic organisims,2006,69(2/3):137-143.
[10] 周勇,曾令兵,张辉,等. 鲤疱疹病毒Ⅱ型TaqMan real-time PCR检测方法的建立及应用[J]. 水产学报,2013(4):607-613.
[11] 于力,王津津,史秀杰,等. 鲤科疱疹病毒2型Taqman实时荧光PCR方法的建立[J]. 中国动物检疫,2015,32(10):80-84.
[12] 徐晔,段宏安,周毅,等. 鲤科疱疹病毒2型TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报,2014(12):952-956.
[13] ZHANG H,ZENG L,FAN Y,et al. A loop-mediated isothermal amplification assay for rapid detection of cyprinid herpesvirus 2 in gibel carp(Carassius auratus gibelio)[J].Scientific world journal,2014,2014:716413.
[14] LIANG L G,XIE J,LUO D. Development of a rapid cyprinid herpesvirus 2 detection method by loop-mediated isothermal amplification[J]. Letters in applied microbiology,2014,59(4):432-437.
(责任编辑;朱迪国)
Development of Real-time PCR Assay for the Detection of Goldfish Haematopoietic necrosis Virus(GFHNV)
Zhang Min1,Wang Shu2,Wang Na1,Jing Hongli1,Xu Lipu2,Wu Shaoqiang1
(1. The Institute of Animal and Plant Quarantine,Chinese Academy of Inspection and Quarantine,Beijing 100176;2. Beijing Fisheries Technical Extension Station,Beijing 100176)
Goldfish haematopoietic necrosis virus(GFHNV)is a pathogen causing high mortalities of goldfish,which belongs to Cyprinivirus. In order to establish a high efficient and reliable diagnostic method,a real-time PCR assay for detection of GFHNV was developed in this paper. The primers and TaqMan probes were designed according to the conserved regions of major capsid protein(MCP)gene of GFHNV. And the MCP gene was ligated into the pUC57 plasmid vector to prepare of recombinant plasmid pUC-T/GFHNV as positive control. The detection limit of this Realtime PCR assay was 10 copies of viral gene segment(in pUC-GFHNV),and there was no cross reaction with other 5 aquatic viruses,such as Koi herpesvirus(KHV),Softshell turtle iridovirus(STIV),Epizootic haematopoietic necrosis(EHNV),Channel catfish virus(CCV)and White spot syndrome virus(WSSV). It's showed that this real-time PCR assay was sensitive and specific for detection of GFHNV and provided an important means for the diagnosis and pathogen detection of the disease.
fish viral diseases;Goldfish haematopoietic necrosis virus(GFHNV);major capsid protein(MCP);real-time PCR;TaqMan probes
S941.41+9
B
1005-944X(2017)11-0099-05
10.3969/j.issn.1005-944X.2017.11.026
国家科技支撑计划(2013BAD12B02);北京市观赏鱼产业创新团队(BAIC03-2017)
吴绍强
