CDV、CPV、CAV-2及CPIV多重PCR的建立及应用
2017-11-08逄春华袁维峰钱爱东崔尚金
刘 畅 ,逄春华 ,刘 存 ,王 静 ,刘 琪 ,梁 琳 ,袁维峰 ,钱爱东 ,崔尚金
(1. 吉林农业大学动物科学技术学院,吉林长春 130118;2. 中国农业科学院北京畜牧兽医研究所,北京 100193;3. 农业部兽用药物与兽医生物技术北京科学观测实验站,北京 100193;4. 青岛机场出入境检验检疫局,山东青岛 266108)
CDV、CPV、CAV-2及CPIV多重PCR的建立及应用
刘 畅1,2,3,逄春华4,刘 存2,3,王 静2,3,刘 琪2,3,梁 琳2,3,袁维峰2,钱爱东1,崔尚金1,2,3
(1. 吉林农业大学动物科学技术学院,吉林长春 130118;2. 中国农业科学院北京畜牧兽医研究所,北京 100193;3. 农业部兽用药物与兽医生物技术北京科学观测实验站,北京 100193;4. 青岛机场出入境检验检疫局,山东青岛 266108)
为建立一种快速检测犬瘟热病毒(CDV)、犬细小病毒(CPV)、犬腺病毒Ⅱ型(CAV-2)和犬副流感病毒(CPIV)的多重PCR方法,参照GenBank中的相关病毒基因序列,分别设计了4对引物,用于特异性扩增CDV H基因、CPV VP2基因、CAV-2 E3基因和CPIV NP基因上的目的片段。通过优化反应条件,建立了同时扩增CDV(410 bp)、CPV(253 bp)、CVA-2(655 bp)和CPIV(868 bp)的多重PCR方法。利用建立的多重PCR方法,对CDV、CPV、CAV-2、CPIV、CDV+CPV+CAV-2+CPIV和犬冠状病毒(CCV)的DNA或cDNA模板进行扩增,发现该方法的特异性良好。利用建立的多重PCR方法与单一PCR方法进行敏感性比较,发现两者敏感性相差10倍,证明多重PCR方法敏感性良好。利用该方法对从北京市采集的30份犬病料样品进行检测,发现CDV阳性率为63.33%(19/30)、CPV阳性率为33.33%(10/30)、CAV-2阳性率为6.66%(2/30)、CPIV阳性率为0(0/30)。检测结果证明建立的多重PCR方法可用于临床诊断。
多重PCR;犬瘟热病毒;犬细小病毒;犬腺病毒Ⅱ型;犬副流感病毒
犬瘟热病毒(Canine distemper virus,CDV),犬细小病毒(Canine prvovirus,CPV),犬腺病毒Ⅱ型(Canine adenovirus type-2,CAV-2)和犬副流感病毒(Canine parainf l uenza virus,CPIV)是引起犬类疾病的主要病原体。CDV是一种引起急性、恶性、高度接触性传染病病原体。其流行范围广,感染率高。在我国哈尔滨市,CDV阳性率高达50.67%[1-3]。CPV主要引起犬的急性出血性胃肠炎和幼犬急性心肌炎。在我国黑龙江省,其阳性率高达47.26%[4-6]。CAV-2主要引起犬持续高温、咳嗽等,传染性强,可造成全群咳嗽,往往与CDV、CPIV等其他呼吸道疾病混合感染[7-9]。CPIV是犬传染性呼吸系统疾病的主要病原之一,常引起犬的呼吸道疾病[10-11]。4种病原体在我国的阳性率都很高,给养犬业带来了严重经济损失。
CDV、CPV、CAV-2和CPIV在临床上经常出现混合感染。这给诊断造成了一定的困难。对于临床上需要检测多个病毒样本,单一PCR技术每次只能诊断1个病例,较为耗时、耗力。因此,有必要建立一种快速鉴别诊断方法,便于及时采取治疗和防控措施,从而减少4种疾病给养犬业带来的经济损失。本试验建立的CDV、CPV、CAV-2及CPIV多重PCR诊断方法很好地解决了这个问题,为临床样品的快速鉴别诊断提供了帮助。
1 材料与方法
1.1 材料
1.1.1 病毒株。CDV、CPV、CAV-2和CPIV,均由本实验室保存。
1.1.2 主要试剂。Trans 2K plus Marker、Random primer、质粒小提试剂盒,购自全式金公司;10 mmol/LdNTP、M-MLV酶、RNA酶抑制剂、pMD18-T Vector,均购自TaKaRa公司;SanPrep柱式DNA胶回收试剂盒,购自上海生工生物有限公司;DNA、RNA快速提取试剂盒和2× Taq PCR Mix,购自北京艾德莱生物科技有限公司。
1.1.3 引物设计。参照GenBank中登录CDV、CPV、CAV-2和CPIV基因组序列,借助Primer 5.0软件设计4对特异性引物,将其用于扩增检测CDV(登录号KU552082.1)、CPV(登录号A26575.1)、CAV-2(登录号U77082.1)和CPIV(登录号JQ743318.1)的目的片段。引物由北京华大公司合成(表1)。

表1 多重PCR引物序列
1.2 方法
1.2.1 CPV和CAV-2 DNA的提取。参照艾德莱公司病毒DNA快速提取试剂盒说明书,提取病毒DNA。
1.2.2 CDV和CPIV cDNA的制备。参照艾德莱公司病毒RNA快速提取试剂盒说明书,提取病毒RNA。通过反转录的方法,采用10 µL的体系制备 CDV 和 CPIV 的 cDNA:RNA 3.0 µL、RNase free H2O 2.0 µL、Random Primer 1.0 µL。上述体系70 ℃反应10 min,迅速急冻2 min。在上述反应体系中继续添加如下试剂:5×RT buffer 2.0 µL、10 mmol/L dNTP 0.5 µL、 M-MLV 0.5 µL、RNA 酶抑制剂0.25 µL、RNase free H2O 0.75 µL。反转录条件:30 ℃ 10 min、40 ℃ 1 h、75 ℃ 15 min。将得到的cDNA直接进行PCR扩增或-80 ℃保存。
1.2.3 标准模板质粒的构建。对CPV和CAV-2的DNA,CPIV和CDV的cDNA进 行PCR扩增。扩增条件为:94 ℃ 3 min,94 ℃ 1 min;CDV和 CPIV 50℃ / CAV-2 53℃ /CPV 55℃ 30 s;72 ℃CPV和CDV 30 s/CAV-2和CPIV 1 min,34个循环;72 ℃ 10 min,4 ℃保存。反应体系为:LA Taq 酶1µL、10×Buffer 2 µL、MgCl20.5 µL、dNTP Mix 1 µL、cDNA 3 µL/DNA 2 µL,上下游引物各 1 µL,ddH2O补足至20 µL。PCR产物胶回收后,分别与pMD18-T Vector 16 ℃连接过夜,进行转化;随机挑取单个菌落,对菌液经PCR鉴定为阳性的提取质粒,送北京华大公司测序,构建标准质粒模板。
1.2.4 CDV、CPV、CAV-2和 CPIV多 重 PCR方法的建立及退火温度的优化。分别以重组质粒pMD-CDV-H、pMD-CPV-VP2、pMD-CAV-2-E3和pMD-CPIV-NP为模板,利用温度梯度PCR仪,设置退火温度50~60 ℃,依次递增1 ℃,进行退火温度优化。将反应采用的PCR扩增为50 µL体系:2× Taq PCR Mix 25 µL,CDV、CPV、CAV-2和CPIV上下游引物各1 µL,重组质粒pMDCDV-H、pMD-CPV-VP2、pMD-CAV-2-E3和pMDCPIV-NP各1 µL,ddH2O补足至50 µL。反应条件:94 ℃ 3 min;94 ℃ 1 min;50~60 ℃(依次递增 1 ℃)30 s;72 ℃ 1 min;34 个循环;72 ℃ 10 min,4 ℃保存。
1.2.5 多重PCR方法的特异性试验。以优化的多重PCR方法,对CDV、CPV、CAV-2、CPIV和犬冠状病毒(CCV)的DNA或cDNA进行扩增,来检测该方法的特异性。
1.2.6 多重PCR方法的敏感性试验。用分光光度测定仪,测定重组质粒pMD-CDV-H、pMD-CPVVP2、pMD-CAV-2-E3和pMD-CPIV-NP的浓度;将该浓度按照拷贝数公式换算成拷贝数。浓度分别为 3.53×1011、8.65×1010、9.19×1010和 1.64×1011copies/µL。用ddH2O将各重组质粒进行10倍系列稀释,以每个稀释度的质粒作为模板,进行多重PCR敏感性检测。
1.2.7 多重PCR与单一PCR对临床样本检测的比较实验。用建立的多重PCR的方法与单一PCR方法对临床采集的30份病料进行检测。
2 结果
2.1 标准模板质粒的构建
对CPV和CAV-2的DNA,CPIV和CDV的cDNA进行PCR扩增;将PCR产物胶回收后,分别与pMD18-T Vector 16 ℃连接过夜,进行转化;随机挑取单个菌落,将菌液经PCR鉴定为阳性的提取质粒,送至北京华大公司测序,制备标准模板质粒(图1)。
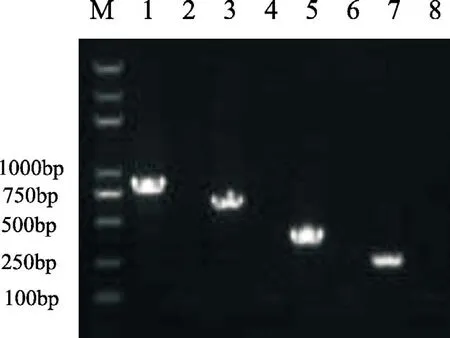
图1 标准模板质粒构建
2.2 多重PCR检测方法最佳退火温度的确定
分别以重组质粒pMD-CDV-H、pMD-CPVVP2、pMD-CAV-2-E3和pMD-CPIV-NP为模板,通过多重PCR方法,分别对CDV、CPV、CAV-2和CPIV目的基因进行扩增;经琼脂糖凝胶电泳检测,获得868、655、410和253 bp的目的片段,发现与预期大小相符(图2)。经过退火温度的优化,最终选择54 ℃为多重PCR方法的最佳退火温度。

图2 多重PCR退火温度的优化
2.3 多重PCR的特异性试验
采用建立的多重PCR方法,对CDV、CPV、CAV-2、CPIV、CDV+CPV+CAV-2+CPIV 和 CCV的DNA或cDNA模板进行扩增,发现只有CDV、CPV、CAV-2、CPIV 和 CDV+CPV+CAV-2+CPIV有特异性条带,CCV未有扩增产物。结果表明该方法具有良好的特异性(图3)。

图3 多重PCR的特异性检测
2.4 多重PCR方法的敏感性试验
将初始浓度分别为 3.53×109、8.65×109、9.19×109和 1.64×109copies/µL的重组质粒 pMDCDV-H、pMD-CPV-VP2、pMD-CAV-2-E3和pMDCPIV-NP,用ddH2O将各重组质粒进行10倍系列稀释,取每个稀释度的重组质粒模板进行多重PCR和单一PCR检测。结果表明:多重PCR方法可以检测CDV、CPV、CAV-2和CPIV的最低拷贝数分别为3.53×106、8.65×106、9.19×106和1.64×106copies/µL,而单一PCR的最低拷贝数分别为 3.53×105、8.65×105、9.19×106和 1.64×105copies/µL(图4)。结果表明多重PCR方法特异性良好。利用建立的多重PCR方法与单一PCR方法进行了敏感性比较,发现两者敏感性相差10倍,多重PCR方法敏感性良好。其中,多重PCR与单一PCR方法的CAV-2敏感性试验结果一致。
2.5 多重PCR与单一PCR方法的初步应用对比

图4 多重和单一PCR方法的敏感性试验
2017年4月于北京农学院动物医院随机收集了犬粪便30份,-80 ℃保存。取粪便加入PBS重旋,离心取上清,提取DNA和RNA。通过比较发现,CDV、CPV、CAV阳性率分别为63.3%(19/30)、33.33%(10/30)、6.66%(2/30),CDV 和 CPV混合感染阳性率为33.33%(10/30),CAV-2和CPV混合感染阳性率为3.33%(1/30),CPIV阳性率为0(0/30)。单一PCR检测的CDV阳性率为66.67%(20/30),而CPV、CAV-2和CPIV的结果与多重PCR一致(表2)。

表2 多重PCR方法和单一PCR方法临床样品结果单位:%
3 讨论
随着人民生活水平的提高,犬已成为人们的精神伴侣,甚至扮演着更为重要的角色。但犬类的多种疾病危害着犬的健康,甚至有些疾病不表现明显特征,就直接导致犬死亡,给犬的饲养和防控增加了难度[12]。目前,对于多种病毒混合感染病症的准确诊断比较困难,尤其是在临床症状相似的情况下[13]。本研究建立的多重PCR方法能够对CDV、CPV、CAV-2、CPIV单个或混合感染的临床样品进行快速鉴别诊断。
建立多重PCR反应的过程中,引物设计是扩增成功的关键。它决定着PCR扩增的特异性、效率和保真度等[14-15]。本试验所用4对引物在设计时分别选取了CDV的H基因序列、CPV的VP2基因序列、CAV-2的E3基因序列和CPIV的NP基因序列。扩增的目的片段大小间隔合适。经电泳结果分析发现,各扩增片段位置明确、条带清晰、便于区分[16-17]。
本试验建立了对CDV、CPV、CAV-2、CPIV快速诊断的多重PCR方法。通过敏感性试验、特异性试验和对30份临床样品进行检测,对多重PCR方法进行验证,发现结果均良好。临床样本检测中,多重PCR和单一PCR的CPV、CAV-2和CPIV检测结果均一致。这表明建立的多重PCR方法可靠性很高。与单一PCR方法进行多次扩增相比,本试验建立的多重 PCR方法不仅省时、省力,节约成本,而且可以同时快速进行4个目的基因的特异性扩增,为犬常见病毒性传染病的快速鉴别诊断以及流行病学调查提供了方法。
[1] 刘彩玉,王吉贵,袁道莉,等. 犬瘟热病毒反转录环介导等温扩增诊断方法的建立[J].中国兽医科学,2010(40):368-372.
[2] 孙喜娟. 哈尔滨市部分宠物门诊犬瘟热病例流行病学调查与防制[D]. 哈尔滨:东北农业大学,2015.
[3] 何洪彬,夏咸柱. 犬瘟热的诊断及其预防免疫的研究进展[J]. 动物医学进展,2001,22(1):12-15.
[4] 耿雨菲. 2014-2015年黑龙江三个地区犬细小病毒2型的PCR检测及其VP2基因序列分析[D]. 大庆:黑龙江八一农垦大学,2016.
[5] 林颖,耿庆华,付海滨,等. 犬细小病毒和犬冠状病毒双重PCR方法的建立及应[J]. 动物医学进展,2011,32(10):71-74.
[6] BATTILANI M,SCAGLIARINI A,CIULLI S,et al.High genetic diversity of the VP2 gene of a canine parvovirus strain detected in a domestic cat[J]. Virology,2006,352(1):22-26.
[7] 胡晓霞. 三种主要犬呼吸道病毒多重PCR方法的建立和应用[D]. 武汉:华中农业大学,2013.
[8] 刘长明,王瑞,张洪英,等. 犬瘟热、猫细小病毒、犬腺病毒弱毒株的理化特性及生物学试验[J]. 中国预防兽医学报,1999,21(2):10-13.
[9] 刘大飞,姜一瞳,戚亭,等. 同时检测犬瘟热病毒、犬细小病毒、Ⅰ型和Ⅱ型犬腺病毒多重PCR方法的建立[J].中国预防兽医学报,2012,34(11):911-914.
[10] 陈龙如,胡贵荣. 犬副流感的治疗[J]. 四川畜牧兽医,2004,31(6):50.
[11] 闫喜军. 犬副流感病毒进化分析及核酸疫苗和犬腺病毒重组疫苗的研究[D]. 长春:吉林大学,2007.
[12] 张晋. 北京地区犬瘟热、犬细小病毒感染及犬冠状病毒病的分子流行病学调查[D]. 南京:南京农业大学,2009.
[13] PIEWBANG C,RUNGSIPIPAT A,POOVORAWAN Y,et al. Development and application of multiplex PCR assays for detection of virus-induced respiratory disease complex in dogs[J]. Journal of veterinary medical science,2016,78(12):1847-1854.
[14] 张洪福. 对PCR引物设计问题的研究[D]. 泰安:山东农业大学,2005.
[15] 磨美兰,甘书钻. 动物传染病研究中PCR引物设计的技巧及相关软件介绍[J]. 广西农业生物科学,2008,27(6):72-75.
[16] 罗亚坤,刘琪,蔺文成,等. CDV和CPV及CCV多重纳米PCR检测方法的建立与应用[J]. 中国兽医科学,2016,46(10):1207-1212.
[17] 康泰,毕玉敏,陈欣,等. CDV、CPV和CPIV多重PCR检测方法的建立[J]. 动物医学进展,2013,34(9):62-65.
(责任编辑:朱迪国)
Establishment and Rudimentary Application of the Multiplex PCR(mPCR)to the Detection of CDV、CPV、CAV-2 and CPIV
Liu Chang1,2,3,Pang Chunhua4,Liu Cun2,3,Wang Jing2,3,Liu Qi2,3,Liang Lin2,3,Yuang Weifeng2,Qian Aidong1,Cui Shangjin1,2,3
(1. College of Animal Science and Technology,Jilin Agricultural University,Changchun,Jilin 130118;2. Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193;3. Beijing Observation Station for Veterinary Drug and Veterinary Biotechnology,Ministry of Agriculture,Beijing 100193;4. Qingdao Airport Entry-exit Inspection and Quarantine Bureau,Qingdao,Shandong 266108)
In order to establish a multiple PCR method for rapid detection of CDV,CPV,CAV-2 and CPIV,according to the gene sequences in GenBank,four pairs of specific primers were designed for amplifying the four specific fragments of CDV H,CPV VP2,CAV-2 E3 and CPIV NP. By optimization of annealing temperature,a multiplex PCR assay of CDV H(410 bp),CPV VP2(253 bp),CAV-2 E3(655 bp)and CPIV NP(868 bp)was established for simultaneous detection of the four viruses. The DNA or cDNA template of CDV,CPV,CAV-2,CPIV,CDV+CPV+CAV-2+ CPIV and CCV were detected by multiplex PCR,and the results showed that the specificity was good. The multiplex PCR method and the single PCR method were compared with the sensitivity. The results of difference was ten times,and the sensitivity of the multiplex PCR was good. Thirty clinical samples of affected dogs from Beijing City were detected by the multiplex PCR,and the positive rate of CDV,CPV,CAV-2 and CPIV were 63.33%(19/30),33.33%(10/30),6.66%(2/30)and 0(0/30),respectively. The results indicated that the established PCR method could be used for clinical diagnosis.
multiplex PCR;Canine distemper virus;Canine parvovirus;Canine adenovirus type-2;Canine parainf l uenza virus
S852.65
A
1005-944X(2017)11-0089-05
10.3969/j.issn.1005-944X.2017.11.024
国家重点研发计划(2016YFD0501003、2017YFD0500905);中国农业科学院创新工程项目(ASTIPIAS-15);基本科研业务费(2016ywf-yb-12)
崔尚金
