山羊痘病毒P32蛋白的原核表达及其免疫原性研究
2017-11-08成伟伟陈伯祥
成伟伟,陈伯祥,杨 明,李 杰
(甘肃省畜牧兽医研究所,甘肃平凉 744000)
山羊痘病毒P32蛋白的原核表达及其免疫原性研究
成伟伟,陈伯祥,杨 明,李 杰
(甘肃省畜牧兽医研究所,甘肃平凉 744000)
为表达山羊痘病毒P32蛋白并研究其免疫原性,构建了含有P32基因的重组表达质粒pET-P32,诱导表达和纯化了P32蛋白;分别运用SDS-PAGE和Western blot,对该蛋白进行了分析和生物活性鉴定;用分析鉴定后的P32蛋白免疫BALB/c小鼠,然后采集小鼠血清,用间接ELISA进行抗体检测;用小鼠脾淋巴细胞增殖试验,检测该蛋白对机体的细胞免疫活性。结果显示:表达纯化的含有GST标签的P32重组蛋白,大小约39 kDa;Western blot显示 P32重组蛋白具有较好的特异性;间接ELISA抗体检测和小鼠脾淋巴细胞增殖试验表明P32重组蛋白具有良好的免疫原性。本试验结果为深入研究P32蛋白的生物学功能以及对山羊痘的诊断与防治奠定了基础。
山羊痘病毒;P32蛋白;免疫原性
山羊痘是由痘病毒科羊痘病毒属山羊痘病毒(Goatpox virus,GTPV)引起山羊及绵羊的一种急性、热性、高度接触性传染病[1]。该病以全身皮肤和黏膜部位出现典型痘疹为主要临床特征[2],具有较高的发病率与死亡率,被世界动物卫生组织(OIE)列为必须报告的动物疫病,被我国列为一类动物疫病[3]。该病呈全球分布,流行广泛[4],对养羊业造成严重危害和巨大经济损失。
GTPV为线性双股DNA病毒,基因组大小约为143~147 kb[5]。GTP 间的核心编码区和两端的反向末端重复序列(Inverted terminal repeat,ITR)构成。基因组中间核心区域(ORFs024-123)比较保守,主要调控病毒的复制、包装和释放;两端的反向重复序列(ORFs001-023和ORFs124-147)具有较高的变异性,主要决定病毒毒力和宿主范围[6-7]。P32基因位于GTPV基因组的64~65 kb处,是GPTV主要的保护性抗原基因,由其编码的P32蛋白是病毒的囊膜蛋白,能够刺激机体产生强烈的免疫反应,产生中和抗体[8-9]。目前,虽然已有很多关于P32蛋白的研究报道,可是P32蛋白表达比较困难,表达效率较低,所以P32蛋白的高效表达对该蛋白的功能研究以及山羊痘疫苗的研制具有重大意义,其免疫原性研究也将会进一步明确该蛋白在山羊痘诊断与防治中的作用。本研究进行了GTPV P32基因扩增,构建了P32基因的原核表达载体pET-P32,并将其转化至大肠杆菌(E.coli)BL21中进行诱导表达;运用Western-blot检测了P32蛋白的表达情况与特异性,运用ELISA检测方法和小鼠淋巴细胞增殖试验对该蛋白的免疫原性进行了检测。
1 材料与方法
1.1 毒株、菌株和质粒
山羊痘病毒株(GTPV-S-1),由甘肃省畜牧兽医研究所动物医学研究室保存;工程菌DH5α、BL21(DE3)感受态细胞,均购自宝生物工程(大连)有限公司;质粒pET-28a(+),购自Thermo Fisher 科技公司。
1.2 主要试剂
DNA提取试剂盒、胶回收试剂盒和质粒提取试剂盒,均购自AXYGEN公司;2×PƒuPCR Master Mix、T4 DNA连接酶和限制性内切酶NcoⅠ、XhoⅠ,均购自宝生物工程(大连)有限公司;DNA Marker 和蛋白Marker,购自生工生物工程(上海)股份有限公司;异丙基硫代半乳糖苷(IPTG)、His-Bind Column(Ni-NTA)树脂,购自北京索莱宝科技有限公司;HRP标记的兔抗小鼠IgG、弗氏完全佐剂和弗氏不完全佐剂,均购自Sigma公司。
1.3 试验动物
SPF级BALB/c小鼠,雌性,4~6周龄,体重16~18 g,购自中国农业科学院兰州兽医研究所实验动物中心。
1.4 方法
1.4.1 GTPV P32基因的扩增。参照GenBank中公布的GTPV P32基因序列,分析表达载体pET-28a(+)的酶切位点序列;应用Primer 5.0软件,设计P32基因的原核表达引物。序列如下:5´-ATCCATGGCAGATATCCCATTATATG-3´(下划线处为NcoⅠ);下游引物:5´-ATCTCGAGTCTAT GAGCCATCCATTTTC-3´(下划线处为XhoⅠ)。上述引物由苏州泓讯生物科技有限公司合成。收集GTPV病毒液,运用DNA提取试剂盒(Qiagen公司)提取GTPV DNA;以提取的GTPV DNA为模板,加入上下游引物,配置反应体系,进行PCR扩增,然后将扩增产物进行纯化回收。
1.4.2 GTPV P32基因原核表达载体的构建。将纯化回收的P32基因扩增产物和pET-28a(+)分别进行NcoⅠ+XhoⅠ双酶切;将酶切产物回收,用T4 DNA连接酶16 ℃恒温连接;将连接产物转化至DH5α感受态细胞进行平板培养,挑取单个菌落进行摇菌培养;提取菌液的重组质粒,进行酶切鉴定;将鉴定正确的重组质粒送上海桑尼生物技术有限公司进行测序;测序正确后将其保存备用,并将重组质粒命名为pET-P32。
1.4.3 重组蛋白的表达纯化。将构建的pET-P32重组质粒转化至表达菌BL21(DE3)中,37 ℃振荡培养至OD600nm值为0.4~0.9,此时加入IPTG 至终浓度为1.0 mol/L;分别诱导培养3、4、5、6 h,同时设pET-28a(+)空载体转化菌的诱导对照,于4℃离心,收集菌体;最后一次收集菌体后,将其置于冰浴中超声裂解(400 W功率)3 s,间隔15 s,超声40 min;然后10 000 g 离心10 min,分别收集上清与沉淀,进行SDS-PAGE鉴定;然后利用北京索莱宝科技有限公司的镍柱His-Bind Column(Ni-NTA)纯化系统,纯化P32重组蛋白。
1.4.4 重组蛋白的Western blot鉴定。取纯化后的P32重组蛋白稀释液(1∶100)50 µL与等体积的2×SDS-PAGE上样缓冲液混匀,并用50 µL ddH2O与等体积的2×SDS-PAGE上样缓冲液混匀作为阴性对照,均沸水煮10 min后,进行SDS-PAGE电泳分析;电泳分析后将蛋白转印至PVDF膜上,置于5%的脱脂奶粉溶液,4 ℃过夜封闭。用PBST洗膜3次,每次10 min;加入GTPV全病毒血清,置于37 ℃孵育2 h后,用PBST洗膜3次;将HRP标记的兔抗小鼠IgG,用PBST以1∶4 000稀释后加入,置37 ℃孵育2 h,用PBST洗膜3次;最后用15 mg DAB粉末和9 mg CoCl2·6H2O溶于30 mL PBS,混匀,再加入10 µL过氧化氢配置的显色液进行显色,最后用PBS终止反应。
1.4.5 重组蛋白免疫小鼠血清抗体ELISA检测。将40只4~6周龄雌性BALB/c小鼠,随机分为4组。A组:p32重组蛋白免疫组;B组:山羊痘活疫苗免疫组;C组:GST标签蛋白免疫组;D组:PBS免疫组。按照各组对应抗原,共免疫3次:初免按照100 µg∕只的剂量,将各组对应抗原与等体积的弗氏完全佐剂充分乳化后,经腹股沟和脚掌板皮下免疫小鼠;初次免疫后14 d,将各组对应抗原与等体积的弗氏不完全佐剂充分乳化后等剂量加强免疫1次;初次免疫后21 d,将各组对应抗原等剂量再加强免疫1次。在第3次免疫后0、7、14、21、28 d,分别采集小鼠尾静脉血,分离血清,采用间接ELISA方法检测各组血清抗体。
1.4.6 重组蛋白刺激小鼠脾淋巴细胞增殖。将断颈法处死的小鼠,在75%的乙醇中浸泡 5 min 左右;无菌取出小鼠脾脏,用 1 mL RPMI-1640 培养液冲洗脾脏,然后将其转移到装有200目尼龙网的小培养皿内;加入 1 mL RPMI-1640 培养液,用玻璃针芯充分研磨;吸取淋巴细胞悬液至2 mL离心管内,4 ℃ 2 000 r/min 离心 5 min;用移液器吸弃上清液,加入2 mL红细胞裂解液,重悬沉淀,37 ℃水浴 3~5 min;之后立即 4 ℃ 2 000 r/min 离心 5 min;用移液器吸弃上清液,加入1 mL RPMI-1640培养液重悬细胞,4 ℃ 2 000 r/min离心5 min;重复该步骤,一次完全去除红细胞裂解液;用移液器吸弃上清液,加入1 mL RPMI-1640 培养液(含10%犊牛血清)重悬细胞,冷却后80倍稀释成单细胞悬液,进行细胞计数;用RPMI-1640(含 10%犊牛血清)培养液将计数的淋巴细胞悬液浓度调整为2×106个/mL;将淋巴细胞悬液加入96孔细胞培养板中(100 µL/孔);对应孔中分别加入100 µL特异性刺激原重组P32蛋白(100 µg/mL)、100 µL非特异性刺激原ConA(刀豆蛋白10 µg/mL)及100 µL PRMI-1640培养液;对不同刺激原,重复3个孔,同时以只加200 µL PRMI-1640培养液、无淋巴细胞的孔作为本底,于37℃ CO2培养箱内静置培养68 h;每孔加入20 µL浓度为5 mg/mL的MTT(3-(4,5-二甲基噻唑-2)-2、5-二苯基溴化四唑),避光培养4 h;每孔吸弃100 µL培养液,加入DMSO(二甲基亚砜)100 µL;10 min内,用酶标仪测定各孔的OD490nm;计算刺激指数(SI)。SI=(刺激组OD值-本底值)/(未刺激组OD值-本底值)。
2 结果
2.1 GTPV P32基因的扩增
琼脂糖凝胶电泳结果显示,PCR扩增产物大小为882 bp(图1),与预期的P32基因的大小一致。

图1 P32基因的PCR扩增
2.2 GTPV P32基因原核表达载体的构建
将重组质粒pET-P32进行XhoⅠ和NcoⅠ双酶切。电泳鉴定显示有5 369 bp和882 bp的载体和目的片段,与预期结果一致(图2),表明表达载体pET-P32构建成功。

图2 重组质粒pET-P32酶切鉴定
2.3 重组蛋白的表达纯化
SDS-PAGE分析表明:诱导后的重组菌pET-P32/BL21(DE3)在相对分子质量约39 kDa处,可见1条特异的蛋白条带;其大小与预期一致,且主要以包涵体的形式存在,并得到纯化(图3)。
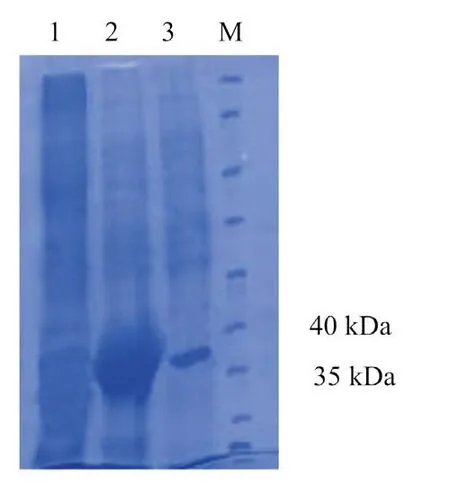
图3 重组蛋白P32表达与纯化SDS-PAGE分析
2.4 重组蛋白的Western blot鉴定
Western-blot结果显示:制备的重组蛋白可与GTPV全病毒血清发生特异性反应;在相对分子质量约39 kDa处可见反应条带,而阴性对照未见该条带(图4)。结果证实P32蛋白在该系统中获得了表达,且具有较强的特异性。
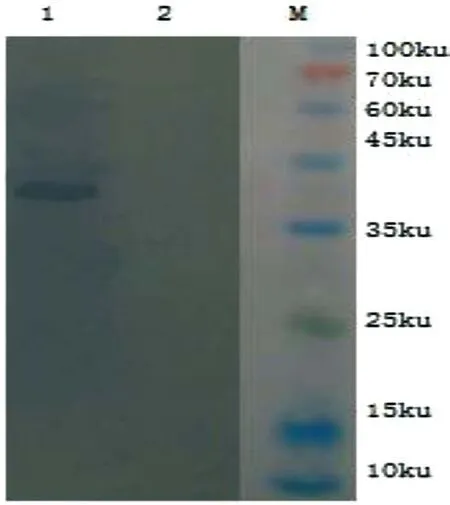
图4 Western-blot鉴定重组蛋白P32
2.5 重组蛋白免疫小鼠血清抗体ELISA检测
各试验组小鼠血清抗体的ELISA检测结果见表1。免疫后7 d,注射重组蛋白P32免疫组和山羊痘疫苗组的抗体水平开始升高,显著高于GST标签蛋白免疫组和PBS组,14 d抗体水平达到最高;山羊痘活疫苗组的抗体水平也显著高于重组P32蛋白组,而GST标签蛋白免疫组和PBS组的抗体水平没有明显变化。
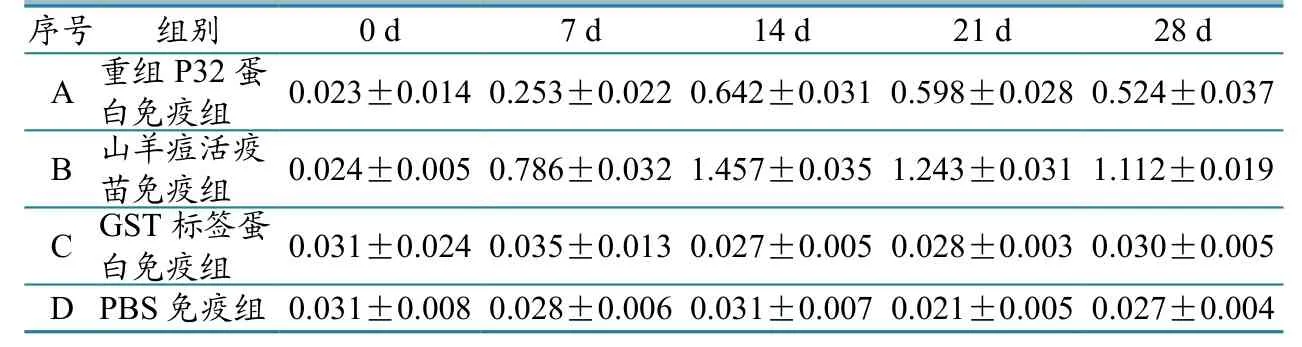
表1 ELISA检测血清抗体OD492值
2.6 重组蛋白刺激小鼠脾淋巴细胞增殖
将分离的淋巴细胞培养2 d后,显微镜下可见用ConA及P32重组蛋白刺激孔内的淋巴细胞开始增殖,出现细胞团,而无刺激源的孔内淋巴细胞不增殖。68 h后,加入MTT继续培养4 h,再加入DMSO,用酶标仪测OD490nm,计算淋巴细胞分裂指数。结果显示:特异性刺激组小鼠淋巴细胞分裂指数均值为5.2,非特异性刺激组均值为2.1(图5),两者差异极显著(P<0.05)。结果证明,用重组蛋白P32作为特异性刺激源刺激后,淋巴细胞发生分裂增殖。
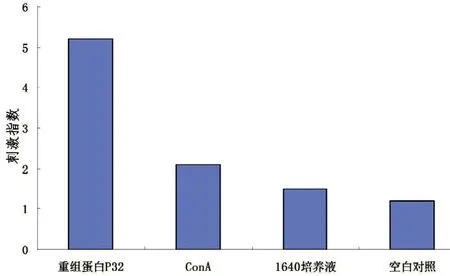
图5 淋巴细胞刺激指数
3 讨论
山羊痘是主要引起山羊和绵羊全身起痘、发热等症状的一种烈性传染病,呈世界性分布,常呈暴发性或地方性流行[10]。被感染的山羊和绵羊通过口腔、鼻腔和眼分泌物排毒,并通过气溶胶和直接接触传播[11]。本病具有较高的死亡率,可使羔羊100%死亡,严重制约了我国养羊业的发展[12]。P32蛋白是GTPV的主要囊膜蛋白,在病毒感染早期能刺激机体产生抗体,诱导机体产生强烈的细胞免疫[13-14]。研究表明,P32蛋白是目前分离鉴定的所有山羊痘病毒株中共有的特异性高、免疫原性强的结构蛋白[9,15]。目前,针对P32蛋白的研究已有很多报道,但是P32蛋白的体外表达效率不高,而针对P32蛋白的免疫原性系统研究却鲜有报道。原核表达的重组蛋白产物保持了很完整的抗原性,甚至生物学活性,可以用于制备针对特定蛋白的多抗血清。P32蛋白原核高效诱导表达可为山羊痘的诊断与疫苗研究奠定基础。其免疫原性研究也进一步奠定了该蛋白在山羊痘诊断与疫苗研究方面的不可替代作用。
本试验将P32基因克隆入原核表达载体pET-28a(+)。为了高效表达出P32蛋白,进行了表达条件优化,发现在IPTG浓度为1.0 mmol/L、低温低转速长时的诱导表达效率最高。P32蛋白的高效表达,为P32蛋白的功能研究以及山羊痘疫苗研制提供了重要的实验材料。运用GTPV全病毒血清作为一抗,进行Western-blot鉴定,发现表达的P32蛋白具有较强的特异性与生物学活性。将P32重组蛋白、山羊痘活疫苗、GST标签蛋白和PBS免疫小鼠,然后采集小鼠血清,运用ELISA进行抗体检测,发现P32重组蛋白免疫组与GST标签蛋白以及PBS免疫组抗体水平差异显著。这表明P32蛋白能够刺激机体产生较强的体液免疫。P32重组蛋白刺激小鼠脾淋巴细胞增殖试验结果显示,特异性刺激组与非特异性刺激组小鼠淋巴细胞分裂指数差异显著,表明P32蛋白能够引起机体较强的细胞免疫。这两项试验结果均表明该蛋白具有良好的免疫原性。
[1] TUPPURAINEN E S M,VENTER E H,SHISLER J L,et al.Review:Capripoxvirus diseases∶ current status and opportunities for control[J]. Transboundary & emerging diseases,2017,4(3):64(3):729-745.
[2] 陈伯祥,杨明,贺泂杰,等. 抗山羊痘病毒P32蛋白杂交瘤细胞的构建及其单克隆抗体的制备[J]. 中国动物检疫,2015,32(12):66-68.
[3] TAO Z,JIA H,CHEN G,et al. Phylogenetic analysis of Chinese sheeppox and goatpox virus isolates[J]. Virology journal,2012,9(1):1-8.
[4] KARIM A,BHATTACHARJEE U,PURO K,et al.Detection of Peste despetits ruminantsvirus and goatpox virus from an outbreak in goats with high mortality in Meghalaya state,India[J]. Veterinary world,2016,9(9):1025-1027.
[5] ZHAO Y L,WU G H,Zhu H X,et al. Cloning and sequence analysis of a6l gene of goatpox virus[J]. China animal husbandry & veterinary medicine,2015,42(8):1973-1978.
[6] CHI X L,ZENG X C,LI W,et al. Complete genome sequence analysis of goatpox virus isolated from China shows high variation[J]. Veterinary microbiology,2014,173(1/2):38-49.
[7] MATHIJS E,VANDENBUSSCHE F,HAEGEMAN A,et al. Complete genome sequence of the goatpox virus strain gorgan obtained directly from a commercial live attenuated vaccine[J]. Genome announcements,2016,4(5):e01113-01116.
[8] 芦晓立,张强. 羊痘病毒P32基因与羊CD58基因共表达载体的构建[J]. 甘肃农业大学学报,2014,49(6):1-4.
[9] DEZHI P U,GONG C Y,LIU Y,et al. Prokaryotic expression and bioinformatics analysis of goatpox virus p32 gene[J]. Biotechnology,2012,4):432-453.
[10] EMBURY-HYATT C,BABIUK S,MANNING L,et al.Pathology and viral antigen distribution following experimental infection of sheep and goats with capripoxvirus[J]. Journal of comparative pathology,2012,146(2/3):106-115.
[11] DIALLO A,VILJOEN G J. Genus capripoxvirus[J].Birkhäuser basel,2007:167-181.
[12] SANTHAMANI R,YOGISHARADHYA R,VENKATESAN G,et al. Detection and differentiation of sheeppox virus and goatpox virus from clinical samples using 30 kDa RNA polymerase subunit(RPO30)gene based PCR[J]. Veterinary world,2013,6(11):923-925.
[13] 丁军涛,王颖,张雪彬,等. 山羊痘病毒P32抗原基因口服活载体DNA疫苗的构建[J].中国兽医科学,2017(3):1673-4696.
[1 4] B H A N O T V,B A L A M U R U G A N V,BHANUPRAKASH V,et al. Expression of P32 protein of goatpox virus in Pichia pastoris and its potential use as a diagnostic antigen in ELISA[J]. Journal of virological methods,2009,162(1/2):251.
[15] GUO J,ZHENG M,LIU Q. Expression of P32 gene of goatpox virus in baculovirus[J]. Chinese journal of veterinary science & technology,2005,35(9):679-683.
(责任编辑:朱迪国)
Prokaryotic Expression and Immunogenicity Research on P32 Protein of Goatpox Virus
Cheng Weiwei,Chen Boxiang,Yang Ming,Li Jie
(Gansu Institute of Animal and Veterinary Science,Pingliang,Gansu 744000)
To study the immunogenicity and expression of P32 protein from goatpox virus,a recombinant plasmids was constructed and named as pET-P32.The P32 protein was induced expression and purified,and was analyzed by SDA-PAGE,its biological activity was determined by Western blot. BALB/c mice were immunized with the purified and determined the recombinant P32 protein to produce immune serum. Polyclonal antibody from immune serum was detected by enzyme linked immunosorbent assay(ELISA),cellular immune function of P32 protein induced organic immune system was detected by experiment of spleen lymphocyte proliferation of mice. The results indicated that the expressed P32 protein,with about 39 KDa molecular weight,showed a good antibody specificity by Western blot,the P32 protein showed a good immunogenicity by enzyme linked immunosorbent assay(ELISA)and experiment of spleen lymphocyte proliferation of mice. The results laid the solid foundation for the further study on biological function of P32 protein and diagnosis and prevention of Goatpox virus.
Goatpox virus;P32 protein;immunogenicity
S851.3
A
1005-944X(2017)11-0094-05
10.3969/j.issn.1005-944X.2017.11.025
甘肃省科技支撑计划(1104NKCL097)
陈伯祥
