三种伪狂犬病病毒gE抗体ELISA检测试剂盒的比较
2017-11-08董雅琴吴发兴李晓成
董雅琴,刘 爽,郑 辉,张 志,吴发兴,李晓成
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛易邦生物工程有限公司,山东青岛 266114)
三种伪狂犬病病毒gE抗体ELISA检测试剂盒的比较
董雅琴1,刘 爽1,郑 辉2,张 志1,吴发兴1,李晓成1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛易邦生物工程有限公司,山东青岛 266114)
为比较3种品牌(A、B、C)伪狂犬病病毒(PRV)gE抗体ELISA检测试剂盒的临床使用效果,应用中和试验来标定伪狂犬病非免疫猪场的180份临床血清样品,同时用3种试剂盒进行检测,并对试剂盒的重复性、敏感性、特异性以及与中和试验结果的符合度等指标进行测定与分析。结果显示:3种试剂盒的批内稳定性均较好,变异系数均小于10%;批间重复性差异较大,变异系数最小者为8.09%,最大者高达21.31%;3种试剂盒的诊断特性良好,敏感性为95.56%~97.78%,特异性为94.44%~100%;各试剂盒检测结果与中和试验结果均完全相符(Kappa值为0.91~0.96)。比较结果表明,3种试剂盒均适用于临床样品的PRV gE抗体检测,其中稳定性及敏感性俱佳的试剂盒C更适用于PRV的持续监测、早期发现、引种检疫及净化效果评估,而特异性与准确性最高的试剂盒B更适用于贵重病畜的诊断淘汰。因此,生产实践中应根据诊断目的合理选择最适试剂盒。
伪狂犬病毒;gE抗体;ELISA检测试剂盒;比较
伪狂犬病(Pseudorabies,PR)又称Aujeszky氏病,是发生于猪及多种家畜和野生动物的高度接触性传染病。其病原为伪狂犬病病毒(Pseudorabies virus,PRV)。动物感染后会出现发热、奇痒及脑脊髓炎等急性病症[1]。世界动物卫生组织(OIE)将该病列为须报告动物疫病[2]。我国将其列入《国家中长期动物疫病防治规划(2012—2020年)》优先防治疫病及重点净化考核疫病,并将到2020年全国所有种猪场达到PR净化标准列为控制目标[3]。为配合猪场做好PR的净化工作,快速准确鉴定PRV野毒感染尤为必要。
当前我国主要通过疫苗免疫进行PR防控。PRV基因缺失疫苗的广泛使用不但可以有效控制PR,还可以通过gE抗体检测来鉴定猪只是否感染PRV野毒。随着PRV gE基因缺失疫苗的广泛应用,针对该基因建立的抗体ELISA检测方法已被普遍用于PRV野毒感染的检测。目前,市场上PRV gE抗体ELISA检测试剂盒品牌众多。如何合理选择诊断试剂盒是基层检测中普遍存在的问题。本研究选择3个应用较广的进口品牌试剂盒,从敏感性、特异性、稳定性、准确性等方面进行比较,以期为实践中PRV gE抗体ELISA检测试剂盒的合理选择提供依据,也为PR净化提供一定的技术保障。
1 材料与方法
1.1 ELISA试剂盒
3种PRV gE抗体ELISA检测试剂盒,每种试剂盒各3个批次:A品牌试剂盒(批号CL456、BL680、BL524)、B品牌试剂盒(批号MAE100633、MAE100640、MAE100652)、C品牌试剂盒(批号P-01024、P-01118、P-1211)。3种试剂盒的原理均为阻断ELISA。
1.2 病毒与细胞
PRV闽A株,猪肾细胞传代细胞系PK-15,均由中国动物卫生与流行病学中心畜病监测室保存。
1.3 参考血清
PR抗体阳性参考血清,中和抗体效价为1∶(1 651±839),PR抗体阴性参考血清,均购自中国兽医药品监察所。
1.4 临床血清样本的定性
背景清楚的临床猪血清样品180份,均来源于PR非免疫场。用病毒中和试验对其进行检测,最终得到90份PR抗体阳性血清和90份PR抗体阴性血清将其用于试剂盒各项指标的测定。具体操作见文献[4]。
1.5 ELISA检测及结果判定
严格按试剂盒说明书对血清样品进行检测,在指定波长下测定样品的OD值。按公式进行换算,并判定结果(表1)。

表1 各试剂盒检测方法及判定条件
1.6 敏感性、特异性、与中和试验的符合度测定
对3种试剂盒各取1个批次,对180份临床血清样品同时进行检测,结果填入表2。按公式敏感性Se=a/(a+c),特异性Sp=d/(b+d)[4-5],计算各试剂盒的Se和Sp。按照公式Kappa12=2(adbc)/(p1q2+p2q1),计算试剂盒与金标方法结果间的Kappa值,比较试剂盒与金标的符合程度。Kappa值在0.81~1,说明两个方法间完全符合;在0.61~0.8,为高度符合;在0.41~0.6,为中度符合;在0.21~0.4,为比较符合;0.2以下为轻度符合;0以下为不符合[6-7]。

表2 敏感性、特异性计算数据统计
1.7 重复性试验
选取经中和试验判定的PR抗体阳性血清和阴性血清各20份,进行重复性试验。在以下两个试验结束后,对每份样品的3个结果(OD值)计算变异系数(CV=平均值/标准差),再计算所有样品的平均变异系数;以批内重复平均变异系数和批间重复平均变异系数的大小,来衡量3种试剂盒的批内、批间稳定性。
1.7.1 批内重复性测定。每种试剂盒随机抽取1个批次,用不同盒的3块板,对以上血清同时进行检测。
1.7.2 批间重复性测定。每种试剂盒随机抽取3个批次,每批各抽1块板,对以上血清同时进行检测。
2 结果与分析
2.1 敏感性、特异性、与中和试验结果的符合度测定结果
各试剂盒敏感性较高,均在95%以上,其中试剂盒C敏感性最高,达到97.78%;各试剂盒特异性均在94%以上,其中试剂盒B的特异性达到100%。各试剂盒检测结果与中和试验结果间的Kappa值均大于0.9。这说明3个品牌试剂盒的测定结果与中和试验结果均完全符合。符合程度由高到低依次为试剂盒B、C、A。
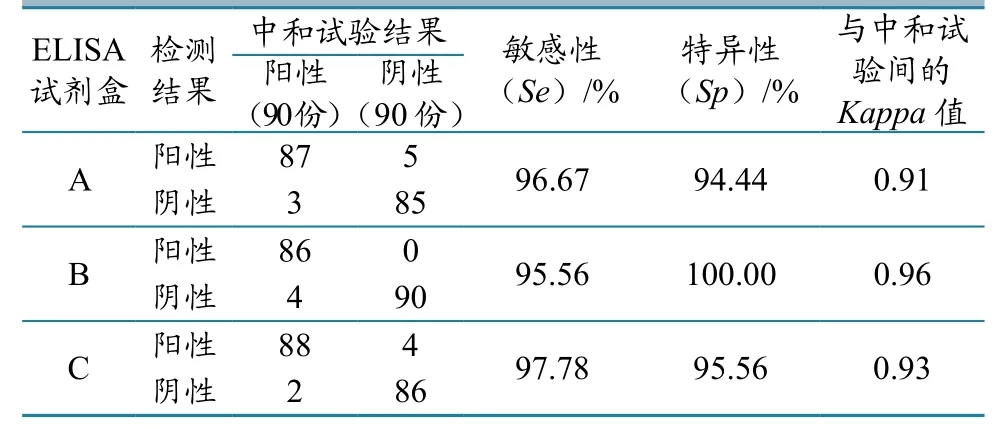
表3 各试剂盒诊断特性统计结果
2.2 重复性测定结果
试剂盒A、B、C的批内平均变异系数均小于10%,由此说明3种试剂盒的批内重复性均良好;试剂盒C变异系数最小说明其批内板间稳定性最好;试剂盒C的批间平均变异系数小于10%,说明其批间重复性良好;试剂盒B的批间平均变异系数为11.02%,说明其批间重复性一般;试剂盒A批间平均变异系数大于20%,说明其批间重复性较差。综合批内、批间重复试验结果,试剂盒稳定性由高到低依次为C、B、A。

表4 各试剂盒批内、批间变异系数的比较
3 讨论
目前对PRV gE抗体ELISA检测试剂盒的比较与评价的研究并不多。陈伟杰等[8]通过分析3种商用试剂盒对同一批临床血清样品的检测结果,计算两两试剂盒结果间的相关性、符合率和Kappa值,发现3种试剂盒具有极显著的相关性以及极强或高度的一致性;通过比较各试剂盒的阳性率高低,直接得出三者敏感性的高低顺序。该研究在计算敏感性时,没有考虑到试剂盒检测出的阳性结果并不一定全是真阳性。而本研究在评价试剂盒的敏感性、特异性时,应用了“金标准”方法——病毒中和试验,来标定血清样品的阴、阳性,以此为标准来衡量待检验试剂盒的特性。这样更加科学。杨涛等[9]应用Kappa检验来比较两种PRV gE抗体ELISA检测试剂盒,得出二者结果高度一致,均可应用于临床检测。该文献只侧重于评价两两试剂盒间的一致性,而对诊断试验的特性——敏感性、特异性以及试验结果的稳定性(重复性)和准确性未作评价。本研究应用来自PR非免疫场的180份临床猪血清样品,先用病毒中和试验对血清进行定性,然后以此结果作为标准,对3种商品化试剂盒的敏感性、特异性和准确度进行了评价;同时随机抽取同批中不同反应板以及不同批次的反应板,来评价3种试剂盒的批内、批间重复性,创新地对3种试剂盒的各项特性进行了全面测定与比较。
国际推荐的检测PR抗体的方法有病毒中和试验(VN)和酶联免疫吸附试验(ELISA)。其中,前者一直被认为是检测PR抗体的“金标准”,后来因其操作复杂、耗时长,在大量检测中往往被ELISA试验所取代[10]。因目前国内使用的PR疫苗均为gE基因缺失苗,故非免疫场中,抗体阳性血清必为感染抗体阳性,即gE抗体阳性。
本研究结果表明,3种试剂盒检测结果与中和试验结果的符合度极高。因此,这3种试剂盒可以保证结果的准确性,均适用于临床PRV gE抗体检测。从稳定性来讲,3种试剂盒的批内稳定性均较好,批内重复平均变异系数均在10%以内(C<B<A);但批间稳定性差异较大,A、B、C的批间重复平均变异系数分别为21.31%、11.02%、8.09%。可见,若要对PRV野毒抗体进行持续监测,就需试剂盒具备较好的稳定性,以保证监测数据的可靠性和纵向可比性。这时应选择稳定性最佳的试剂盒C。从诊断特性来讲,3种试剂盒的敏感性和特异性均较好,但仍有差异。试剂盒A、B、C的敏感性分别为96.67%、95.56%、97.78%;特异性分别为94.44%、100.00%、95.56%。临床上在选用诊断试剂盒时,在准确性和稳定性相当的情况下,通常都想追求高敏感性和高特异性,但有时无法兼得。因此,在选用试剂盒时应根据诊断目的,来对敏感性和特异性进行取舍。如:用于疫病的早期发现、引种检疫、证明某地无疫或评价猪场净化效果时,就要求诊断试验的敏感性越高越好,即假阴性结果越少越好,不让任何发病(感染)动物漏检,此种情况下建议使用试剂盒C;若用于淘汰贵重病畜、出口贸易时,则要求诊断试验的特异性越高越好,即假阳性结果越少越好,不错杀1例或错判1份样品,此时最好使用试剂盒B。临床实践中,应综合分析试剂盒的各项性能指标,并根据工作需求合理选择最合适的诊断试剂。
[1] 郝飞,汤德元,李春燕,等. 伪狂犬病病毒Guizhou-DY株的分离鉴定及致病性研究[J]. 畜牧兽医学报,2013,44(11):1851-1856.
[2] 田克恭. 人与动物共患病[M]. 北京:中国农业出版社,2013.
[3] 李达,马萍,汤德元,等. 规模化猪场猪瘟和伪狂大病的净化方案[J]. 畜牧与兽医,2015,47(7):119-123.
[4] 世界动物卫生组织. 陆生动物诊断试验和疫苗手册[M].农业部兽医局,中国动物卫生与流行病中心,译. 5版.北京中国农业出版社,2004:16-24.
[5] 中华人民共和国国家质量监督检验检疫总局. 出入境动物检疫诊断试剂盒质量评价规程:SN/T 2435—2010 [S]. 北京:中国标准出版社,2010-01-10.
[6] 颜虹. 医学统计学[M]. 北京:人民卫生出版社,2009:21.
[7] 夏邦世,吴金华. Kappa一致性检验在检验医学研究中的应用[J]. 中华检验医学杂志,2006,29(1):83-84.
[8] 陈伟杰,赵灵燕,周彩琴,等. 3种 ELISA 试剂盒检测猪伪狂犬病 gE抗体的比较[J]. 畜牧与兽医,2009,41(11):57-59.
[9] 杨涛,李谓娟. Kappa 检验比较2种猪伪狂犬 gE 抗体 ELISA检测试剂盒[J]. 福建畜牧兽医,2015,37(6):11-13.
[10] MOENNING V,WOLDESENBERT P,FEY H R,et al. Comparative Evaluation of ELISA and neutralization test for the diagnosis of Aujeszky's disease[M]. Netherlands:Springer,1982.
(责任编辑:朱迪国)
Comparison on Three ELISA Test Kits for gE Antibodies of Pseudorabies Virus
Dong Yaqin1,Liu Shuang1,Zheng Hui2,Zhang Zhi1,Wu Faxing1,Li Xiaocheng1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Yebio Biological Engineering Co.,Ltd.,Qingdao,Shandong 266114)
To compare the clinical using effects from three brands of commercial ELISA test kits for Pseudorabies virus(PRV)gE antibodies,180 sera samples were collected from swine farms without PRV vaccination. The sera was determined by virus neutralization test(VN)and was tested by the three ELISA kits at the same time. The characteristics of the three kits were determined and analyzed,including the repeatability,diagnostic sensitivity,specificity and coincidence with VN. The results were as follows:all the three kits had good stability in the inter-assay test with coefficient of variation(CV)below 10%,whereas they were quite different in the intra-assay test with CV,which ranged from 6.90% to 28.87%. And all of the three kits performed well in their sensitivity(from 95.56% to 97.78%)and specificity(from 94.44% to 100%). Besides,test results of the three kits were completely consistent with those of VN,with the Kappa value from 0.91 to 0.96. The results of the study indicated that all the three brands of ELISA kits were applicable for detection of PRV gE antibodies. Kit C was suitable for continuous surveillance,early detection,introduction quarantine and evaluation on eradication effect because of its best stability and sensitivity;while kit B could be used to diagnose culling expensive animals based on its best specificity and accuracy. Therefore,the optimum reagent kit should be chosen reasonably according to the purpose of diagnosis in production practice.
Pseudorabies virus;gE antibody;ELISA test kits;comparison
S852.659.1
B
1005-944X(2017)11-0079-04
10.3969/j.issn.1005-944X.2017.11.021
国家重点研发计划项目(2017YFC1200500);科技部科技基础性工作专项(2012FY111000)
李晓成
