枸杞多糖对中波紫外线照射HaCaT细胞低氧诱导因子1α、血管内皮细胞生长因子表达的影响
2017-11-07张洪长左立春孙海才律广富李娜林喆
张洪长 左立春 孙海才 律广富 李娜 林喆
130117长春中医药大学中医药与生物工程研究开发中心(张洪长、律广富、李娜、林喆);长春中德骨科医院(左立春、孙海才)
枸杞多糖对中波紫外线照射HaCaT细胞低氧诱导因子1α、血管内皮细胞生长因子表达的影响
张洪长 左立春 孙海才 律广富 李娜 林喆
130117长春中医药大学中医药与生物工程研究开发中心(张洪长、律广富、李娜、林喆);长春中德骨科医院(左立春、孙海才)
目的探讨枸杞多糖对中波紫外线(UVB)照射HaCaT细胞低氧诱导因子1α(HIF⁃1α)、血管内皮细胞生长因子(VEGF)的表达。方法将常规培养的HaCaT细胞,分为对照组和枸杞多糖给药组(12.5、25.0、50.0、100.0 μg/ml浓度),各组在给药4 h后同时进行不同强度UVB(0、20、40、60 mJ/cm2)照射,培养24 h。用CCK⁃8法检测细胞生存率。酶生化法检测细胞内超氧化物歧化酶(SOD)的活性;RT⁃PCR及Western印迹检测HIF⁃1α、VEGF基因及蛋白的表达。结果对照组同照射剂量比,枸杞多糖(12.5、25.0、100.0 μg/ml浓度)各组不同程度提高UVB照射损伤细胞的生存率(P<0.05),以50.0 μg/ml枸杞多糖组升高最明显,差异有统计意义(P<0.01)。枸杞多糖各给药组SOD活性以50.0 μg/ml SOD活性升高最明显,差异有统计学意义(P<0.01)。随着UVB照射剂量(20、40、60 mJ/cm2)增加,HIF⁃1α、VEGF基因、蛋白的表达也逐渐增高,与对照组相比,50.0 μg/ml枸杞多糖给药组能够有效降低细胞内HIF⁃1α、VEGF基因及蛋白的表达,差异有统计意义(P<0.05)。结论枸杞多糖通过对HaCaT细胞内HIF⁃1α、VEGF基因及蛋白表达的影响,可能参与预防UVB照射损伤的过程。
紫外线;枸杞;多糖类;内皮生长因子;低氧诱导因子1α;HaCaT细胞
机体受低剂量UVB照射后,可产生大量氧自由基,引起强烈的脂质过氧化反应,导致细胞、组织损伤[1],基因突变,从而有产生癌变的可能[2]。SOD是过氧化物的清除剂,是最有效的抗氧化剂和自由基清除剂[3]。低氧诱导因子1α(HIF⁃1α)是HIF转录复合体成员之一,与细胞衰老和肿瘤有密切的关系[4],而UVB照射HaCaT细胞可增强HIF⁃1α及其下游的血管内皮细胞生长因子(VEGF)蛋白表达[5]。枸杞多糖是从枸杞子提取的有效成分之一,具有较强的生理活性,如清除机体自由基[6],抗肿瘤[7]等。目前对枸杞多糖抗UVB照射[8]损伤HaCaT细胞的报道较多,但对影响HIF⁃1α、VEGF表达的相关报道不多见。本研究采用枸杞多糖处置HaCaT细胞、UVB照射后,观察其对细胞生存率、SOD的活性及HIF⁃1α、VEGF基因蛋白表达的影响,以阐明枸杞多糖预防UVB照射所致皮肤癌发生的可能机制。
一、资料与方法
(一)资料:HaCaT细胞购于中南大学湘雅中心实验室细胞库。枸杞多糖(>50%纯度)购于成都克洛玛生物科技有限公司。胎牛血清购于美国Thermo公司,DMEM培养基购于美国Gibco公司。CCK⁃8细胞增殖毒性检测试剂盒、RNA⁃OUT总RNA提取试剂盒、总蛋白定量测试盒(BCA法)、SOD试剂盒均购于南京建成生物工程研究所。HIF⁃1α、VEGF和β肌动蛋白引物,由上海生工生物工程技术服务有限公司合成。鼠抗人HIF⁃1α、VEGF单克隆抗体、鼠抗人β肌动蛋白、单克隆抗体均购自美国Novus公司。羊抗小鼠二抗购于北京康为世纪公司。
(二)方法:
1.枸杞多糖溶液的配制:称取枸杞多糖原粉,溶解于DMEM培养液中,配制成1 mg/ml浓度的枸杞多糖试验用液10 ml,无菌条件下,0.22 μm微孔滤膜过滤后4℃保存备用。
2.细胞分组与干预:将对数生长期的HaCaT细胞,接种于含有10%胎牛血清DMEM培养基的培养皿中,37℃、5%CO2的细胞培养箱内常规培养;分为对照组和枸杞多糖组(12.5、25.0、50.0、100.0 μg/ml浓度),给药组在给药4 h后与对照组同时进行UVB(0、20、40、60)mJ/cm2照射;照射后继续给药培养24 h。照射剂量(mJ/cm2)=照射强度(W/cm2)×照射时间(s)。
3.CCK⁃8法检测细胞生存率:选择生长良好的HaCaT细胞,以每孔5 × 105ml⁃1浓度的细胞悬液200 μl,接种于96孔板中;检测时吸出培养基,每孔加入不含胎牛血清的DMEM培养液100 μl及10 μl CCK⁃8,CO2培养箱中孵育2 h,用酶联免疫检测仪测定450 nm波长下的吸光度(A)值,换算为细胞增殖率。细胞生存率=实验组A值/无照射对照组A值×100%。
4.SOD活性检测:将种于6孔板的HaCaT细胞2 ml(5×105/ml),吸去上清,用PBS冲洗3遍,加入0.2 ml RIPA裂解液,待细胞破碎完全,用刮刀将细胞刮下,移至微量离心管中,10 000×g离心30 min,收集上清液置-80℃冰箱待测。将收集好的细胞裂解上清液置于2℃冰箱内融化,分别按照SOD试剂盒的操作步骤进行实验。
5.RT⁃PCR检测HIF⁃1α、VEGF mRNA表达:将对数生长期的HaCaT细胞,以5×105/ml接种于6孔培养板中,选给药的最佳浓度组(50.0 μg/ml),按3培养处置细胞后;用Trizol提取细胞总RNA,反转录合成cDNA,RT⁃PCR方法测定HIF⁃1α、VEGF mRNA的表达。以β肌动蛋白为内参照。PCR反应条件:94 ℃变性5 min(94 ℃、30 s;60 ℃、30 s;72 ℃、30 s)× 35个循环,72 ℃延伸5 min。HIF⁃1α正向引物:5′⁃TCCATGTGAC CATGAGGAAA⁃3′;反向引物5′⁃TATCCAGGCTGTGTCGACT G⁃3′,扩增产物片段长度338 bp。VEGF正向引物:5′⁃GGCC TCTGAAACCATGAACT⁃3′,反向 引 物:5′⁃ATGCTGCAGGAA GCTCATCT⁃3′,扩增产物片段长度385 bp。β肌动蛋白正向引物5′⁃AGTTGCGTTACACCCTTTC ⁃3′;反向引物5′⁃CCTTC ACCGTTCCAGTTT⁃3′,扩增产物片段长度152 bp。扩增产物于1.5%琼脂糖凝胶中电泳,凝胶图像分析系统进行图像采集与分析。以目的基因与β肌动蛋白mRNA电泳带的灰度比值作为目的基因的相对表达量。实验重复6次,取均值。
6.Western 印迹检测HIF⁃1α、VEGF蛋白表达:将对数生长期的HaCaT细胞,以5×105/ml接种于6孔培养板中,选给药的最佳浓度组(50.0 μg/ml);PBS漂洗2次,加入细胞裂解液RIPA,冰上静置15 min后收集裂解液,-80℃保存备用。将上述裂解产物反复冻融裂解3次,10 000×g离心30 min,按照BCA⁃200蛋白定量试剂盒说明书进行蛋白定量。取50 μg蛋白,经SDS⁃PAGE凝胶电泳分离后,转移至PVDF膜上,用封闭液封闭后,分别加入单克隆抗体HIF⁃1α、VEGF抗体(1∶250),37℃作用2 h;TBST 洗涤3次,每次10 min;加入稀释羊抗小鼠IgG(1∶5 000)二抗,室温作用1 h;洗膜后加化学发光剂ECL反应1 min,曝光、冲洗后扫描蛋白条带。以目的蛋白与β肌动蛋白蛋白条带灰度比值作为目的蛋白相对表达量。
7.统计学方法:实验数据采用SPSS 13.0统计软件进行数据分析。各组细胞增殖率、SOD活性、HIF⁃1α及VEGF基因和蛋白表达水平以±s表示,多组间样本均数比较采用单因素方差分析;两两比较采用t检验。
二、结果
1.HaCaT细胞生存率比较:CCK⁃8法检测结果显示,随着照射剂量(20、40、60 mJ/cm2)增加,细胞的生存率逐渐下降;与对照组比较,各给药组细胞的生存率均有升高,其中枸杞多糖12.5、25.0、100.0 μg/ml组与对照组比较,P< 0.05,枸杞多糖50.0 μg/ml组细胞生存率升高最明显,P<0.01,差异有统计学意义。见表1。
表1 对照组和枸杞多糖各组HaCaT细胞生存率比较(%,±s)
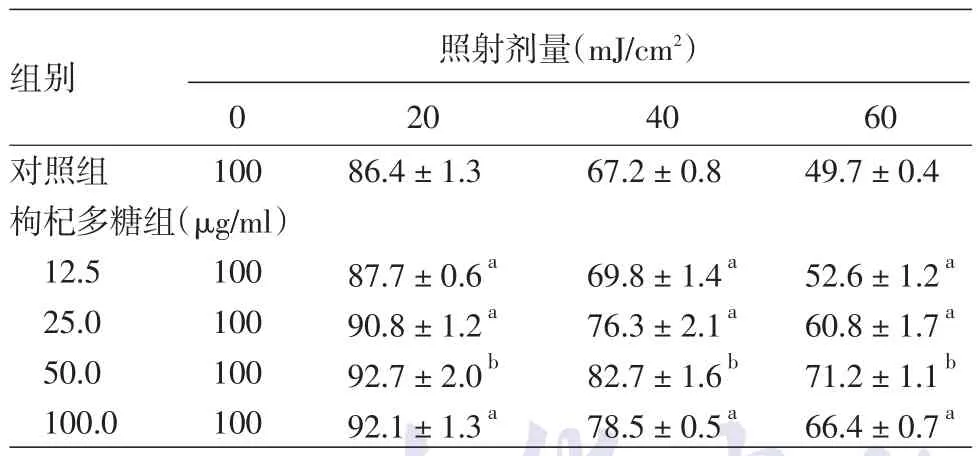
表1 对照组和枸杞多糖各组HaCaT细胞生存率比较(%,±s)
注:n=6。a:与对照组比,P < 0.05;b:与对照组比,P < 0.01
组别对照组枸杞多糖组(μg/ml)12.5 25.0 50.0 100.0照射剂量(mJ/cm2)0 100 20 86.4±1.3 40 67.2±0.8 60 49.7±0.4 100 100 100 100 87.7±0.6a 90.8±1.2a 92.7±2.0b 92.1±1.3a 69.8±1.4a 76.3±2.1a 82.7±1.6b 78.5±0.5a 52.6±1.2a 60.8±1.7a 71.2±1.1b 66.4±0.7a
2.SOD活性:与对照组比较,枸杞多糖各给药组SOD活性均有增高,其中枸杞多糖12.5、25.0、100.0 μg/ml组与对照组比较,P>0.05,差异无统计学意义。枸杞多糖50.0 μg/ml组的SOD活性升高最明显,P<0.01,差异有统计学意义。见表2。
表2 UVB照射后对照组和枸杞多糖各组HaCaT细胞的超氧化物激化酶(SOD)活性(±s)
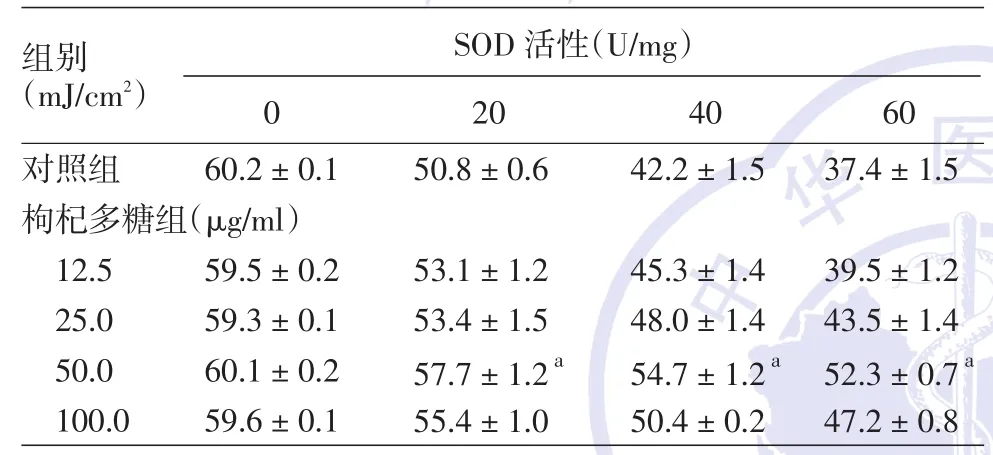
表2 UVB照射后对照组和枸杞多糖各组HaCaT细胞的超氧化物激化酶(SOD)活性(±s)
注:n=6。a:与对照组比,P < 0.01
组别(mJ/cm2)对照组枸杞多糖组(μg/ml)12.5 25.0 50.0 100.0 SOD 活性(U/mg)0 60.2±0.1 20 50.8±0.6 40 42.2±1.5 60 37.4±1.5 59.5±0.2 59.3±0.1 60.1±0.2 59.6±0.1 53.1±1.2 53.4±1.5 57.7±1.2a 55.4±1.0 39.5±1.2 43.5±1.4 52.3±0.7a 47.2±0.8 45.3±1.4 48.0±1.4 54.7±1.2a 50.4±0.2
3.RT⁃PCR HIF⁃1α、VEGFmRNA的表达:50 μg/ml给药组 UVB(0、20、40、60 mJ/cm2)照射培养 24 h,对 HIF⁃1α、VEGFmRNA表达的影响与对照组比较,50 μg/ml给药组UVB照射各组HIF⁃1α、VEGFmRNA 表达明显降低(P<0.05),见图1。
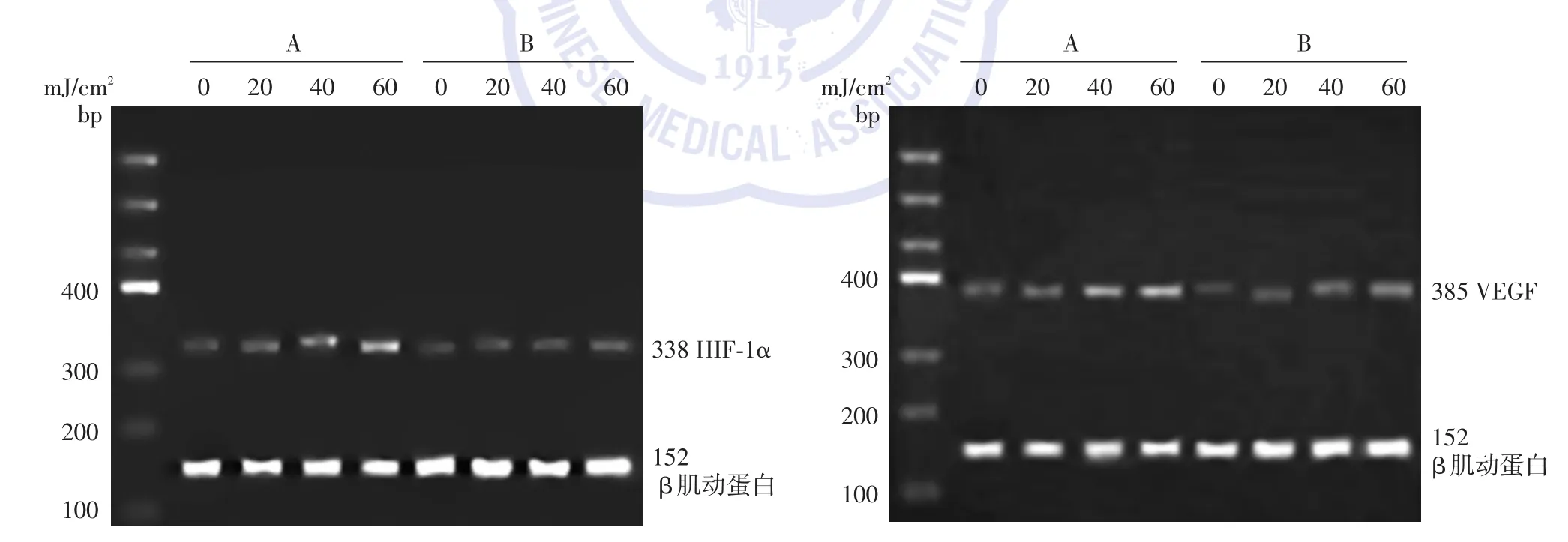
图1 对照组和枸杞多糖组UVB照射细胞中低氧诱导因子(HIF)⁃1α、血管内皮细胞生长因子(VEGF)mRNA电泳图 A:对照组;B:枸杞多糖组
4.Western印迹检测HIF⁃1α、VEGF蛋白:50 μg/ml给药组UVB照射培养24 h,经Western印迹检测分析,对照组随着照射剂量(20、40、60 mJ/cm2)的增加,HIF⁃1α、VEGF蛋白呈上升趋势,但50 μg/ml给药组中HIF⁃1α、VEGF的蛋白表达与对照组相比明显降低。经灰度分析显示:对照组的HIF⁃1α、VEGF蛋白表达水平显著高于50 μg/ml给药组(P< 0.05),见表3。
表3 对照组和枸杞多糖组UVB照射细胞中HIF⁃1α、VEGF蛋白表达(±s)
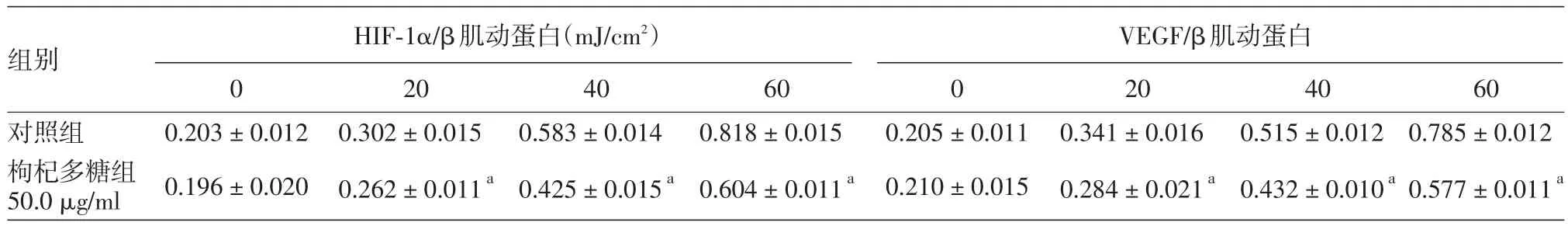
表3 对照组和枸杞多糖组UVB照射细胞中HIF⁃1α、VEGF蛋白表达(±s)
注:n=6。a:与对照组比,P<0.05。HIF:低氧诱导因子;VEGF:血管内皮细胞生长因子
组别对照组枸杞多糖组50.0 μg/ml HIF⁃1α/β肌动蛋白(mJ/cm2)VEGF/β肌动蛋白0 0.203±0.012 0.196±0.020 20 0.302±0.015 0.262±0.011a 40 0.583±0.014 0.425±0.015a 60 0.818±0.015 0.604±0.011a 0 0.205±0.011 0.210±0.015 20 0.341±0.016 0.284±0.021a 40 0.515±0.012 0.432±0.010a 60 0.785±0.012 0.577±0.011a
三、讨论
日光中的紫外线(UV)依波长不同可分为:短波紫外线(UVC),中波紫外线(UVB)和长波紫外线(UVA)。UVB照射皮肤诱导DNA损伤、断裂和肿瘤抑癌基因p53点突变,这与皮肤肿瘤发生发展有着密切的关系[9]。UVB及UVB引起的缺氧能够引起HIF⁃1α的积聚和活性增高、可调节多种细胞许多基因的表达,包括血管内皮细胞生长因子(VEGF),转铁蛋白受体(TFR)等[10]。HIF⁃1α及其下游的VEGF可由UVB诱导激活,通过调节下游基因的转录和表达,刺激肿瘤新生血管生成、抑制肿瘤细胞凋亡、促进肿瘤细胞转移,从而使肿瘤细胞适应缺氧微环境并不断增殖、侵袭和转移[11]。人类肿瘤活组织免疫组化分析表明在大部分肿瘤中HIF⁃1α表达明显增高,并且和肿瘤VEGF表达及血管化作用相关[12]。HIF⁃1α、VEGF活性的丧失或获得可以负相或正相的与肿瘤生长和血管发生相关[13]。
枸杞多糖是从枸杞子中提取的主要有效成分,具有较强的生理活性,有较好的抗照射、抗癌及抗氧化等作用[14]。我们将枸杞多糖作用HaCaT细胞,通过不同剂量UVB照射,来观察枸杞多糖对UVB照射HaCaT细胞生存率、SOD活性及细胞内HIF⁃1α、VEGF基因、蛋白表达的影响。研究显示,UVB可以造成体外培养的HaCaT细胞增殖活力降低,而枸杞多糖可以增加HaCaT细胞的增殖活力;表明枸杞多糖有抗UVB引起的HaCaT细胞损伤的能力。健康的生命体存在强大的防护机制,可对抗自由基的损害,SOD是最有效的抗氧化剂和自由基清除剂,SOD的活力高低间接反映了机体清除氧自由基的能力。研究显示,UVB照射致HaCaT细胞内SOD活性降低,说明UVB可通过抑制SOD,降低其清除活性氧族的能力;而加入枸杞多糖干预后却可明显的增高SOD活性,说明枸杞多糖有很好的抗氧化、抗照射作用,尤以枸杞多糖(50.0 μg/ml)组最为明显。枸杞多糖抑制肿瘤的生长的作用机制说法不一,有认为通过激活机体的免疫系统而抗肿瘤[15],还有资料表明,枸杞多糖的抗肿瘤作用与调节钙离子浓度有关[16]。本研究发现,HaCaT细胞在UVB照射下,枸杞多糖可明显抑制HIF⁃1α和VEGF基因、蛋白的表达,这可能是枸杞多糖抗UVB照射、防止皮肤肿瘤发生的分子机制之一。
[1]Cadet J,Bellon S,Douki T,et al.Radiation⁃induced DNA damage:formation,measurement,and biochemical features[J].J Environ Pathol Toxicol Oncol,2004,23(1):33⁃43.
[2]Strozyk E,Kulms D.The role of AKT/mTOR pathway in stress response to UV⁃irradiation:implication in skin carcinogenesis by regulation of apoptosis,autophagy and senescence[J].Int J Mol Sci,2013,14(8):15260⁃15285.DOI:10.3390/ijms140815260.
[3]张洪长,王恩鹏,陈新,等.人参皂苷Re对UVC辐射损伤细胞的保护作用[J].吉林大学学报:医学版,2013,39(3):507⁃511.DOI:10.7694/jldxyxb20130317.
[4]Deudero JJ,Caramelo C,Castellanos MC,et al.Induction of hypoxia⁃inducible factor 1alpha gene expression by vascular endothelial growth factor[J].J Biol Chem,2008,283(17):11435⁃11444.DOI:10.1074/jbc.M703875200.
[5]张洪长,刘明昕,宋宁,等.人参、黄芩仿生化提取物对UVB照射HaCaT细胞HIF⁃1α表达的影响[J].上海中医药杂志,2015,(03):88⁃90+94.DOI:10.16305/j.1007⁃1334.2015.03.028.
[6]Niu AJ,Wu JM,Yu DH,et al.Protective effect of Lyciumbarbarum polysaccharides on oxidative damage in skeletal muscle of exhaustive exercise rats[J].Int J Biol Macromol,2008,42(5):447⁃449.DOI:10.1016/j.ijbiomac.2008.02.003.
[7]Luo Q,Li Z,Yan J,et al.Lycium barbarum polysaccharides induce apoptosis in human prostate cancer cells and inhibits prostate cancer growth in a xenograft mouse model of human prostate cancer[J].J Med Food,2009,12(4):695 ⁃703.DOI:10.1089/jmf.2008.1232.
[8]李红光,高银娟,韩喜莉,等.枸杞多糖在UVB辐射人角质形成细胞氧化损伤中的保护作用[J].中国医学工程,2011,(12):60⁃61.
[9]Bosch R,Philips N,Suárez⁃Pérez JA,et al.Mechanisms of photoaging and cutaneous photocarcinogenesis,and photoprotec⁃tive strategies with phytochemicals[J].Antioxidants(Basel),2015,4(2):248⁃268.DOI:10.3390/antiox4020248.
[10]Ichihashi M,Ueda M,Budiyanto A,et al.UV⁃induced skin damage[J].Toxicology,2003,189(1⁃2):21⁃39.
[11]刘阳,杨福兵,刁正文,等.葡萄糖转运蛋白⁃3及缺氧诱导因子1α在星形细胞瘤中的表达[J].中华神经医学杂志,2011,10(1):29⁃32.DOI:10.3760/cma.j.issn.1671⁃8925.2011.01.007.
[12]Kummar S,Raffeld M,Juwara L,et al.Multihistology,target⁃driven pilot trial of oral topotecan as an inhibitor of hypoxia⁃inducible factor⁃1α in advanced solid tumors[J].Clin Cancer Res,2011,17(15):5123⁃5131.DOI:10.1158/1078⁃0432.CCR⁃11⁃0682.
[13]Kilic⁃Eren M,Boylu T,Tabor V.Targeting PI3K/Akt represses Hypoxia inducible factor⁃1α activation and sensitizes Rhabdomyo⁃sarcoma and Ewing′s sarcoma cells for apoptosis[J].Cancer Cell Int,2013,13:36.DOI:10.1186/1475⁃2867⁃13⁃36.
[14]郭敏,乌兰托雅,李刚.枸杞多糖药理作用的研究进展[J].华西药学杂志,2013,28(6):633⁃635.
[15]Gan L,Hua ZS,Liang YX,et al.Immunomodulation and antitumor activity by a polysaccharide⁃protein complex from Lyciumbarbarum[J].Int Immunopharmacol,2004,4(4):563 ⁃569.DOI:10.1016/j.intimp.2004.01.023.
[16]Zhang M,Chen H,Huang J,et al.Effect of lyciumbarbarum polysaccharide on human hepatoma QGY7703 cells:inhibition of proliferation and induction of apoptosis[J].Life Sci,2005,76(18):2115⁃2124.DOI:10.1016/j.lfs.2004.11.009.
Effect ofLycium barbarumpolysaccharide on expression of vascular endothelial growth factor and hypoxia inducible factor⁃1α in ultraviolet B⁃radiated HaCaT cells
Zhang Hongchang,Zuo Lichun,Sun Haicai,Lyu Guangfu,Li Na,Lin Zhe
Center of Traditional Chinese Medicine and Bioengineering,Changchun University of Chinese Medicine,Changchun 130117,China(Zhang HC,Lyu GF,Li N,Lin Z);Changchun Sino⁃German Orthopaedic Hospital,Changchun 130051,China(Zuo LC,Sun HC)
Lin Zhe,Email:linzhe1228@163.com
ObjectiveTo evaluate effects ofLycium barbarumpolysaccharide (LBP) on expression of vascular endothelial growth factor(VEGF)and hypoxia inducible factor⁃1α(HIF⁃1α)in ultraviolet B(UVB)⁃radiated HaCaT cells.MethodsConventionally cultured HaCaT cells were divided into control group and LBP groups,which were firstly treated with DMEM,12.5,25.0,50.0 and 100 μg/ml LBP solution respectively for 4 hours,and then were irradiated by UVB at different intensity of 0,20,40,60 mJ/cm2separately.After 24⁃hour continuing culture,CCK⁃8 assay was performed to determine the cell survival rate,and an enzymatic⁃biochemical method to estimate the activity of superoxide dismutase(SOD).RT⁃PCR and Western blot analysis were conducted to measure the mRNA and protein expression of HIF⁃1α and VEGF respectively.ResultsCompared with the control group at the same UVB radiation dose,the 12.5⁃,25.0⁃and 100.0⁃μg/ml LBP groups showed different extents of increase in survival rates of UVB⁃radiated cells(P< 0.05),and the 50.0⁃μg/ml LBP group showed the highest cell survival rate(P< 0.01).Among all the LBP groups,SOD activity was highest in the 50.0⁃μg/ml LBP group(P< 0.01).Along with the increase of UVB radiation dose,the mRNA and protein expression of HIF⁃1α and VEGF all gradually increased.Compared with the control group,the 50.0⁃μg/ml LBP group could effectively reduce the mRNA and protein expression of HIF⁃1α and VEGF in HaCaT cells(allP< 0.05).ConclusionLBP may play a role in protecting cells from UVB radiation⁃mediated damage,likely by influencing the mRNA and protein expression of HIF⁃1α and VEGF in HaCaT cells.
Ultraviolet rays;Lycium barbarum;Polysaccharides;Endothelial growth factors;Hypoxia inducible factor 1α;HaCaT cells
林喆,Email:linzhe1228@163.com
10.3760/cma.j.issn.0412⁃4030.2017.09.012
吉林省科技厅科技发展计划项目(20140414051GH)
Fund program:Science and Technology Development Project of Jilin Provincial Department of Science and Technology(20140414051GH)
2016⁃12⁃26)
(本文编辑:吴晓初)
