金黄色葡萄球菌肠毒素B对LAD2肥大细胞系活化作用的研究
2017-11-07王珊赵作涛王誉涵涂平刘玲玲
王珊 赵作涛 王誉涵 涂平 刘玲玲
100034北京大学第一医院皮肤科 皮肤病分子诊断北京市重点实验室(第一作者现在国家儿童医学中心 首都医科大学附属北京儿童医院皮肤科,100045北京)
金黄色葡萄球菌肠毒素B对LAD2肥大细胞系活化作用的研究
王珊 赵作涛 王誉涵 涂平 刘玲玲
100034北京大学第一医院皮肤科 皮肤病分子诊断北京市重点实验室(第一作者现在国家儿童医学中心 首都医科大学附属北京儿童医院皮肤科,100045北京)
目的用LAD2肥大细胞系与金黄色葡萄球菌肠毒素B(SEB)共培养,探讨SEB对肥大细胞非IgE机制的活化作用。方法建立LAD2与不同浓度的SEB(0.01、0.1、1、10、100 μg/ml)以及A23187阳性对照、阴性对照的孵育体系,培养箱中培养30 min后,光镜下观察SEB对肥大细胞的细胞形态影响并收集各体系上清液,通过酶活性法检测肥大细胞分泌的类胰蛋白酶浓度,并通过ELISA法检测组胺水平。结果LAD2与SEB共孵育30 min后,光镜下可见肥大细胞形态为细胞略增大、边缘模糊、突起增多,折光性下降,呈放射状毛刺样。LAD2与不同浓度SEB(0.01、0.1、1、10、100 μg/ml)共孵育30 min后,上清液检测类胰蛋白酶浓度分别为(4.116±0.651)、(5.344±0.874)、(3.806±0.459)、(1.309 ± 0.247)、(0.310 ± 0.199)ng/ml,SEB浓度在0.01、0.1、1 μg/ml时,释放类胰蛋白酶浓度明显高于阴性对照组(P<0.05),而SEB浓度继续增加则类胰蛋白酶浓度水平依次下降。不同SEB浓度下检测组胺水平分别为(242.409±63.915)、(522.491± 73.466)、(550.926± 84.466)、(334.397±33.640)、(226.527 ± 5.678)ng/ml,SEB浓度在0.01、0.1、1 μg/ml时,肥大细胞释放的组胺浓度随SEB浓度的增加而增高,明显高于阴性对照组(P<0.05);而SEB浓度继续增加时,肥大细胞释放组胺浓度依次下降。结论SEB可通过非IgE依赖机制直接作用于肥大细胞,使肥大细胞活化发生形态变化并释放类胰蛋白酶和组胺。
肥大细胞;金黄色葡萄球菌;肠毒素类;类胰蛋白酶类;组胺;皮炎,特应性
近年研究发现,肥大细胞在炎症性皮肤病如特应性皮炎(atopic dermatitis,AD)的发病过程中起到重要的作用,特别是急性发作阶段[1⁃2]。AD的发病机制涉及到遗传、免疫、皮肤屏障和感染等多个方面,构成复杂的网络[3],AD感染与免疫机制的相互作用是研究热点之一。金黄色葡萄球菌(金葡菌)的感染/定植在AD的作用中已得到公认[4],其机制目前认为主要是与金葡菌超抗原(staphylococcal super antigen,SsAg)对T细胞的作用有关,其中金黄色葡萄球菌肠毒素B(Staphylococcus aureusenterotoxins B,SEB)最常见[4]。以往研究证实,肥大细胞可通过B淋巴细胞被金葡菌抗原激活后产生的IgE活化而脱颗粒,间接加重AD的炎症[5],但是,金葡菌的感染/定植时产生的超抗原SEB能否直接活化肥大细胞,以及肥大细胞是否参与AD金葡菌感染/定植导致的皮炎尚未见报道。我们用LAD2(laboratory of allergic disease 2)肥大细胞系与SEB共培养,研究SEB对肥大细胞非IgE机制的活化作用,进一步探讨AD相关发病机制。
资料与方法
一、资料
1.实验细胞:肥大细胞系LAD2由北京大学深圳医院余佯洋博士惠赠(为LAD2标准品,来源于美国NIH,Laboratory of Allergic Diseases)[6]。
2.主要实验试剂:Stem Pro⁃34培养基(美国Gibco公司),SEB(美国AnaSpec公司),肥大细胞脱颗粒检测试剂盒、A23187(美国Millipore公司),组胺ELISA定量检测试剂盒(美国Genwaybio公司)。
二、方法
1.肥大细胞系LAD2的建立与培养:LAD2细胞以含300 U/L干细胞因子的StemPro⁃34培养液中(含营养强化剂、100 ng/ml SCF、50 ng/ml IL⁃6、1%青链霉素以及2 mmol/l L谷氨酰胺),在37℃、5%CO2环境下培养。细胞悬浮生长,部分贴壁。每周换液1次,每2周传代,以每106个细胞接种于25 cm2培养瓶中,选择生长旺盛、形态良好的细胞用于实验。
2.LAD2与SEB共孵育体系的建立:将LAD2调整为浓度2×106/ml的细胞悬液,在6孔板中每孔加入1 ml细胞悬液和10 μl不同浓度(0.01、0.1、1、10、100μg/ml)的SEB,为不同浓度SEB组。1ml细胞悬液+10 μl培养基为阴性对照组,1 ml细胞悬液+2 nmol/L A23187为阳性对照组。各组在37℃、5%CO2孵箱内孵育30 min。光镜下观察孵育前后肥大细胞的形态变化。110×g离心收集上清液,4℃储存,用于检测。
3.上清液类胰蛋白酶浓度检测:通过酶活法进行检测。按肥大细胞脱颗粒检测试剂盒步骤,取不同待测细胞上清液180 μl及类胰蛋白酶底物20 μl于96孔板内,在37℃恒温箱内孵育2h。在酶标仪405nm波长下读取各孔A值,依据标准曲线计算各样本的类胰蛋白酶浓度。每组样本设3个复孔取均值。
4.上清液中组胺浓度的检测:通过组胺ELISA试剂盒采用竞争法原理进行检测。将待测上清液酰化后,取50 μl加至96孔板,加入50 μl酶联物及50 μl组胺抗血清,振荡器上室温温育3 h。洗涤后加入100 μl TMB底物液,振荡器上室温温育20 min后加入终止液终止底物反应,酶标仪上450 nm波长处读取A值,依据标准曲线计算组胺浓度。每组样本设3个复孔取均值。
5.统计学方法:数据的统计和分析采用SPSS14.0统计分析软件。数据结果均用±s进行描述。多组间比较采用单因素方差分析(ANOVA)和Tukey⁃Kramer检验。P<0.05为差异有统计学意义。
结 果
一、光镜下观察LAD2细胞系与SEB共孵育后肥大细胞形态学变化
共孵育前肥大细胞呈规则圆形,大小较为一致,细胞核偏于一侧,胞质内具有大量折光性强的颗粒,少数细胞细胞膜处可见芽状突起;将1 μg/ml的SEB与肥大细胞共孵育10 min,在光学显微镜×100和×400下观察到肥大细胞细胞形态发生变化,随时间推移而明显:肥大细胞较未共孵育前体积略有增大,折光性下降,细胞表面突起明显增多、增长,呈放射状毛刺样;此改变与阳性对照组胺释放剂A23187对肥大细胞的作用类似。图1为共孵育前和共孵育30 min时LAD2形态。
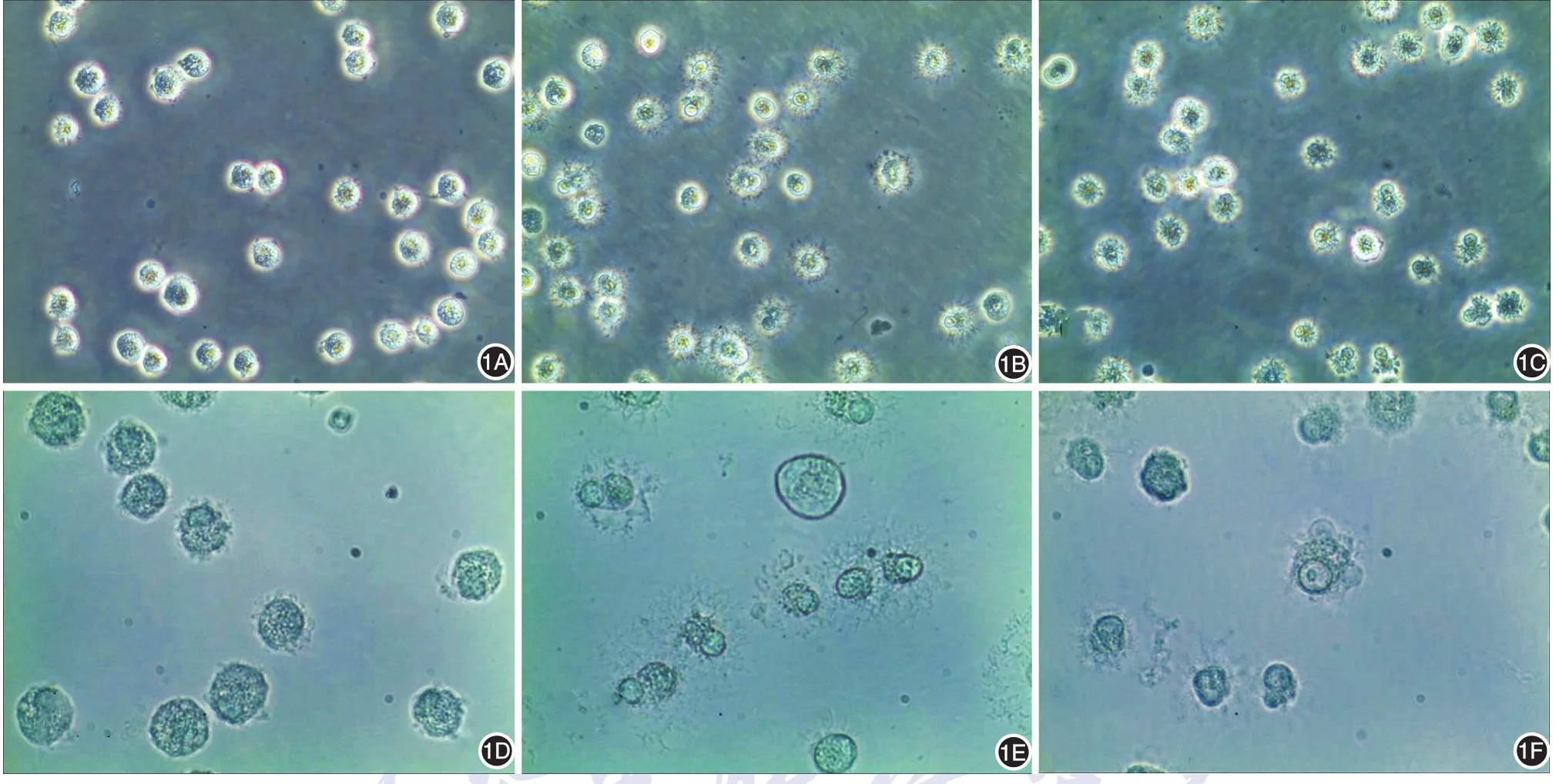
图1 光镜下观察LAD2细胞系与金黄色葡萄球菌肠毒素B(SEB)共孵育前后的细胞形态(1A~1C:×100;1D~1F:×400) 1A、1D:共孵育前LAD2细胞大小一致,核偏于一侧,胞质内有大量折光性强的颗粒;1B、1E:与SEB共孵育30 min后,LAD2细胞折光性下降,表面突起明显增多、增长,呈放射状毛刺样;1C、1F:与阳性对照A23187共孵育30 min后,LAD2与SEB处理后类似
二、LAD2细胞系与不同浓度SEB共孵育后上清液中类胰蛋白酶浓度检测
检测结果见表1。采用单因素方差分析,F=28.951,P<0.001,各组间差异有统计学意义。在SEB 0.01、0.1、1 μg/ml组,LAD2细胞系释放的类胰蛋白酶浓度均较阴性对照组增高,用Tukey⁃Kramer检验进行组间比较,差异均有统计学意义(t=3.913,P=0.020、t=5.777,P=0.001和t=3.441,P=0.048),其中SEB 0.1 μg/ml组的类胰蛋白酶浓度达高峰;而SEB浓度继续增长至10 μg/ml及100 μg/ml时,类胰蛋白酶浓度依次下降,低于阴性对照组(t=0.348,P=0.999和t=1.864,P=0.531)。见表 1,图2。
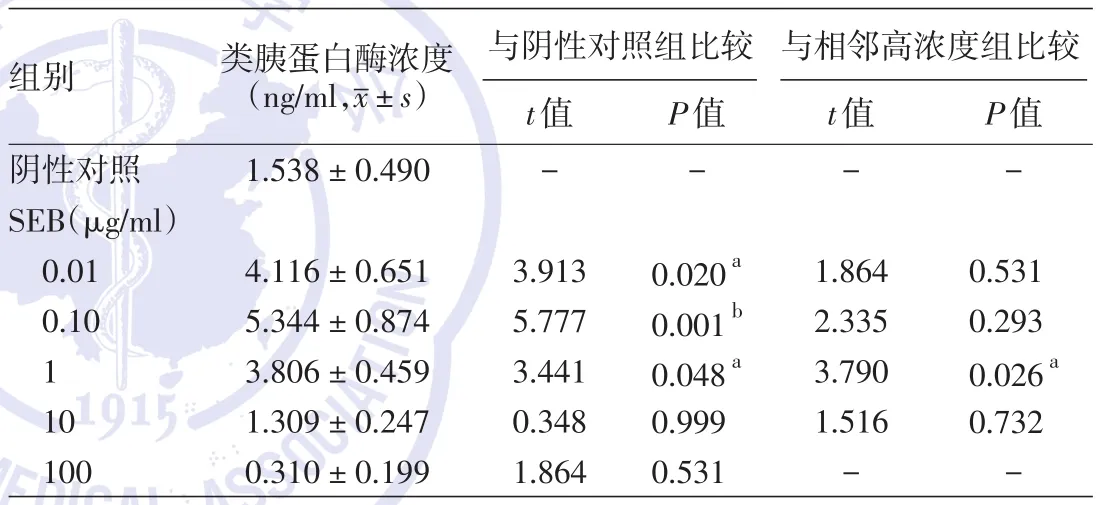
表1 不同浓度金黄色葡萄球菌肠毒素B(SEB)刺激LAD2细胞系后上清液类胰蛋白酶浓度比较
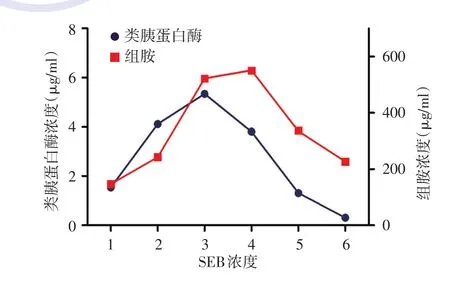
图2 肥大细胞释放类胰蛋白酶及组胺浓度随SEB浓度的变化曲线 1:阴性对照;2:0.01 μg/ml;3:0.1 μg/ml;4:1 μg/ml;5:10 μg/ml;6:100 μg/ml SEB:金黄色葡萄球菌肠毒素B
三、LAD2细胞系与不同浓度SEB共孵育后上清液中组胺浓度检测
采用单因素方差分析,F=23.024,P<0.001,各组间差异有统计学意义。各SEB浓度组组胺浓度均高于阴性对照组,用统计学Tukey⁃Kramer检验进行组间比较,除 SEB 0.01 μg/ml和 100 μg/ml组外,各SEB浓度组与阴性对照组的差异有统计学意义(均P<0.01),其中SEB 1 μg/ml组的组胺浓度达高峰。SEB在0.01、0.1、1 μg/ml浓度下,肥大细胞释放组胺浓度随SEB浓度的增加而增高。而SEB浓度增加至10、100 μg/ml时,肥大细胞释放组胺浓度依次下降,SEB 10 μg/ml组与阴性对照组比较增高,差异有统计学意义(t=3.670,P=0.004),而SEB 100 μg/ml组与阴性对照组比较,差异无统计学意义(t=1.564,P=0.637)。见表2,图2。

表2 不同浓度金黄色葡萄球菌肠毒素B(SEB)刺激LAD2细胞系上清液组胺浓度比较
讨 论
金黄色葡萄球菌是常见毒力最强的表皮定植细菌,其可分泌肠毒素A~E、中毒休克综合征毒素1(toxic shock syndrometoxin,TSST⁃1)、表皮剥脱毒素(exfoliative toxin,ET)等[7]。这些毒素都属于超抗原(superantigen,sAg),即能在极低浓度下即可非特异地刺激多数T细胞克隆活化增殖,产生极强免疫应答的物质。AD皮损局部的金葡菌更易于产生外毒素,以SEB最常见,其次为SEA及TSST⁃1[7⁃8],理论上SsAg只需极低浓度(1~10 ng/ml)即可刺激强烈的T细胞免疫应答,但本研究采用的SEB浓度为10~100 μg/ml,是针对肥大细胞探讨SEB刺激产生免疫应答的浓度。LAD2细胞系来源于人肥大细胞白血病患者的骨髓穿刺液,是目前最适宜做人类肥大细胞生物学研究的肥大细胞系[9]。与传统肥大细胞系H肥大细胞1相比,LAD2活化后能产生更高水平的类胰蛋白酶和糜蛋白酶,更接近成熟的皮肤肥大细胞[10]。因此,我们采用LAD2模拟成熟肥大细胞在体外的活化。A23187是一种钙离子载体,能使钙离子迅速内流[11],是肥大细胞脱颗粒实验的阳性对照试剂。本研究在光镜下观察肥大细胞分别与A23187和SEB共孵育30 min后,均可见到肥大细胞形态变化。且记录形态变化的同时检测到肥大细胞脱颗粒释放的组胺及类胰蛋白酶均显著上升,因此,可证实此种形态变化即为肥大细胞活化后脱颗粒的光镜表现。肥大细胞的脱颗粒过程通常在电镜下观察,而本实验初步证实,光镜下也可见LAD2的脱颗粒表现,猜测细胞边缘的毛刺状突起即为肥大细胞颗粒合并形成的脱粒管道。
在SEB诱发加重AD皮损的机制中,除了其强大的活化T细胞作用外,肥大细胞的作用机制是通过活化B细胞介导的,SEB作为过敏原使B细胞活化产生IgE后作用于肥大细胞表面交联造成肥大细胞活化而释放炎症介质。SEB同时是一种超抗原,是否可以在非IgE机制下直接活化肥大细胞?Ackermann等[12]以SEB刺激H肥大细胞1,发现SEB可以直接活化肥大细胞,产生5羟色胺等物质。本研究显示,SEB与LAD2细胞系共孵育30 min后,肥大细胞即发生细胞形态学变化并促进类胰蛋白酶及组胺的释放,且在SEB不同浓度作用下释放的类胰蛋白酶和组胺水平变化趋势大致一致。与阴性对照组比较可明显增强类胰蛋白酶和组胺释放的SEB浓度分别是0.01~ 1 μg/ml和0.1~ 100 μg/ml(P<0.05)。进一步证实,在无IgE的存在下,超抗原SEB仍可在极低浓度下直接活化肥大细胞细胞系LAD2,促使其释放类胰蛋白酶和组胺,产生类似于肥大细胞超抗原的作用。因肥大细胞很敏感,很多因素均可引起活化,故与阴性对照的目的是去除肥大细胞的非特异活化产生的炎症介质的释放。SEB活化肥大细胞的方式,初步推测可能是通过肥大细胞表面的模式识别受体Toll样受体识别的。
Yoshino等[13]在有关超抗原对AD患者淋巴细胞的增殖作用的研究中发现,SEB可诱导重度AD患者T淋巴细胞的凋亡,同时使外周血单核细胞的增殖明显受抑制。本研究显示,肥大细胞释放的类胰蛋白酶和组胺的水平并不随SEB浓度的增长而一直升高,超过一定浓度范围(SEB浓度10 μg/ml和100 μg/ml),其活化水平反而随SEB浓度的增长而下降,与阴性对照组比较,类胰蛋白酶的活性反而更低,组胺水平趋于和阴性对照组相当,说明高浓度的SEB可能反而会抑制肥大细胞的活化,其机制可能与SEB的毒性作用相关。综上所述,本研究通过LAD2与SEB共培养及上清液检测初步证实SEB可通过非IgE依赖机制直接作用于肥大细胞,使肥大细胞活化发生形态变化并释放类胰蛋白酶和组胺;且SEB对肥大细胞的作用在中、低浓度下具有活化作用,在浓度过高时具有抑制作用。
[1]Kawakami T,Ando T,Kimura M,et al.Mast cells in atopic dermatitis[J].Curr Opin Immunol,2009,21(6):666⁃678.DOI:10.1016/j.coi.2009.09.006.
[2]王珊,刘玲玲.肥大细胞在特应性皮炎发病机制中的作用[J].中国医学文摘皮肤科学,2016,33(2):114⁃121.
[3]Weidinger S,Novak N.Atopic dermatitis[J].Lancet,2016,387(10023):1109⁃1122.DOI:10.1016/S0140⁃6736(15)00149⁃X.
[4]Brüssow H.Turning the inside out:the microbiology of atopic dermatitis[J].Environ Microbiol,2016,18(7):2089 ⁃2102.DOI:10.1111/1462⁃2920.13050.
[5]Leung DY,Harbeck R,Bina P,et al.Presence of IgE antibodies toStaphylococcal exotoxinson the skin of patients with atopic dermatitis.Evidence for a new group of allergens[J].J Clin Invest,1993,92(3):1374⁃1380.DOI:10.1172/JCI116711.
[6]Jin M,Yu B,Zhang W,et al.Toll⁃like receptor 2⁃mediated MAPKs and NF⁃κB activation requires the GNAO1⁃dependent pathway in human mast cells[J].IntegrBiol,2016,8(9):968 ⁃975.DOI:10.1039/c6ib00097e.
[7]赵辨.特应性皮炎与金黄色葡萄球菌超抗原[J].中国中西医结合皮肤性病学杂志,2012,11(1):1⁃3.DOI:10.3969/j.issn.1672⁃0709.2012.01.001.
[8]邢嬛,佟月娟,马琳,等.特应性皮炎患儿皮损局部金黄色葡萄球菌外毒素检测[J].中华皮肤科杂志,2004,37(4):227⁃229.DOI:10.3760/j.issn:0412⁃4030.2004.04.013.
[9]Kirshenbaum AS,Akin C,Wu Y,et al.Characterization of novel stem cell factor responsive human mast cell lines LAD 1 and 2 established from a patient with mast cell sarcoma/leukemia;activation following aggregation of FcepsilonRI or FcgammaRI[J].Leuk Res,2003,27(8):677⁃682.
[10]Guhl S,Babina M,Neou A,et al.Mast cell lines HMC⁃1 and LAD2 in comparison with mature human skin mast cells--drastically reduced levels of tryptase and chymase in mast cell lines[J].Exp Dermatol,2010,19(9):845⁃847.DOI:10.1111/j.1600⁃0625.2010.01103.x.
[11]Hosokawa J,Suzuki K,Nakagomi D,et al.Role of calcium ionophore A23187⁃induced activation of IkappaB kinase 2 in mast cells[J].Int Arch Allergy Immunol,2013,161 Suppl 2:37⁃43.DOI:10.1159/000350357.
[12]Ackermann L,Pelkonen J,Harvima IT.Staphylococcal entero⁃toxinB inhibits the production of interleukin⁃4 in a human mast⁃cell line HMC⁃1[J].Immunology,1998,94(2):247⁃252.
[13]Yoshino T,Asada H,Sano S,et al.Impaired responses of peri⁃pheral blood mononuclear cells to staphylococcal superantigen in patients with severe atopic dermatitis:a role of T cell apoptosis[J].J Invest Dermatol,2000,114(2):281⁃288.DOI:10.1046/j.1523⁃1747.2000.00878.x.
Role ofStaphylococcus aureusenterotoxin B in activation of LAD2 mast cells
Wang Shan,Zhao Zuotao,Wang Yuhan,Tu Ping,Liu Lingling
Department of Dermatology,Peking University First Hospital,Beijing Key Laboratory of Molecular Diagnosis on Dermatoses,Beijing 100034,China(Current affiliation of the first author was Department of Dermatology,Beijing Children′s Hospital,Capital Medical University,National Center for Children′s Health,Beijing 100045,China)
Liu Lingling,Email:liulingling@medmail.com.cn
ObjectiveTo investigate the role ofStaphylococcus aureusenterotoxin B(SEB)in non⁃IgE mediated activation of mast cells(MCs)byin vitroco⁃culture of laboratory of allergic disease 2(LAD2)cells and SEB.MethodsThe LAD2 cells were incubated with SEB at different concentrations of 0.01,0.1,1,10 and 100 μg/ml,A23187 positive control and negative control separately for 30 minutes.Then,effects of SEB on the morphology of MCs were observed by using a light microscope,and culture supernatants of the above incubation systems were collected.The concentration of tryptase released from MCs was analyzed by enzymatic activity assay,and the level of histamine was detected by enzyme⁃linked immunosorbent assay(ELISA).ResultsAfter 30⁃minute co⁃culture of LAD2 cells and SEB,MCs showed larger size,obscure boundaries,increased number of protuberances on the cell surface and decreased refractivity,with a radial burr fin⁃like appearance.After 30⁃minute co⁃culture of LAD2 cells and SEB at different concentrations of 0.01,0.1,1,10 and 100 μg/ml,the concentrations of tryptase in the culture supernatants were 4.116 ±0.651,5.344±0.874,3.806±0.459,1.309±0.247,0.310±0.199 ng/ml respectively.Additionally,the tryptase levels were significantly higher in the 0.01⁃,0.1⁃,1⁃μg/ml SEB groups than in the negative control group(1.538 ± 0.490,allP< 0.05),and gradually decreased along with the increase of SEB concentrations.The histamine levels in the 0.01⁃,0.1⁃,1⁃,10⁃and 100⁃μg/ml SEB groups were 242.409 ± 63.915,522.491 ±73.466,550.926 ± 84.466,334.397 ± 33.640,226.527 ± 5.678 ng/ml respectively.In the 0.01⁃,0.1⁃,1⁃μg/ml SEB groups,the levels of histamine released from MCs were gradually increased along with the increase of SEB concentrations,and were significantly higher than those in the negative control group(146.436±3.100,allP< 0.05).However,with the continued increase of SEB concentrations,the histamine levels gradually decreased.ConclusionSEB can directly activate MCs by a non⁃IgE mediated mechanism,followed by morphologic changes of MCs and release of tryptase and histamine.
Mast cells;Staphylococcus aureus;Enterotoxins;Tryptases;Histamine;Dermatitis,atopic
刘玲玲,Email:liulingling@medmail.com.cn
10.3760/cma.j.issn.0412⁃4030.2017.09.002
2017⁃02⁃03)
(本文编辑:吴晓初)
