门诊血液透析患者血管通路感染目标性监测
2017-11-07曹先伟唐素琴饶思友
徐 珍, 邓 琼, 章 琦, 曹先伟, 唐素琴, 饶思友, 余 奇, 周 芸
(南昌大学第一附属医院, 江西 南昌 330006)
2016-11-20
江西省教育厅青年基金项目(GJJ150124)
徐珍(1982-),女(汉族),江西省丰城市人,主管护师,主要从事医院感染管理研究。
徐珍 E-mail:1322804147@qq.com
10.3969/j.issn.1671-9638.2017.11.012
·论著·
门诊血液透析患者血管通路感染目标性监测
徐 珍, 邓 琼, 章 琦, 曹先伟, 唐素琴, 饶思友, 余 奇, 周 芸
(南昌大学第一附属医院, 江西 南昌 330006)
目的了解门诊血液透析患者血管通路感染发病情况及其危险因素。方法采用前瞻性监测方法,参照国内外相关指南及规范制定监测方法,对某院2014年6月1日—2016年5月31日所有门诊血液透析患者进行目标性监测。结果2014年6月1日—2016年5月31日共有门诊血液透析患者584例,血管通路总次数为64 203例次,发生感染79例,85例次,血管通路感染例次发病率为1.32‰。其中血管穿刺部位感染36例(42.35%),血管通路相关血流感染49例(57.65%)。不同血管通路类型患者中人工血管患者的血管通路感染发病率最高(19.67‰),其次为非隧道式中心静脉置管患者(4.91‰)、隧道式中心静脉置管患者(0.73‰)、动静脉内瘘患者(0.09‰)。年龄>60岁、透析时间>1年、伴有糖尿病、高血压是门诊血液透析患者发生血管通路感染的危险因素(均P<0.05)。 49例血管通路相关血流感染患者送检的血标本中共分离病原菌39株。革兰阳性球菌36株(92.31%),主要为金黄色葡萄球菌(30株,其中6株为耐甲氧西林金黄色葡萄球菌);革兰阴性杆菌3株(7.69%)。结论加强前瞻性目标监测,可以更好地了解门诊血液透析患者血管通路感染的现状、特征及其危险因素,有利于采取针对性的预防控制措施,从而减少门诊血液透析患者血管通路感染的发生。
门诊; 血液透析; 血管通路感染; 目标性监测
[Chin J Infect Control,2017,16(11):1044-1047]
感染属于血液透析常见的并发症,是导致血液透析患者病死率上升的重要原因之一,而血管通路感染是其主要的感染部位[1-2]。为了解门诊血液透析患者血管通路感染的现状、特征及其危险因素,探讨有效的预防及控制措施,本文对门诊血液透析患者开展目标性监测,现将2014年6月1日—2016年5月31日的监测结果进行分析总结,报告如下。
1 对象与方法
1.1 研究对象 某院血液透析中心2014年6月1日—2016年5月31日所有门诊血液透析患者。
1.2 研究方法 采用前瞻性监测方法,参照美国疾病控制与预防中心/国家医疗保健安全网络(CDC/NHSN)发布的标准中门诊血液透析患者血液透析事件的监测方法,依据卫生部2009年发布的《医院感染监测规范》中“成人及儿童重症监护病房(ICU)医院感染监测”的“器械相关感染发病率”的监测方法,对所有维持血液透析的门诊患者进行目标性监测。利用医院血液透析管理信息系统记录所有门诊血液透析患者姓名、年龄、性别、透析年限、基础疾病等资料。每日填写“门诊血液透析患者日志”,记录不同血管通路类型的人次数。对发生血管通路感染的患者填写《门诊血液透析患者血管通路感染调查表》,收集内容包括血管通路类型、置管日期、感染症状(如导管口有红、肿、热、痛或脓性分泌物,发热、寒战等)、导管血和外周血培养结果等。
1.3 相关定义
1.3.1 门诊血液透析患者 指所有在血液透析室进行维持性血液透析的门诊患者,包括短期血液透析患者(如因假期、急诊、短期转床等原因维持血液透析<30 d或<13次的患者),但不包括在病房住院的患者。
1.3.2 血管穿刺部位感染 指血管穿刺部位出现脓液、或超过预期的发红、或肿胀,但未发生血流感染。
1.3.3 血管通路相关血流感染 指与血管通路部位有关或来源不明的血流感染。
1.3.4 血管通路感染 血管通路感染包括血管穿刺部位感染和血管通路相关血流感染。
1.4 统计分析 应用SPSS 19.0软件进行统计分析,计数资料采用χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 基本情况 2014年6月1日—2016年5月31日共有门诊血液透析患者584例。男性373例,女性211例;年龄16~88岁,平均年龄50.5岁;透析时间≤1年者483例,>1年者101例;基础疾病:糖尿病93例,高血压232例,心功能不全35例;血管通路类型:人工血管通路305例次、非隧道式中心静脉置管14 861例次、隧道式中心静脉置管2 753例次、动静脉内瘘46 284例次。
2.2 血管通路感染发病率 584例门诊血液透析患者血管通路总次数为64 203例次,发生感染79例,85例次,血管通路感染例次发病率为1.32‰。其中血管穿刺部位感染36例(占42.35%),血管通路相关血流感染49例(占57.65%)。不同血管通路类型患者血管通路感染发病情况见表1。
表1不同血管通路类型门诊血液透析患者血管通路感染发病情况
Table1Occurrence status of VAI in hemodialysis outpatients with different types of vascular access
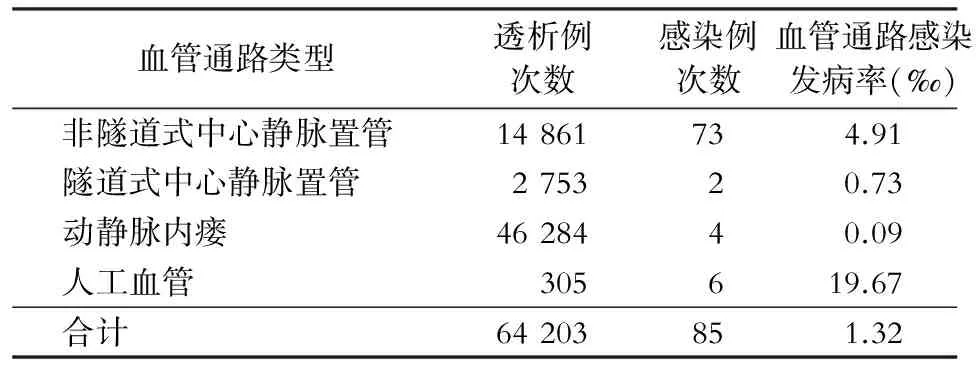
血管通路类型透析例次数感染例次数血管通路感染发病率(‰)非隧道式中心静脉置管14861734.91隧道式中心静脉置管275320.73动静脉内瘘4628440.09人工血管305619.67合计64203851.32
2.3 危险因素分析 584例患者中共有79例患者发生血管通路感染。单因素分析结果显示:年龄>60岁、透析时间>1年、伴有糖尿病、高血压是门诊血液透析患者发生血管通路感染的危险因素(均P<0.05)。见表2。
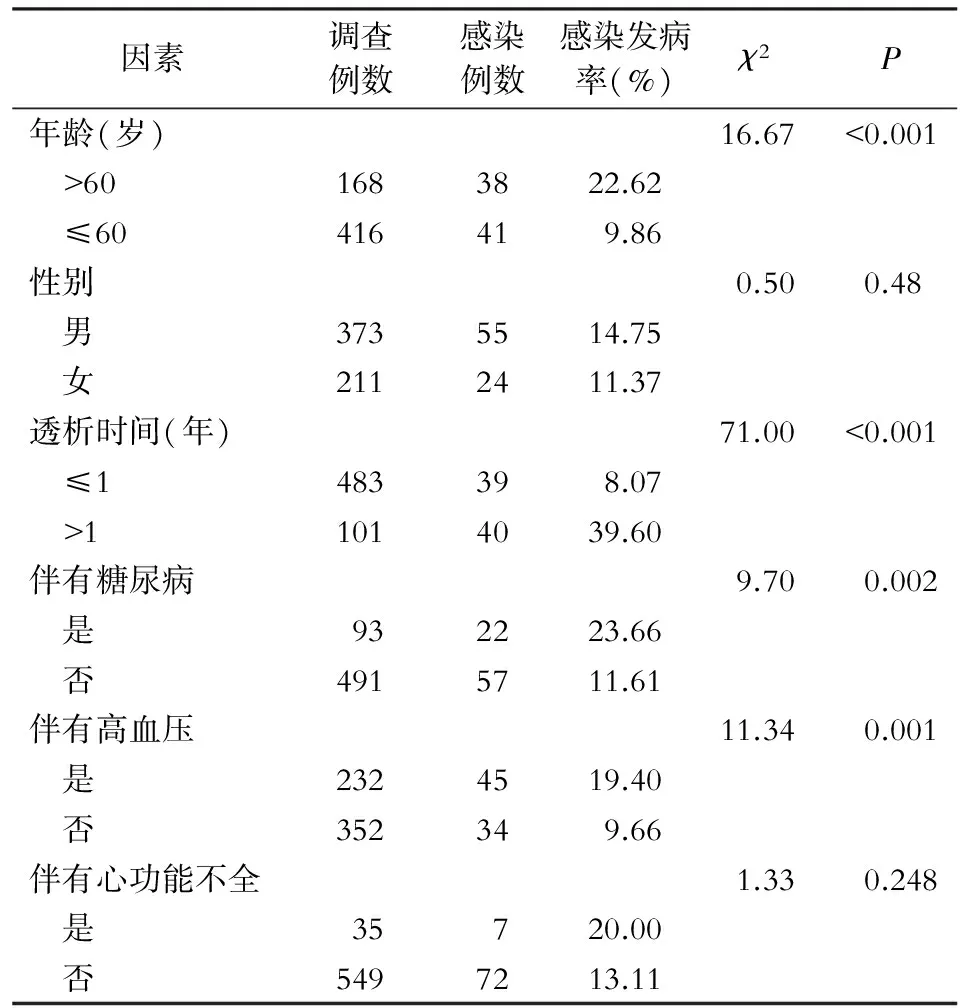
表2 门诊血液透析患者血管通路感染危险因素分析
2.4 血管通路相关血流感染病原菌分布 49例血管通路相关血流感染患者送检的血标本中共分离出病原菌39株。革兰阳性球菌36株(占92.31%),以金黄色葡萄球菌为主(30株),其中6株为耐甲氧西林金黄色葡萄球菌(MRSA);革兰阴性杆菌3株(占7.69%)。见表3。
表3门诊血液透析患者血管通路相关血流感染病原菌分布
Table3Distribution of pathogens causing vascular access-related bloodstream infection in hemodialysis outpatients
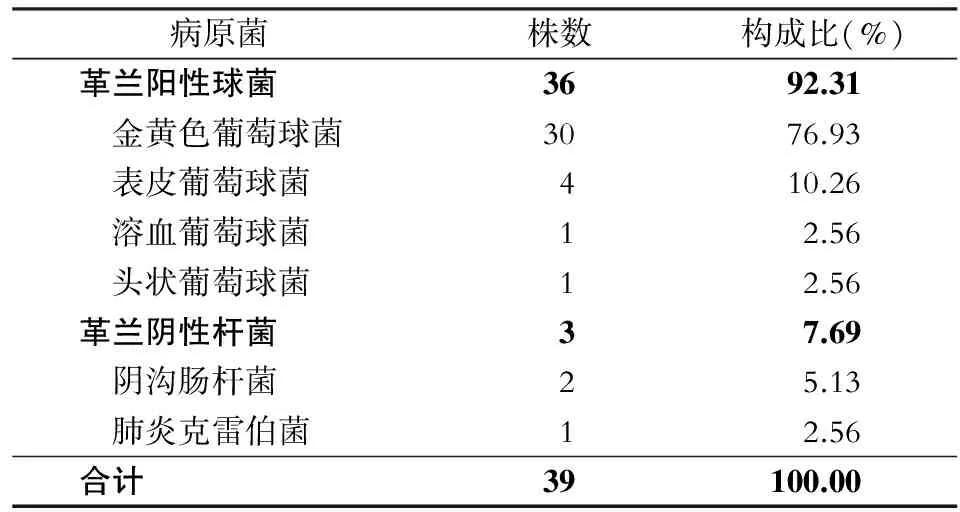
病原菌株数构成比(%)革兰阳性球菌3692.31 金黄色葡萄球菌3076.93 表皮葡萄球菌410.26 溶血葡萄球菌12.56 头状葡萄球菌12.56革兰阴性杆菌37.69 阴沟肠杆菌25.13 肺炎克雷伯菌12.56合计39100.00
3 讨论
血管通路的建立是血液透析成功的基础。门诊血液透析患者的血管通路类型主要有非隧道式中心静脉置管、隧道式中心静脉置管、动静脉内瘘、人工血管,在长期血液透析治疗过程中根据病情及血管情况,大多患者会使用多种血管通路类型。国内血液透析血管通路感染的监测主要参照导管相关感染的监测标准,且主要针对住院患者。2014年由四川大学华西医院医院感染管理科发起的门诊血液透析患者监测,参照美国CDC/NHSN的监测方法,将血液透析血管通路感染及感染相关的事件整合为血液透析事件。血液透析事件发生率按百分比计算,即血液透析事件发生率=(血液透析事件总数/患者总数·月)×100%,如果患者的血管通路超过一种,只统计感染危险因素最高的通路。而NHSN则按照患者总数·月计算[3-4]。本研究参照2009年卫生部发布的《医院感染监测规范》中“成人及儿童重症监护病房(ICU)医院感染监测”的“器械相关感染发病率”的监测方法,门诊血液透析患者血管通路感染发病率采用千分比计算,即血管通路(类型)感染发病率=血管通路感染例次数/患者血管通路(类型)总次数×1 000‰。血管通路感染发病率计算方法的不同,与国内外相关研究报道结果存在差异。本次研究结果,血管通路类型中人工血管感染发病率最高,为19.67‰,其次为非隧道式中心静脉置管(4.91‰)、隧道式中心静脉置管(0.73‰)、动静脉内瘘(0.09‰)。美国透析监测网络(Dialysis Surveillance Network, DSN)收集的1999—2001年门诊血液透析监测资料显示血管通路类型中人工血管感染发病率最高,其次为动静脉內瘘、非隧道式中心静脉置管、隧道式中心静脉置管[5]。Badawy等[6]2012年监测门诊血液透析中心结果显示,隧道式中心静脉置管和非隧道式中心静脉置管较动静脉內瘘和人工血管更容易发生血管通路感染。国内张慧等[7]报道,非隧道式中心静脉置管感染发病率最高,为18.3%,其次为隧道式中心静脉置管(9.8%)、动静脉内瘘(6.6%)、人工血管(0)。
研究结果显示,年龄>60岁、血液透析时间>1年、糖尿病、高血压是门诊血液透析患者血管通路感染的危险因素。与相关报道[8-10]结果一致。高龄患者容易发生血管通路感染可能与患者本身免疫功能下降有关。透析时间较长,破坏了患者机体防御屏障,从而增加感染机会。伴有糖尿病、高血压基础疾病导致患者自身抵抗力的下降,特别是糖尿病的患者,组织细胞内糖分较高会更利于病原菌的培养,因此容易发生感染。
本次研究结果,门诊血液透析患者血管通路相关血流感染的致病菌主要为革兰阳性球菌,占92.31%,其中以金黄色葡萄球菌为主,占76.93%。与国内文献[11-13]报道基本一致。主要原因为体表定植菌沿着置管口表面向体内迁移时大量繁殖所形成。值得重视的是,近年来MRSA感染增速很快,本次研究发现,30株金黄色葡萄球菌中有6株为MRSA,需引起高度重视。
加强前瞻性目标监测,可以更好地了解门诊血液透析患者血管通路感染的现状、特征及其危险因素,有利于采取针对性的预防控制措施,从而减少门诊血液透析患者血管通路感染的发生。
[1] Centers for Disease Control and Prevention. NHSN dialysis event protocol [EB/OL].(2015-05)[2016-05].http://www.cdc.gov/nhsn/cda/faq-electronic-repor-ting-cda.html.
[2] 张丽萍,付阿丹,朱江,等. 血液透析患者导管相关性血流感染风险评估研究[J].中华医院感染学杂志, 2015, 25(23):5421-5423.
[3] 张慧, 宗志勇.门诊血液透析患者血液透析事件监测进展[J].中国感染控制杂志, 2015, 14(8):565-570.
[4] Klevens RM, Edwards JR, Andrus ML, et al. Dialysis surveillance report: National Healthcare Safety Network(NHSN) Data Summary for 2006[J]. Semin Dial, 2008, 21(1): 24-28.
[5] Tokars JI, Miller ER, Stein G. New national surveillance system for hemodialysis-associated infections: initial results[J]. Am J Infect Control, 2002, 30(5): 288-295.
[6] Badawy DA, Mowafi HS, Al-Mousa HH. Surveillance of dialysis events: 12-month experience at five outpatient adult hemodialysis centers in Kuwait[J]. J Infect Public Health, 2014, 7(5): 386-391.
[7] 张慧, 尹维佳, 李超, 等.医院门诊血液透析患者血液透析事件的监测分析[J].中华医院感染学杂志, 2015, 25(21):4925-4928.
[8] 何惠芬, 许晓妹, 毛晓红, 等.尿毒症血液透析患者长期留置导管感染因素分析及预防策略[J].中华医院感染学杂志, 2013, 23(12):2864-2865, 2934.
[9] 王文静, 张燕, 唐伟华.血液透析患者导管相关性血流感染的影响因素分析[J].中华医院感染学杂志, 2014, 24(16):4004-4008.
[10] 胡玉纹, 陈学波, 张亮, 等.血液透析患者医院感染危险因素分析及预防对策[J].中华医院感染学杂志, 2014, 24(1):128-129, 135.
[11] 李月婷, 车丽双, 黄荣桂.血液透析导管相关性血流感染的病原学分析[J].中华医院感染学杂志, 2015, 25(12):2707-2708, 2711.
[12] 杨春琴,黄敏,翁明祥.血液透析患者导管相关性血流感染病原菌分布与危险因素分析[J].中华医院感染学杂志,2015,25(9):2028-2032.
[13] 楼宏青,金云燕,许桂军.血液透析患者导管相关性血流感染病原菌分布及耐药性分析[J].中华医院感染学杂志,2014,24(12):2891-2895.
Targetedsurveillanceofvascularaccessinfectioninhemodialysisoutpatients
XUZhen,DENGQiong,ZHANGQi,CAOXian-wei,TANGSu-qin,RAOSi-you,YUQi,ZHOUYun
(TheFirstAffiliatedHospitalofNanchangUniversity,Nangchang330006,China)
ObjectiveTo investigate the occurrence and risk factors of vascular access infection(VAI) in hemodialysis outpatients.MethodsProspective surveillance method, monitoring methods was formulated and adopted by referring to the relevant guidelines and regulations at home and abroad, targeted surveillance was performed among all outpatients receiving hemodialysis in a hospital from June 1, 2014 to May 31, 2016.ResultsA total of 584 outpatients
hemodialysis from June 1, 2014 to May 31, 2016, with 64 203 times of vascular access, 79 patients developed 85 cases of infection, case incidence of VAI was 1.32‰. 36 cases(42.35%) were infection at vascular puncture sites, 49 (57.65%) were vascular access-related bloodstream infection. Among patients with different types of vascular access, incidence of VAI was the highest among patients with artificial vascular graft(19.67‰),followed by those with non-tunneled central venous catheter(4.91‰), with tunneled central venous catheter(0.73‰), and with arteriovenous fistula(0.09‰). Age>60 years, hemodialysis time>1 year, diabetes, and hypertension were risk factors for VAI in outpatients with hemodialysis(allP<0.05). 39 strains of pathogens were isolated from 49 patients with vascular access-related bloodstream infection, including 36 (92.31%) gram-positive bacteria, mainlyStaphylococcusaureus(n=30, 6 of which were methicillin-resistantStaphylococcusaureus); 3(7.69%) gram-negative bacteria.ConclusionStrengthening prospective targeted surveillance can better understand the status, characteristics, and risk factors of VAI in hemodialysis outpatients, it is conducive to taking targeted prevention and control measures, thus reduce the incidence of VAI in hemodialysis outpatients.
outpatient department; hemodialysis; vascular access infection; targeted surveillance
R181.3+2
A
1671-9638(2017)11-1044-04
(本文编辑:陈玉华)
