不同细菌所致小鼠血流感染模型中MIP-1β、MIP-2和IL-12p70的表达及变化规律
2017-11-07麻雅婷段欣欣王佳楠张可昕王成彬
杨 明,麻雅婷,何 赏,段欣欣,王佳楠,荆 颖,张可昕,王成彬
(1 解放军总医院,北京 100853; 2 温州医科大学检验医学院 生命科学学院,浙江 温州 325035)
2017-03-30
国家重大科学仪器专项项目任务(2012YQ18011708)
杨明(1990-),男(汉族),湖南省益阳市人,硕士研究生,主要从事细菌性血流感染的早期诊断研究。
王成彬 E-mail:wangcb301@126.com
10.3969/j.issn.1671-9638.2017.11.001
·论著·
不同细菌所致小鼠血流感染模型中MIP-1β、MIP-2和IL-12p70的表达及变化规律
杨 明1,2,麻雅婷1,2,何 赏1,段欣欣1,王佳楠1,荆 颖1,张可昕1,2,王成彬1,2
(1 解放军总医院,北京 100853; 2 温州医科大学检验医学院 生命科学学院,浙江 温州 325035)
目的探讨4种血流感染常见细菌致小鼠血流感染后MIP-1β、MIP-2和IL-12p70的表达及变化规律。方法建立金黄色葡萄球菌、粪肠球菌、大肠埃希菌和肺炎克雷伯菌CD-1(ICR)小鼠血流感染模型,采用Luminex液相芯片系统检测各实验组和PBS对照组小鼠感染后0.5、1、3、6、12、24和48 h MIP-1β、MIP-2和IL-12p70的含量。结果MIP-1β的浓度在细菌入血后1 h时明显升高,金黄色葡萄球菌、粪肠球菌、大肠埃希菌、肺炎克雷伯菌组和对照组浓度分别为(134.5±18.3)、(61.5±15.4)、(3 354.0±809.0)、(6 888.4±1 100.2)和(28.9±4.6)pg/mL;IL-12p70达峰值时的浓度分别为(389.3±118.1)、(127.6 ±10.0)、(42.2±3.5)、(62.8±8.4)和(4.8±0.3)pg/mL。MIP-1β、MIP-2的浓度在大肠埃希菌组和肺炎克雷伯菌组高于其他实验组和对照组(均P<0.01),而IL-12p70的浓度在金黄色葡萄球菌组和粪肠球菌组中高于大肠埃希菌组、肺炎克雷伯菌组和对照组(均P<0.01)。结论大肠埃希菌组和肺炎克雷伯菌组MIP-1β和MIP-2的浓度高于金黄色葡萄球菌组和粪肠球菌组,而金黄色葡萄球菌组和粪肠球菌组IL-12p70的浓度高于大肠埃希菌组和肺炎克雷伯菌组。联合检测多种细胞因子或趋化因子在预测革兰阳性或革兰阴性菌感染方面有一定价值,且可能为感染早期指导治疗提供依据。
血流感染; MIP-1β; MIP-2; 小鼠模型; IL-12p70
[Chin J Infect Control,2017,16(11):993-998]
血流感染是指病原体侵入血液循环后持续存在,迅速繁殖,引起机体出现寒战、高热、皮疹及肝脾大等全身症状,预后差,是医院内常见的感染性疾病之一[1]。其病原体主要包括细菌和真菌等,以细菌性血流感染为主[2-3]。近年来,由于抗菌药物的滥用,血管内导管的不合理应用和大量侵入性诊疗技术的开展,细菌性血流感染发病率逐年升高,病情发展迅速,病死率高达30%[4-5]。因此,血流感染的早期诊断和治疗尤为重要。现今,血培养是诊断细菌性血流感染的金标准[6],但需时长、阳性率低,致使大部分患者得不到及时的诊断和治疗。除血培养外,血流感染分子诊断方法有实时荧光定量PCR(real-time PCR)、PCR+测序、肽核酸+荧光原位杂交(PNA+FISH)等[7],但操作复杂、耗时长,给细菌性血流感染的早期诊断带来困难。细菌感染机体后会促使机体免疫细胞产生一系列的细胞因子、趋化因子和急性时相反应蛋白等血清标志物,如巨噬细胞炎性蛋白-1β(MIP-1β)、巨噬细胞炎性蛋白-2(MIP-2),IL-12p70、CRP和PCT等[8],C反应蛋白(CRP)、降钙素原(PCT)现已在临床广泛使用,但其浓度上升时间较细胞因子晚,特异性差,不能区分革兰阴性和革兰阳性菌感染[9]。MIP-1β和MIP-2均属于趋化因子,当机体受到细菌感染后,MIP-1β和MIP-2能够趋化单核细胞到达炎症部位,引起炎细胞的浸润从而发挥抗炎效应。IL-12p70是一种细胞因子,是由p35和p40两个亚基通过二硫键连接而成,主要由树突状细胞、单核巨噬细胞及其他的抗原提呈细胞产生,能促进 CD4+T 辅助细胞(Th1)的增殖和分化,在细菌感染后免疫中起重要作用[10]。关于MIP-1β、MIP-2和IL-12p70在细菌进入血液后,免疫过程中的变化及不同病原菌感染后的差异鲜有报道。本研究以小鼠血流感染模型为基础,前期工作中建立了单病原菌小鼠血流感染模型并进行了相关评价[11-12],然后采用Luminex液相悬浮芯片系统同时检测小鼠血流感染后不同时间段MIP-1β、MIP-2和IL-12p70在金黄色葡萄球菌组、粪肠球菌组、大肠埃希菌组和肺炎克雷伯菌组血清中的浓度,探讨MIP-1β、MIP-2和IL-12p70在不同菌感染早期的变化规律及在区分革兰阳性菌和革兰阴性菌感染中的价值,为细菌性血流感染的早期诊断和不同菌所致血流感染的鉴别诊断提供辅助依据。
1 对象与方法
1.1 研究对象 SPF级CD-1(ICR)雄性小鼠,购自维通利华(北京)实验动物科技有限公司[SCXK (京) 2016-0011)],体重25~27 g。小鼠饲养温度18℃~25℃,湿度50%~70%,动物在实验前适应环境1周。
1.2 实验菌株 金黄色葡萄球菌标准菌株ATCC 25923、大肠埃希菌标准菌株ATCC 25922和粪肠球菌标准菌株ATCC 29212由解放军302医院检验科惠赠。肺炎克雷伯菌标准菌株ATCC 700603由解放军总医院微生物科惠赠。

1.4 小鼠模型的建立 将175只小鼠随机分为金黄色葡萄球菌组、粪肠球菌组、大肠埃希菌组、肺炎克雷伯菌组和无菌PBS对照组,每个组分别按标本收集时间不同分为7组,每组5只。通过前期大量摸索实验条件,各实验组将细菌均以1/2致死量(LD50)浓度经小鼠尾静脉注射至小鼠体内,注射剂量为0.1 mL/10 g,对照组尾静脉注射相应剂量无菌PBS溶液。按感染时间不同分别于感染后0.5、1、3、6、12、24和48 h处死小鼠,收集小鼠血液。
1.5 标本的收集和处理 小鼠眼球取血法收集小鼠全血置于普通EP管中,5 000 r/min,离心20 min后分装血清,保存于-80℃待检。

1.7 统计学分析 应用SPSS 17.0软件进行数据分析,数据服从正态分布,以均值±标准差表示,两组间数据比较用t检验,多组间数据比较用ANOVA,P≤0.05表示差异有统计学意义。
2 结 果
2.1 LD50的测定 经过前期的实验摸索,得出金黄色葡萄球菌、粪肠球菌、大肠埃希菌和肺炎克雷伯菌的LD50分别约为8.1×108/mL、9.6×108/mL、8.1×108/mL和1.1×109/mL。
2.2 MIP-1β浓度的检测 金黄色葡萄球菌组小鼠感染后1 h MIP-1β的浓度明显升高,高于对照组(P<0.01),感染后6 h达最大值。粪肠球菌组和金黄色葡萄球菌组感染相似,感染后3 h MIP-1β的浓度明显升高且达峰值。大肠埃希菌组和肺炎克雷伯菌组MIP-1β的浓度在感染后0.5 h即高于对照组(均P<0.01),且上升的速度和幅度快于金黄色葡萄球菌组和粪肠球菌组,在细菌感染后1 h时大肠埃希菌组和肺炎克雷伯菌组MIP-1β的浓度高于金黄色葡萄球菌组和粪肠球菌组(均P<0.05)。对照组小鼠MIP-1β的浓度在此过程中无明显变化。见表1。
2.3 MIP-2浓度的检测 小鼠感染金黄色葡萄球菌后的前12 h内 MIP-2的浓度逐渐上升,12 h时达峰值[(258.8±34.7)pg/mL],此时高于对照组(P<0.01)。小鼠感染粪肠球菌后与感染金黄色葡萄球菌后相似,12 h达峰值[(437.5±67.4)pg/mL]。大肠埃希菌组或肺炎克雷伯菌组,感染后1~3 h即达峰值,达峰值时浓度分别为(2 080.0±234.2)、(5 471.2±1 147.6) pg/mL,高于金黄色葡萄球菌或粪肠球菌的峰值浓度(均P<0.01)。各组菌感染后2 d,小鼠MIP-2的浓度降至正常水平。见表2。
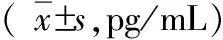
表1 实验组和对照组在感染后不同时间段MIP-1β的浓度
*:跟对照组相比,P<0.01
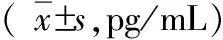
表2 实验组和对照组在感染后不同时间段MIP-2的浓度
*:跟对照组相比,P<0.01
2.4 IL-12p70浓度的检测 金黄色葡萄球菌组小鼠IL-12p70的浓度在细菌感染后3 h高于对照组(P<0.05),感染后6 h达最大值[(389.3±118.1)pg/mL]。粪肠球菌组IL-12p70浓度在感染后3 h高于对照组(P<0.01),12 h时达最大值[(127.6±10.0)pg/mL]。大肠埃希菌组和肺炎克雷伯菌组小鼠IL-12p70的浓度于感染后1 h开始升高(P<0.05),感染后3 h达峰值,浓度分别为(42.2±3.5)、(62.8±8.4) pg/mL,升高的幅度低于金黄色葡萄球菌组和粪肠球菌组。对照组IL-12p70的浓度在此过程中无明显变化。见表3。
2.5 细菌感染后小鼠细胞因子的变化规律 各实验组细菌感染小鼠后1 h MIP-1β的浓度即明显升高(见图1A),与对照组比较差异有统计学意义(均P<0.05);在感染早期,2种革兰阴性(G-)菌组小鼠MIP-1β的浓度较2种革兰阳性(G+)菌组升高快且明显。MIP-2的变化规律与MIP-1β相似,感染后1 h时在2种G-菌组小鼠明显升高(见图1E),G+菌组小鼠浓度上升较G-菌组慢。而IL-12p70的浓度在细菌感染1 h时稍升高(见图1I、1J),感染6 h时,2种G+菌组小鼠IL-12p70的浓度高于2种G-菌组(见图1K、1L)。见图1。
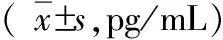
表3 实验组和对照组在感染后不同时间段IL-12p70的浓度
*:跟对照组相比,P<0.01; #:跟对照组相比,P<0.05
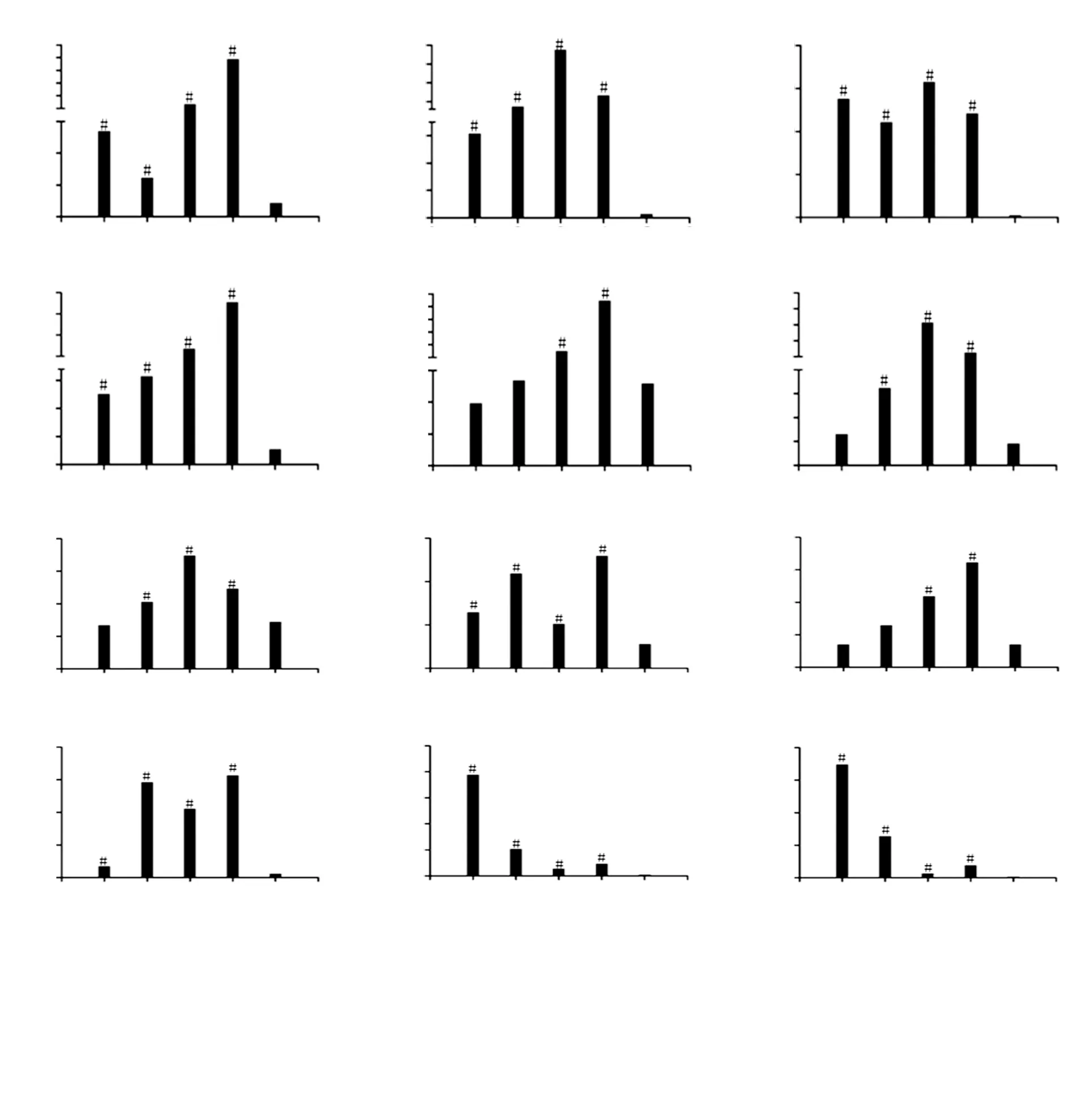
注:横坐标1—5分别表示金黄色葡萄球菌组、粪肠球菌组、大肠埃希菌组、肺炎克雷伯菌组和无菌PBS对照组。A—D分别表示细菌感染小鼠后1、3、6和12 h 各实验组和对照组MIP-1β的浓度;E—H分别表示细菌感染小鼠后1、3、6和12 h 各实验组和对照组MIP-2的浓度;I—L分别表示细菌感染小鼠后1、3、6和12 h 各实验组和对照组IL-12p70的浓度;#:跟对照组相比,差异有统计学意义(P<0.05)
图1细菌感染后小鼠血清中MIP-1β、MIP-2和IL-12p70的浓度随时间变化规律
Figure1Variations of concentrations of MIP-1β, MIP-2, and IL-12p70 in serum of mice infected with bacteria at different time
3 讨论
多种原因,如抗生素和血管内导管的不合理使用,大量侵入性诊疗技术的开展等,使血流感染的发病率逐年上升。现有的血流感染早期快速诊断方法少,主要依赖血培养结果,血培养需时长、阳性率低,不能在血流感染早期提供充足的诊断依据。以往的研究结果显示,细菌入血后刺激机体产生的细胞因子和趋化因子等血清标志物在辅助诊断血流感染方面具有重要的作用[13-14]。因此,细菌感染尤其是感染早期刺激机体产生的血清标志物有望早期辅助或鉴别诊断病原菌。
不同细菌引起机体产生的免疫反应过程不尽相同。根据细菌在机体内定植部位的不同,可分为胞内菌免疫和胞外菌免疫。且G+菌和G-菌由于其自身结构的不同,促使机体产生的免疫反应过程也不尽相同。本研究以小鼠为实验模型,通过前期大量的实验摸索,成功建立了金黄色葡萄球菌、粪肠球菌、大肠埃希菌和肺炎克雷伯菌4种血流感染常见菌的单一菌感染小鼠血流感染模型[15-16],并利用Luminex液相芯片筛查血流感染早期标志物和不同菌感染后的差异标志物,以期发现血流感染早期不同细菌感染的差异性标志物,为细菌性血流感染的早期诊断提供辅助依据,为后续的临床验证提供研究基础。
MIP-1β和MIP-2均属于趋化因子家族,当机体局部有炎症时,MIP-1β和MIP-2等趋化因子能够趋化单核细胞向炎症部位聚集,从而发挥其抗炎效应。以往关于MIP-1α的研究报道较多,鲜有关于MIP-1β和MIP-2在细菌性血流感染中的相关研究报道。本研究主要探讨在不同细菌入血后MIP-1β和MIP-2随时间变化的规律,结果表明细菌入血1 h时各实验组MIP-1β的浓度跟对照组相比明显升高,细菌入血后3 h内,实验组中大肠埃希菌组和肺炎克雷伯菌组MIP-1β的浓度高于金黄色葡萄球菌组和粪肠球菌组,与徐舒敏等[16]的研究结果相似。细菌入血后早期阶段MIP-1β的浓度升高提示可能为细菌感染,MIP-1β的浓度升高越明显,越有可能为大肠埃希菌和肺炎克雷伯菌等G-菌感染,否则G+菌感染的可能性较大。
各实验组和对照组小鼠IL-12p70浓度随时间变化结果表明,当金黄色葡萄球菌或粪肠球菌进入小鼠血液后,前1 h IL-12p70的浓度跟对照组相比无明显变化;随着感染时间的增加,IL-12p70的浓度均逐渐上升;细菌感染6 h时,IL-12p70的浓度明显升高(P<0.01),为对照组的40~100倍;感染后1 d 两组小鼠IL-12p70浓度均处于较高水平。当小鼠感染大肠埃希菌或肺炎克雷伯菌1 h后, IL-12p70的浓度升高,跟对照组相比,差异有统计学意义(均P<0.05)。大肠埃希菌组或肺炎克雷伯菌组小鼠IL-12p70达峰值时,其浓度约为对照组的10倍。随着感染时间的增加,其浓度先增加后下降,感染2 d时,IL-12p70的浓度跟对照组相比无明显差异。
综上所述,血流感染发病率居高不下,且血培养不能在感染早期提供有效的诊断依据来指导临床早期决策和治疗。细胞因子和趋化因子在细菌性血流感染早期辅助和鉴别诊断病原菌方面有广泛的应用前景。但单个时间点或单个生物标志物指标结果对细菌性血流感染的辅助诊断作用较小,加之每种细菌感染小鼠后促使小鼠产生的免疫反应不尽相同,提示我们联合多种细胞因子和多时间点检测有助于预测是否为细菌性血流感染或为哪类细菌感染。结合本实验研究结果提示,若小鼠有立毛、发热等感染征象,且IL-12p70升高不明显,但MIP-1β和MIP-2的浓度在感染早期即明显升高,提示可能为G-菌感染。若有感染症状且IL-12p70浓度随感染时间延长明显升高,MIP-1β和MIP-2的浓度变化不明显,则提示可能为G+菌感染。当然,本研究所使用的全部菌株均为标准菌株,同一种细菌的临床分离菌株和标准菌株的细胞因子谱及浓度是否存在差异,我们也将在后续的研究中进一步进行探讨,且将研究更多的细菌性血流感染常见病原菌以探讨细菌入血后细胞因子和趋化因子等的变化规律,同期我们也在收集临床标本进行验证,以期达到早期辅助诊断和鉴别不同病原血流感染的目的。
[1] 张凯,喻华,黄湘宁,等. 8 548例血流感染病原菌分布及耐药性分析[J]. 中国执业药师,2014,11(9):3-8.
[2] 彭敏颜, 吴雪开. 2008—2012年血培养标本中病原菌分布及其耐药性分析[J]. 现代医药卫生,2013,29(12):1789-1790,1792.
[3] 胡付品, 朱德妹, 汪复, 等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2014,14(5):365-374.
[4] 李若倩, 蒋清清, 马萍, 等. C反应蛋白和中性粒细胞/淋巴细胞比值对血流感染的诊断价值[J]. 检验医学,2016,31(10):902-903.
[5] 吴琼, 李丽娟, 刘国梁, 等. 中性粒细胞/淋巴细胞比值联合降钙素原检测在血流感染诊断中的价值[J]. 检验医学,2016,31(10):898-901.
[6] 郭建, 吴文娟. 血流感染分子诊断的研究进展[J]. 检验医学,2014,29(6):584-589.
[7] Zhang L, Rickard CM. Non-culture based diagnostics for intravascular catheter related bloodstream infections[J]. Expert Rev Mol Diagn, 2017, 17(2): 181-188.
[8] Tavares E, Maldonado R, Ojeda ML, et al. Circulating inflammatory mediators during start of fever in differential diagnosis of gram-negative and gram-positive infections in leukopenic rats[J]. Clin Diagn Lab Immunol, 2005, 12(9): 1085-1093.
[9] Reinhart K, Meisner M, Brunkhorst FM. Markers for sepsis diagnosis: what is useful?[J]. Crit Care Clin, 2006, 22(3): 503-519.
[10] 陈聪, 刘芳, 张聪, 等. il-12p40、il-12p70在经典型霍奇金淋巴瘤中的表达及意义[J]. 安徽医科大学学报,2015,50(9):1308-1312.
[11] 谢尹晶, 段晋燕, 张洪瑞, 等. 临床分离菌株ICR小鼠血流感染模型的建立[J]. 中华医院感染学杂志,2014,24(3):521-523.
[12] Duan J, Xie Y, Yang J, et al. Variation of circulating inflammatory mediators inStaphylococcusaureusandEscherichiacolibloodstream infection[J]. Med Sci Monit, 2016, 22: 161-171.
[13] Slaats J, Ten Oever J, van de Veerdonk FL, et al. IL-1β/IL-6/CRP and IL-18/ferritin: distinct inflammatory programs in infections[J]. PLoS Pathog, 2016, 12(12): e1005973.
[14] Loonen AJ, de Jager CP, Tosserams J, et al. Biomarkers and molecular analysis to improve bloodstream infection diagnostics in an emergency care unit[J]. PLoS One, 2014, 9(1): e87315.
[15] 杨明,麻雅婷,何赏,等.经小鼠尾静脉注射诱导肺炎克雷伯菌血流感染模型的建立及评价[J].中华医院感染学杂志,2017,27(6):1206-1210,1214.
[16] 徐舒敏, 谢尹晶, 郭宇妮, 等. MIP-2、MIP-1α和IL-6在小鼠血流感染中的变化规律实验研究[J]. 北京医学,2015,37(1):37-40.
ExpressionandvariationofMIP-1β,MIP-2,andIL-12p70inmousemodelswithbloodstreaminfectioncausedbydifferentbacteria
YANGMing1,2,MAYa-ting1,2,HEShang1,DUANXin-xin1,WANGJia-nan1,JINGYing1,ZHANGKe-xin1,2,WANGCheng-bin1,2
(1ChinesePLAGeneralHospital,Beijing100853,China; 2SchoolofLaboratoryMedicine&LifeScience,WenzhouMedicalUniversity,Wenzhou325035,China)
ObjectiveTo investigate the expression and variation of MIP-1β, MIP-2, and IL-12p70 in mice with bloodstream infection caused by 4 kinds of bacteria.MethodsCD-1 (ICR) mouse models of bloodstream infection withStaphylococcusaureus(S.aureus),Enterococcusfaecalis(E.faecalis),Escherichiacoli(E.coli), andKlebsiellapneumoniae(K.pneumoniae) were established. After mice in each trial group and PBS control group were infected by bacteria for 0.5h, 1h, 3h, 6h, 12h, 24h, and 48h, concentrations of MIP-1β, MIP-2, and IL-12p70 were detected by Luminex liquid suspension chip system.ResultsConcentrations of MIP-1β increased significantly 1h after bacteria was in blood,S.aureus,E.faecalis,E.coli,K.pneumoniae, and control groups were (134.5±18.3), (61.5±15.4), (3 354.0±809.0), (6 888.4±1 100.2), and (28.9±4.6) pg/mL respectively; the peak values of IL-12p70 were (389.3±118.1), (127.6±10.0), (42.2±3.5), (62.8±8.4), and (4.8±0.3) pg/mL respectively. Concentrations of MIP-1β and MIP-2 inE.coliandK.pneumoniaegroups were significantly higher than other trial groups and control group (allP<0.01), while concentrations of IL-12p70 inS.aureusandE.faecalisgroups were both significantly higher thanE.coli,K.pneumoniae, and control groups (allP<0.01).ConclusionConcentrations of MIP-1β and MIP-2 inE.coliandK.pneumoniaegroups were both significantly higher than those inS.aureusandE.faecalisgroups, while concentrations of IL-12p70 inS.aureusandE.faecalisgroups were both significantly higher than those inE.coliandK.pneumoniaegroups. The combination detection of multiple cytokines or chemokines are valuable in predicting gram-positive or gram-negative bacterial infection, and can provide basis for treatment of early infection.
bloodstream infection; MIP-1β; MIP-2; mouse model; IL-12p70
R446.5
A
1671-9638(2017)11-0993-06
(本文编辑:左双燕)
