补体分子C1q免疫透射比浊法试剂的性能验证
2017-11-07黄立纲周玮闪全忠
黄立纲,周玮,闪全忠
补体分子C1q免疫透射比浊法试剂的性能验证
黄立纲,周玮,闪全忠
100016 北京,清华大学第一附属医院检验科
C1q 是补体 C1 的重要组成部分,是补体系统经典途径的重要识别分子,能够启动经典途径,并且在固有免疫和特异性免疫之间发挥主要的连接作用。最近的研究发现,C1q 能增强多种吞噬细胞的吞噬功能,例如增强对于细菌、免疫复合物、凋亡细胞、损伤的脂蛋白等的吞噬清除。此外,C1q 也可以调节白细胞炎症反应和信号传导[1]。C1q 在清除凋亡细胞的过程中,有着重要的防御自身抗体产生及免疫自稳的作用[2]。当 C1q 缺失、消耗过多或功能低下,会诱发肾病、动脉粥样硬化、中枢神经系统疾病的发生发展,而且 C1q 与衰老相关。因此,监测血清 C1q 水平变化有助于疾病的早发现、早治疗,可作为疾病疗效评估和预后观察的有效指标[3]。
将补体 C1q 免疫透射比浊法试剂,安装在全自动生化分析仪,对患者标本进行检测,可以提高工作效率,减少患者等候时间。本文的研究目的在于,参照 CLSI EP15-A3、CLSI EP6-A、CLSI EP7-A2 等文件,验证上海北加生化试剂有限公司生产的补体分子 C1q 免疫透射比浊法试剂在 Roche cobas c502 全自动生化分析仪上的性能是否符合要求。
1 材料与方法
1.1 材料
1.1.1 仪器 Roche cobas c502 全自动生化分析仪为德国 Roche 公司产品。
1.1.2 试剂 C1q 检测试剂盒(批号:20160815)、C1q 检测校准品(批号:20161114)、C1q 检测质控品(低值,批号:20170226、浓度 174 mg/L;高值,批号:20161217、浓度 306 mg/L)均购自上海北加生化试剂有限公司。
1.1.3 标本 在我院体检中心进行查体的人群中选择各项生化指标正常,既往无明确肾病、免疫系统疾病、高血压、糖尿病、脑梗死或冠心病病史,血清生物化学各项指标在参考范围内且不接近于其上下限,且查体期间无任何自觉症状的健康成年人,年龄 25 ~ 40 岁,清晨空腹坐位抽血,要求抽血前无剧烈运动。从符合条件的人群中随机选取男女各 20 例共 40 例,检测其血清内 C1q 活性水平。
依据试剂厂家提供的线性范围(50 ~ 400 mg/L),在日常工作中,筛选新鲜的低值标本和高值标本。
1.2 方法
1.2.1 仪器校准 采用试剂厂家提供的参数,并使用配套校准品进行定标,方法评价期间每日测定 2 个水平定值质控品判断是否在控,以确保验证试验的可行性和准确性。
1.2.2 反应体系配制
1.2.2.1 精密度验证混合血清 制备一份浓度介于配套质控品两水平之间的混合血清,分装 20 份于–20 ℃冻存。从符合条件的人群中随机选取 10 例男性血清,充分混合,制备混合血清。
1.2.2.2 线性试验 收集接近厂家提供的线性范围上限及下限的新鲜临床标本。
1.2.3 精密度验证 将试剂配套低值、高值两水平质控品复溶,分装成 20 份冻于–20 ℃。参考 CLSI EP15-A3 文件[4],测定两水平定值质控品及一份混合血清,连续测定5 d,每天测定 4 次,每两次间隔时间不少于 2 h。计算各水平批内及批间的标准差 SD 及变异系数 CV。
1.2.4 标本携带污染评价 依次测定一份高水平质控品及三份去离子水,连续测定 5 d,每天测定 1 次,计算样品探针携带污染率,接受标准区间为–3% ~ +3%。
1.2.5 正确度验证 在精密度验证及标本携带污染评价完成且结果良好时,进行后续验证试验。因厂家仅提供一个批次的校准品,故参考 CLSI EP15-A3 文件[4],取低值、高值两水平厂家定值质控品进行正确度验证,复溶后上机各测定 5 次,计算偏倚(Bias%)。
1.2.6 线性范围验证 参照 CLSI EP6-A 文件[5],依据试剂厂家提供的线性范围(50 ~ 400 mg/L)收集新鲜的低值标本(L)与高值标本(H),按体积比例 L、7/8 L + 1/8 H、3/4 L + 1/4 H、5/8 L + 3/8 H、L + H、3/8 L + 5/8 H、1/4 L +3/4 H、1/8 L + 7/8 H及 H 配制成 9 个水平梯度的混合血清,依照低→高、高→低、低→高的顺序测定 3 次,计算均值,与预期值 X =(CL× VL+ CH× VH)/(VL+ VH)比较,利用 SPSS19.0 统计软件检查所得数据,检查有无离群值并判断重复性,然后分别拟合 1 次、2 次、3 次方程进行评价。
1.2.7 最大稀释度试验 选取我院住院患者新鲜血清上机检测,选择 C1q 水平接近线性范围上限的标本,参考试剂厂商提供的检测下限,用生理盐水 2、4、8、16、32 及64 倍稀释,分别上机测定 3 次,求平均值,并将检测结果与稀释后的预期值比较,得出回收率=(测定值/预期值)× 100%,可接受范围为 90% ~ 110%。
1.2.8 临床可报告范围 在进行过线性范围验证、最大稀释度试验之后,通过计算确定 C1q 的临床可报告范围。
1.2.9 生物参考区间验证 在以上性能评价试验完成并通过后,进行参考区间的验证试验。参考 CLSI C28-A3 文件[6],测定结果与已建立的参考范围(男性 >142 mg/L,女性 > 144 mg/L)比对,检验有无离群值。
2 结果
2.1 精密度验证试验
配套质控品及混合血清的批内及批间精密度见表 1,其中低值及高值质控批内 CV 分别为 1.34% 及3.03%,批间 CV 分别为 1.57% 及 3.15%。均低于厂家做出的 10%,也低于本实验室标准(5%)。
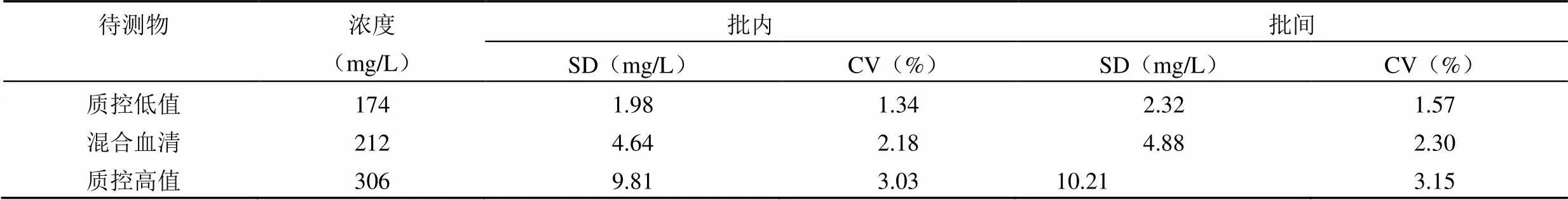
表 1 C1q 各水平精密度
2.2 标本携带污染评价试验
C1q 在 cobas c502 上连续 5 d 的携带污染率分别为 0.77%、0.72%、0.71%、0.83% 及 0.77%,标本平均携带污染率为 0.76%,携带污染判断为合格。
2.3 正确度验证试验
配套两水平质控品(低值 174.0 mg/L、高值 306.0 mg/L)的测定均值分别是 179.0 mg/L 及 311.5 mg/L,偏倚为 2.87% 及 1.80%,均小于本实验室标准(5%),可确保试验结果的正确度。
2.4 线性范围验证试验
收集的低值及高值血清接近但略超出厂家提供的线性范围(50 ~ 400 mg/L),因此分别上机测定 10 次,均值为 46.33 mg/L 及 433.2 mg/L,计算得出重复检测集合方差(SDr),分别为 2.56% 及 4.76%,均低于本实验室规定的允许误差范围 5%,检测结果显示两血清可以用于线性范围评价。配制 9 个水平梯度的混合血清,上机检测并与预期值比较。以预期值为 X 轴、实际测得的均值为 Y 轴进行多项式回归,数据拟合结果显示,b2、b3 与 0 比较差异无统计学意义(> 0.05),为一次线性方程,y = 1.0155x(2= 0.9983,< 0.05),线性范围为 46.33 ~ 433.2 mg/L。线性评价结果见图 1。
2.5 最大稀释度试验
2、4、8、16、32、64 倍稀释的测定均值、预期值及回收率见表 2,其中 64 及 128 倍稀释的回收率超过 90% ~ 110% 的可接受范围,因此在 cobas c502 上 C1q 检测的最大稀释倍数为 32 倍。
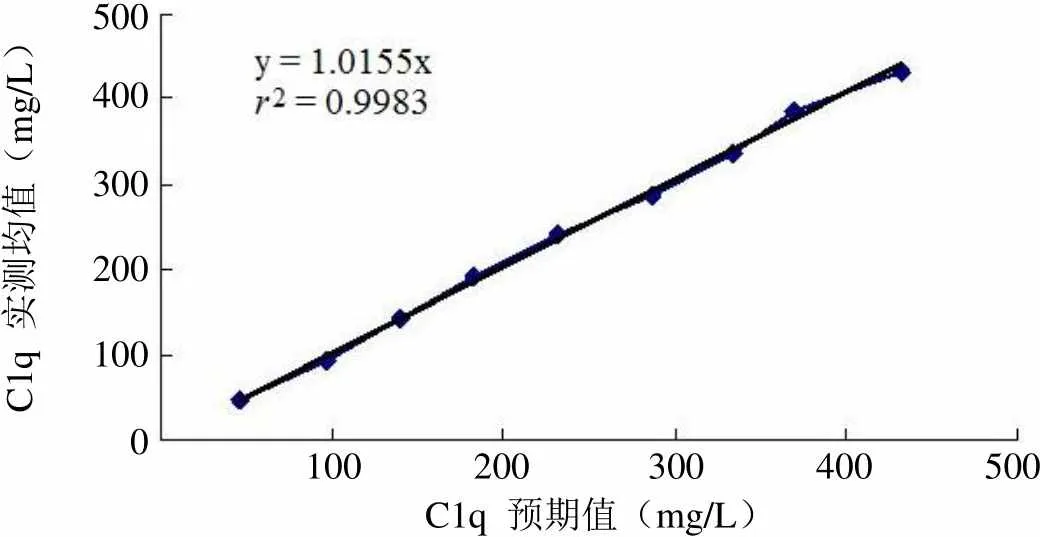
C1q 实测均值(mg/L)5004003002001000 100 200 300 400 500 C1q 预期值(mg/L)
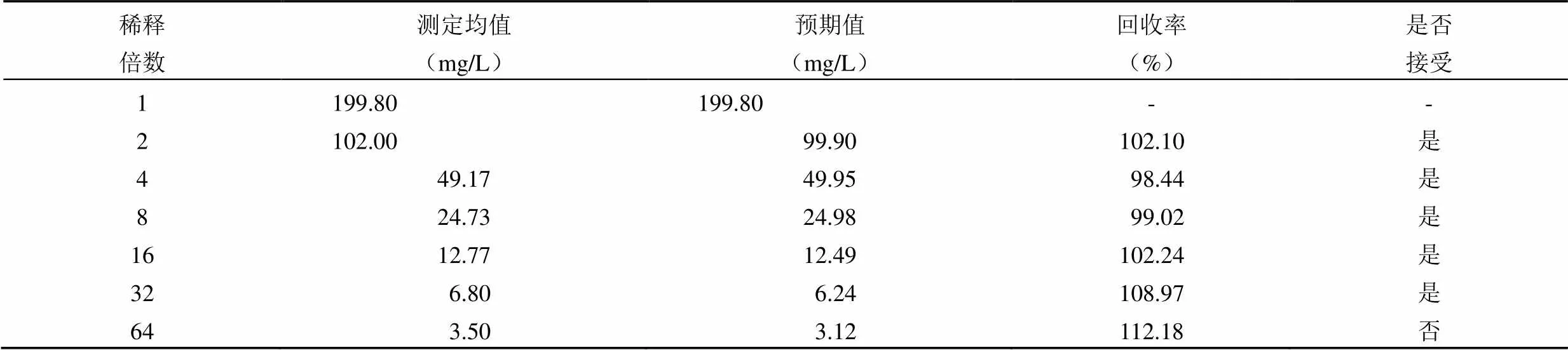
表 2 最大稀释度试验结果
2.6 临床可报告范围
依据线性范围验证及最大稀释度试验结果,以线性范围上限 433.2 mg/L 稀释 32 倍计算,C1q 临床可报告的最高水平为 14259.4 mg/L,临床可报告范围为 40.6 ~ 14259.4 mg/L。
2.7 生物参考区间验证试验
男女各 20 例血清 C1q 水平测定结果为男性(193.0 ± 50)mg/L、女性(196.3 ± 52)mg/L,均在已建立的参考范围(男性 > 142 mg/L,女性 > 144 mg/L)内(表 3),可以此作为本实验室测定 C1q 的参考范围。

表 3 C1q生物参考区间验证结果(mg/L)
3 讨论
精密度是反映仪器整体检测性能的重要指标,检测系统精密度良好是进行后续验证实验的前提和保障。由于C1q 检验项目,无论是美国《临床实验室改进法案修正案》(CLIA’88)或是 ISO 15189 都没有提供相关的允许总误差判断标准,因此本次验证以本实验室内规定的 CV < 5% 为判断标准,验证实验所得的 CV 值 2.1% 属于可接受范围内,因此判定在 cobas c502 上 C1q 检测精密度符合标准。
CLSI EP15-A3 文件提供两种方式来验证正确度,即方法学比对或分析有证参考物质,后者包括厂家提供的校准物、定值质控物及其他附有证书、可溯源的参考物质。C1q 在国内属于还未正式开展的检验项目,所以无法获取美国病理学家协会(CAP)或卫生部临床检验中心提供的正确度验证材料;国内仅有少量医院将 C1q 检测应用于临床,鉴于检测方法的差异,也无法通过实验室间比对完成正确度验证;厂家提供的试剂,其校准品为同一批次,因此本次性能评价采用厂家提供的定值质控进行。结果显示两水平质控品的偏倚为 2.87% 及 1.80%,均小于本实验室标准(5%),可保证检测的准确性。
线性范围是指患者标本不经任何预处理、检验方法直接测定出待测物的范围,反映检测系统的输出特性。本次实验中用于验证的低值、高值血清略超出 50 ~ 400 mg/L 的范围,但经测定及计算后其 SDr 均未超过本实验室设定的允许误差范围 5%,可以用于线性范围验证。所得线性范围 46.33 ~ 433.2 mg/L,回归方程为 y = 1.0155x,2= 0.9983,与厂家提供的 50 ~ 400 mg/L、2= 0.9900 略有出入但基本一致,回归方程显示呈一次线性,线性评价有意义。
本次验证实验得出的最大稀释度为 32 倍稀释,回收率在 90% ~ 110% 的可接受范围内,因此理论上临床可报告范围为 40.6 ~ 14259.4 mg/L。在实际报告时一定要结合对应的临床意义,高值标本测定值超出线性范围后,一定要将其稀释至仪器的分析范围内再做检测,否则可能造成结果的不准确。
CLSI C28-A3 文件提供 3 种方法来评估参考区间验证是否可接受:系统性评审;20 个参考值数据验证;60 个参考值数据验证。鉴于 C1q 的性别差异,本实验室严格筛选健康成年人男女各 20 例,以验证试剂厂商提供的参考区间。文件规定,只要 20 个参考数值中不超过 2 个落到已建立的参考区间外,该实验室就可以采用此参考区间。本次验证结果男性(193.0 ± 50)mg/L、女性(196.3 ± 52)mg/L,均在厂商提供的参考范围内。因此,补体 C1q 免疫透射比浊法试剂与配套生化检测系统相关性良好,符合质量标准,能够满足临床检测的需要,可以用于临床检测。
[1] Fraser DA, Tenner AJ. Directing an appropriate immune response: the role of defense collagens and other soluble pattern recognition molecules. Curr Drug Targets, 2008, 9(2):113-122.
[2] Ho MM, Manughian-Peter A, Spivia WR, et al. Macrophage molecular signaling and inflammatory responses during ingestion of atherogenic lipoproteins are modulated by complement protein C1q. Atherosclerosis, 2016, 253:38-46.
[3] Ding ML, Fan LY. Recent advances in research of cofactor C1q related diseases. Chin J Lab Med, 2015, 38(9):642-645. (in Chinese)
丁梦蕾, 范列英. 补体C1q与疾病发生发展相关性研究的新进展.中华检验医学杂志, 2015, 38(9):642-645.
[4] Clinical and Laboratory Standards Institute. User verification of precision and estimation of bias; approved guideline--third edition. CLSI document EP15-A3. Wayne, Pennsylvania: Clinical and Laboratory Standards Institute, 2014. [2017-05-10]. https://clsi.org/ standards/products/method-evaluation/documents/ep15/.
[5] Clinical and Laboratory Standards Institute. Evaluation of the linearity of quantitative measurement procedures; a statistical approach; approved guideline. CLSI document EP6-A. Wayne, Pennsylvania: Clinical and Laboratory Standards Institute, 2003. [2017-05-10]. https://clsi.org/standards/products/method-evaluation/documents/ep06/.
[6] Clinical and Laboratory Standards Institute. Defining, establishing, and verifying reference intervals in the clinical laboratory; approved guideline--third edition. CLSI document C28-A3c. Wayne, Pennsylvania: Clinical and Laboratory Standards Institute, 2008. [2017-05-10]. https://clsi.org/standards/products/method-evaluation/ documents/ep28/.
10.3969/j.issn.1673-713X.2017.05.016
闪全忠,Email:clinchem@163.com
2017-08-25
