靶向PLK1 PBD小分子抑制剂荧光偏振高通量筛选模型的建立
2017-11-07陈云雨缪冬冬张叶明刘晓平张晶
陈云雨,缪冬冬,张叶明,刘晓平,张晶
靶向PLK1 PBD小分子抑制剂荧光偏振高通量筛选模型的建立
陈云雨,缪冬冬,张叶明,刘晓平,张晶
241002 芜湖,皖南医学院药学院(陈云雨、缪冬冬、张叶明、刘晓平);130022 长春,中国科学院长春应用化学研究所化学生物学实验室(陈云雨);100050 北京,中国医学科学院医药生物技术研究所国家新药(微生物)筛选实验室(陈云雨、张晶)
建立适用于靶向 PLK1 PBD 小分子抑制剂规模化筛选的荧光偏振高通量筛选模型。以 pET-28a-PLK1 PBD 质粒转化Rosetta BL21(DE3),诱导表达并纯化 PLK1 PBD蛋白。利用荧光偏振原理,以 FITC-Poloboxtide 作为分子探针,优选分子探针和 PLK1 PBD 最佳工作浓度,建立适用于 PLK1 PBD 小分子抑制剂筛选的荧光偏振高通量筛选模型。同时采用上述建立的荧光偏振筛选模型检测 poloxin 的抑制活性。成功诱导表达并纯化 PLK1 PBD 蛋白。选用 30 nmol/L分子探针和 200 nmol/L PLK1 PBD 蛋白建立荧光偏振高通量筛选模型,其 Z' 因子可达 0.74。基于该方法,检测 poloxin 的抑制活性,其 IC50值为(4.27 ± 0.69)μmol/L。成功建立了适用于靶向 PLK1 PBD 小分子抑制剂筛选的荧光偏振高通量筛选模型。
荧光偏振免疫测定; 高通量筛选分析; PLK1 PBD 抑制剂
保罗样激酶-1(polo-like kinase 1,PLK1)是广泛存在于真核生物中的一类丝/苏氨酸蛋白激酶。PLK1 主要在细胞有丝分裂的 G2晚期和 M 期表达,在有丝分裂启动、中心体成熟、纺锤体组装、染色体整列等细胞有丝分裂过程中发挥重要作用[1]。PLK1 在大部分恶性肿瘤细胞中呈过度表达并且与肿瘤的发生与发展密切相关,被认为是肿瘤分子靶向治疗中最具潜力的重要靶标之一[2]。
与 PLK1 功能相反,PLK2 和 PLK3 被认为是重要的抑癌因子,在检查点导致的周期阻滞中发挥作用以保证基因组稳定性,防止癌变[3-5]。因此,小分子抑制剂对 PLK1 的高度选择性是靶向 PLK1 治疗肿瘤的关键。
PLK1 ~ 3 的结构具有较大的相似性,N 端具有一个高度同源的激酶结构域(kinase domain,KD),C 端具有调节 PLK1 催化活性及亚细胞动态定位的特征性结构域(polo-box domain,PBD)。由于激酶结构域在众多激酶结构中的高度保守性及其结构变异导致的耐药问题,使开发高选择性 PLK1 抑制剂面临极大的挑战。因此,PLK1 特有的底物结合域 PBD 成为新型 PLK1 小分子抑制剂开发的理想靶点[6]。
荧光偏振技术(fluorescence polarization,FP)在 20 世纪 90 年代中期开始应用于药物的高通量筛选,并且在以蛋白质-蛋白质相互作用为靶点的药物发现中展现出无可比拟的应用前景[7]。本实验拟利用荧光偏振技术原理,建立基于以 FITC-Poloboxtide 作为 PLK1 PBD 结合配体的荧光偏振高通量筛选模型[8],为靶向 PLK1 PBD 小分子抑制剂的理性化发现奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料及试剂 pET-28a-PLK1 PBD(326-603 aa)重组质粒由本室构建;Rosetta BL21(DE3) 感受态细胞购自北京全式金生物技术有限公司;page rulerTMunstained protein ladder(Cat#26630)、BCATMprotein assay kit 购自美国Thermo Fisher 公司;GelRedTMnucleic acid gel stain(Cat#41003)购自美国Biotium公司;蛋白胨、酵母粉、琼脂粉购自英国Oxide公司;诱导剂 IPTG 购自德国Merck公司;HisTrapTMHP 亲和层析柱(Cat# 17-5247-01)购自瑞典GE Healthcare公司;FITC-Poloboxtide(FITC-GPMQSpTPLNG-OH,Mw:1583.61,纯度> 95%,λex/λem:485/535 nm)由上海强耀生物科技有限公司合成;DMSO 及 poloxin 购自美国Sigma-Aldrich公司;其他试剂为国产分析纯。
1.1.2 仪器 Wallac EnVision 2104 型多功能微孔板检测仪及 384 孔全黑色不透明微孔板(Cat# 6007270)购自美国PerkinElmer公司。
1.2 方法
1.2.1 PLK1 PBD 蛋白原核表达与分离纯化 将质粒 pET-28a-PLK1 PBD(326-603 aa)转化宿主菌株Rosetta BL21(DE3) 感受态细胞,构建重组工程菌。重组工程菌转接于 200 ml 含 50 μg/ml 卡那霉素的 LB 液体培养基中,生长至600≈ 0.9 时,加入终浓度0.5 mmol/L 的IPTG,20 ℃诱导 12 h 后,3300 r/min 离心 30 min 收集菌体。将收集的菌体沉淀重悬于 10 ml 裂解液(25 mmol/L Tris、0.5 mol/L NaCl、50 mmol/L 咪唑,pH 7.8)后,置于冰上并以超声波裂解菌体。待菌体悬液澄清后结束裂解,4 ℃、10 000 r/min 离心 30 min,收集裂解上清液。上清液以 0.45 μm 滤膜过滤后,以HisTrapTMHP 亲和层析柱分离纯化,采用梯度咪唑浓度洗脱,分离纯化 PLK1 PBD 蛋白。目的蛋白以透析袋法经透析液(20 mmol/L Tris、100 mmol/L NaCl、1 mmol/L EDTA、10% 甘油,pH 8.0)透析后,采用 BCATMprotein assay kit 进行蛋白浓度测定。
1.2.2 FITC-Poloboxtide 工作浓度的优选 将2 mmol/L FITC-Poloboxtide 溶液以 FP 反应液(50 mmol/L Tris-HCl、10 mmol/L NaCl、1 mmol/L EDTA,pH 8.0)进行系列稀释,使其终浓度分别达到 50、45、40、35、30、25、20、15、10 和5 nmol/L。将上述各浓度的稀释液以 60 μl/孔依次加入到 384 孔板中,每个浓度设立 3 组复孔。以多功能微孔板检测仪进行millipolarization 单位(mP)检测。
1.2.3 PLK1 PBD 工作浓度的优选 将稀释后 60 nmol/L FITC-Poloboxtide 溶液以 30 μl/孔依次加入 384 孔板中,同时将 24 μmol/L PLK1 PBD以 FP 反应液进行系列稀释。将各浓度的 PLK1 PBD 稀释液(500、450、400、350、300、250、200、150、100、50、25、12.5 和 0 nmol/L)以 30 μl/孔依次加入到含有 FITC-Poloboxtide 的 384 孔板中,每个浓度设立 3 组复孔。室温缓慢振摇,避光孵育 15 min,以多功能微孔板检测仪进行 mP 检测,其中 0% 和 100% 抑制时体系最稳定的 mP 值之间的范围是 mP 值的最佳范围,该 mP 范围另需满足 HTS 基本参数的相关要求。以 GraphPad Prism5.0 软件拟合结合曲线并计算 PLK1 PBD/FITC-Poloboxtide 结合反应的 Kd值,确定 PLK1 PBD 的最佳工作浓度。
1.2.4 DMSO 浓度对筛选模型的影响 DMSO 是小分子化合物在高通量筛选中最常使用的有机溶剂。合理控制并降低 DMSO 浓度对 PLK1 PBD/FITC-Probe 结合反应的影响对于荧光偏振高通量筛选模型的建立及活性化合物的高效、快速发现是至关重要的。
FITC-Poloboxtide 和 PLK1 PBD 最佳工作浓度确定后,将含有终浓度为 0%、2.5%、5%、7.5%、10%、12.5%、15%、17.5% 和 20% DMSO 的各反应体系(含 30 nmol/L FITC-Poloboxtide 溶液和 200 nmol/L PLK1 PBD)均匀混合后,以 60 μl/孔依次加入 384 孔板中,每个 DMSO 浓度设立 3 组复孔。反应体系于室温缓慢振摇孵育 15 min,以多功能微孔板检测仪进行 mP 检测。
1.2.5 Poloxin 检测筛选模型的特异性 Poloxin 是首个报道的 PLK1 PBD 小分子抑制剂[9],故以其检测所建立的荧光偏振筛选模型的特异性。将 400 nmol/L PLK1 PBD 溶液以 29 μl/孔依次加入到 384 孔板中,再将 1 μl 以 2 倍倍比稀释的 poloxin(起始浓度 333.33 μmol/L,设置 11 个浓度梯度)加入到含有 400 nmol/L PLK1 PBD 的 384 孔板中,同时以加入 1 μl DMSO 作为阳性对照。将上述反应体系混匀后于室温缓慢振摇孵育 45 min 后,再将 60 nmol/L FITC-Poloboxtide 以 30 μl/孔依次加入到含有上述反应体系的 384 孔板中,室温缓慢振摇,避光孵育 15 min。以多功能微孔板检测仪进行 mP 检测并以 GraphPad Prism5.0 软件拟合曲线,计算 poloxin 的 IC50值。
1.2.6 Z' 因子及其他主要技术参数的测定 将 30 μl 60 nmol/L FITC-Poloboxtide、30 μl 400 nmol/L PLK1 PBD 和 0.3 μl DMSO 混匀后室温缓慢振摇,避光孵育 15 min,以多功能微孔板检测仪进行 mP 检测并以其作为阴性对照。同时,将 30 μl 60 nmol/L FITC-Poloboxtide、30 μl FP 反应液和0.3 μl DMSO 混匀后室温缓慢振摇,避光孵育15 min,以多功能微孔板检测仪进行 mP 检测并以其作为阳性对照。其中,1#~ 30#孔为阴性对照;31#~ 60#孔为阳性对照。以多功能微孔板检测仪检测 mP 值并按照 FP 检测系统的相关程序进行 Z'因子的自动计算。
另外,根据参考文献[10-12],我们也对本筛选模型的信号本底比(S/B),信号窗(SW)、信噪比(S/N)、信号/本底变异系数(CV)进行系统测定。
1.2.7 数据处理 采用 GraphPad Primer 5 软件拟合曲线计算 Kd值和 poloxin IC50值,其中 poloxin 抑制率计算公式如下:

抑制率(%)=mP阴性对照– mPpoloxin× 100% mP阴性对照– mP阳性对照
2 结果
2.1 PLK1 PBD 蛋白原核表达与分离纯化
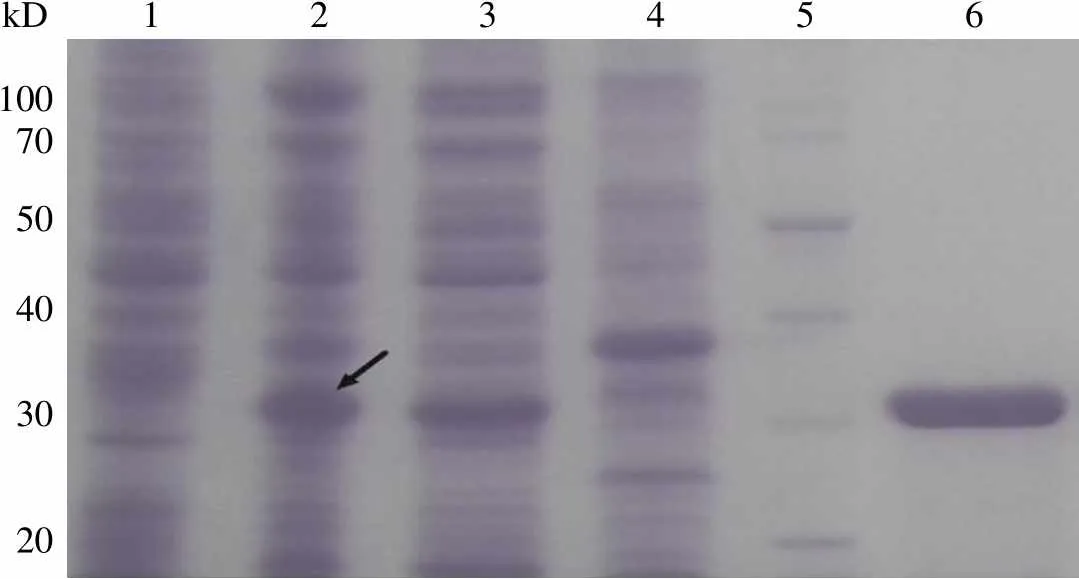
将质粒 pET-28a-PLK1 PBD(326-603 aa)转化宿主菌株Rosetta BL21(DE3) 后,以0.5 mmol/L IPTG,20 ℃诱导 12 h,目的蛋白在30 kD 附近有明显的条带并大部分以可溶形式表达(图 1 箭头处),故本研究选用上述表达条件为最终表达方案。将裂解上清液经HisTrapTMHP 亲和层析柱分离纯化,以咪唑浓度梯度洗脱,样品进行 SDS-PAGE 电泳,经考马斯亮蓝染色后呈单一蛋白条带,表明已制备出较高纯度的 PLK1 PBD 蛋白(图 1)。纯化的蛋白经透析后,其浓度达0.85 mg/ml(约 24 μmol/L)。
2.2 FITC-Poloboxtide 工作浓度的确定
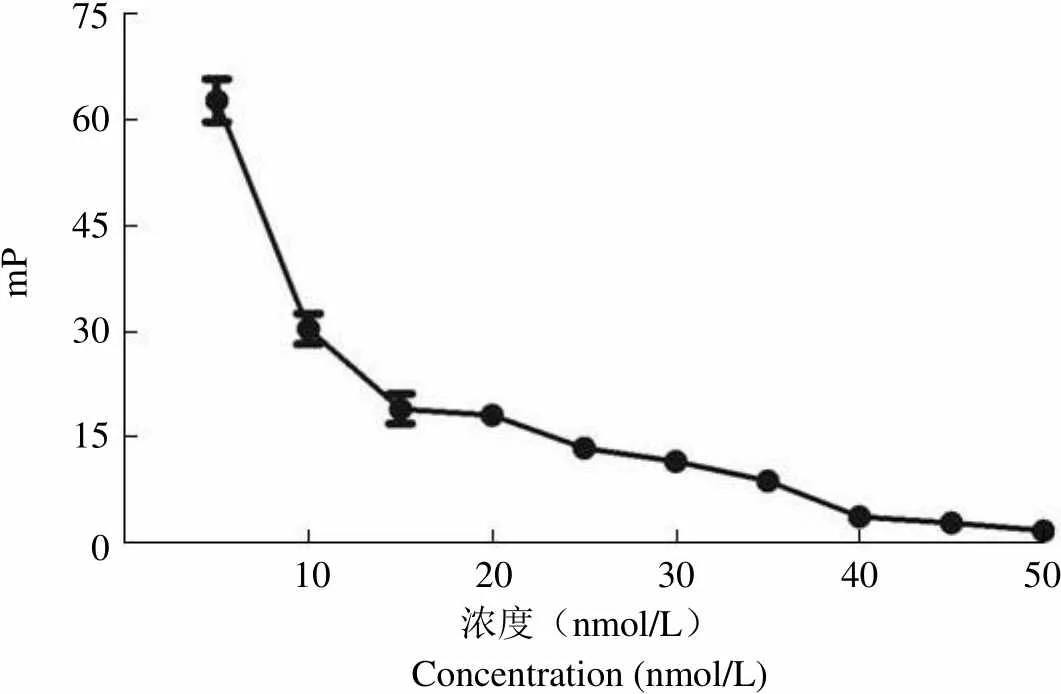
随着 FITC-Poloboxtide 浓度的逐渐升高,mP 值逐渐降低。在 25 ~ 35 nmol/L 时,mP 值趋于稳定并始终维持在 11.82 ~ 8.25 之间,具有较低的背景值(图 2)。所以,在后续 FP 实验中采用终浓度 30 nmol/L FITC-Poloboxtide 作为其最佳工作浓度。
2.3 PLK1 PBD 工作浓度的确定
随着 PLK1 PBD 浓度的上升,mP 值逐渐升高。当 PLK1 PBD 浓度达到500 nmol/L 时,mP 值达到最大(mPmax= 198.62)并趋于平台期(图 3)。经 GraphPad Prism 5.0 软件拟合结合曲线,计算其结合反应的 Kd值约为 130 nmol/L。为了使其结合反应在 FP 实验体系中接近饱和状态,实际使用的 PLK1 PBD 浓度应达到 Kd值的 1.5 倍左右[13]。故此,在后续 FP 实验中采用终浓度 200 nmol/L PLK1 PBD 作为其最佳工作浓度。
kD 1 2 3 4 5 6 10070 50 40 30 20
Figure 1 Expression and purification of PLK1 PBD
mP75 60 45 30 15 0 10 20 30 40 50 浓度(nmol/L)Concentration (nmol/L)
Figure 2 Optimal FITC-Poloboxtide concentration in FP assay
Figure 3 Optimal PLK1 PBD concentration in FP assay
2.4 DMSO 浓度对荧光偏振筛选模型的影响
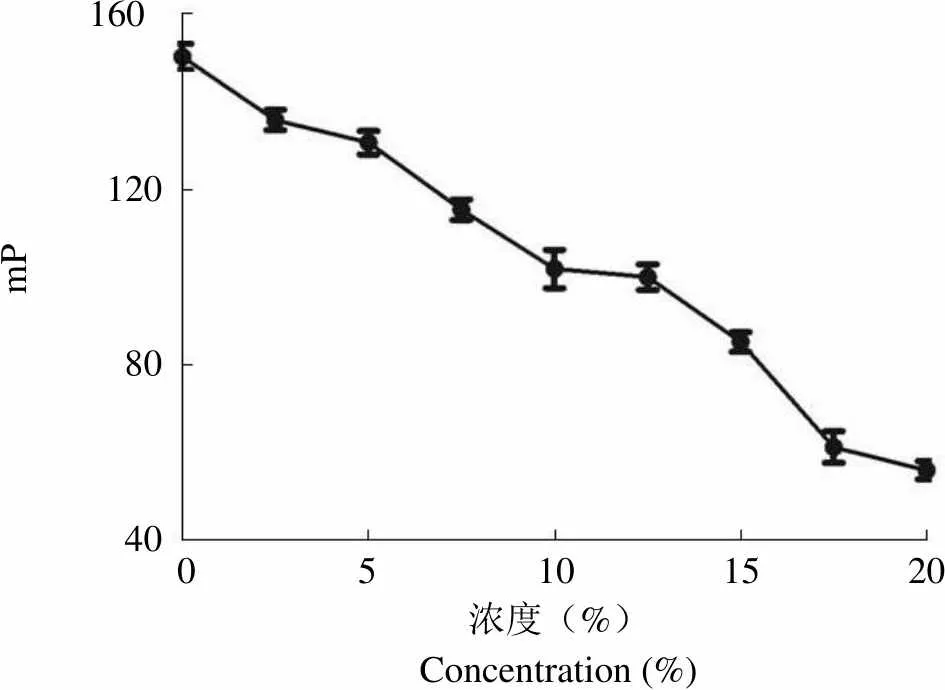
DMSO 浓度在 0% ~ 5% 时,mP 值趋于稳定并维持在 150 ~ 130 之间,其对 PLK1 PBD/FITC-Poloboxtide 结合未产生显著的影响(图 4)。故此,选用 0.5% DMSO 浓度进行后续的 FP 高通量筛选是切实可行的。
mP160 120 80 40 0 5 10 15 20 浓度(%)Concentration (%)
Figure 4 Effect of DMSO concentrations on PLK1 PBD/FITC-Poloboxtide binding
2.5 特异性评价
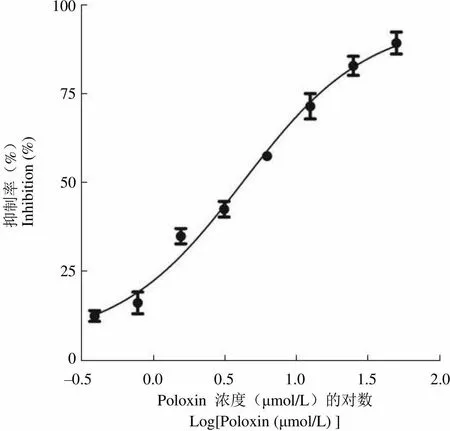
以上述优化 FITC-Poloboxtide 和 PLK1 PBD 浓度的 FP 筛选模型进行 poloxin 的抑制实验,poloxin 的 IC50≈(4.27 ± 0.69)μmol/L(图 5),其与文献报道的 IC50值(4.8 ± 1.3)μmol/L 基本一致[9]。这表明所建立的荧光偏振筛选模型具有较好的特异性。
抑制率(%)Inhibition (%)100 75 50 25 0 –0.5 0.0 0.5 1.0 1.5 2.0 Poloxin 浓度(μmol/L)的对数Log[Poloxin(μmol/L) ]
Figure 5 Poloxin inhibitory activity in FP assay
2.6 Z' 因子及其他参数的测定
通过综合分析及计算,本筛选模型 Z'因子值约为 0.74,满足高通量筛选中 Z'因子> 0.5 的基本要求(图 6)。
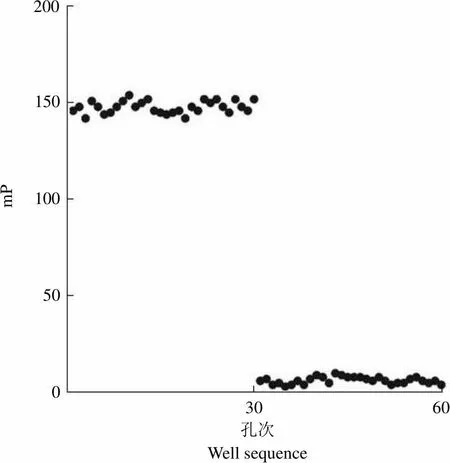
mP200 150 100 50 0 30 60 孔次Well sequence
Figure 6 Determination of Z' factor in FP assay
除 Z'因子外,信号本底比(S/B)、信号窗(SW)、信噪比(S/N)、信号/本底变异系数(CV)四个指标也完全满足高通量筛选的基本要求(表 1)。

表 1 荧光偏振高通量筛选模型的综合评价
3 讨论
自 1926 年法国物理学家 Perrin 首次提出荧光偏振理论以来,荧光偏振技术在研究蛋白质-蛋白质相互作用、蛋白质-核酸相互作用、抗原-抗体相互作用、激素-受体相互作用、免疫分析、蛋白激酶活性及酶动力学及血药浓度监测等基础科学研究领域和药物筛选研究领域得到了极大的应用与发展。
荧光偏振技术主要基于荧光分子的偏振性与其受激发时荧光分子的旋转速度密切相关的原理[6]。当荧光分子受平面偏振光激发时,如果荧光分子在受激发时保持静止状态,那么发射光将位于同样的偏振平面;如果荧光分子在受激发时保持旋转状态,那么发射光将位于与激发光不同的偏振面。如果用垂直的偏振光激发荧光素,可以在垂直的和水平的偏振平面检测发射光光强(发射光从垂直平面偏向水平平面的程度与荧光素标记的分子的迁移率有关)。如果分子量较大,受激发时荧光分子的旋转速度较慢,则发射光偏振程度较高;如果分子量较小,受激发时荧光分子的旋转速度较快,则发射光相对于激发光平面将去偏振化。
相对于研究蛋白质-蛋白质相互作用与蛋白质-核酸相互作用的传统方法,荧光偏振技术具有诸多优势,不但避免了放射性同位素的使用和有害的放射性废物的产生,而且使检测方法更灵敏、操作流程更快速、筛选成本更低廉。此外,由于荧光偏振技术在溶液中进行,可以最大程度地模拟真实的生命环境;荧光偏振技术也是均相检测形式(中间不含分离/洗涤步骤)的最佳解决方案,其允许实时跟踪监测分子间结合/分离的动力学变化,所需样品量少,重复性好,且对样品无破环性,可以实现大样本的简便、快速的高通量筛选与分析[7,14]。
笔者在拟建立荧光偏振高通量筛选模型进行靶向 PLK1 PBD 小分子抑制剂筛选工作之前,曾试图建立基于荧光免疫吸附法原理的筛选模型进行高通量筛选,但是经过反复尝试均以失败告终。探究其根本原因,可能是由于以固相化方式包被 PLK1 PBD 蛋白后导致其空间结构发生较大改变,使得 PLK1 PBD 与 FITC-Poloboxtide 的空间结构依赖性和磷酸化依赖性的结合极大地减弱,致使难以检测到稳定荧光信号的产生。所以,在后续的实验设计中,我们建立具有均相检测和液相反应形式的荧光偏振高通量筛选模型来进行靶向 PLK1 PBD 小分子抑制剂的高效、快速筛选。
Z'因子是公认的药物筛选模型评价中的核心参数,一般认为 Z'因子大于 0.5 才可用于高通量筛选[10]。根据上述一系列反应条件优化,我们所建立的荧光偏振高通量筛选模型的 Z'因子为 0.74,表明该筛选模型具有较好的灵敏性和稳定性。在此条件下,poloxin 在本模型中的 IC50约为(4.27 ±0.69)μmol/L,与文献报道基本一致,也进一步证实了本筛选模型的灵敏性和特异性。故此,本研究所建立的荧光偏振高通量筛选模型符合高通量筛选的基本要求,具有较好的灵敏性、稳定性和特异性,对于靶向 PLK1 PBD 小分子抑制剂的规模化筛选具有重要意义。
[1] Archambault V, Glover DM. Polo-like kinases: conservation and divergence in their functions and regulation. Nat Rev Mol Cell Biol, 2009, 10(4):265-275.
[2] Lens SM, Voest EE, Medema RH. Shared and separate functions of polo-like kinases and aurora kinases in cancer. Nat Rev Cancer, 2010, 10(12):825-841.
[3] Strebhardt K. Multifaceted polo-like kinases: drug targets and antitargets for cancer therapy. Nat Rev Drug Discov, 2010, 9(8):643- 660.
[4] Syed N, Smith P, Sullivan A, et al. Transcriptional silencing of Polo-like kinase 2 (SNK/PLK2) is a frequent event in B-cell malignancies. Blood, 2006, 107(1):250-256.
[5] Yang Y, Bai J, Shen R, et al. Polo-like kinase 3 functions as a tumor suppressor and is a negative regulator of hypoxia-inducible factor-1 alpha under hypoxic conditions. Cancer Res, 2008, 68(11):4077-4085.
[6] Lee KS, Idle JR. Pinning down the polo-box domain. Chem Biol, 2008, 15(5):415-416.
[7] Lea WA, Simeonov A. Fluorescence Polarization assays in small molecule screening. Expert Opin Drug Discov, 2011, 6(1):17-32.
[8] Elia AE, Rellos P, Haire LF, et al. The molecular basis for phosphodependent substrate targeting and regulation of Plks by the polo-box domain. Cell, 2003, 115(1):83-95.
[9] Reindl W, Yuan J, Krämer A, et al. Inhibition of polo-like kinase 1 by blocking polo-box domain-dependent protein-protein interactions. Chem Biol, 2008, 15(5):459-466.
[10] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[11] Gong S, Han X, Li X, et al. Development of a high-throughput screening strategy for upregulators of the OPG/RANKL ratio with the potential for antiosteoporosis effects. J Biomol Screen, 2016, 21(7): 738-748.
[12] Dong YS, Zhang H. The concept of enzyme inhibitors and general screening methods//Si SY, Zhang YQ. Drug screening: methods and practice. Beijing: Chemical Industry Press, 2007:58-59. (in Chinese)
董悦生, 张华. 酶抑制剂概念与一般筛选方法//司书毅, 张月琴. 药物筛选——方法与实践. 北京: 化学工业出版社, 2007:58-59.
[13] Reindl W, Strebhardt K, Berg T. A fluorescence polarization assay for the discovery of inhibitors of the polo-box domain of polo-like kinase 1. Methods Mol Biol, 2012, 795:69-81.
[14] Owicki JC. Fluorescence polarization and anisotropy in high throughput screening: perspectives and primer. J Biomol Screen, 2000, 5(5):297-306.
Development of a novel fluorescence polarization-based high-throughput screening method for PLK1 PBD inhibitors
CHEN Yun-yu, MIAO Dong-dong, ZHANG Ye-ming, LIU Xiao-ping, ZHANG Jing
School of Pharmacy, Wannan Medical College, Wuhu 241002, China (CHEN Yun-yu, MIAO Dong-dong, ZHANG Ye-ming, LIU Xiao-ping); Laboratoty of Chemical Biology, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, China (CHEN Yun-yu); National Laboratory for Screening New (Microbial) Drugs, Institute of Medicinal Biotechnology, Academy of Chinese Medical Sciences & Peking Union Medical College, Beijing 100050, China (CHEN Yun-yu, ZHANG Jing)
To develop a novel fluorescence polarization (FP)-based high throughput screening (HTS) method for PLK1 PBD inhibitors.Rosetta BL21(DE3) competent cells were transformed with pET-28a-PLK1 PBD plasmid. PLK1 PBD proteins were expressed after induction and purified. The HTS assay was based on the fluorescence polarization principle, and FITC-Poloboxtide served as the molecular probe for binding to PLK1 PBD. The FP-based HTS assay was established and optimized using an optimal concentration of FITC-Poloboxtide and PLK1 PBD. Besides, the inhibitory activity of poloxin was measured by this FP assay.PLK1 PBD was successfully expressed and purified. The FP-based HTS assay was performed using 30 nmol/L FITC-Poloboxtide and 200 nmol/L PLK1 PBD, with the Z' factor of 0.74. Furthermore, the IC50value of poloxin was (4.27 ±0.69) μmol/L in this FP assay.A reliable FP-based HTS assay is successfully developed for screening PLK1 PBD inhibitors.
Fluorescence polarization immunoassay; High-throughput screening assays; PLK1 PBD inhibitors
LIU Xiao-ping, Email: liuxiaoping@wnmc.edu.cn; ZHANG Jing, Email: jingjing-506@hotmail.com
10.3969/j.issn.1673-713X.2017.05.001
国家自然科学基金面上项目(81370087);吉林省科技发展计划(20160520045JH);皖南医学院博士科研启动基金(rcqd201617)
刘晓平,Email:liuxiaoping@wnmc.edu.cn;张晶,Email:jingjing-506@hotmail.com
2017-08-31
