肺炎链球菌蛋白PspC的制备与鉴定
2017-11-07谭亚军王丽婵卫辰张华捷侯启明张庶民马霄
谭亚军,王丽婵,卫辰,张华捷,侯启明,张庶民,马霄
肺炎链球菌蛋白PspC的制备与鉴定
谭亚军,王丽婵,卫辰,张华捷,侯启明,张庶民,马霄
100050 北京,中国食品药品检定研究院百白破疫苗与毒素室/卫生部生物技术产品检定方法及其标准化重点实验室
对肺炎链球菌表面蛋白 C(PspC)进行全基因合成、重组表达、纯化制备和鉴定。根据 GenBank 中 PspC 的基因序列和氨基酸序列,通过密码子优化和全基因合成的方式获得目的蛋白基因,构建无标签、高效重组表达菌株,建立重组蛋白的纯化制备方法,并进行抗原鉴定及免疫原性检测分析。人工合成的 PspC 基因序列经鉴定与预期一致,目的蛋白在大肠杆菌中获得了高效表达,表达量在 30% 以上,经两步纯化后纯度达到 95%。重组蛋白能与肺炎链球菌阳性血清产生特异性抗原抗体反应,免疫小鼠后可诱导产生较高水平的蛋白特异性抗体。获得了重组肺炎链球菌蛋白 PspC,其具有与天然抗原相似的抗原性和免疫原性,为今后开展疫苗研制、载体蛋白应用等研究奠定基础。
肺炎链球菌; 重组蛋白质类; 肺炎链球菌表面蛋白 C
肺炎链球菌表面蛋白 C(pneumococcal surface protein C,PspC),也称为胆碱结合蛋白 A(choline binding protein A,CbpA),是一个多型蛋白,分子量在 69 ~ 120 kD 之间,具有与肺炎链球菌表面蛋白 A(pneumococcal surface protein A,PspA)高度同源的胆碱结合结构域。主要由信号肽(37 个氨基酸),α 螺旋区,脯氨酸富集区,胆碱结合区和C 端尾巴五个区域组成,其 N 端的 α 螺旋区在不同的肺炎链球菌株中大小和序列都高度可变。根据结构不同,PspC 可分为 Clade A 和 Clade B 两种类型,其中 Clade A 序列较长,α 螺旋区与 PspA 一样包含 region1 和 region 2 两个区域,Clade B 则只包含 region 1 区域,分离菌株中 Clade B 所占比例可高达 96%[1],两者与 PspA 都具有交叉反应。PspC 既是黏附素,又是侵袭蛋白,还可以与补体 C3、人血清因子 H 结合,帮助细菌免于补体旁路途径的攻击。由此可见,PspC 是一个多功能蛋白,在肺炎链球菌黏附、入侵和逃避机体补体系统进攻过程中起主要作用[2]。N 端 α 螺旋区域虽然可变度大,但形成的空间构象种类有限,并具有免疫保护作用,试验结果显示 PspC 的 N 端区能够大大提高腹腔或者静脉攻击动物的存活率[3-11]。因此 PspC 可作为肺炎链球菌蛋白疫苗的候选抗原。
本课题根据 GenBank 中 PspC 蛋白的基因序列和氨基酸序列,通过密码子优化和全基因合成的方式获得目的基因,构建无标签、高效重组表达菌株,并对重组蛋白 PspC 进行了纯化方法的建立、抗原鉴定及免疫原性检测。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备 PTC-100 PCR 仪为美国 MJ Research 公司产品;HZQ-QX 恒温气浴振荡器为哈尔滨东联电子技术开发有限公司产品;Soniprep150 超声波细胞破碎仪为日本 Sanyo 公司产品;ÄKTA Purifier 100 纯化仪、ImageMaster VDS 凝胶成像系统为美国 GE Healthcare 公司产品;Tetra MP4 垂直电泳仪、Trans-Blot SD 半干式电转仪为美国 Bio-Rad 公司产品;Spectramax PLUS 酶标仪为美国 Molecular Devices 公司产品。
1.1.2 菌株和质粒 大肠杆菌 DH5α 和 BL21(DE3) 由中国食品药品检定研究院百白破疫苗与毒素室保存,表达质粒 pET-30a 为德国默克 Novagen 公司产品。
1.1.3 实验动物 Balb/c 小鼠由中国食品药品检定研究院实验动物资源研究所提供,小鼠性别为雌性,6 ~ 8周龄,SPF 级,采用独立通气笼具系统饲养。
1.1.4 主要试剂与耗材 Ex Taq DNA 聚合酶、dNTP、IPTG、DNA 分子量标准为日本 Takara 公司产品;T4 DNA 连接酶、限制性内切酶、DNA 纯化回收试剂盒、质粒提取试剂盒为美国 Promega 公司产品;蛋白纯化用层析柱为美国 GE Healthcare 公司产品;蛋白分子量标准为美国 Thermo Scientific 公司产品;PVDF 膜为美国 Millipore 公司产品;OPD、DAB 显色试剂为美国 Sigma 公司产品;HRP 标记的羊抗人 IgG 为美国 Santa Cruz 公司产品;琼脂糖、丙烯酰胺、甲叉双丙烯酰胺、Tris、SDS、甘氨酸、过硫酸胺、四甲基乙二胺(TEMED)、二硫苏糖醇(DTT)、硫酸卡那霉素、4-(2-氨乙基)苯磺酰氟盐酸盐(AEBSF)为美国Amresco公司产品;胰蛋白胨、酵母粉为英国 Oxoid 公司产品;甘油、氯化钠、Na2HPO4、NaH2PO4、氯化钾等为国产分析纯试剂。
1.2 方法
1.2.1 PspC 基因序列优化和全合成 使用codon usage analyzer 对PspC 蛋白的 DNA 序列进行密码子使用频数分析。依据大肠杆菌的偏爱密码子,同时考虑 mRNA 翻译起始区(translation initiation region,TIR)的二级结构,调整 G+C% 含量和分布,利用 Gene Designer 软件进行密码子优化,以提高蛋白表达量;并使用 RNAstructure5.2 软件分析 TIR 二级结构和自由能,Codonw 在线分析密码子适应指数(codon adaption index,CAI);同时在 5'端引入I 酶切位点(CATATG),3'端I 酶切位点前加入双终止密码子(TAATAA),以保证基因序列的无标签表达。根据优化的核苷酸序列,采用重叠延伸 PCR 技术进行全基因合成。PspC 的表达基因序列长度为 1365 bp。
1.2.2 重组表达质粒的构建和鉴定 合成的PspC 基因序列与表达质粒 pET30a 经I、I 酶切、连接、构建重组表达质粒,并转化到大肠杆菌表达菌株 BL21(DE3) 中。挑取转化后的单一菌落接种到含50 μg/ml 卡那霉素的 LB 液体培养基中,37 ℃振荡培养过夜后提取质粒,分别进行 PCR 扩增、双酶切鉴定及测序以筛选出阳性克隆。
1.2.3 重组蛋白PspC 的诱导表达 取阳性克隆37 ℃振荡培养复苏;按 1:50 转接于新鲜培养基中,37 ℃,200 r/min 振荡培养至550 nm值达 0.6 ~ 0.8;加入 IPTG 至终浓度 1 mmol/L,37 ℃诱导表达 4 h,以含空载体 pET-30a 的菌株作为阴性对照;离心收集菌体后用 pH 8.9 的 20 mmol/L Tris-HCl 缓冲液重悬,冰浴中超声破碎菌体,分别对未超声菌体、超声沉淀和上清取样进行 SDS-PAGE 电泳分析,以分析目的蛋白的表达水平和鉴定蛋白的表达形式。
1.2.4 重组蛋白 PspC 的纯化 对重组蛋白进行放大诱导表达和纯化制备。收集的菌体用缓冲液 A1(50 mmol/L Na2HPO4-NaH2PO4,pH 7.5)悬浮,冰浴超声破碎;4 ℃,12 000 r/min离心 30 min,取上清加入硫酸铵至 1 mol/L,进行 Butyl HP 疏水层析,以含 1 ~ 0 mol/L 硫酸铵的缓冲液 A1 梯度洗脱;收集目的洗脱液进行 DEAE FF 离子交换层析,以含 0 ~ 1 mol/L NaCl 的缓冲液 A2(20 mmol/L Tris,pH 9.5)梯度洗脱。分别取少量收集液进行 SDS-PAGE 检测和纯度分析。
1.2.5 重组蛋白 PspC 的鉴定及免疫原性检测
1.2.5.1 ELISA 检测 以 3 μg/ml 的纯化蛋白每孔 100 μl 包被酶标板,设复孔,4 ℃放置过夜;检测前洗板6 次,然后以每孔200 μl 加入封闭液,37 ℃封闭 1 h;洗板 3 次后,取稀释好的肺炎链球菌感染患者血清(1:40 稀释)按每孔 100 μl 加入酶标板中,37 ℃孵育 1 h;洗板 6 次,每孔加入100 μl 辣根过氧化物酶标记的羊抗人 IgG(1:3000 稀释),37 ℃孵育 1 h;洗板 6 次,每孔加 OPD 底物100 μl,37 ℃静置 20 min,然后以每孔加入50 μl 2 mol/L H2SO4溶液终止反应;酶标仪在波长 490 nm 读取检测数据。同时设置 PBS(mmol/L、mmol/L、mmol/LNaHPO、2 mmol/LKHPO作为阴性对照。
1.2.5.2 Western blot 鉴定 重组蛋白进行 SDS-PAGE 电泳,转印至硝酸纤维素膜上,按照常规方法进行 Western blot 鉴定,检测用阳性血清及二抗同1.2.5.1 项,加底物反应液 DAB 显色,显色终止后拍摄照片。
1.2.5.3 免疫原性检测 采用雌性 Balb/c 小鼠(6 ~ 8 周龄),腹部皮下接种稀释的重组蛋白 5 μg,免疫小鼠 6 只,分别于第 0,14,28 天免疫 3 次,第 35 天采血,分离血清,同时设立阴性对照组。采用间接 ELISA 法检测 3 针免疫后血清中PspC 蛋白的特异性抗体滴度。将纯化后蛋白 3 μg/ml 包被酶标板,待检血清稀释至合适倍数(起始稀释倍数为 1:100),以每孔 200 μl 加入酶标板 A 排,以 100 μl 体系对样品进行系列倍比稀释,检测用二抗为辣根过氧化物酶标记的羊抗鼠 IgG(1:3000 稀释),同时以对照血清作为阴性对照。阳性判定的 Cut-off 值为 2.1 × 阴性对照值。
1.2.5.4 与 PspA 蛋白的交叉反应分析 将重组蛋白 PspC 和课题组之前已完成的来自肺炎链球菌株 DBL6A、RX1 和 EF3296 的三种蛋白PspA1、PspA2、PspA3 以 3 μg/ml 分别包被酶标板,检测抗体为1.2.5.3 中的 PspC 免疫小鼠血清,其余操作步骤同1.2.5.1 项。
2 结果
2.1 PspC 基因序列优化和全合成
本研究选择具有代表性 N 端区域的 PspC 蛋白,根据氨基酸序列信息进行优化设计所需的模板 DNA,通过避开常用酶切位点,调整 GC 含量,使优化后的基因序列密码子出现频率都在 20% 以上,CAI 为 0.74,TIR 自由能为–5.4 kcal/mol。新设计基因 mRNA 的 TIR 稳定性有所降低,结构较松散,有利于翻译效率的提高。采用重叠延伸 PCR 技术获得PspC 的全基因合成产物。
2.2 重组表达质粒的构建和鉴定
PspC 基因片段长度是 1365 bp,其 DNA 产物和 pET-30a 连接构建表达质粒。以表达质粒为模板,采用通用引物进行 PCR 扩增,经 1% 琼脂糖凝胶电泳鉴定,扩增片段长度与预期大小一致;对表达质粒用I 和I 双酶切鉴定,结果显示插入片段大小与预期一致,结果见图 1。筛选出的阳性克隆经序列测定后进一步确证了连接的正确性。
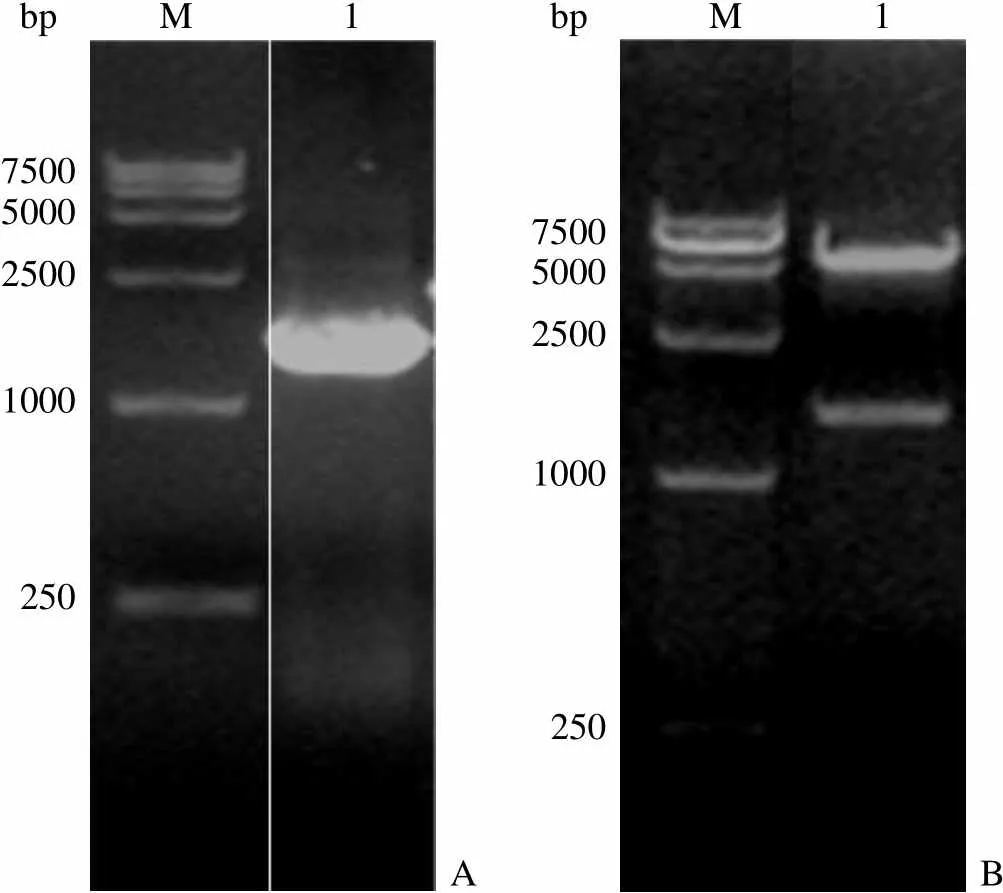
bp M 1 bp M 1 750050002500 1000 250A 750050002500 1000 250B
Figure 1 Identification by PCR (A) and enzyme digestion (B) for expression plasmid of PspC protein
2.3 重组蛋白 PspC 的表达结果
经诱导表达条件的摸索,PspC 蛋白在大肠杆菌 BL21(DE3) 中得到了高效表达。电泳扫描分析显示 PspC 表达条带的分子量与实际大小(52 kD)有些偏移,与文献[12-13]报道一致。目的蛋白表达量占菌体总蛋白的 30% 以上。超声破菌后收集的上清和沉淀经 SDS-PAGE 分析可见 PspC 重组蛋白,主要存在于超声裂解上清,以可溶形式表达,结果见图 2A。
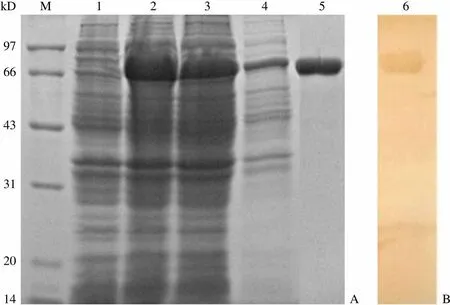
kD M 1 2 3 4 5 6 9766 43 31 20 14AB
Figure 2 Results of recombination expression and purification analysis (A) and immunoblot identification (B) of PspC protein
2.4 重组蛋白 PspC 的纯化结果
PspC 蛋白以无标签形式表达,纯化难度较大,经过对不同纯化方法及不同纯化条件的一系列摸索,确定了合适的纯化方案。PspC 蛋白经疏水层析、离子交换层析纯化,获得的目的蛋白纯度可达 95%,结果见图 2A。
2.5 重组蛋白 PspC 的鉴定及免疫原性检测
2.5.1 重组蛋白 PspC 的 ELISA 和 Western blot 鉴定结果 采用肺炎链球菌感染患者血清对重组蛋白 PspC 进行 ELISA 检测,样品490 nm为 2.003、2.07,阴性对照490 nm为 0.238,结果为阳性;同时进行 Western blot 鉴定,结果显示显色条带位置与预期一致(图 2B)。上述表明PspC 表达产物能与阳性血清发生特异性的抗原抗体结合反应,重组蛋白具有良好的抗原特异性。
2.5.2 重组蛋白 PspC 的免疫原性检测 PspC 重组蛋白免疫小鼠 3 针后,采用间接 ELISA 法检测动物体内的蛋白特异性 IgG 抗体滴度,结果显示PspC 蛋白可诱导小鼠产生较高水平的蛋白特异性抗体,滴度在1:1600,1:3200,1:6400,1:12 800的频数分别为1,1,3,1,计算几何平均滴度为 5080,表明重组蛋白具有良好的免疫原性。
2.5.3 与 PspA 蛋白的交叉反应分析 重组蛋白 PspC 和 PspA1、PspA2 、PspA3 蛋白作为包被抗原分别检测 PspC 免疫小鼠血清,结果显示 PspC 与来源于不同分支肺炎链球菌的 PspA 蛋白存在不同的交叉反应性,见表 1。

表 1 重组蛋白 PspC 与 PspA 蛋白的交叉反应检测结果
3 讨论
本研究所表达的目的蛋白 PspC 是一多型蛋白,选择具有代表性 N 端区域的PspC 蛋白,根据氨基酸序列信息进行基因序列优化和全合成,获得了高效表达。这种方法不仅可以免去对肺炎链球菌的培养过程,而且目的基因的获得不受现有菌株的限制,并可以通过基因密码子的优化,提高目的蛋白的表达水平。
为了避免融合标签对目标蛋白的潜在不利影响,防止应用时对人体存在的潜在威胁,本研究在实验设计时将终止密码子添加在融合标签之前,使表达出的蛋白不带任何标签。经疏水层析、离子交换层析等多种纯化方法联合应用和条件优化,建立了 PspC 蛋白的纯化方法,获得的无标签重组蛋白纯度可达 95%。ELISA 和 Western blot 鉴定结果显示,重组PspC 蛋白能够与肺炎链球菌感染患者血清发生特异性结合,说明该蛋白具有良好的抗原特异性。免疫小鼠三针后,可诱导产生较高水平的蛋白特异性抗体,说明其也具有良好的免疫原性,为将来肺炎链球菌重组蛋白在疫苗研制、载体蛋白应用等研究方面奠定了基础。
不同类型的 PspC 与 PspA 因胆碱结合结构域的同源性而具有一定的交叉反应性,本研究通过交叉反应分析得出制备的 PspC 蛋白与不同分支来源的肺炎链球菌的 PspA 蛋白存在不同的交叉反应性,其中与源自 DBL6A、RX1 菌株的 PspA 有较强的交叉反应,而与源自 EF3296 菌株的 PspA 没有交叉反应。说明单独应用一种 PspC 或 PspA 蛋白可能不能针对不同类型菌株产生足够的抗体保护性,将其作为疫苗的候选蛋白,可能需要几种不同类型的蛋白组合才能预防更广范围的肺炎链球菌感染[14-15]。
[1] Brooks-Walter A, Briles DE, Hollingshead SK. The pspC gene of Streptococcus pneumoniae encodes a polymorphic protein, PspC, which elicits cross-reactive antibodies to PspA and provides immunity to pneumococcal bacteremia. Infect Immun, 1999, 67(12):6533-6542.
[2] Dave S,Brooks-Walter A,Pangburn MK, et al. PspC,a pneumococcal surface protein,binds human factor H. Infect Immun, 2001, 69(5): 3435-3437.
[3] Balachandran P, Brooks-Walter A, Virolainen-Julkunen A, et al. Role of pneumococcal surface protein C in nasopharyngeal carriage and pneumonia and its ability to elicit protection against carriage of Streptococcus pneumonia. Infect Immun, 2002, 70(5):2526-2534.
[4] Cao J, Gong Y, Li D, et al. CD4(+) T lymphocytes mediated protection against invasive pneumococcal infection induced by mucosal immunization with ClpP and CbpA. Vaccine, 2009, 27(21): 2838-2844.
[5] Basset A, Thompson CM, Hollingshead SK, et al. Antibody-independent, CD4+ T-cell-dependent protection against pneumococcal colonization elicited by intranasal immunization with purified pneumococcal proteins. Infect Immun, 2007, 75(11):5460- 5464.
[6] Xin W, Wanda SY, Li Y, et al. Analysis of type II secretion of recombinant pneumococcal PspA and PspC in a salmonella enterica serovar typhimurium vaccine with regulated delayed antigen synthesis. Infect Immun, 2008, 76(7):3241-3254.
[7] Daniels CC, Coan P, King J, et al. The proline-rich region of pneumococcal surface proteins A and C contains surface-accessible epitopes common to all pneumococci and elicits antibody-mediated protection against sepsis. Infect Immun, 2010, 78(5):2163-2172.
[8] Ferreira DM, Darrieux M, Silva DA, et al. Characterization of protective mucosal and systemic immune responses elicited by pneumococcal surface protein PspA and PspC nasal vaccines against a respiratory pneumococcal challenge in mice. Clin Vaccine Immunol, 2009, 16(5):636-645.
[9] Linder A, Hollingshead S, Janulczyk R, et al. Human antibody response towards the pneumococcal surface proteins PspA and PspC during invasive pneumococcal infection. Vaccine, 2007, 25(2):341- 345.
[10] Bernatoniene J, Zhang Q, Dogan S, et al. Induction of CC and CXC chemokines in human antigen-presenting dendritic cells by the pneumococcal proteins pneumolysin and CbpA, and the role played by toll-like receptor 4, NF-kappaB, and mitogen-activated protein kinases. J Infect Dis, 2008, 198(12):1823-1833.
[11] Ricci S, Janulczyk R, Gerlini A, et al. The factor H-binding fragment of PspC as a vaccine antigen for the induction of protective humoral immunity against experimental pneumococcal sepsis. Vaccine, 2011, 29(46):8241-8249.
[12] Rosenow C, Ryan P, Weiser JN, et al. Contribution of novel choline-binding proteins to adherence, colonization and immunogenicity of Streptococcus pneumoniae. Mol Microbiol, 1997, 25(5):819-829.
[13] Ogunniyi AD, Woodrow MC, Poolman JT, et al. Protection against Streptococcus pneumoniae elicited by immunization with pneumolysin and CbpA. Infect Immun, 2001, 69(10):5997-6003.
[14] Iannelli F, Oggioni MR, Pozzi G. Allelic variation in the highly polymorphic locus pspC of Streptococcus pneumonia. Gene, 2002, 284(1-2):63-71.
[15] Miyaji EN, Ferreira DM, Lopes AP, et al. Analysis of serum cross-reactivity and cross-protection elicited by immunization with DNA vaccines against Streptococcus pneumoniae expressing PspA fragments from different clades. Infect Immun, 2002, 70(9):5086- 5090.
Preparation and identification of recombinant Streptococcus pneumoniae protein PspC
TAN Ya-jun, WANG Li-chan, WEI Chen, ZHANG Hua-jie, HOU Qi-ming, ZHANG Shu-min, MA Xiao
National Institutes for Food and Drug Control, Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, Beijing 100050, China
To perform the gene synthesis, recombinant expression, preparation and identification of the Streptococcus pneumoniae protein PspC.The gene of PspC was obtained by chemical synthesis after codons optimization according to the gene sequence and amino acid sequence in the GenBank. The label-free and efficient recombinant expression strain was constructed by molecular biological methods. The purification method of recombinant protein was established. And the protein’s antigen identification and immunogenicity was tested.The synthetic gene sequence of PspC was consistent with the database. The recombinant protein was highly expressed inExpression of the target protein accounted for more than 30% of the total bacterial proteins. After purification by two-step chromatography, the protein purity reached 95%. The protein could react with human serum of clinically diagnosed pneumonia, indicating the protein had good antigenicity. Also high level of specific antibody could be induced after immunization with the protein in mice.The recombinant Streptococcus pneumoniae protein PspC is successfully prepared without label, which had similar antigenicity and immunogenicity as that of natural protein. This research provides foundation for future research on vaccine development and carrier protein application.
Streptococcus pneumoniae; Recombinant proteins; Pneumococcal surface protein C
MA Xiao, Email: maxiao421@sina.cn
10.3969/j.issn.1673-713X.2017.05.003
国家高技术研究发展计划(863 计划)(2012AA02A402)
马霄,Email:maxiao421@sina.cn
2017-06-09
