基于新型量子点荧光微球的氯霉素免疫层析试纸条的制备和应用
2017-11-06丁乔棋范文韬吕亚楠胡建华闫丽萍宋素泉
丁乔棋 李 丽 范文韬 吕亚楠 胡建华 闫丽萍 宋素泉
(南京农业大学动物医学院,南京210095)
基于新型量子点荧光微球的氯霉素免疫层析试纸条的制备和应用
丁乔棋 李 丽 范文韬 吕亚楠 胡建华 闫丽萍*宋素泉*
(南京农业大学动物医学院,南京210095)
以羧基化CdTe/ZnSe量子点荧光微球为标记物,通过1-乙基-(3-二甲基氨基丙基)碳二亚胺/N-羟基琥珀酰亚胺(EDC/NHS)活化法将氯霉素(CAP)单克隆抗体与量子点荧光微球偶联制备荧光探针。氯霉素全抗原(CAP-HS-BSA)及羊抗鼠二抗分别喷涂硝酸纤维素膜,形成检测线(T线)和质控线(C线),组装成新型氯霉素量子点荧光微球免疫层析试纸条,建立了快速、定量检测牛奶中CAP的方法。本研究开发的量子点荧光微球试纸条可在15 min内完成牛奶样品中CAP的定量检测,线性范围为0.1~100.0 μg/L,检出限为0.1 μg/L。牛奶样品CAP的加标回收率为93.3%~97.9%,相对标准偏差在4.9%~6.9%之间。
氯霉素; 量子点微球; 免疫层析试纸条
2017-05-09投稿:2017-09-04接受
本文系国家重点研发计划(Nos. 2016YFD0501200, 2016YFD0501009)、中央高校基本业务费(No.Y0201500195)、江苏省自然基金面上项目 (No.BK20161452)、广东省科技计划重点项目(No. 2017B020202010)和江苏高校优势学科建设工程资助项目资助
* E-mail: yanliping@njau.edu.cn; suquan.song@njau.edu.cn
1 引 言
氯霉素(Chloramphenicol, CAP)是一种价格低廉、高效广谱的抗生素,曾经广泛应用于畜牧业生产中。然而,由于其分子结构中带有毒性硝基基团且半衰期较长,极易残留在畜禽体内产生毒副作用,残留的CAP还可以通过食物链危害消费者健康[1,2]。目前,许多国家都禁止在畜牧生产中使用CAP,如欧盟规定氯霉素在肉、海鲜、鸡蛋、牛奶、蜂蜜等食用动物内的最小执行限量(MRPL)为0.3 μg/kg[3]。我国农业部235号公告中明确规定禁止使用CAP[4]。然而,CAP的滥用问题仍非常严重,CAP残留超标时有发生,因此加强动物性食品中CAP的监测非常重要。
目前,检测CAP的常用方法包括微生物测试法、ELISA法及液相色谱分析法等[5]。微生物法操作简便但灵敏度不高[6];ELISA灵敏度较好,但常存在假阳性,且耗时较长[7];色谱分析法具有良好的灵敏度、准确性与重复性,但样品前处理过程繁琐、费用高且对需要专门的操作人员[8]。而免疫层析技术成本低、检测速度快、操作简单、对设备要求低且适合现场应用,已广泛用于食品安全的现场筛查[9]。目前常用的免疫层析技术的标记物为胶体金[10],通常通过肉眼观察进行定性分析,检测结果受主观影响大,不适于进行定量分析。相比之下,采用荧光标记的免疫试纸条显示出更高的灵敏度,适于样品的定量分析。如Song等[11]采用镧系元素Eu(III)-BHHCT修饰的荧光纳米材料二氧化硅为探针,建立了猪尿中盐酸克伦特罗的免疫层析检测方法,检出限为3.7 μg/L,灵敏度高于胶体金免疫层析试纸条。
量子点(Quantum dots, QDs)是目前常用的一种荧光标记物,是由II~VI族或III~V族元素组成的新型荧光纳米材料。与传统有机染料相比,QDs具有一元激发多元发射、激发光谱宽、发射光谱窄、光稳定性好和抗漂白能力强等特点,因此采用量子点标记的免疫层析试纸条具有相对较高检测的灵敏度[12~14],而将大量QDs包裹于聚合物材料制备得到的量子点微球(Quantum dot submicrobeads, QBs) 则可表现出更高的荧光强度和更好的光学稳定性[15,16]。目前,以QBs为探针的氯霉素免疫层析试纸条尚未见报道。本研究采用CdTe/ZnSe QBs标记的抗CAP单克隆抗体为指示物,开发出一种特异性检测CAP的QBs荧光免疫层析试纸条,并应用于实际牛奶样品中CAP的检测,显示出良好的实用性。
2 实验部分
2.1仪器与试剂
HSC-24A氮吹仪(天津恒奥科技发展有限公司);LC-20AT高效液相色谱仪(日本岛津公司); Gel Doc XR凝胶成像系统(美国Bio-rad公司); 硝酸纤维素膜(NC膜)、玻璃纤维素膜、滤纸(美国Millipore公司); 表面羧基化修饰的CdTe/ZnSe量子点微球(QBs,上海艾信生物科技公司),平均粒径为174 nm,激发波长为365 nm时的最大发射波长为610 nm; 氯霉素标准品(北京百灵威科技公司); 胎牛血清蛋白(BSA)、羊抗鼠二抗、2-(N-吗啡啉)乙基磺酸(MES)、4-羟乙基哌嗪乙磺酸(HEPES)(北京索莱宝生物科技有限公司); 琥珀酸酐(HS, 上海源叶生物公司); 吡啶(南京化学试剂股份有限公司); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(碳二亚胺,EDC)、N-羟基硫代琥珀酰亚胺钠盐(Sulfo-NHS)(上海麦克林生化科技有限公司); CAP单克隆抗体由本实验室免疫合成,效价为1×105。氯霉素ELISA检测试剂盒(上海生工生物工程公司)。
2.2氯霉素全抗原的制备
采用EDC法制备氯霉素全抗原[17],具体过程如下:称取HS 930 mg置于平底烧瓶,加入8 mL丙酮,1.5 mL吡啶,60℃水浴加热搅拌至澄清,记为A液; 称取2 g CAP,溶于5 mL丙酮中,记为B液; 将B液逐滴加到A液中,60℃回流2 h后加丙酮并吹干。体系中加入30 mL乙酸乙酯和10 mL 0.1 mol/L HCl,振荡除去除酸层,用蒸馏水洗两次。随后向乙酸乙酯层中加入10% (w/w)NaHCO3,搅拌使其溶解,用浓HCl调至pH 3,得到黄色粘稠的半抗原氯霉素琥珀酸酯(CAP-HS)。CAP-HS经高效液相色谱法(HPLC)鉴定后,冻干保存。称取150 mg CAP-HS,溶于2.5 mLN,N-二甲基甲酰胺(DMF)中,依次加入适量MES缓冲溶液、EDC溶液和Sulfo-NHS溶液后,室温下搅拌反应3 h,随后加入20 mg/mL BSA,室温避光搅拌反应3 h,然后4℃下搅拌过夜。最后用0.05 mol/L硼酸缓冲液透析纯化,得到偶联物CAP-HS-BSA。HPLC分析条件为:流动相为甲醇-乙腈-乙酸铵溶液(pH 6.8, 0.05 mol/L)(0.2∶19.8∶80,V/V),流速为0.5 mL/min,分析温度30℃,SPD-20A紫外检测器,检测波长276 nm。
2.3量子点微球标记氯霉素单克隆抗体
采用EDC-NHS法[18]偶联QBs和CAP抗体:将10 mg QBs 加入到4 mL MES(0.1 mol/L,pH 5.5)缓冲液中入,混匀,20000 r/min离心15 min,弃上清液,加入1 mL MES缓冲液重悬。体系中分别加入10 mg/mL的EDC和sulfo-NHS溶液,37℃振荡反应1 h后,20000 r/min离心15 min,沉淀加入1 mL HEPES缓冲液(0.05 mol/L,pH 7.4)重悬。将CAP抗体加入到上述溶液中,37℃反应2 h,然后加入含有10% BSA的PBS溶液封闭2 h,得到量子点荧光微球标记的CAP单抗(简称QBs探针), 4℃储存,备用。
2.4QBs免疫标记快速检测试纸条的组装及结果判读
QBs荧光试纸条由样品垫、结合垫、NC膜、吸水纸及PVC底板5部分组成,如图1A所示。将适当浓度的氯霉素全抗原及羊抗鼠二抗喷涂在NC膜上,分别作为检测线(T线)和质控线(C线),结合垫上包被QBs探针。将NC膜、结合垫、样品垫及吸水纸依次粘贴在PVC底板上,相互重叠0.2 mm。组装好后切成 4 mm条状试纸条,置于锡箔袋中, 加入干燥剂密封保存,备用。使用时,将待测样品滴加到样品垫上,样品在虹吸作用下缓慢向吸水纸方向迁移。当样品中没有CAP时,QBs探针就会与包被在T线上的CAP全抗原结合而出现荧光条带,剩余的QBs探针继续向前移动,被C线上的二抗捕获,C线也发出荧光; 当样品液中含有CAP时,结合垫上QBs荧光探针会和CAP结合,因此在T线处与CAP全抗原结合的QBs探针的量就会减少,T线处荧光强度变弱或消失,即T线的荧光强度和CAP的量成反比。无论样品中是否含有CAP,C线都应出现荧光条带,否则试纸条结果判定为无效。反应后的试纸条可通过Gel Doc XR成像系统读取C线和T线上的荧光强度值(C值和T值),用于定量检测。试纸条结果示意图如图1B所示。

图1 QBs荧光试纸条检测氯霉素的原理图。(A)试纸条组装结构图; (B)试纸条结果示意图Fig.1 Schematic illustration of quantum dot submicrobeads (QBs)-based immunochromatographic test strip (ICST) for chloramphenicol (CAP) detection: (A) structure of QBs-based ICTS; (B) schematic diagram of CAP detection by QBs-based ICTS
2.5QBs荧光试纸条性能评价
在优化条件下,采用本试纸条对含有不同浓度CAP的牛奶样品进行检测,通过凝胶成像系统读取试纸条的T值和C值,每个浓度重复3次,并以CAP的浓度为横坐标,以B/B0(不同CAP浓度测得的T/C值与CAP=0时测得的T/C值的比值)为纵坐标,绘制拟合曲线。
考察结构类似物氟苯尼考、甲砜霉素、青霉素和莱克多巴胺(1000 μg/L)在试纸条上的显色情况,以PBS作为空白对照,分析试剂条的特异性。制备的荧光试纸条封闭在含有干燥剂的铝箔袋中,37℃下保存,2周后随机取出数根试纸条,测定梯度浓度的CAP标准溶液,分析试纸条的稳定性。
2.6实际牛奶样品分析
通过在阴性牛奶中的加标回收实验,评价QBs荧光试纸条的准确性以及精密度,加标浓度为0.1和10 μg/L。为了进一步评价开发的QBs荧光试纸条的实用性,研究分析了30份加标牛奶样品(10份牛奶加标浓度为0.1 μg/L,10份牛奶加标浓度为10 μg/L,其余10份为阴性对照),并将实验结果与商品化ELISA试剂盒的检测结果进行对比。
3 结果与分析
3.1半抗原CAP-HS和全抗原CAP-HS-BSA的鉴定
采用HPLC分析半抗原CAP-HS的合成效果。结果表明,CAP色谱峰保留时间为8.0 min(图2A),CAP-HS的保留时间为9.5 min(图2B)。BSA(500 μg/mL)、CAP-HS-BSA(500 μg/mL)及CAP-HS(50 μg/mL)在220~340 nm范围内的紫外光谱图如图2C所示,CAP-HS-BSA和BSA在280 nm左右均有一个吸收峰,但是相同蛋白浓度的CAP-HS-BSA在280 nm的吸光值是BSA吸光值的数倍,这是由于BSA与CAP-HS偶联后吸光值叠加的缘故,因此可以初步判定CAP-HS与BSA偶联成功。SDS-PAGE凝胶电泳分析(图2D)也显示,CAP-HS-BSA的电泳条带滞后于蛋白标准品BSA,说明全抗原CAP-HS-BSA合成成功。

图2 氯霉素半抗原CAP-HS及全抗原CAP-HS-BSA鉴定。(A) CAP标准品的高效液相色谱图; (B) CAP-HS高效液相色谱图; (C) CAP-HS-BSA,CAP-HS 以及 BSA的紫外光谱图; (D) CAP-HS-BSA与BSA的SDS-PAGE电泳图Fig.2 Identification of CAP-HS and CAP-HS-BSA. (A) HPLC analysis of CAP; (B) HPLC analysis of CAP-HS; (C) UV spectra of CAP-HS-BSA, CAP-HS and BSA; (D) SDS-PAGE electrophoretogram of CAP-HS-BSA and BSA. HS, succinic anhydride; BSA, bovine serum albumin; SDS-PAGE, sodium dodecyl sulfate polyacrylamide gel electrophoresis
3.2QBs荧光探针制备条件的优化
本研究通过将适量的QBs荧光探针溶液滴加在试纸条的结合垫上(试纸条的NC膜只包被有C线),根据C线的荧光情况选出制备QBs荧光探针的最佳条件。当pH 7.5时,C线上QBs探针-二抗偶联物的荧光强度最强,随着pH值升高,C线荧光强度下降(见图3A),原因可能是pH值过高导致蛋白变性,从而导致QBs与单抗偶联效率降低[19]。在其它条件相同的情况下,当加入EDC和Sulfo-NHS偶联剂的量不足时, QBs与CAP抗体偶联不完全,当偶联剂的加入量为150 μL时,QBs探针-二抗偶联物的荧光强度最强(图3B)。考察了QBs与抗体的质量比对试纸条的荧光效果的影响(图3C)。结果表明,当QBs与抗体(1 mg/mL)的质量比为7.5∶1.0时,获得的QBs探针与二抗作用荧光效果最好。由图3D可见,QBs与抗体偶联前后QBs的峰型保持对称,半峰宽不变,且均无拖尾现象,表明二者粒径分布均匀,分散性好,荧光性能良好。另外,QBs和CAP单抗结合后表现出更高的荧光强度,其荧光值由原来的264.128 a.u升高至284.546 a.u。

图3 QBs荧光探针制备条件的优化。(A)pH的影响; (B)偶联剂EDC-NHS剂量的影响; (C)抗体量的影响; (D)QBs偶联前后荧光光谱图。Fig.3 Optimization of synthesis conditions of QBs-probe. (A) Effect of pH; (B) Effect of dosage of coupling agent; (C) Effect of the dosage of CAP monoclonal antibodies (mAb); (D) Fluorescence spectra of CdTe/ZnSe QBs and CdTe/ZnSe QBs-mAb/CAP. EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide; NHS, N-Hydroxysuccinimide
3.3实验条件优化
3.3.1NC膜、QBs探针浓度以及测试时间的选择比较了两种NC(Satorius CN140 NC膜和TEST G-140 NC膜)组装的试纸条的检测效果(图4A, 4B)。结果表明,加入0.1~1.0 μg/L CAP标准品后15 min,随CAP浓度的增加,前者测得 T/C值呈明显的梯度下降趋势,且荧光强度更亮; 而由后者组装的试纸条则变化不明显。因此,本研究采用Satorius CN140 NC膜组装CAP荧光试纸条。
使用2倍稀释的QBs探针组装的试纸条(喷涂量2 μL/cm)检测含有CAP的样品时,获得的T/C值明显高于3倍稀释的QBs探针,因此本研究最终选择2倍稀释的QBs探针包被试纸条的结合垫(见图4C)。
免疫层析试纸条的显色是抗原抗体免疫学动态反应过程,为了优化反应时间,本研究考察了试纸条检测1 μg/L CAP浓度时T/C值随时间的变化,加入待测样品后,通过成像系统每隔5 min记录试纸条T线和C线荧光强度(图4D,插图为不同免疫反应时间下的S/N值)。结果表明,在30 min内,空白对照组和阳性组的T/C值变化不明显,在15 min时,S/N值(相同时间点下对照组和阳性组的T/C值的比值)达到最大,随着时间延长,S/N值逐渐降低, NC膜上的非特异性结合增强使背景颜色加深,故选择15 min为试纸条的最佳分析时间。
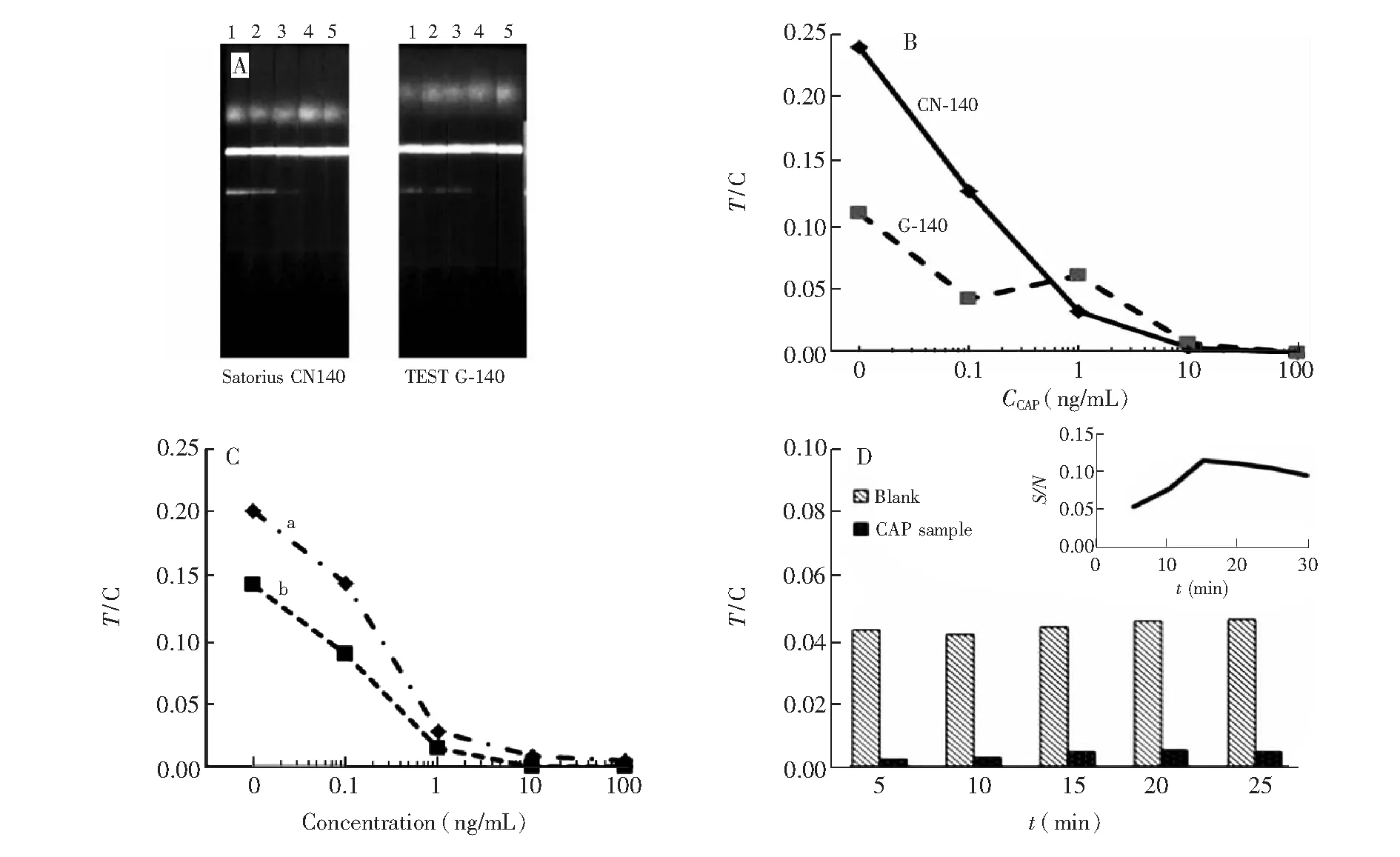
图4 QBs试纸条制备条件的优化。(A) 两种NC膜的显色效果; (B) 两种NC膜上CAP对应的T/C值; (C) QBs优化图,曲线a和b分别为QBs探针2倍和3倍稀释后测试氯霉素溶液所对应的T/C值; (D)试纸条的T/C值随反应时间的变化图,插图为不同反应时间下的S/N值,CAP浓度为 1 μg/L。Fig.4 Optimization of immunochromatographic strip test (ICST). (A) Chromogenic result of two kinds of nitrocellulose (NC) membranes. (B) Fluorescence intensity ratio of test line (T line) and C-line (C line) (T/C value) of ICST with two kinds of NC menmbranes . (C) Effect of concentration of QBs-probe on T/C value of ICST. (D) Effect of immunoreaction time on T/C value of ICST, Inset is the chang of signal to noise ration (S/N) value along with immunoreaction time. Concentraion of CAP is 1 μg/L
3.3.2T线抗原及C线二抗喷涂浓度的优化由表1可知,固定C线喷涂的二抗含量,试纸条T线的荧光强度随T线上抗原的浓度增加而加强,T/C值也随着抗原浓度的加大而增加; 当固定T线上抗原的量为0.6 mg/mL时,试纸条C线的荧光强度随着二抗浓度的加大而增强。第4、5和8、9组中,虽然T线和C线的荧光强度随着抗原或二抗的浓度增加而增加,但抑制率偏低; 第6组中,包被的二抗浓度为0.2 mg/mL时,检测到C线值偏低; 而第7组实验中,当T线抗原的喷涂量浓度为0.6 mg/mL、C线上二抗的喷涂浓度为0.4 mg/mL时,试纸条T线和C应的荧光强度值最佳,且T/C值也较高,CAP阳性实验中竞争抑制率为42%,因此选用该组浓度喷涂试纸条的T线和C线。
3.4QBs试纸条的检测性能
采用CAP阴性的牛奶样品配制CAP系列标准溶液检测QBs试纸条的灵敏度及检测范围。由图5
表1 T线抗原及C线二抗喷涂浓度的优化(n=3)
Table 1 Optimization of concentration of CAP-HS-BSA sprayed on T-line and secondary antibody on C-line (n=3)

组别Groups抗原喷涂浓度ConcentrationofCAP⁃HS⁃BSA(mg/mL)二抗喷涂浓度ConcentrationofGaMIgG(mg/mL)T线荧光强度FLintensityofT⁃lineC线荧光强度FLintensityofC⁃lineT/C值T/Cvalue竞争抑制率1⁃(B/B0)Inhibitionrate(1⁃B/B0)10.21437±1427540±330.0159±0.120.46±0.0220.41485±7429312±420.0165±0.060.44±0.0630.61497±3224997±100.0199±0.150.46±0.0340.81508±2826210±720.0194±0.090.34±0.11511607±2221102±120.0288±0.240.30±0.0860.60.2412±112342±530.1761±0.180.38±0.0570.60.4440±4510182±490.0432±0.320.42±0.1480.60.6265±816442±360.0181±0.140.14±0.0490.60.8445±2820460±270.0170±0.060.27±0.07注:CAP浓度为0.1μg/L,B和B0分别为CAP存在和不存在时的T/C值。Note:ConcentrationofCAPis0.1mg/mL.BandB0areT/CvaluesinthepresenceandabsenceofCAP,respectively.GaMIgG,goatanti⁃mouseimmunoglobulin
可知,随着牛奶中CAP含量增加,T线的荧光强度则逐渐变浅直至完全消失,当CAP的浓度为0.1 μg/L时,试纸条T线的荧光强度明显弱于阴性对照组的T线,因此以0.1 μg/L为试纸条的检出限(图5A)。从图5B可知,检测CAP的浓度范围为0.1~100.0 μg/L,QBs荧光试纸条的拟合曲线为lgy=0.8103-0.6115lgx,R2=0.9915。

图5 试纸条的性能评价。(A)试纸条灵敏度实验,1~9 CAP浓度分别为:0、 0.1、 0.5、 1.0、 5.0、 10.0、 25.0、 50.0和100.0 μg/L; (B)试纸条的拟合曲线。Fig.5 Evaluation of property of ICST. (A) Sensibility of CAP ICST, the concentration of CAP from 1-9 is 0, 0.1, 0.5, 1.0, 5.0, 10.0, 25.0, 50.0 and 100.0 μg/L, (B) Calibration curves of ICST
3.5荧光免疫试纸条的特异性和稳定性
分别选择氟苯尼考、甲砜霉素、莱克多巴胺、青霉素4种抗生素(浓度为1000 μg/L)评价QBs荧光试纸条的特异性,以PBS作为空白对照。结果显示,当试纸条上滴加4种抗生素时,其T线和C线荧光条带与空白对照组基本相同,T/C值检测结果也证明四种抗生素在试纸条上无交叉反应。通过37℃加速稳定性实验考察试纸条的稳定性,结果表明,在2周的保存期内,虽然试纸条的T线和C线荧光强度值有所减弱,但试纸条的T/C值的相对标准偏差(RSD)为2.3%~7.0%,检测性能未发生明显变化。因此,本研究制备的QBs荧光试纸条具有良好的特异性和稳定性。
3.6实际样品分析
阴性牛奶样品两个浓度水平(0.1和10.0 μg/L)的加标回收率分别为97.9%和93.3%,RSD<7%(n=5)。因此,本研究制备的QBs荧光试纸条具有良好的特异性和稳定性,其准确性和精密度可以满足快速定量筛查的需求。
采用CAP QBs荧光试纸条检测30个牛奶样品的结果表明,20份加标样品中, 19份样品的检测结果为阳性; 10份阴性样品的检测结果皆为阴性,而且本实验结果与商品化ELISA检测试剂盒的检测结果一致。与ELISA方法相比,QBs荧光试纸条法操作更为简单,检测时间仅需15 min。与常规胶体金试纸条法(LOD: 0.2~2.0 μg/L)[20,21]相比,CAP QBs荧光试纸条具有更高的检测灵敏度和更强的特异性,可实现目的分子的定量分析,显示出良好的应用前景。
1 Fraunfelder F T, Bagby G C, Kelly D J.Am.J.Ophthalmol.,1982, 93(3): 420-422
2 Kucers A.J.Antimicrob.Chemother.,1980, 6(1): 1-4
3 Samanidou V, Kehagia M, Kabir A, Furton K G.Analy.Chim.Acta,2016, 914: 62-74
4 WU Li-Yuan.TheChineseLivestockandPoultryBreeding,2014, 10(4): 43-44
吴丽媛. 中国畜禽种业,2014, 10(4): 43-44
5 YANG Cheng-Dui, SONG Li-Hui, MAO Li-Ha, LIU Mi-Xin.ChineseJ.Anal.Chem.,2004, 32(7): 905-907
杨成对, 宋莉晖, 毛利哈, 刘密新. 分析化学,2004, 32(7): 905-907
6 Schwarm E F, Dabner C, Wilson J W, Boghosian M P.J.Pharmaceut.Sci.,1966, 55(7): 744-745
7 Anna Y K, Jeanne V S, Alexey M. Egorov.FoodAgri.Immunol.,2000, 12: 115-120
8 ZHANG Xiao-Jun, ZHENG Bin.ChineseJournalofAnalysisLaboratory,2010, 29(6): 115-118
张小军, 郑 斌. 分析试验室,2010, 29(6) : 115-118
9 Huang X, Aguilar Z P, Xu H, Lai W, Xiong Y.Biosens.Bioelectron.,2016, 75: 166-180
10 Sakamoto S, Yusakul G, Nuntawong P, Kitisripanya T, Putalun W, Miyamoto T, Tanaka H, Morimoto S.J.Chromatogr.B,2017, 1048: 150-154
11 Song C, Zhi A, Liu Q, Yang J, Jia G, Shervin J, Tang L, Hu X, Deng R, Xu C, Zhang G.Biosens.Bioelectron.,2013, 50: 62-65
12 Wang C, Hou F, Ma Y.Biosens.Bioelectron.,2015, 68: 156-162
13 Taranova N A, Berlina A N, Zherdev A V, Dzantiev B B.Biosens.Bioelectron.,2015, 63(2): 255-261
14 Di Nardo F, Anfossi L, Giovannoli C, Passini C, Goftman V V, Goryacheva I Y, Baggianic C.Talanta,2016, 150: 463-468
15 DUAN Hong, CHEN Xue-Lan, JIANG Hu, SHEN Jun, DONG Sheng-Ming, XIONG Yong-Hua, Andrew Wang.ChineseJ.Anal.Chem.,2015, 43(3): 338-343
段 宏, 陈学岚, 江 湖, 沈 骏, 董胜明, 熊勇华, Andrew Wang. 分析化学,2015, 43(3): 338-343
16 ZHOU Yao-Feng,XIONG Si-Cheng, JIANG Hu, DUAN Hong, XIONG Yong-Hua.ChineseJ.Anal.Chem.,2015, 43(12): 1837-1843
周耀峰, 熊斯诚, 江 湖, 段 宏, 熊勇华. 分析化学,2015, 43(12): 1837-1843
17 Campbell G S, Mageau R P, Schwab B, Johnston R W.Antimicrob.AgentsChemother.,1984, 25(2): 205-211
18 Kolosova A Y, Samsonova A M.FoodAgri.Immunol.,2000, 12(2):115-125
19 WANG Hong-Jiang, LIU Ting, XIE Ji, LI Wan-Yuan, GUO Ai-Ling, CAI Zhao-Xia.ChineseJ.Anal.Chem.,2010, 38(5): 632-637
王洪江, 柳 婷, 谢 跻, 栗婉媛, 郭爱玲, 蔡朝霞. 分析化学,2010, 38(5): 632-637
20 XU Sheng-Nan,YU Qiong-Wei, YUAN Bi-Feng, FENG Yu-Qi.JournalofAnalyticalScience,2016, 32(4): 471-474
许胜男, 余琼卫, 袁必锋, 冯钰锜. 分析科学学报,2016, 32(4): 471-474
21 XIAO Zhi-Li, ZENG Wen-Liang, WANG Hong, SHEN Yu-Dong, SUN Yuan-Ming, YANG Jin-Yi.Food&Machinery,2013, 29(4): 54-58
肖治理, 曾文亮,王 弘, 沈玉栋,孙远明,杨金易. 食品与机械,2013, 29(4): 54-58
This work was supported by the National Key R&D Program (Nos. 2016YFD0501200, 2016YFD0501009), the Fundamental Research Funds for the Central Universities (No. Y0201500195), the Natural Science Foundation of Jiangsu Province (No. BK20161452), the Key Program of Science and Technology Planning of Guangdong Province, China (No. 2017B020202010), and the Priority Academic Program Development of Jiangsu Higher Education Institutions (Jiangsu, China).
DevelopmentofQuantumDotSubmicrobeads-based
FluorescentImmunochromatographicTestStripfor
RapidDetectionofChloramphenicol
DING Qiao-Qi, LI Li, FAN Wen-Tao, LYU Ya-Nan, HU Jian-Hua, YAN Li-Ping*, SONG Su-Quan*
(CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
A fluorescent immunochromatographic test strip based on the quantum dots submicrobeads (QBs) was developed for quantitative detection of chloramphenicol (CAP). In this method, monoclonal antibody of CAP and OBs complex fluorescent probe was first prepared using 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide/N-hydroxysuccinimide coupling approach, then complete antigen CAP-HS-BSA was synthesized and sprayed on nitrocellulose membrane as test line (T line). Similarly, goat anti-mouse antibody was sprayed as control line (C line). The time required for the analysis was 15 min, and the limit of detection (LOD) for CAP was 0.1 μg/L, with a working range of 0.1-100 μg/L. In spiked milk samples, the test strip demonstrated high recoveries in the range from 93.3% to 97.9% with relative standard deviations of less than 7%.
Chloramphenicol; Quantum dot submicrobeads; Immunochromatographic test strip
9 May 2017; accepted 4 September 2017)
10.11895/j.issn.0253-3820.170300
