镍钛合金纤维基体表面纳米多孔复合氧化物的可控生长及其对多环芳烃的选择性固相微萃取
2017-11-06杜稼健王雪梅杜新贞卢小泉
杜稼健 张 敏 甄 琦 王雪梅,2 杜新贞*,2 卢小泉,2
(西北师范大学化学化工学院1, 甘肃省生物电化学与环境分析重点实验室2, 兰州 730070)
镍钛合金纤维基体表面纳米多孔复合氧化物的可控生长及其对多环芳烃的选择性固相微萃取
杜稼健1张 敏1甄 琦1王雪梅1,2杜新贞*1,2卢小泉1,2
(西北师范大学化学化工学院1, 甘肃省生物电化学与环境分析重点实验室2, 兰州 730070)
采用水热氧化法制备镍钛合金(NiTi)固相微萃取纤维。实验结果表明,在80℃的H2O2溶液中,直接氧化NiTi纤维基体可在其表面原位生长纳米多孔氧化镍/氧化钛复合涂层,其中氧化镍含量显著高于氧化钛含量。与高效液相色谱-紫外检测器(HPLC-UV)检测技术联用,考察了所制备NiTi纤维对典型芳香族化合物的萃取性能。结果表明,富Ni复合氧化物涂层对多环芳烃(PAHs)表现出良好的萃取选择性。在优化实验条件下,方法的线性范围为0.1~400.0 ng/mL,相关系数大于0.999,PAHs的检出限为0.026~0.056 ng/mL。对于50 ng/mL加标水样,单支NiTi纤维日内和日间测量的相对标准偏差(RSDs)分别为4.8%~6.2%和5.4%~6.5%(n=5),使用5支不同批纤维测量的RSDs为6.4%~8.4%。本方法适用于环境水样中PAHs的富集和测定,相对回收率为89.9%~108.5%,RSDs<8.1%。而且,NiTi纤维机械强度高, 化学稳定性好,制备过程精密可控。
多孔二氧化钛; 镍钛合金纤维; 固相微萃取; 多环芳烃
2017-06-27收稿;2017-09-08接受
本文系国家自然科学基金项目(No. 21265019)资助
* E-mail: duxz@nwnu.edu.cn
1 引 言
固相微萃取(SPME)是由Arthur等[1]于1990年建立的样品制备方法, 广泛应用于复杂样品基质中痕量分析物的富集与分离[2~4]。常规SPME纤维的耐用性取决于纤维基体的强度和其表面涂层的稳定性,然而,大多数市售SPME纤维是以熔融石英作为纤维基体,存在易断裂、耐用性差和成本较高的缺点[5]。因此,开发具有萃取效率高、选择性好和稳定性强的新型涂层是其发展的核心,将新型纳米材料作为纤维涂层牢固结合在金属纤维基体上是SPME研究领域的重要课题[6],特别是在金属基体上原位组装纳米结构涂层,提供了制备高稳定性SPME纤维的新途径[7~10]。
镍钛形状记忆合金(NiTi)是一类镍与钛含量近似相等的合金,具有独特的形状记忆效应、超弹性、优异的耐腐蚀性和良好的生物相容性[11]。Setkova等[12]首次研究了以NiTi丝作为纤维基体制作SPME纤维的可行性,获得了高强度的SPME纤维。此后,Budziak等[13]在NiTi纤维基体表面电沉积了氧化锆涂层用于测定水样中的卤代酚,单支纤维可使用500次,并在此基础上进一步用溶胶-凝胶技术制备了聚乙二醇的纤维涂层[14]。Azenha等[15]以NiTi丝为基体, 采用UV固化的溶胶-凝胶技术制备了功能化二氧化硅颗粒层,用于富集分离水样中苯甲醛、苯乙酮和二甲基苯酚。本实验室在前期工作中分别采用水热处理和电化学处理法在NiTi纤维基体上原位生长复合氧化物纳米片[16]和纳米管[17], 具有非常大的表面积和优良的萃取性能,一支纤维可完成萃取性能研究、条件优化、方法评价和批量样品的测定。
本研究采用水热氧化法直接在NiTi纤维基体上控制生长纳米多孔氧化镍/氧化钛(NiO/TiO2)涂层,表征了所组装纤维的表面形貌和元素组成;与高效液相色谱-紫外检测(HPLC-UV)联用,考察了所组装纤维对UV吸收剂、酞酸酯(PAEs)、多氯联苯(PCBs)和PAHs的萃取性能,并与市售聚二甲基硅氧烷(PDMS)和聚丙烯酸酯(PA)纤维进行了比较。最后,将NiTi纤维成功用于不同环境水样中目标PAHs的富集分离和测定。
2 实验部分
2.1仪器与试剂
Ultra Plus场发射扫描电镜,附能量色散X-射线光谱仪(德国Zeiss公司);Waters 600 HPLC系统,2487紫外-可见检测器(美国Waters公司),N-2000色谱工作站(浙江大学智达信息工程有限公司);SPME-HPLC接口(美国Supelco公司);KQ-100B超声清洗器(昆山舒美超声仪器有限公司);盛德利超纯水系统(重庆市澳凯龙医疗器械有限公司)。
甲醇(色谱纯,禹王实业有限公司),H2O2(AR,烟台双双化工有限公司);萘(Nap)、菲(Phe)、荧蒽(Fla)、芘(Pyr)和苯并[a]芘(B[a]P)(Aldrich);邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)、邻苯二甲酸二异辛酯(DEHP)、二甲苯酮(BP)、2-羟基-4-甲氧基二甲苯酮(BP-3)、2-乙基己基-4-(N,N-二甲氨基)苯甲酸酯(OD-PABA)、2-乙基己基-4-甲氧基肉桂酸酯(EHMC)、2,4,4'-三氯联苯(PCB-28)、2,4',5-三氯联苯(PCB-31)、2,3',4,4',5-五氯联苯(PCB-118)和2,2',4,4',5,5'-六氯联苯(PCB-153)(AccuStandard公司);2-乙基己基水杨酸酯(EHS,Ehrenstorfer公司);外径0.25 mm NiTi丝(Alfa Aesar公司);85 μm PA纤维和100 μm PDMS纤维(Supelco公司)。
2.2NiTi-SPME纤维的制备
用丙酮和超纯水依次超声清洗NiTi纤维丝,然后将NiTi丝插入内有15 mL H2O2溶液的反应釜中,80℃反应30 min,取出超声清洗2 min,随后将其插入新配制的H2O2溶液中,在相同条件下再次氧化,最后用超纯水冲洗NiTi纤维,空气中干燥,备用。
2.3SPME-HPLC
以磷酸盐缓冲溶液调节和控制样品溶液的pH值。萃取过程中,将制备的NiTi纤维浸入内有15 mL样品溶液的样品瓶中,搅拌萃取完成后,再将其插入SPME-HPLC接口静态解吸进行HPLC分析。UV吸收剂、PCBs、PAEs和PAHs分析的流动相分别为甲醇-水(85∶15、87∶13、75∶25和85∶15,V/V),流速为1 mL/min,对应的检测波长分别为310、254、280和254 nm。每次萃取前,NiTi纤维依次用甲醇和水超声清洗15和5 min,以消除可能的萃取残留物。
3 结果与讨论
3.1纳米多孔结构涂层的制备和表征
用扫描电镜(SEM)表征了NiTi纤维在H2O2溶液中氧化前后的表面形貌。如图1所示,未处理的NiTi纤维基体表面光滑(图1A),但其微观上有不连续的细微裂纹(图1B);经H2O2溶液氧化1次(图1C)、2次(图1D)、3次(图1E)和4次(图1F)后,其表面呈均匀分布纳米结构,可极大地增加NiTi纤维的表面积,有利于提高萃取效率和传质。经H2O2溶液2次氧化后,直接原位生长的纳米多孔结构更致密,可用于后续SPME研究。
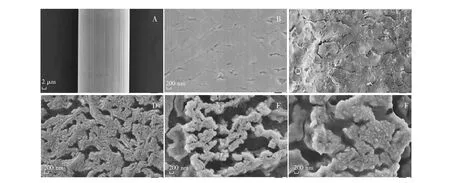
图1 NiTi纤维丝水热氧化处理前后的SEM图:(A)和(B)为未处理的NiTi纤维;氧化处理(C) 1次、(D) 2次、(E) 3次和(F) 4次后的NiTi纤维Fig.1 Scanning electron microscopy (SEM) images of NiTi wires(A) and (B) Original NiTi wire; NiTi wires after (C) the first, (D) the second,(E) the third and(F)the fourth hydrothermal oxidation.
3.2多孔复合氧化物涂层的表面元素组成
通过能量色散X-射线光谱(EDS)对纳米多孔涂层的元素组成进行了分析。如图2A所示,未氧化处理的NiTi纤维基体表面由Ni、Ti和O元素组成,说明其表面氧化已形成钝化膜,而且膜中Ni和Ti元素的百分含量(wt%)近似相等。经H2O2溶液氧化处理后,复合氧化物涂层中Ni元素含量远高于Ti元素的含量(图2B),表明通过水热氧化处理可有效控制复合氧化物涂层中NiO的相对含量。
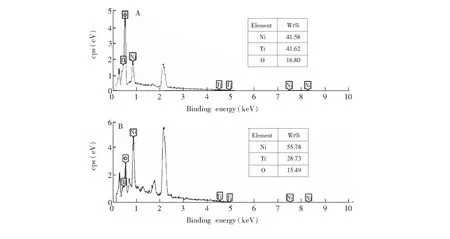
图2 NiTi纤维丝水热氧化处理前(A)和后(B)的EDS光谱Fig.2 Energy dispersive X-ray (EDS) spectra of NiTi wires before and after hydrothermal oxidation(A) Original NiTi wire; (B) Hydrothermally oxidized NiTi wire
3.3萃取选择性和萃取效率
研究了所制备NiTi纤维对PAEs(DMP、DEP、DBP、DOP和DEHP)、UV吸收剂(BP、BP-3、OD-PABA、EHMC和EHS)、PCBs(PCB-28、PCB-31、PCB-118和PCB-153)和PAHs(Nap、Phe、Fla、Pyr和B[a]P)的萃取性能。如图3所示,NiTi纤维对PAEs几乎没有萃取能力,对PCBs的萃取能力较小,对UV吸收剂具有一定的萃取能力,但NiTi纤维对PAHs具有优异的萃取能力,此结果与文献[17,18]所报道的Ti和NiTi纤维的萃取选择性不同,可能是由于NiTi纤维表面含有更多NiO,NiO中的Ni2+具有未饱和外层电子结构,对具有离域键体系富电子的PAHs有更强的亲和作用[19]。该结果表明通过调控复合氧化物涂层中NiO的相对含量改变了纤维涂层的萃取选择性。
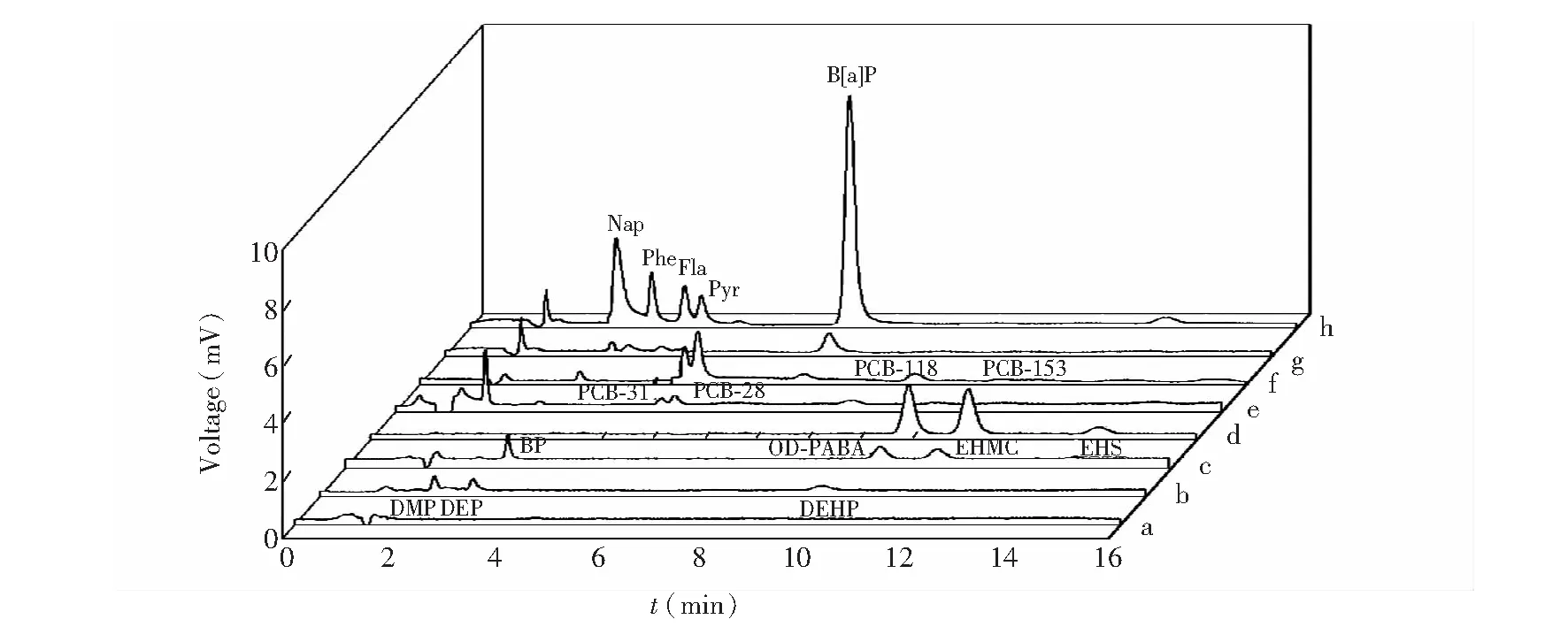
图3 HPLC和SPME-HPLC色谱图Fig.3 Typical chromatograms of direct high performance liquid chromatography (HPLC) and NiTi-solid phase micro-extraction (SPME)-HPLC(a)and(b)Dimethyl phthalate(DMP),diethyl phthalate(DEP)and di-(2-ethylhexyl) phthalate(DEHP);(c)and(d)2-Hydroxy-4-methoxybenzophenone(BP-3),2-ethylhexyl 4-(N,N-dimethylamino) benzoate(OD-PABA),2-ethylhexyl-4-methoxycinnamate(EHMC)and 2-ethylhexyl salicylate(EHS);(e)and(f)2,4,4′-Trichlorobiphenyl(PCB-28),2,4′,5-trichlorobiphenyl(PCB-31),2,3′,4,4′,5-pentachlorobiphenyl(PCB-118)and 2,2′,4,4′,5,5′-hexachlorobiphenyl(PCB-153);(g)and(h)Naphthalene(Nap),phenanthrene(Phe),fluoranthene(Flu),pyrene(Pyr)and benzo[a]pyrene(B[a]P);Spiking water,50 ng/L each analyte.
进一步将所制备NiTi纤维的萃取能力与市售PDMS和PA纤维进行了比较研究。如图4所示,相对于PA纤维(图4b)和PDMS纤维(图4c),氧化处理的NiTi纤维对PAHs显示出更强的萃取能力(图4d),萃取后Nap、Phe、Fla、Pyr和B[a]P的富集倍数分别达到138、122、99、87和171,此结果可归因于H2O2溶液二次氧化后的多孔氧化物纳米结构具有极大的表面积,从而增加NiTi纤维的萃取容量。
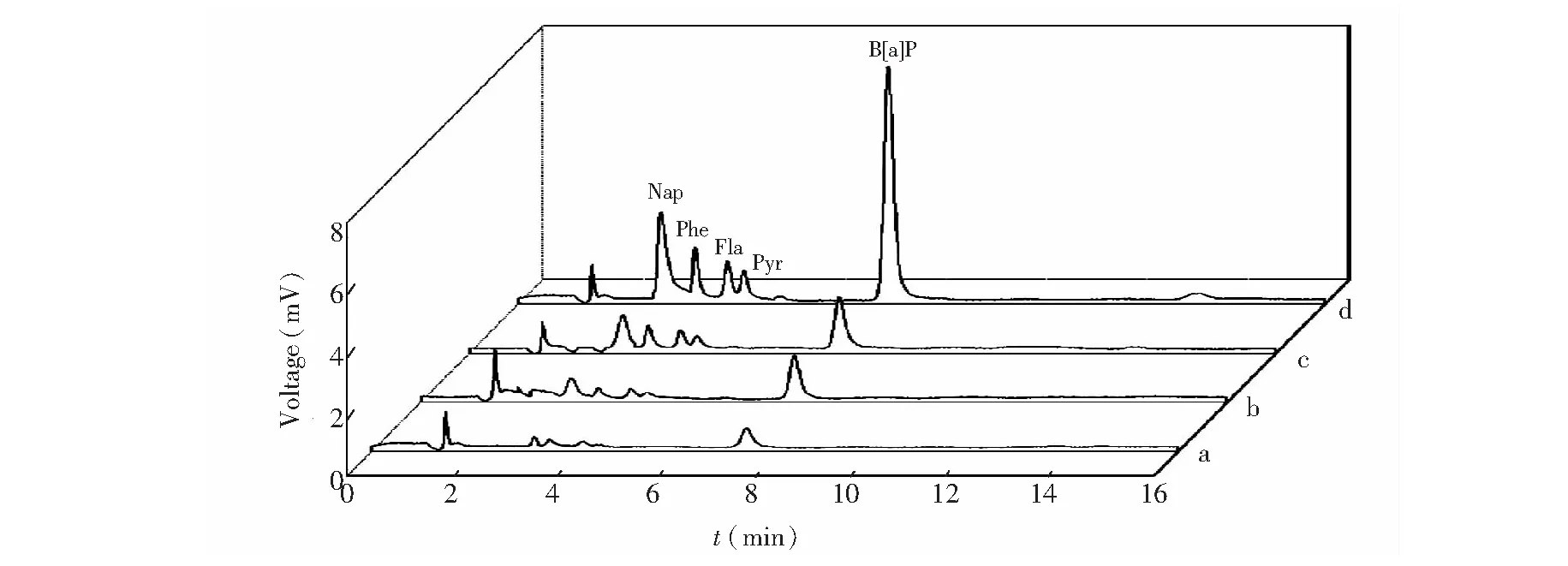
图4 采用NiTi纤维和市售纤维的SPME-HPLC色谱图. (a)直接 HPLC;(b)PA-SPME-HPLC;(c)PDMS-SPME-HPLC;(d)NiTi-SPME-HPLCFig.4 Typical chromatograms of SPME-HPLC with NiTi and commercial fibers(a) Direct HPLC;(b) polyacrylate (PA)-SPME-HPLC;(c) polydimethylsiloxane (PDMS)-SPME-HPLC;(d)NiTi-SPME-HPLC;Spiking level of each analyte,50 ng/mL.
3.4SPME条件优化
3.4.1萃取时间SPME过程中,分析物吸附平衡之前的萃取量取决于萃取时间。实验中考察了PAHs在15~40 min内的萃取效率,30 min内PAHs在样品溶液和NiTi纤维涂层间可达到萃取平衡。
3.4.2搅拌速率搅拌可以有效改善分析物从样品溶液到纤维涂层的传质速率,从而减少平衡时间。结果表明,当搅拌速率达到300 r/min时,萃取效率最高。
3.4.3萃取温度温度对SPME过程具有动力学和热力学影响。当萃取温度从15℃升高至30℃,PAHs萃取效率提高,此时动力学因素有利于萃取;随后,萃取效率随温度升高而降低,此时热力学因素又不利于萃取。另外,在较高温度下,PAHs的溶解度增加也会导致萃取效率降低。因此,在后续研究中萃取温度为30℃。
3.4.4离子强度SPME过程中,由于盐析效应,有机化合物的溶解度通常随着盐的加入而降低,从而改善萃取效率。本实验中,通过向样品溶液中加入0~25%(w/V)的NaCl溶液,考察离子强度的影响。结果表明,当NaCl含量为20%(w/V)时,分析物的萃取量达到最大。
3.4.5溶液pH值pH值对NiO/TiO2涂层表面性质的影响会间接影响SPME的效率。考察了pH 3.0~9.0对PAHs萃取效率的影响。结果表明,pH=7时NiTi纤维的萃取效率最高。
3.5方法的线性范围、精密度和检出限
在优化条件下,考察了所建立方法对PAHs的分析性能。如表1所示,本方法的线性范围为0.1~400 ng/mL,相关系数大于0.999,回收率为95.9%~106.2%;空白加标实验结果表明,在相同条件下平行测定5次,方法的检出限(S/N=3)为0.026~0.056 ng/mL;对于50 ng/mL的加标水样,单支纤维在日内和日间测定的相对标准偏差(RSDs,n=5)分别为4.8%~6.2%和5.4%~6.5%,5支不同批纤维测量的RSDs为6.4%~8.4%。
表1 实验方法的分析性能
Table 1 Analytical performance of the proposed method (n=5)
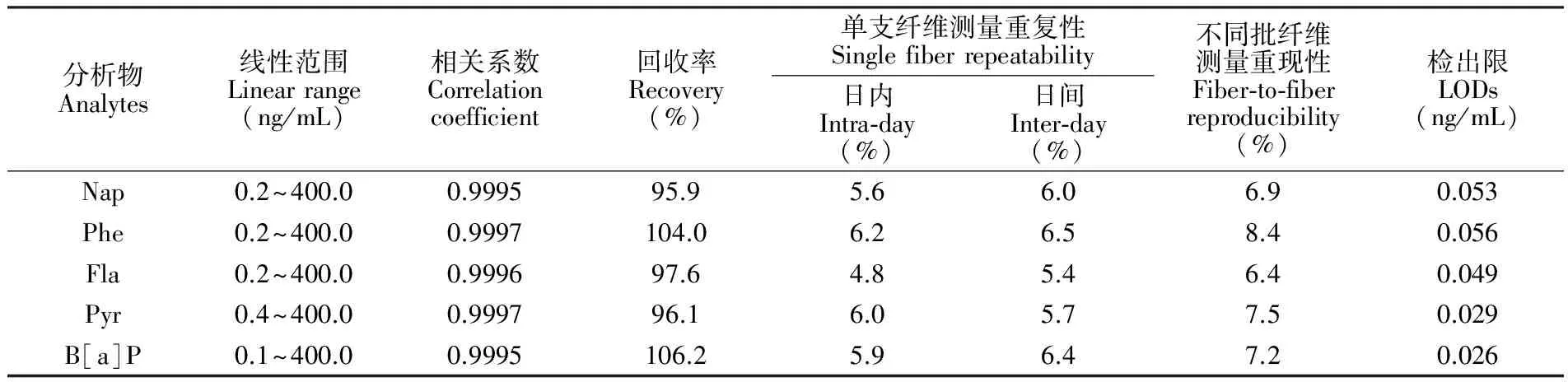
分析物Analytes线性范围Linearrange(ng/mL)相关系数Correlationcoefficient回收率Recovery(%)单支纤维测量重复性Singlefiberrepeatability日内Intra⁃day(%)日间Inter⁃day(%)不同批纤维测量重现性Fiber⁃to⁃fiberreproducibility(%)检出限LODs(ng/mL)Nap0.2~400.00.999595.95.66.06.90.053Phe0.2~400.00.9997104.06.26.58.40.056Fla0.2~400.00.999697.64.85.46.40.049Pyr0.4~400.00.999796.16.05.77.50.029B[a]P0.1~400.00.9995106.25.96.47.20.026
3.6实际水样分析
PAHs是环境中典型的持久性有机污染物,环境水体中PAHs含量极低,需在仪器分析之前进行预富集[20,21]。收集了兰州段黄河水样和当地污水处理厂水样,水样经砂芯漏斗过滤除去悬浮颗粒物,将所建立分析方法应用于实际水样目标PAHs的选择性富集和定量分析,分析结果见表2。5和25 ng/mL的加标水样的回收率分别为89.9%~108.5%和93.3%~103.1%,实际水样基体效应小。因此,本方法适用于不同环境水样中目标PAHs的选择性萃取富集和分析测定。
表2 实际水样的分析结果
Table 2 Analytical results of polycyclic aromatic hydrocarbons (PAHs) in different environmental water samples (n=3)
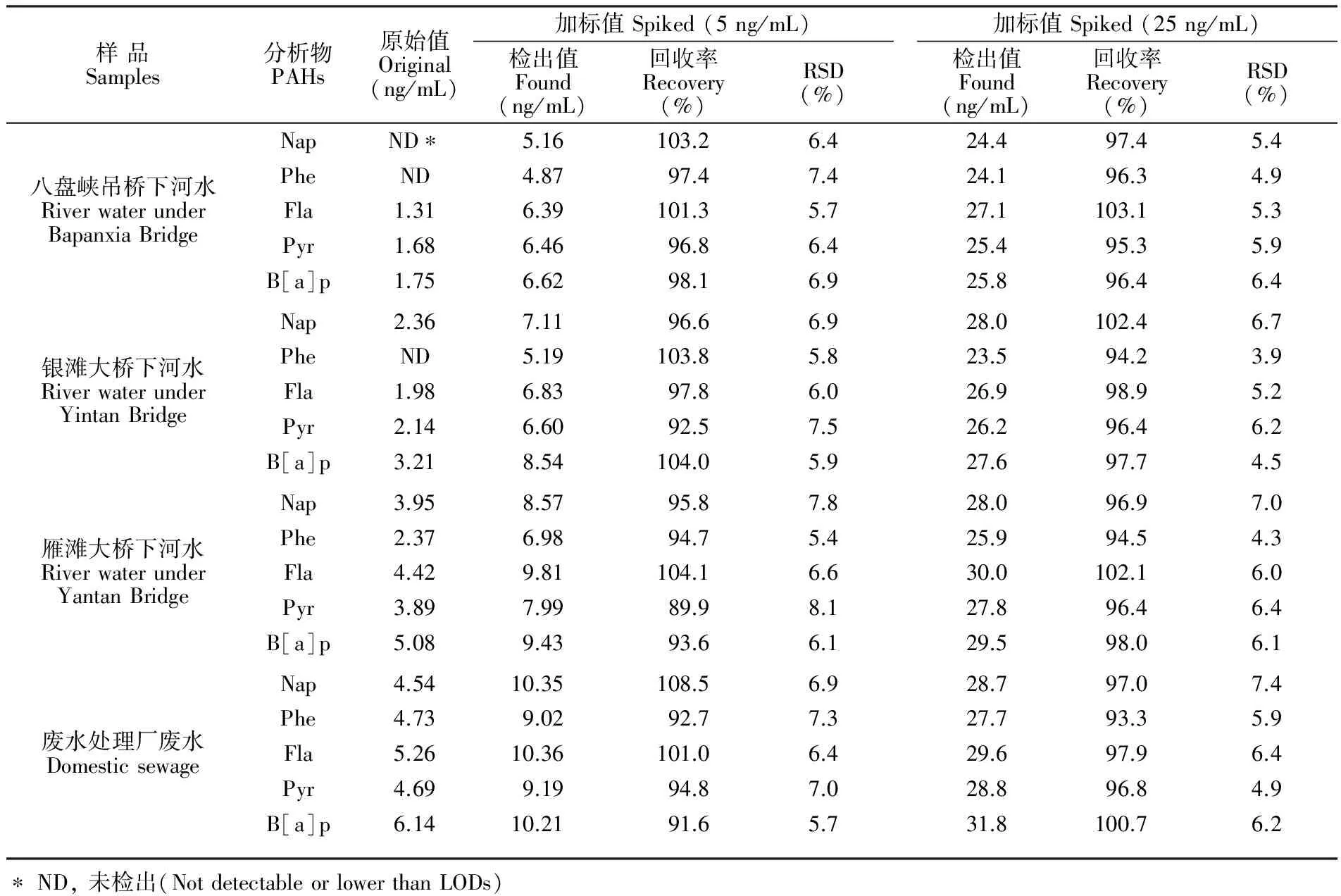
样品Samples分析物PAHs原始值Original(ng/mL)加标值Spiked(5ng/mL)检出值Found(ng/mL)回收率Recovery(%)RSD(%)加标值Spiked(25ng/mL)检出值Found(ng/mL)回收率Recovery(%)RSD(%)八盘峡吊桥下河水RiverwaterunderBapanxiaBridge银滩大桥下河水RiverwaterunderYintanBridge雁滩大桥下河水RiverwaterunderYantanBridge废水处理厂废水DomesticsewageNapND∗5.16103.26.424.497.45.4PheND4.8797.47.424.196.34.9Fla1.316.39101.35.727.1103.15.3Pyr1.686.4696.86.425.495.35.9B[a]p1.756.6298.16.925.896.46.4Nap2.367.1196.66.928.0102.46.7PheND5.19103.85.823.594.23.9Fla1.986.8397.86.026.998.95.2Pyr2.146.6092.57.526.296.46.2B[a]p3.218.54104.05.927.697.74.5Nap3.958.5795.87.828.096.97.0Phe2.376.9894.75.425.994.54.3Fla4.429.81104.16.630.0102.16.0Pyr3.897.9989.98.127.896.46.4B[a]p5.089.4393.66.129.598.06.1Nap4.5410.35108.56.928.797.07.4Phe4.739.0292.77.327.793.35.9Fla5.2610.36101.06.429.697.96.4Pyr4.699.1994.87.028.896.84.9B[a]p6.1410.2191.65.731.8100.76.2∗ND,未检出(NotdetectableorlowerthanLODs)
3.7NiTi纤维的稳定性
SPME纤维的稳定性在实际应用中至关重要。在实验操作中,单支纤维使用250次以上,对加标浓度为25 ng/mL的PAHs的5次平行测定的回收率为84.9%~91.6%。此纤维可以将纳米多孔NiO/TiO2涂层的优良萃取性能与NiTi纤维的超高强度相结合,一支纤维即可完成整个目标分析物的分析性能的考察、SPME优化和批量水样的测定。
4 结 论
通过水热氧化法在NiTi纤维基体表面原位生长了均匀致密纳米多孔NiO/TiO2涂层,通过复合氧化物涂层中NiO的控制生长,新型NiTi纤维可选择性地高效萃取PAHs,传质速率快,体现了SPME在样品前处理中简便、快速、灵敏和无溶剂的优点,且比市售的PDMS和PA纤维具有更高萃取效率。不同批次NiTi纤维具有良好的制备重现性,而且NiTi纤维机械强度高、化学稳定性好、使用寿命长,一支NiTi纤维即可完成整个分析过程。NiTi纤维基体有望替代常规石英纤维基体用于实际样品的SPME。
1 Arthur C L, Pawliszyn J.Anal.Chem.,1990, 62(19): 2145-2148
2 WEI Li-Ming, OU Qing-Yu, LIANG Bing.JournalofInstrmentalAnalysis,2004, 23(5): 17-20
魏黎明, 欧庆瑜, 梁 冰. 分析测试学报,2004, 23(5): 17-20
3 ZHANG Yong, CHEN Lei, HUANG Xiao-Jia, YUAN Dong-Xing.ChineseJ.Anal.Chem.,2015, 43(9): 1335-1441
张 咏, 陈 蕾, 黄晓佳, 袁东星. 分析化学,2015, 43(9): 1335-1441
4 PENG Ying, ZHUANG Yuan, HE Huan, SUN Cheng, YANG Shao-Gui.ChineseJ.Anal.Chem.,2014, 42(9): 1359-1363
彭 英, 庄 园, 何 欢, 孙 成, 杨绍贵. 分析化学,2014, 42(9): 1359-1363
5 Alpendurada M D F.J.Chromatogr.A,2000, 889(1-2): 3-14
6 Feng J J, Qiu H D, Liu X, Jiang S X.TrAC-TrendsAnal.Chem.,2013, 46: 44-58
7 Cao D D, Lu J X, Liu J F, Jiang G B.Anal.Chim.Acta,2008, 611: 56-61
8 Liu H M, Wang D A, Ji L, Li J B, Liu S J, Liu X, Jiang S X.J.Chromatogr.A,2010, 1217: 1898-1903
9 Zeng J B, Zhao C Y, Chong F Y, Cao Y Y, Subhan F, Wang Q R, Yu J F, Zhang M S, Luo L W, Ren W, Chen X, Yan Z F.J.Chromatogr.A,2010, 1319: 21-26
10 Zeng J B, Zhao C Y, Chen J J, Subhan F, Luo L W, Yu J F, Cui B W, Xing W, Chen X, Yan Z F.J.Chromatogr.A,2014, 1365: 29-34
11 Shabalovskaya S, Anderegg J, Van Humbeeck J.ActaBiomater.,2008, 4(3): 447-467
12 Setkova L, Risticevic S, Linton C M, Ouyang G F, Bragg L M, Pawliszyn J.Anal.Chim.Acta,2007, 581: 221-231
13 Budziak D, Martendal E, Carasek E.Anal.Chim.Acta,2007, 598(2): 254-260
14 Budziak D, E Martendal, Carasek E.J.Chromatogr.A,2008, 1198-1199(1): 54-58
15 Azenha M, Ornelas M, Silva A F.J.Chromatogr.A,2009, 1216(12): 2302-2306
16 Zhang M, Zhen Q, Wang H J, Guo M, Zhou S S, Wang X M, Du X Z.Talanta,2016, 158: 214-221
17 Zhen Q, Zhang M, Song W L, Wang H J, Wang X M, Du X Z.J.Sep.Sci.,2016, 39(19): 3761-3768
18 Li Y, Zhang M, Yang Y X, Wang X M, Du X Z.J.Chromatogr.A,2014, 1358: 60-67
19 Xu H L, Li Y, Jiang D Q, Yan X P.Anal.Chem.,2009, 81(12): 4971-4977
20 Feng J J, Sun M, Liu H M, Li J B, Liu X, Jiang S X.Anal.Chim.Acta,2011, 701(2): 174-180
21 Guo M, Song W L, Wang T E, Li Y, Wang X M, Du X Z.Talanta,2015, 144(2): 998-1006
This work was supported by the National Natural Science Foundation of China (No.21265019).
ControllableGrowthofNanoporousMetalOxideCompositesonNickel-TitaniumAlloyFibersforSelectiveSolid-PhaseMicroextractionofPolycyclicAromaticHydrocarbons
DU Jia-Jian1, ZHANG Min1, ZHEN Qi1, WANG Xue-Mei1,2, DU Xin-Zhen*1,2, LU Xiao-Quan1,2
(1CollegeofChemistryandChemicalEngineering,NorthwestNormalUniversity,2KeyLabofBioelectrochemistry&EnvironmentalAnalysisofGansu,Lanzhou730070,China)
Hydrothermal oxidation was used to prepare a nickel-titanium alloy (NiTi) solid-phase microextraction fiber. The experimental results demonstrated that a nanoporous NiTi oxide composite coating was in situ grown on the surface of NiTi substrate by direct oxidation in aqueous H2O2solution at 80℃. The resulting composite oxide coating included more nickel and less titanium. The prepared NiTi fiber with Ni-rich oxide coating was used to extract typical aromatic compounds coupled with HPLC-UV and exhibited good extraction selectivity for polycyclic aromatic hydrocarbons (PAHs). The key factors affecting extraction efficiency of PAHs were examined. Under the optimized conditions, the calibration curves were linear in the range from 0.05 to 500 ng/mL with correlation coefficients ≥0.999, and the limits of detection were 0.026-0.056 ng/mL. Furthermore, the relative standard deviations (RSDs) for intra-day and inter-day repeatability of the single fiber varied from 4.8% to 6.2% and from 5.4% to 6.5% for five replicates of PAHs at the spiking level of 50 ng/mL, respectively. The RSDs for the fiber-to-fiber reproducibility of five fibers prepared in different batches ranged from 6.4% to 8.4%. This method was suitable for selective enrichment and detection of target PAHs in environmental water samples with relative recoveries of 87.4%-108.2% and RSDs <8.1%. Moreover, this novel NiTi fiber was mechanically strong and chemically stable, and its preparation was precisely controllable.
Nanoporous titanium dioxide; Nickel-titanium alloy fiber; Solid-phase microextraction; Polycyclic aromatic hydrocarbons
27 June 2017; accepted 8 September 2017)
10.11895/j.issn.0253-3820.171038
