固定化氧化还原介体加速Escherichia coli BL21还原Cr(Ⅵ)的影响因素研究
2017-11-04平佳芃许志芳郭延凯郭建博
平佳芃,许志芳,郭延凯,郭建博,廉 静
(1.河北科技大学环境科学与工程学院,河北石家庄 050018;2.河北省污染防治生物技术实验室,河北石家庄 050018;3.华能国际电力股份有限公司上安电厂,河北石家庄 050000;4.天津城建大学市政与环境工程学院,天津 300384)
1008-1542(2017)05-0493-06
10.7535/hbkd.2017yx05013
固定化氧化还原介体加速EscherichiacoliBL21还原Cr(Ⅵ)的影响因素研究
平佳芃1,2,许志芳3,郭延凯1,2,郭建博4,廉 静1,2
(1.河北科技大学环境科学与工程学院,河北石家庄 050018;2.河北省污染防治生物技术实验室,河北石家庄 050018;3.华能国际电力股份有限公司上安电厂,河北石家庄 050000;4.天津城建大学市政与环境工程学院,天津 300384)
为了研究非水溶性醌类介体加速Cr(Ⅵ)生物还原过程的影响因素,采用乙酸纤维素包埋法固定非水溶性醌类介体,探讨其调控EscherichiacoliBL21还原Cr(Ⅵ)的过程。结果表明,蒽醌、1-氯蒽醌、2-氯蒽醌、1,5-二氯蒽醌、1,8-二氯蒽醌和1,4,5,8-四氯蒽醌6种非水溶醌的加速顺序为1-氯蒽醌>1,5-二氯蒽醌>2-氯蒽醌>1,8-二氯蒽醌>蒽醌>1,4,5,8-四氯蒽醌;1-氯蒽醌的最佳加速浓度为0.048 mol/L;生物还原的最佳pH值为7.00;最佳初始Cr(Ⅵ)质量浓度为30 mg/L;在温度范围为20~60 ℃时,Cr(Ⅵ)的去除率随温度的上升而增加;在重复利用性实验中,1-氯蒽醌乙酸纤维素小球循环使用6次,Cr(Ⅵ)生物还原速率仍是空白菌液5倍以上。乙酸纤维素固定非水溶性醌可以有效加速EscherichiacoliBL21还原Cr(Ⅵ)过程,具有良好的应用价值。
水污染防治工程;Cr(Ⅵ);氧化还原介体;生物还原;固定化
铬及其化合物是重要的工业原料,广泛应用于电镀、制革、木材防腐、合金制造等行业,导致大量含Cr(Ⅵ)废水的产生,造成了严重的铬污染[1-3]。铬在水环境中的存在形态主要有2种:Cr(Ⅲ)和Cr(Ⅵ)。Cr(Ⅵ)毒性大,易迁移、易被人体吸收,可致癌、致突变,对生态环境和人类生存产生了巨大危害,是美国EPA公认的优先污染物之一[4-5],也被中国列入《重金属污染综合防治“十二五”规划》总量控制指标之一[1,6]。与Cr(Ⅵ)相比,Cr(Ⅲ)的毒性较小,将较高毒性的Cr(Ⅵ)还原为较低毒性的Cr(Ⅲ),是铬污染修复的有效途径,也因此成为国内外学者的研究热点[7]。目前,含Cr(Ⅵ)废水的处理方法主要有物理法、化学法和生物法。其中,生物法具有处理成本低、二次污染小等特点[8],具有较为广泛的应用前景,但仍然存在处理速率慢的问题。目前,已有研究结果表明氧化还原介体能够加速电子供体与电子受体间的电子传递速率,从而提高处理多种污染物的氧化还原速率[9-11]。另外,在实际应用过程中,水溶性醌类介体的使用易流失,从而造成二次污染,且连续投加增加运行成本,而将非水溶性醌类介体固定化后可以有效的避免这些问题。
本研究开展了利用乙酸纤维素包埋固定的非水溶性醌类介体加速EscherichiacoliBL21(简称E.coliBL21)还原Cr(Ⅵ)过程的特性研究,以期为非水溶性醌类介体在含重金属废水处理领域中的应用提供理论和技术支持。
1 材料与方法
1.1 菌种来源及培养
菌种为实验室购买的E.coliBL21。将E.coliBL21按5%体积比接种到LB培养基中,37 ℃,140 r/min振荡培养至OD660值为1.1。离心收集细胞(8 000×g,15 min),用无菌磷酸钠缓冲溶液(20 mmol/L,pH值为7.00)清洗2遍,按4%体积比转接到重金属还原培养基中,37 ℃,140 r/min振荡培养10 h。
LB培养基(富集培养基)(g/L):酵母粉 5.0,胰蛋白胨 10.0,NaCl 10.0。pH值调至7.00±0.02,高压蒸气灭菌(1×105Pa灭菌30 min)。
重金属还原培养基(g/L):NH4Cl 1.0,NaHCO31.0,K2HPO40.2,MgSO40.1,NaCl 1.0,葡萄糖2.0,pH值调至7.20±0.02,高压蒸气灭菌(1×105Pa灭菌30 min)。
1.2 废水来源
采用铬酸钾(K2CrO4,分析纯)按所需浓度配置含Cr(Ⅵ)模拟废水,高压蒸气灭菌(1×105Pa灭菌30 min)待用。
1.3 实验材料
实验所选6种氧化还原介体:蒽醌(AQ)、1-氯蒽醌(1-AQ)、2-氯蒽醌(2-AQ)、1,5-二氯蒽醌(1,5-AQ)、1,8-二氯蒽醌(1,8-AQ)和1,4,5,8-四氯蒽醌(1,4,5,8-AQ)6种醌类化合物为氧化还原介体,均购于上海试四赫维化工有限公司。
1.4 介体的固定
本实验采用乙酸纤维素包埋法固定非水溶性醌[12]。
1.5 Cr(Ⅵ)还原的实验步骤
将培养完成的E.coliBL21取出混匀后分装到250 mL锥形瓶中,加入已灭菌的Cr(Ⅵ)储备液使体系中初始Cr(Ⅵ)质量浓度为35 mg/L,加入含有不同种类、不同浓度非水溶性醌的乙酸纤维素小球,用橡胶塞密封,通过注射器取样。放置于37 ℃恒温箱进行反应,每2 h取样一次。
1.6 分析方法
Cr(Ⅵ):使用722S分光光度计测定,采用二苯碳酰二肼分光光度法[13]。
pH值:使用PHS225C型数字酸度计测定。
2 结果与讨论
2.1 非水溶性醌对E.coli BL21还原Cr(Ⅵ)的影响
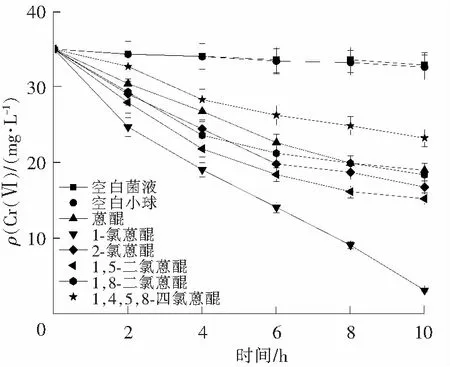
图1 6种非水溶性醌对Cr(Ⅵ)质量还原的影响Fig.1 Effect of six non-dissolved quinones on Cr(Ⅵ) reduction process
为了探讨对还原Cr(Ⅵ)加速效果最佳的非水溶性醌,实验考察了蒽醌,1-氯蒽醌,2-氯蒽醌,1,5-二氯蒽醌,1,8-二氯蒽醌,1,4,5,8-四氯蒽醌对Cr(Ⅵ)还原的加速作用,每种醌的投加量分别为0.036 mol/L,以空白菌液和空白小球作为对照,实验结果如图1所示。
由图1可知,与空白菌液相比,6种非水溶性醌对Cr(Ⅵ)还原均有加速作用,加速快慢顺序为1-氯蒽醌>1,5-二氯蒽醌>2-氯蒽醌>1,8-二氯蒽醌>蒽醌>1,4,5,8-四氯蒽醌。在降解10 h后,Cr(Ⅵ)去除率分别为91.43%,56.66%,55.20%,47.63%,45.89%,33.66%。其中1-氯蒽醌作用效果最明显,故选择1-氯蒽醌进行后续研究。CERVENTES[14]研究表明,醌类化合物加速机制大致有2种:一种是醌类化合物具有生物厌氧还原过程中辅酶所具有的结构特征,在还原过程中起到类似辅酶的作用;另一种是醌类化合物在酶的作用下会形成活性高且有一定稳定性的中间体,它们能从底物中获得氢质子或电子传递给最终电子受体,从而将其还原。STOLZ[15]研究表明,在有合适电子供体时,氧化还原介体还原为氢醌之后能够还原多种氧化性化合物并且完成介体的再生,从而加速电子在电子供体和电子受体之间的传递过程。XI等[16]研究表明醌类化合物可以作为电子载体缩短反硝化时间,而且醌类化合物与反硝化中的辅酶甲基萘醌结构相似。

图2 不同浓度的1-氯蒽醌对Cr(Ⅵ)还原的影响Fig.2 Effect of different concentrations of 1-dichloroanthraquinone on Cr(Ⅵ) reduction process
2.2 不同浓度1-氯蒽醌对Cr(Ⅵ)还原的影响
为了考察不同1-氯蒽醌的浓度对E.coliBL21还原Cr(Ⅵ)的影响,实验设置了不同浓度的1-氯蒽醌,分别为0.012,0.024,0.036,0.048,0.060 mol/L,以空白菌液和空白小球作为对照,考察1-氯蒽醌浓度对E.coliBL21还原Cr(Ⅵ)的影响。实验结果如图2所示。
由图2可知,5种浓度的醌反应体系对Cr(Ⅵ)还原均有一定的加速作用。在降解10 h后,Cr(Ⅵ)去除率分别为48.6%,51.4%,64.3%,90.0%,63.9%。可以看出1-氯蒽醌浓度为0.048 mol/L时加速效果最明显。当体系中1-氯蒽醌浓度为0.012~0.048 mol/L时,还原速率随着1-氯蒽醌浓度增加而增加;但当1-氯蒽醌浓度增加至0.060 mol/L时,还原速率与1-氯蒽醌浓度为0.048 mol/L相比出现了下降,可能是因为醌具有一定毒性,影响了菌的活性[17]。有研究表明[18],醌类可以通过NADPH-细胞色素P450和NADH-细胞色素b5还原酶进行单电子酶还原,产生可以进行氧化还原循环的半醌基团,进而产生活性氧(reactive oxygen species,ROS),包括超氧阴离子自由基、过氧化氢和羟基,导致了对细胞的毒性。故后续实验使用0.048 mol/L 1-氯蒽醌进行研究。
2.3 初始Cr(Ⅵ)质量浓度对还原的影响

图3 不同初始Cr(Ⅵ)质量浓度对还原的影响Fig.3 Effect of differentinitial Cr(Ⅵ) concentrations on Cr(Ⅵ) reduction process
为了考察不同初始Cr(Ⅵ)浓度对还原过程的影响,实验设置了6种不同初始Cr(Ⅵ)质量浓度,分别为10,20,30,40,50,60 mg/L,考察初始Cr(Ⅵ)质量浓度对还原过程的影响,实验结果如图3所示。

图4 不同初始pH值对Cr(Ⅵ)还原的影响Fig.4 Effect of different initial pH values on Cr(Ⅵ) reduction process
由图3可知,在不同初始Cr(Ⅵ)质量浓度下,E.coliBL21对Cr(Ⅵ)均有一定的还原作用,初始Cr(Ⅵ)质量浓度为10,20,30,40,50,60 mg/L,还原体系的速率常数分别为8.05,8.05,8.37,7.08,6.61,6.34 mg Cr(Ⅵ)/(g·h),可以看出,当初始Cr(Ⅵ)质量浓度为30 mg/L时,Cr(Ⅵ)还原速率较大,与张娜[19]和赵欣欣[20]实验结果类似。当Cr(Ⅵ)质量浓度较高时对菌体有较强的毒性作用,这可能是其他对照组去除率较低的原因。RIDA等[21]研究结果显示,Cr(Ⅵ)能引起细胞形态的改变,使细胞膜表面粗糙,出现褶皱且通透性增加。
2.4 初始pH值对Cr(Ⅵ)还原的影响
在微生物生命活动过程当中,大部分需要酶的参与,过高或者过低的pH值都会影响酶的活性,不同的酶最适pH值也不同[22]。因此本实验研究了不同初始pH值对E.coliBL21还原Cr(Ⅵ)的影响。实验设定了6种不同的初始pH值,分别为5.00,6.00,7.00,7.50,8.00,9.00,并以空白小球作为对照。实验结果如图4所示。
如图4可知,与空白小球相比,在不同pH值情况下,1-氯蒽醌对E.coliBL21还原Cr(Ⅵ)过程均有加速效果,当pH值为7.00时,作用效果最为明显,其次是pH值为7.50时。与王雪艳[23]研究结果相似。MURUGAVELH等[24]研究结果表明,在pH值较低时可能导致细胞裂解;而在pH值较高时,细胞表面活性部位和解离状态受到了抑制。另外,在极端条件下,反应体系的传质也受到制约,尤其是醌类化合物起到的调控作用会受到大幅度影响[12]。
2.5 温度对Cr(Ⅵ)还原的影响
微生物的生长繁殖都有一个适宜的温度范围,温度过高会使细胞内蛋白质变质失活,温度过低时会使微生物进入低温休眠状态[25]。本实验考查了在20,30,37,40,50,60 ℃的条件下,1-氯蒽醌调控E.coliBL21还原Cr(Ⅵ)的影响,并设置空白小球作为对照。实验结果如图5所示。
由图5可以看出在温度从20 ℃升高到60 ℃时,Cr(Ⅵ)还原速率呈上升趋势。20,30,37,40,50,60 ℃还原体系的速率常数分别为7.15,8.62,12.35,14.11,23.48,28.17 mgCr(Ⅵ)/(g·h)。根据阿伦尼乌斯方程,拟合实验数据可得到反应速率常数k与热力学温度T的相关性[10],如图6所示。从图6可以看出,lnk和T-1具有高度的相关性(R2=0.962 7),其线性关系式为y=-3.643x+14.314,由线性关系式和阿伦尼乌斯方程得到该反应条件下的活化能Ea=28.47 kJ/mol,指前因子A为14.87 mgCr(Ⅵ)/(g·h)。考虑到E.coliBL21的最佳生长温度为37 ℃,选择相应实验的温度条件均选择为37 ℃。
2.6 1-氯蒽醌乙酸纤维素小球的重复利用性
为了确定1-氯蒽醌乙酸纤维素小球的可重复利用性,本实验对比了6次连续重复使用1-氯蒽醌的乙酸纤维素小球体系与空白菌液体系,来判定固定后非水溶性醌的生物催化稳定性,在37 ℃,pH值为7.00,Cr(Ⅵ)初始质量浓度为35 mg/L的条件下进行对比。实验结果如图7所示。投加1-氯蒽醌的乙酸纤维素小球体系与空白菌液体系相比,6次重复利用后的还原速率仍是空白对照的5倍以上。由此可知,乙酸纤维素包埋非水溶性醌加速E.coliBL21还原Cr(Ⅵ)是一个操作性好,整体效率高且有实际应用价值的Cr(Ⅵ)生物修复的方法。

图5 不同温度对Cr(Ⅵ)还原的影响Fig.5 Effect of different temperatures on Cr(Ⅵ) reduction process

图6 反应速率常数k与热力学温度T的相关性Fig.6 Relationship of reation rate constant and thermodynamic temperature

图7 乙酸纤维素固定1-氯蒽醌调控还原Cr(Ⅵ)连续重复实验的结果Fig.7 Immediate repeated experiment result of Cr(Ⅵ) reduction accelerated by cellulose acetate immobilized 1-dichloroanthraquinone
3 结 语
本研究通过批次实验考察了非水溶性醌影响E.coliBL21还原Cr(Ⅵ)过程中的多种因素。结果表明:6种非水溶性醌对E.coliBL21还原Cr(Ⅵ)均有加速作用,其中1-氯蒽醌加速效果最为明显,最佳浓度为0.048 mol/L;1-氯蒽醌调控E.coliBL21还原Cr(Ⅵ)最佳pH值为7.00;1-氯蒽醌乙酸纤维素小球在循环使用后仍能保持较高的Cr(Ⅵ)生物催化还原性能。
目前有许多关于氧化还原介体加速Cr(Ⅵ)生物还原的研究,LIU等[26]使用指甲花醌为氧化还原介体,4 h内还原了质量浓度为97.5 mg/L的Cr(Ⅵ);GUO等[10]使用AQS为氧化还原介体,当Cr(Ⅵ)初始质量浓度为32 mg/L时,经过7.5 h的还原,Cr(Ⅵ)去除率为98.5%;CHEN等[27]使用AQDS作为氧化还原介体,当Cr(Ⅵ)初始质量浓度为10 mg/L时,经过30 h的还原,Cr(Ⅵ)去除率为100%。但是由于上述研究中均采用的是水溶性氧化还原介体,其使用过程中会带来二次污染和成本增加的问题,而经过固定后的氧化还原介体可有效解决上述问题。本研究中乙酸纤维素固定的1-氯蒽醌可有效加速E.coliBL21还原Cr(Ⅵ)的过程,且与以往GUO等[28]、郭建博等[29]、康丽等[30]的固定方法相比,具有较好的机械性能和可重复利用性。因此,利用乙酸纤维素包埋非水溶性氧化还原介体加速Cr(Ⅵ)生物还原是一种具有较高实际应用价值的Cr(Ⅵ)生物修复的方法。
/
[1] 裴耀文, 骆祝华, 黄翔玲, 等. 深海抗铬(Ⅵ)细菌的分离、鉴定及其铬(Ⅵ)还原能力的研究[J]. 海洋学报, 2004, 26(2): 140-148.
PEI Yaowen, LUO Zhuhua, HUANG Xiangling, et al. Isolation and identification of chromate-tolerant deep-sea bacteria and their chromate reduction capability[J]. Acta Oceanologica Sinica, 2004, 26(2): 140-148.
[2] URVASHI T, RASESH P, YOGESH S, et al. Hexavalent chromium reduction byProvidenciasp.[J]. Process Biochemistry, 2006, 41(6): 1332-1337.
[3] 魏斐, 杨丽荣, 薛保国, 等. 还原六价铬细菌及其还原酶的研究[J]. 中国生物工程杂志, 2012, 32(4): 53-59.
WEI Wen, YANG Lirong, XUE Baoguo, et al. Study on the restore hexavalent chromium bacteria and its reductase[J]. China Biotechnology, 2012, 32(4): 53-59.
[4] VENITT S, LEVY L S. Mutagenicity of chromates in bacteria and its relevance to chromate carcinogenesis[J]. Nature (London) 1974, 250(5466): 493-495.
[5] 高小朋, 张欠欠, 许平, 等. 微生物还原Cr(Ⅵ)的研究进展[J]. 微生物学通报, 2008, 35(5): 820-824.
GAO Xaopeng, ZHANG Qianqian, XU Ping, et al. Advances in microbial reduction of Cr(Ⅵ)[J]. Microbiology China, 2008, 35(5): 820-824.
[6] US EPA. Health assessment document for chromium. Final Report[R].Washington, DC:US Evironmental Protection Agency,1984.
[7] 刘荣香, 张焕祯. 含Cr(Ⅵ)废水处理技术研究进展[J]. 环境科技, 2012, 24(2): 94-96.
LIU Rongxiang, ZHANG Huanzhen. Research progress of Cr(Ⅵ) containing wastewater treatment[J]. Environmental Science and Technology, 2012, 24(2): 94-96.
[8] 朱玲玲, 曹佳妮, 张文, 等. 一株耐铬细菌的鉴定及其还原铬性能分析[J]. 环境科学学报, 2013, 33(10): 2717-2723.
ZHU Lingling, CAO Jiani, ZHANG Wen, et al. Identification of a chromium-tolerant bacterial strain and analysis of its Cr(Ⅵ)-reducing ability[J]. Acta Scientiae Circumstantiae, 2013, 33(10): 2717-2723.
[9] 陈延明, 张华雨, 赵丽君, 等. 氧化还原介体在环境治理中应用研究进展[J]. 河北工业科技, 2013, 30(4): 266-271.
CHEN Yanming, ZHANG Huayu, ZHAO Lijun, et al. Development and application of redox mediators for environmental protection[J]. Hebei Journal of Industrial Science and Technology, 2013, 30(4): 266-271.
[10] GUO Jianbo, LIAN Jing, XU Zhifang, et al. Reduction of Cr(Ⅵ) byEscherichiacoliBL21 in the Presence of Redox Mediators[J]. Bioresource Technology, 2012, 123: 713-716.
[11] 马志远, 许志芳, 康丽, 等. 固定化氧化还原介体强化酸性红B生物脱色作用研究[J]. 河北工业科技, 2013, 30(3): 133-137.
MA Zhiyuan, XU Zhifang, KANG Li, et al. Enhanced bio-decolorization of acid red B with immobilized redox mediator[J]. Hebei Journal of Industrial Science and Technology, 2013, 30(3): 133-137.
DU Haifeng, ZHAO Lijun, GUO Yankai, et al. Accelerating characteristic of non-dissolved redox mediators immobilized by cellulose acetate(CA) on denitrification[J]. Chinese Journal of Environmental Engineering, 2014, 8(6): 2417-2422.
[13] 国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M].4版.北京: 中国环境科学出版社, 2002.
[14] CERVANTES-CARRILLO F J. Quinones as Electron Acceptors and Redox Mediators for the Anaerobic Biotransformation of Priority Pollutants [M]. Wageningen: Wageningen University, 2002.
[15] STOLZ A. Basic and applied aspects in the microbial degradation of azo dyes[J]. Applied Microbiology and Biotechnology, 2001, 56(1): 69-80.
[16] XI Zhenhua, GUO Jianbo, LIAN Jing, et al. Study the catalyzing mechanism of dissolved redox mediators on bio-denitrification by metabolic inhibitors[J]. Bioresource Technology, 2013, 140: 22-27.
[17] JIAO Ling, LU Hong, ZHOU Jiti, et al. Quinone-mediated decolorization of sulfonated azo dyes by cels and cel extracts from Sphingomonas xenophaga[J]. Journal of Environment Science, 2009, 21(4): 503-508.
[18] RUI X, DAVID S, DAVID R. Quinone-induced protein handling changes: Implications for major protein handling systems in quinone-mediated toxicity[J]. Toxicology and Applied Pharmacology, 2014, 280(2): 285-295.
[19] 张娜. 海洋细菌Pseudoalteromonassp.对六价铬的还原性能研究[D]. 济南:山东大学, 2016.
在本文中,将总信道带宽划分为多个等带宽的子信道,通过各个子信道中的信息符号的调制,获得各个子载波的调制频率谱。最终,每个子信道符号将在时域持续的时间比单载波持续的时间长很多,使光信号因受多径而衰落的影响就大大减弱了。
ZHANG Na. Characteristics of Cr(Ⅵ) Reduction by Marine BacteriumPseudoalteromonassp.[D].Jinan: Shandong University, 2016.
[20] 赵欣欣. 基于亚硝酸盐还原酶酶学特性的优势菌除Cr(Ⅵ)机理研究[D]. 广州:广东工业大学, 2013.
ZHAO Xinxin. Mechanism Study on Cr(Ⅵ) Removal by a Strain ofBacillussp. Based on Characteristics of NiR Enzyme[D].Guangzhou: Guangdong University of Technology, 2013.
[21] BATOOL R, KIM Y, SHAHIDA H. Hexavalent chromium reduction by bacteria from tannery effluent[J]. Journal of Microbiology and Biotechnology, 2012, 22(4):547-554.
[22] CHEN Guiqiu, ZENG Guangming, TU Xiang, et al. Application of a by-product of Lentinus edodes to the bioremediation of chromate contaminated water[J]. Journal of Hazardous Materials, 2006,135(1): 249-255.
[23] 王雪艳. 南海深海细菌Pseudoalteromonassp. CF10-13 对六价铬去除特性和机理研究[D].济南:山东大学, 2014.
WANG Xueyan. Characteristic and Mechanisms of Cr(Ⅵ) Removal by the Deep-sea BacteriumPseudoalteromonassp. CF10-13[D]. Jinan: Shandong University, 2014.
[24] MURUGAVELH S, MOHANTY K. Bioreduction of hexavalent chromium by free cells and cell free extracts ofHalomonassp.[J]. Chemical Engineering Journal, 2012, 203(1): 249-255.
[25] DUGAN N R, WILLIAMS D J, MEYER M, et al. The impact of temperature on the performance of anaerobic biological treatment of perchlorate in drinking water[J]. Water Research, 2009, 43(7): 1867-1878.
[26] LIU Guangfei, YANG Hua, WANG Jing, et al. Enhanced chromate reduction by restingEscherichiacolicells in the presence of quinone redox mediators[J]. Bioresource Technology, 2010, 101: 8127-8131.
[27] CHEN Hong, LI Xiaojuan, XU Zhiwei. Cr(Ⅵ) remediation by enriched sediment with anthraquinone-2,6-disulfonate as electron shuttles[J]. Physics and Chemistry of the Earth, 2011, 36: 451-454.
[28] GUO Jianbo, LIU Huijuan, QU Jiuhui, et al. The structure activity relationship of non-dissolved redox mediators during azo dye bio-decolorization processes[J]. Bioresource Technology, 2012, 112: 350-354.
[29] 郭建博, 周集体, 王栋, 等. 固定化蒽醌对偶氮染料生物降解促进作用研究[J]. 环境科学, 2006, 27(10): 2071-2075.
GUO Jianbo, ZHOU Jiti, WANG Dong, et al. Accelerating effects of immobilized anthanquinone on the anaerobic biodegradation[J]. Environmental Science, 2006, 27(10): 2071-2075.
[30] 康丽, 郭建博, 廉静, 等. 介体厌氧催化活性艳红K-2BP脱色及构效特性研究[J]. 环境科学, 2011, 32(4): 1060-1065.
KANG Li, GUO Jianbo, LIAN Jing, et al. Catalyst effect and the structure-activity characteristics of redox mediators on the reactive brilliant red K-2BP decolorization[J]. Environmental Science, 2011, 32(4): 1060-1065.
Research of the influencing factors of the immobilized redox mediators accelerating Cr(Ⅵ) reduction by Escherichia coli BL21
PING Jiapeng1,2, XU Zhifang3, GUO Yankai1,2, GUO Jianbo4, LIAN Jing1,2
(1.School of Environmental Science and Engineering, Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China; 2.Pollution Prevention Biotechnology Laboratory of Hebei Province, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018,China; 3.Shang’an Power Plant, Huaneng Power International Inc., Shijiazhuang, Hebei 050000, China; 4.Tianjin Key Laboratory of Aquatic Science and Technology, School of Environmental and Municipal Engineering, Tianjin Chengjian University, Tianjin 300384, China)
In order to study the influencing factors of non-dissolved redox mediators on Cr (Ⅵ) bioreduction, the accelerating effect of non-dissolved redox mediators immobilized by cellulose acetate (CA) on the reduction of Cr(Ⅵ) byEscherichiacoliBL21 is investigated. The results show that the accelerating order is 1-chloroanthraquinone>1,5-dichloroanthraquinone>2-chloroanthraquinone>1,8-dichloroanthraquinone>anthraquinone>1,4,5,8-tetrachloroanthtaquinone; the optimal concentration of 1-chloroanthraquinone pH and initial Cr(Ⅵ) concentration are 0.048 mol/L, 7.00 and 30 mg/L, respectively; the removal rate increases with the increasing temperature when it is in the range of 20~60 ℃; after 6 times of recycling experiments, and the Cr(Ⅵ) bioreduction rate with the immobilized 1-chloroanthraquinone maintains above 5 times of margin bacterium's. It indicates that non-dissolved redox mediators immobilized by CA can effectively accelerate the reduction rate of Cr(Ⅵ) byEscherichiacoliBL21, which has favourable application value.
water pollution control engineering; Cr(Ⅵ); redox mediators; bioreduction; immobilization
X712
A
2017-05-03;
2017-07-13;责任编辑:王海云
国家自然科学基金(51208170)
平佳芃(1993—),女,河北石家庄人,硕士研究生,主要从事水处理方面的研究。
廉 静副教授。E-mail:ningjingzhiyuan98@163.com
平佳芃,许志芳,郭延凯,等.固定化氧化还原介体加速EscherichiacoliBL21还原Cr(Ⅵ)的影响因素研究[J].河北科技大学学报,2017,38(5):493-498.
PINGJjiapeng,XU Zhifang,GUO Yankai,et al. Research of the influencing factors of the immobilized redox mediators accelerating Cr(Ⅵ) reduction byEscherichiacoliBL21[J].Journal of Hebei University of Science and Technology,2017,38(5):493-498.
