相变吸收剂捕集二氧化碳的研究进展
2017-11-04边阳阳申淑锋
边阳阳,申淑锋
(河北科技大学化学与制药工程学院,河北石家庄 050018)
1008-1542(2017)05-0460-09
10.7535/hbkd.2017yx05008
相变吸收剂捕集二氧化碳的研究进展
边阳阳,申淑锋
(河北科技大学化学与制药工程学院,河北石家庄 050018)
人类工业活动排放的大量CO2气体是导致全球变暖的主要因素,CO2捕集、封存与利用(CCUS)是实现碳减排和应对全球变暖最有效的技术方向。常用的CO2捕集技术中,采用有机胺类化学吸收剂的水溶液捕集CO2面临的主要技术难题是再生能耗高,如何降低能耗将直接关系到CCUS技术的未来走向。相变吸收剂在吸收CO2时具有优异的吸收特性,而且可分离为液-液或液-固两相,其中一相富集CO2,在降低能耗方面呈现出较大优势。通过对传统有机胺水溶液脱除CO2工艺的能耗结构进行分析,综述了CO2相变吸收体系在碳捕集方面的研究现状,并对相变吸收剂的研究动向和技术发展前景进行了展望:探索相变吸收剂的相变机理,解决其组成和工艺稳定性问题;开展微胶囊、极性摆动等新型吸收剂和耐热酶、固体酸等催化再生技术方面的研究。
吸收;二氧化碳;相变吸收剂;二氧化碳捕集;再生能耗
全球气温升高以及气候变化是当今非常严重且受关注的环境问题,科学界普遍认为人类工业活动排放的大量CO2气体是导致全球变暖的主要因素[1-2]。2015年,全球化石燃料及工业CO2排放总量约363亿t,燃烧化石燃料碳排放占总量的40%~45%,其中中国排放104亿t,约占全球总量的29%。中国作为主要的CO2排放国之一,限制CO2排放行动刻不容缓。CO2捕集、封存与利用(CCUS)是实现碳减排和应对全球变暖最有效的技术方向。燃烧后化学溶剂捕获是分离燃煤电厂烟道气CO2常用且较成熟的技术之一,也是目前CCUS项目示范运行的热点方向[3-4]。目前有机胺或醇胺水溶液捕集CO2工艺再生能耗为3.7~4.0 GJ/t,再生过程中的能耗成本占总捕集成本的60%~80%[5],高能量需求制约了CO2捕集项目的规模化发展与应用。近年来具有大幅降低再生能耗潜力的相变吸收剂受到了广泛关注与研究[6-8]。本文分析了传统化学溶剂吸收工艺脱除CO2过程的能耗结构,综述了近年来CO2相变吸收剂的研究现状,同时对相变吸收剂的研究方向和技术前景进行了展望。
1 传统化学溶剂脱除CO2工艺
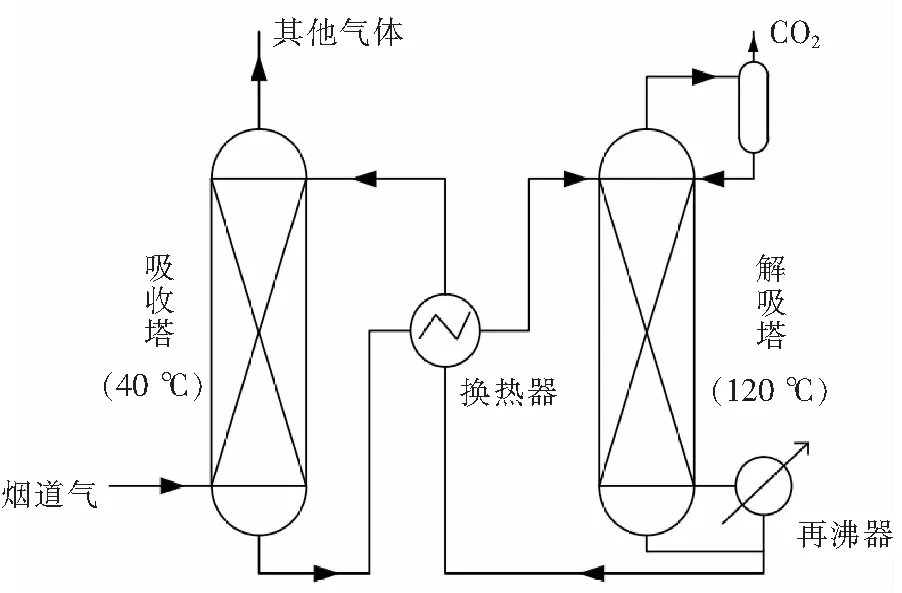
图1 有机胺水溶液脱除CO2工艺流程Fig.1 Process of removal CO2 using aqueous amine-based solution
化学溶剂吸收法是最常用且较成熟的分离富集CO2的方法,其实质是利用碱性溶液与CO2气体发生化学反应进行吸收,通过高温解吸实现CO2富集以及溶剂的再生。目前,工业上常用的化学吸收剂是有机胺或醇胺水溶液,典型的吸收剂是单乙醇胺(MEA)[5,9]。化学溶剂捕集CO2工艺流程如图1所示。火电厂烟道气经过预处理后进入吸收塔底部,吸收剂从塔顶喷淋而下,与烟道气逆向接触吸收,吸收温度约为40 ℃,吸收后的烟道气从塔顶排出,将CO2富液从吸收塔塔底输送至解吸塔进行高温(约120 ℃)解吸,脱除CO2后的贫液降温后被输送至吸收塔塔顶进行循环使用。在解吸阶段,大量汽化水分与CO2一起在解吸塔顶冷凝进而分离纯化CO2,需要消耗大量的热量和冷量,再生能耗较高[6,9-10]。目前国内外燃煤电厂及大型示范性项目,如中国华能集团上海石洞口电厂、加拿大SaskPower BD3、全球最大的美国德克萨斯州WA Parish火电站“Petra Nova”碳捕集项目等,均采用有机胺法脱除CO2。醇胺溶液脱除CO2工艺再生能耗普遍约为3.7 GJ/t,中国华能集团优化的捕集CO2工艺可把能量消耗降低到3.4~3.6 GJ/t[5,11]。
通过对吸收剂水溶液负载CO2后再生能耗(QR)的分析可知,能量主要用于3个方面(见式1):1)CO2吸收反应热;2)溶液升温到解吸温度所需要的显热;3)蒸发大量水分所需要的汽化潜热,其中50%~70%的能量用于加热溶液的显热和蒸发水分需要的潜热。在化学吸收剂挥发性较大时,还需考虑再生温度下蒸发化学吸收剂所需要的潜热。
(1)
目前化学溶剂脱除CO2工艺中吸收剂的水分含量为60%~70%,解吸塔(温度120 ℃)水气分压较高,汽化水分会消耗大量的热量,再生能耗高。为了降低碳捕集能耗,研究人员对选择不同结构的化学吸收剂来降低吸收热、提高吸收剂浓度等方法进行了大量研究,但其对降低碳捕集的能耗也是相当有限的。
2 相变吸收剂CO2捕集及研究现状

图2 相变吸收剂脱除CO2工艺流程Fig.2 Process of removal CO2 using phase change absorbents
近年来,相变吸收剂吸收CO2技术受到了广大研究者的关注与青睐。相比于传统的有机胺或醇胺水溶液,相变吸收剂的优势在于吸收剂负载了CO2后可形成明显特征的两相,即CO2富相和CO2贫相,因此仅需解吸CO2富相便可实现溶剂的再生循环。相变吸收剂捕集CO2工艺流程如图2所示。气液逆流吸收,负载CO2的溶液被输送至分离器进行分离后,仅CO2富相进入解吸塔进行高温再生,随后与CO2贫相混合,循环使用。该工艺避免了蒸发大量溶剂,减少了溶液循环用量以及再生过程中溶剂的汽化量[6-7,12-13]。相变吸收剂主要分为液-固相变和液-液相变2个体系,以下对近几年国内外研究的不同类型的相变吸收剂进行分类评述,并对具有代表性的相变吸收剂进行简单介绍。
2.1 液-固相变吸收剂
这类体系常见于均相溶液吸收一定量的CO2后能够产生固相沉淀,其中固相富集大部分的CO2。研究表明,富含CO2的固相的产生可以增加CO2的负载容量,加快吸收速率以及降低溶剂循环量等。目前,液-固相变吸收剂主要包含氨基酸盐溶液、碳酸钾溶液、冷氨溶液等水性溶液以及一些基于非水溶剂的胺类溶液,主要特性见表1[14-39]。

表1 液-固相变吸收剂
2.1.1 基于水体系的液-固相变吸收剂
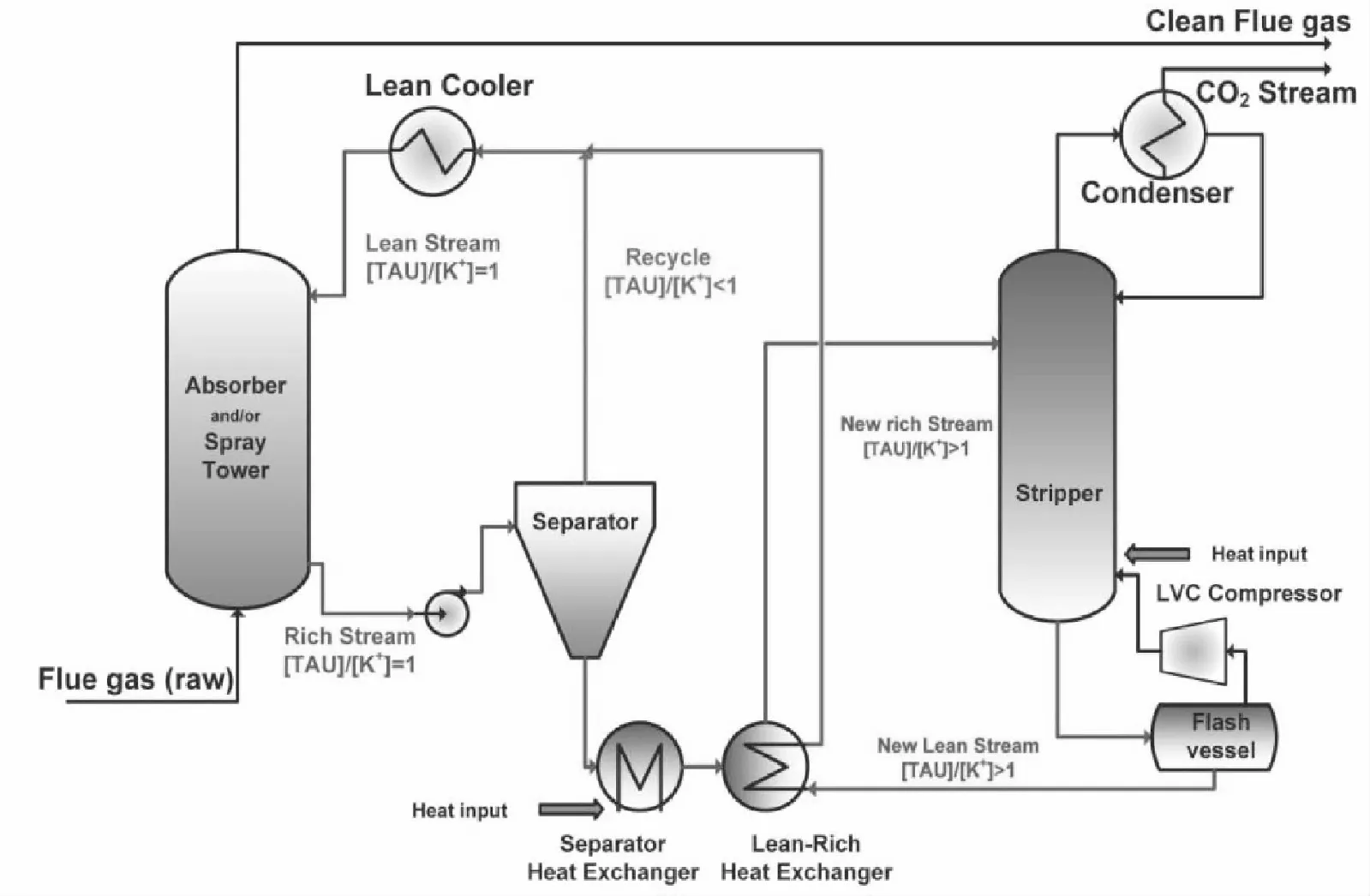
图3 牛磺酸钾沉淀的DECAB Plus过程Fig.3 DECAB Plus based on precipitation potassium taurate
氨基酸盐绿色无污染,具有和醇胺相同的氨基官能团,其反应活性以及热稳定性高、难挥发等优点受到了广大研究者的青眛[14-19]。近年来研究发现,部分氨基酸盐溶液吸收CO2后会产生富集CO2的固相沉淀,给氨基酸盐工艺降低再生能耗研究提供了新思路。WANG等[20]发现了丙氨酸水溶液吸收CO2后的液固分相现象,发现约90%的CO2以碳酸氢盐的形式富集于固相沉淀中,对分离出的固相进行解吸循环,负载量可达0.62(mol CO2/mol Ala)。FERNANDEZ[21-24]等提出了4.0 mol/L牛磺酸钾盐水溶液的DECAB Plus沉淀工艺,如图3所示。同时研究发现,牛磺酸钾溶液吸收CO2的过程中固相沉淀的产生有利于溶液负载量的增加,解吸能耗从醇胺溶液(MEA)3.7 GJ/t降低到了2.4 GJ/t。此外,研究表明,高浓度的肌氨酸钾和脯氨酸钾水溶液吸收CO2后也存在富集CO2沉淀的现象[25-26]。
碳酸钾溶液具有低毒、吸收热低、热稳定性好以及成本低等优势,因而在高温高压的吸收体系中得到了长足发展。近年来,墨尔本大学等研究机构致力于将高浓度碳酸钾体系应用于燃烧后CO2捕集的研究,提出了基于碳酸钾溶液的沉淀工艺——UNO MK3, 该系统的CO2处理量可达1 t/d。碳酸钾溶液吸收CO2后经过冷却降温使碳酸氢钾沉淀出来,后序再进行固液分离,继而高温分解碳酸氢钾释放出CO2,生成的碳酸钾循环使用。UNO MK3工艺减少了再生过程的水分汽化量,再生能耗从无沉淀工艺的3.0 GJ/t降低到约2.5 GJ/t[27-28]。
冷氨水溶液捕集CO2的过程最早由GAL提出。与传统的吸收剂单乙醇胺(MEA)相比,冷氨水溶液具有难氧化、能量利用率高、吸收热低以及溶剂损失小等优点。冷氨溶液捕集过程与传统工艺相似,气液逆流吸收,负载CO2的低温(2~10 ℃)氨水溶液在塔底形成沉淀,沉淀富液被输送至解吸塔高温(110~150 ℃)解吸[29]。GAZZANI等[30]的研究结果表明,具有沉淀特性的冷氨水溶液工艺比无沉淀的氨水工艺总能耗降低10%。DARDE等[31]进一步研究了冷氨溶液吸收CO2的工艺,结果表明氨水溶液吸收热低,解吸塔的热量需求约2 GJ/t。
2.1.2 基于非水溶剂的液-固相变吸收剂
近年来,研究人员尝试采用一些非水溶剂来代替水溶液进行捕集CO2的研究。利用有机溶剂代替水溶液具有如下优点:1)减少设备腐蚀性;2)加快反应速率,如CO2在乙醇中的溶解度高于水中;3)降低解吸温度。非水溶剂环境下反应产物以氨基甲酸盐为主,且氨基甲酸盐的分解温度较低。BARZAGLI等[32]研究了NH3在乙醇、1-丙醇和N,N-二甲基甲酰胺(DMF)等有机溶剂中吸收CO2的过程,结果发现固相中氨基甲酸盐的含量可达54%。PERRY等[33]考察了1,3-双(3-氨基丙基)-1,1,3,3-四硅氧烷(GAP-0)吸收CO2的过程,结果发现GAP-0吸收剂负载CO2后,由一个低黏度的液体变成了富集大量CO2的固体,并且初步工艺模型显示该工艺把能耗从MEA工艺的30%降低到了18%。RAHMAN等[34]为了实现捕集CO2的高效性,将醇胺吸收速率快以及室温离子液体的热稳定性好、沸点高等优势相结合,探索了二乙醇胺(DEA)和2-氨基-2-甲基-1-丙醇(AMP)以室温离子液体作溶剂的新型相变吸收剂,溶液吸收CO2后生成了易分离的液固两相。分析表明,沉淀物主要为DEA-氨基甲酸和AMP-氨基甲酸,解吸温度分别为55 ℃和75 ℃,在降低解吸能耗方面表现出了巨大优势。ZHANG等[35]研究了功能性离子液体[N1111][Gly]和DMEE混合吸收剂,结果表明上清液以DMEE类为主,固相主要为吸收了CO2的甘氨酸四甲基胺,DMEE的加入降低了吸收剂的黏度,加快了吸收速率并且增大了负载容量,353 K下的解吸效率高达97%,具有良好的循环使用性能。ZHENG等[36]在三乙烯四胺(TETA)-乙醇体系吸收CO2的研究上做了大量工作,研究结果发现TETA-乙醇体系吸收CO2后,生成的固相富含了吸收CO2量的81.8%,沉淀物为TETA-氨基甲酸,分解温度约为90 ℃;同时,TETA-乙醇体系吸收速率是TETA-水体系的2倍以上,但是过程中对于大量溶剂的损失仍需进一步加以研究解决。张政[37]进行了有机胺非水体系相变吸收CO2的研究,研究发现DETA,TETA和TEPA在乙醇、二乙二醇二甲醚、N-甲基吡咯烷酮等有机溶剂中吸收CO2后均实现了液固分相,并且吸收速率快、负载容量大,经进一步分析固体产物确定为相应的氨基甲酸盐,且固体产物的分解温度都低于相应胺的挥发温度,有望达到降低能耗的目的。针对氨基酸盐水溶液沉淀体系较窄的操作条件,申淑锋[38-39]等研究了脯氨酸钾盐乙醇溶液吸收CO2的特性,研究结果发现脯氨酸钾乙醇溶液在低CO2分压、低浓度下可产生液固分相,固相以氨基甲酸和碳酸氢盐形式富集了约60%的CO2,固相的产生大大增加了溶液的负载量,并且该吸收剂吸收速率快,具有良好的循环稳定性。氨基酸盐溶液环境友好、稳定性高、无毒兼具吸收容量大和吸收速率快等特点,其沉淀体系在降低能耗方面展现了巨大潜力。典型的相变吸收剂液固分离特征见图4。

图4 典型的液-固相变吸收剂Fig.4 Typical liquid-solid phase-change absorbents
2.2 液-液相变吸收剂
近年来,液-液相变体系得到大量研究和报道。溶液吸收CO2后形成两层特征明显的液相,其中一相包含吸收产物富集CO2。目前已报道的液-液相变吸收剂主要包含混合胺、温控亲脂性胺以及DMX-1TM等水体系吸收剂以及少量非水体系的液-液相变吸收剂,各吸收剂的主要特性见表2。
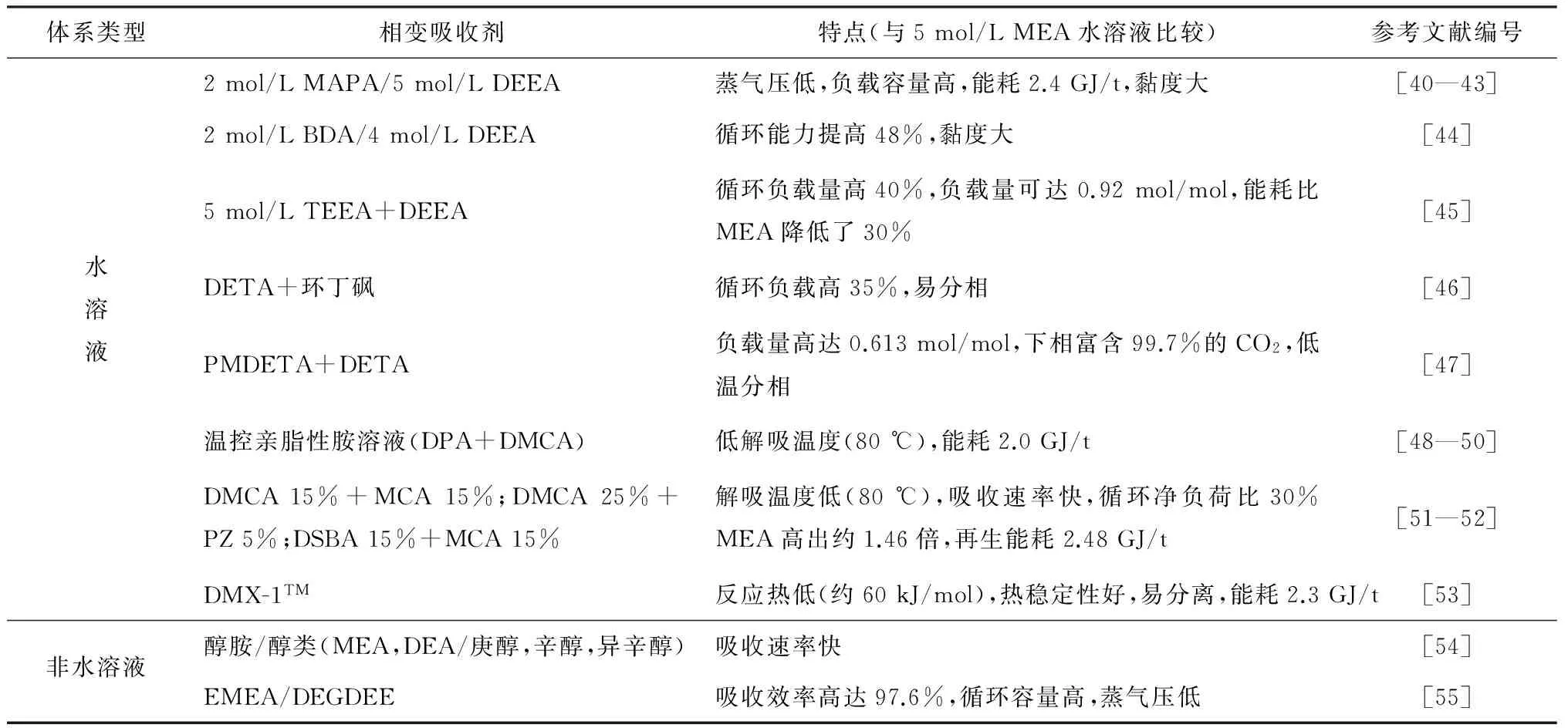
表2 液-液相变吸收剂
2.2.1 基于水体系的液-液相变吸收剂
用混合胺溶液进行CO2吸收时,溶液的吸收速率以及循环负载量显著增加。CIFTJA等[40]研究了DEEA-CO2-H2O,MAPA-CO2-H2O和DEEA-MAPA-CO2-H2O混合胺溶液,结果表明5 mol/L DEEA-2 mol/L MAPA水溶液吸收CO2后形成了2种液相,下相富含MAPA-氨基甲酸及碳酸氢盐,上相主要为DEEA及少量CO2。PINTO等[41-43]进一步研究了该体系的再生能耗,模拟数据显示再生过程中的能量消耗为2.4 GJ/t,低于30% MEA水溶液的3.7 GJ/t。XU等[44]筛选了不同浓度的BDA和DEEA混合吸收性能,结果发现2 mol/L BDA和4 mol/L DEEA混合水溶液循环负载量比MEA水溶液高48%,由于BDA与CO2的快速反应以及DEEA在反应产物中有限的溶解度,溶液形成了液液两相,上相主要为DEEA,下相以BDA-氨基甲酸和碳酸氢盐形式富集大部分CO2,进一步研究表明在总负载0.46 mol/mol条件下,下相中BDA,BDA-氨基甲酸和碳酸氢盐的比例分别为16.8%,55.8%和27.4%。YE等[45]结合单胺或多胺吸收速率快以及DMCA或DEEA促进解吸效率的优势,研究了50种混合胺水溶液30 ℃下的吸收和80 ℃下的解吸行为,筛选出了吸收CO2后具有液液相分离特性的TEEA+DEEA吸收剂,其中5 mol/kg TEEA+DEEA最高负载容量可达0.92 mol/mol,循环负载提高了40%,吸收热降低了15%,蒸发热降低了30%。LUO等[46]开展了DETA+环丁砜+水体系捕集CO2的研究,结果表明吸收CO2后,上相为水相,富含DETA和CO2,下相主要为环丁砜,同时考察了两相溶剂的循环过程,以20%DETA+40%环丁砜+40%水作为吸收剂,吸收后液液分相,占总量60%的上相(30%DETA+10%环丁砜+60%水)进行解吸,该过程溶液循环用量可减少40%,循环负载比30%的MEA溶液高35%。ZHOU等[47]探索了PMDETA-DETA液液相变溶剂,结果表明该吸收剂CO2负载量高达0.623 mol/mol,上相主要为PMDETA,下相占总体积的57%,以氨基甲酸以及碳酸氢盐的形式富含了99.7%的CO2;同时研究结果还表明在较低的温度(30~60 ℃)下,相变行为良好。
有机胺溶液的临界溶解温度与其结构中的疏水性烷基和亲水性氨基基团的水溶性相关,而基团的水溶性作用和温度也密切相关。控制温度变化,使基团间的自聚集作用增强有利于不同性质的两液相形成温控相变过程。温控亲脂性胺溶液(TBS)过程的典型溶液是DPA/DMCA水溶液。ZHANG等[48-50]对DPA/DMCA水溶液吸收CO2的过程进行了研究,溶剂吸收CO2后升温形成液液两相,上层为有机相,下层为水相,有机相中主要为胺类,水相中主要为氨基甲酸、碳酸氢盐以及质子化的胺,解吸温度约80 ℃,解吸能耗可降低到约2.0 GJ/t。汪明喜等[51-52]利用亲脂性胺相变促进再生以及混合胺原理,开展了以亲脂性胺N,N-二甲基环已胺(DMCA)二仲丁胺(DSBA)为基础试剂、MCA和PZ为活化剂的混合胺实验。结果表明,活化后的DMCA和DSBA胺类试剂能够在80 ℃下进行有效再生,且再生过程中相分层行为促进了再生的进行,同时添加的MCA以及PZ能够有效地改善吸收液的性能,提高循环净负荷。在与30% MEA对比实验中,15% DMCA+15% MCA溶液具有与之相当的吸收速率,且循环净负荷高出约1.46倍,具有较大的发展潜力。
2011年,IFP能源信息中心提出了一种基于液-液相变分离的CO2捕集技术。RAYNAL等[53]研究了1,3-二丙基-甲基黄嘌呤(DMX-1)溶剂,结果发现DMX-1溶剂拥有CO2吸收负载较高、热稳定性高以及两相分离快等优点,产生液液相变后,下相是富集CO2的水相,上相为有机相,具有液液分离特性的DMX-1吸收体系减少了解吸过程的溶液用量,经模拟能量消耗降低到了2.1 GJ/t。典型的液-液相变吸收剂吸收特征见图5。

图5 典型的液-液相变吸收剂Fig.5 Typical liquid-liquid phase-change absorbents
2.2.2 基于非水溶剂的液-液相变吸收剂
一些胺在醇类或醚类等非水溶剂中吸收CO2后也可呈现液液两相分离行为。KIM等[54]考察了醇胺(单乙醇胺MEA、二乙醇胺DEA)在醇类溶剂(1-庚醇、1-辛醇、异辛醇)中吸收CO2的行为,结果表明负载CO2后产生液液两相分离,上相为醇类等非水溶剂,下相为负载CO2的氨基甲酸和质子化的胺,并且DEA的非水溶剂体系CO2负载量随胺浓度的增加而增加。BARZAGLI等[55]对胺在非水溶剂中的吸收行为进行了筛选,发现MMEA/DEGDEE,EMEA/DEGDEE,MMEA/DEGDME这3种溶液吸收CO2后具有液液分相特性。经过对EMEA/DEGDEE溶液的进一步研究,结果表明上相为DEGDEE有机相,下相为氨基甲酸和质子化的胺,CO2富集在下相,下相解吸温度为110 ℃;同时EMEA/DEGDEE非水溶剂CO2负载量为0.52~0.54,吸收效率高达97.6%;与30% MEA水溶液相比,两相分离行为减少了溶液解吸用量,在降低能耗方面具有很大潜力。
3 结论与展望
化学吸收剂的再生性能是评价吸收剂的主要指标之一。再生能耗高是目前制约有机胺水溶液捕集CO2大规模应用的关键问题,如何降低能耗将直接关系到CCUS技术的未来走向。尽管CO2相变吸收剂处于试验研究和开发阶段,但利用吸收过程中形成的两相性质不同,特别是CO2在相间分配的差异性,仍有望大幅降低碳捕集能耗,为推进低能耗吸收剂的研究提供一种新型的方案和思路。
与现有成熟的醇胺吸收剂工艺相比,液-液或固-液相变吸收剂的优势突出,但要付于实践应用,今后相变吸收剂的研究仍需要解决或考虑以下问题。
1) 高反应活性环境友好吸收剂的选择仍是重要指标,要构建良好相变特性的吸收体系,使吸收相变容易、操作窗口宽,同时保持较高的CO2吸收速率和容量。另外非水相变体系还要考虑溶剂的挥发性问题。
2) 相比传统工艺,相变捕集技术将增加工艺操作步骤(如相分离和CO2富相再生后的混合过程等),保持工艺的稳定性和连续性问题将更加突出,应合理选择吸收塔和解吸塔的类型,特别是对于固-液相变过程。
3) 充分考虑相变吸收剂处理CO2应用领域的差异性,如处理生物气和燃烧前的合成气等可采用非水相变体系;但对于燃煤电厂燃烧后烟气水含量较多时,则要考虑使用非水相变体系的可行性,或水含量对吸收相变过程的影响等因素。
在降低再生能耗方面,除了采用相变吸收技术,一些新型吸收剂和再生技术在未来研究中也应该给予重视。对于功能化离子液体、溶剂核-高渗透性能壳结构的微胶囊溶剂、极性摆动辅助功能溶剂等研究不仅要着眼于溶剂体系组成的优化,同时要考虑如何克服或降低这些体系在实际应用中面临的缺点或不利因素,如黏度高、溶剂成本高和杂质对微胶囊壳孔堵塞等。催化技术的应用,特别是耐热酶、固体酸等催化剂在提高再生速率的同时还可以降低再生活化能、再生温度等,也是化学溶剂法碳捕集工艺的重要技术方向。
/
[1] 李小森, 鲁涛. 二氧化碳分离技术在烟气分离中的发展现状[J]. 现代化工, 2009, 29(4): 25-30.
LI Xiaosen, LU Tao. Present development situation of techniques separating carbon dioxide separation techniques infrom flue gas separation[J]. Modern Chemical Industry, 2009, 29(4): 25-30.
[2] 费维扬,艾宁,陈健. 温室气体CO2的捕集和分离——分离技术面临的挑战与机遇[J]. 化工进展, 2005, 24(1): 1-4.
FEI Weiyang, AI Ning, CHEN Jian. Capture and separation of greenhouse gases CO2:The challenge and opportunity for separation technology[J]. Chemical Industry and Engineering Progress, 2005, 24(1): 1-4.
[3] PACHAURI R K, REISINGER A, Core Writing Team. Climate Change 2007: Synthesis Report[R]. Geneva:[s.n.], 2007.
[4] 申淑锋. 基于碳酸钾溶液吸收CO2的研究进展[J].河北科技大学学报,2013,34(2):142-146.
SHEN Shufeng. Research progress in carbon dioxide absorption with aqueous potassium cabonate-based solutions[J]. Journal of Hebei University of Science and Technology, 2013, 34(2):142-146.
[5] IDEM R, SUPAP T, SHI H, et al. Practical experience in post-combustion CO2capture using reactive solvents in large pilot and demonstration plants[J].Int J Greenh Gas Control, 2015, 40: 6-25.
[6] BUDZIANOWSKI W M. Explorative analysis of advanced solvent processes for energy efficient carbon dioxide capture by gas-liquid absorption[J].Int J Greenh Gas Control, 2016,49: 108-120.
[7] 张政,刘彪,覃显业,等. 相变溶剂吸收CO2研究进展[J]. 材料导报(A刊:综述篇),2014,28(11):94-99.
ZHANG Zheng, LIU Biao, QIN Xianye, et al. Progress in CO2capture using phase-changing solvents[J]. Stanford Materials(A: Summary), 2014,28(11):94-99.
[8] 方梦祥,周旭萍,王涛,等. CO2化学吸收剂[J]. 化学进展,2015,27(12):1808-1814.
FANG Mengxiang, ZHOU Xuping, WANG Tao, et al. Solvent development in CO2chemical absorption[J]. Progress in Chemistry, 2015, 27(12):1808-1814.
[9] ROCHELLE G T. Amine scrubbing for CO2capture[J]. Science, 2009, 325(5948):1652-1654.
[10] LIANG Z, RONGWONG W, LIU H, et al. Recent progress and new developments in post-combustion carbon capture technology with reactive solvents[J].Int J Greenh Gas Control, 2015, 40: 26-54.
[11] HUANG B, XU S, GAO S, et al. Industrial test and techno-economic analysis of CO2capture in Huaneng Beijing coal-fired power station[J]. Applied Energy, 2010, 87: 3347-3354
[12] 安山龙,汪黎东,于松华,等. 相变溶剂捕集CO2技术的研究进展[J]. 化工环保,2017,37(1):31-37.
AN Shanlong, WANG Lidong, YU Songhua, et al. Research progresses in CO2capture technology using phase change solvents[J]. Environmental Protection of Chemical Industry, 2017, 37(1):31-37.
[13] MUMFORD K A, WU Y, SMITH K H. Review of solvent based carbon-dioxide capture technologies[J].Front Chem Sci Eng, 2015,9: 125-141.
[14] SHEN S, YANG Y, WANG Y, et al. CO2absorption into aqueous potassium salts of lysine and proline: Density, viscosity and solubility of CO2[J].Fluid Phase Equilib, 2015, 399: 40-49.
[15] BIAN Y, SHEN S, ZHAO Y, et al. Physicochemical properties of aqueous potassium salts of basic amino acids as absorbents for CO2capture[J]. J Chem Eng Data,2016,61: 2391-2398.
[16] SHEN S, YANG Y, BIAN Y, et al. Kinetics of CO2absorption into aqueous basic amino acid salt: Potassium salt of lysine solution[J]. Environ Sci Technol,2016,50: 2054-2063.
[17] SHEN S, FENG X, ZHAO R, et al. Kinetic study of carbon dioxide absorption with aqueous potassium carbonate promoted by arginine[J]. Chem Eng Journal,2013,222: 478-487.
[18] MAJCHROWICZ M E, KERSTEN S, BRILMAN W. Reactive absorption of carbon dioxide inL-prolinate salt solutions[J]. Ind Eng Chem Res,2014,53: 11460-11467.
[19] van HOLST J, VERSTEEG G F, BRILMAN D W F, et al. Kinetic study of CO2with various amino acid salts in aqueous solution[J]. Chem Eng Sci,2009,64: 59-68.
[20] WANG X, AKHMEDOV N G, HOPKINSON D, et al. Phase change amino acid salt separates into CO2-rich and CO2-lean phases upon interacting with CO2[J]. Applied Energy,2016,161: 41-47.
[21] FERNANDEZ E S, HEFERNAN K, van DERHAM L, et al. Conceptual design of a novel CO2capture process based on precipitating amino acid solvents[J]. Ind Eng Chem Res,2013,52: 12223-12235.
[22] FERNANDEZ E S, MERCADER F D M, MISISK K, et al. New process concepts for CO2capture based on precipitation amino acids[J]. Energy Procedia,2013,37: 1160-1171.
[23] FERNANDEZ E S, HEFERNAN K, van DERHAM L, et al. Analysis of process configurationsfor CO2capture by precipitating amino acid solvents[J]. Ind Eng Chem Res,2014,53: 2348-2361.
[24] FERNANDEZ E S, HEFERNAN K, van DERHAM L, et al. Precipitating amino acid solvents for CO2capture:Opportunities to reduce costs in post combustion capture[J]. Energy Procedia,2014,63: 727-738.
[25] MAJCHROWICZ M E, BRILMAN D W F, GROENEVELD M J. Precipitation regime for selected amino acid salts for CO2capture from flue gases[J].Energy Procedia,2009,1(1):979-984.
[26] ARONU U E, KIM I, HAUGEN G. Evaluation of energetic benefit for solid-liquid phase change CO2absorbents[J]. Energy Procedia,2014,63: 532-541.
[27] ANDERSON C, HARKIN T, HO M, et al. Developments in the CO2CRC UNO MK 3 Process:A multi-component solvent process for large scale CO2capture[J]. Energy Procedia,2013,37: 225-232.
[28] SMITH K, XIAO G, MUMFORD K, et al. Demonstration of aconcentrated potassium carbonate process for CO2capture[J]. Energy Fuels,2014,28: 299-306.
[29] GAL E. Ultra Cleaning of Combustion Gas Including the Removal of CO2[P]. WO:022885,2006-02-03.
[30] GAZZANI M, SUTTER D, MAZZOTTI M. Improving the efficiency of a chilled ammonia CO2capture plant through solid formation: A thermodynamic analysis[J]. Energy Procedia,2014,63: 1084-1090.
[31] DARDE V, THOMSEN K, van WELL W J M, et al. Chilled ammonia process for CO2capture[J]. Int J Greenhouse Gas Control,2010,4: 13-16.
[32] BARZAGLI F, MANI F, PERUZZINI M. From greenhouse gas to feedstock: Formation of ammonium carbamate from CO2and NH3in organic solvents and its catalytic conversion into urea under mild conditions[J]. Green Chem,2011,13: 1267-1274.
[33] PERRY R J, WOOD B R, GENOVESE S, et al. CO2capture using phase-changing sorbents[J]. Energy Fuels,2012,26: 2528-2538.
[34] RAHMAN M, SIAJ M, LARACHI F. CO2capture in alkanolamine/room-temperature ionic liquid emulsions: A viable approach with carbamate crystallization and curbed corrosion behavior[J]. Int J Greenhouse Gas Control,2012,6: 246-252.
[35] ZHANG F, GAO K, MENG Y, et al. Intensification of dimethyaminoethoxyethanol on CO2absorption in ionic liquid of amino acid[J]. International Journal of Greenhouse Gas Control,2016,51: 415-422.
[36] ZHENG S, TAO M, LIU Q, et al. Capturing CO2into the precipitate of a phase-changing solvent after absorption[J]. Environ Sci Technol,2014,48: 8905-8910.
[37] 张政. 有机胺非水体系相变吸收CO2研究[D]. 昆明:昆明理工大学, 2016.
[38] 申淑锋,边阳阳,赵月. 用于气体混合物中脱除二氧化碳的非水吸收剂[P]. 中国专利: 201610329274.4, 2016.
[39] SHEN S F, BIAN Y Y, ZHAO Y. Energy-efficient CO2capture using potassium prolinate/ethanol solution as a phase-changing absorbent[J].Int J Greenh Gas Control, 2017, 56: 1-11.
[40] CIFTJA A, HARTONO A, SVENSDEN H F. Experimental study on phase change solvents in CO2capture by NMR spectroscopy[J]. Chemical Engineering Science,2013,102: 378-386.
[41] LIEBENTHAL U,PINTO D, MONTEIRO J, et al. Overall process a nalysis and optimisation for CO2capture from coal fired power plants based on phase change solvents forming two liquid phases[J]. Energy Procedia,2013,37: 1844-1854.
[42] PINTO D, ZAIDY S, HARTONO A, et al. Evaluation of a phase change solvent for CO2capture: Absorption and desorption tests[J]. Int J Greenh Gas Control,2014,28: 318-327.
[43] PINTO D, KNUUTILA H, FYTIANOS G, et al. CO2post combustion capture with a phase change solvent pilot plant campaign[J]. International Journal of Greenhouse Gas Control,2014,31: 153-164.
[44] XU Z, WANG S, CHEN C. CO2absorption by biphasic solvents: Mixtures of 1,4-butanediamine and 2-(diethylamino)-ethanol[J]. Int J Greenhouse Gas Control,2013,16: 107-115.
[45] YE Q, WANG X, LU Y. Screening and evaluation of novel biphasic solvents for energy-efficient post-combustion CO2capture[J]. Int J Greenh Gas Control,2015,39: 205-214.
[46] LUO W, GUO D,ZHENG J, et al. CO2absorption using biphasic solvent: Blends of diethylenetriamine, sulfolane and water[J]. Int J Greenhouse Gas Control,2016,53: 141-148.
[47] ZHOU X, LIU F, LYU B, et al. Evaluation of the novel biphasic solvents for CO2capture: performance and mechanism[J]. Int J Greenhouse Gas Control,2017,60: 120-128.
[48] ZHANG J, NWANI O, TAN Y, et al. Carbon dioxide absorption intobiphasic amine solvent with solvent loss reduction[J]. Chem Eng Res Des,2011,89: 1190-1196.
[49] ZHANG J, QIAO Y, AGAR D W. Intensification of low temperature thermomorphic biphasic amine solvent regeneration for CO2capture[J]. Chem Eng Res Des,2012,90: 743-749.
[50] ZHANG J, QIAO Y, WANG W, et al. Development of an energy-efficient CO2capture process using thermomorphic biphasic solvents[J]. Energy Procedia,2013,37: 1254-1261.
[51] 汪明喜,方梦祥,汪桢,等. 相变吸收剂对CO2吸收与再生特性[J]. 浙江大学学报(工学版),2013,47(4):662-668.
WANG Mingxi, FANG Mengxiang, WANG Zhen, et al. CO2absorption and desorption by phase transition lipophilic amine solvent[J]. Journal of Zhejiang University(Engineering Science), 2013, 47(4):662-668.
[52] 汪明喜. 基于燃煤烟气CO2捕集的相变吸收剂试验研究[D]. 杭州:浙江大学, 2013.
WANG Mingxi. Experimental Study of Phase Transition Solvents for CO2Capture from Coal-fire Flue Gas[D]. Hangzhou:Zhejiang University, 2013.
[53] RAYNAL L, PASCAL A, BOUILLON P A, et al. The DMX process: An original solution for lowering the cost of post-combustion carbon capture[J]. Energy Procedia,2011,4: 779-786.
[54] KIM Y E, PARK J H, YUN S H, et al. Carbon dioxide absorption using a phase transitional alkanolamine-alcohol mixture[J]. Journal of Industrial and Engineering Chemistry,2014,20: 1486-1492.
[55] BARZAGLI F, MANI F, PERUZZINI M. Novel water-free biphasic absorbents for efficient CO2cpture[J]. Int J Greenhouse Gas Control,2017,60: 100-109.
Research progress in carbon dioxide capture using phase-change absorbents
BIAN Yangyang, SHEN Shufeng
(School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
The emission of CO2gas by human industrial activity is the main factor that contributes to global warming, while the CO2capture, storage and utilization (CCUS) are the most effective technical direction to achieve carbon reduction and fight against global warming. In commonly used CO2capture technologies, the main technical difficulty in the use of aqueous solutions of organic amine absorbent for CO2capture is that the renewable energy consumption is high. How to reduce the energy consumption has the direct bearing on the CCUS technology's future development. Phase-change absorbents have excellent absorption characteristics in absorbing CO2, and can be separated into liquid-liquid or liquid-solid two-phase. One of the two-phase is enriched by CO2, which presents a significant advantage in reducing energy consumption. Through analysis of the structure of energy consumption of CO2removal process using the traditional organic amine solutions, the research status of CO2phase change absorption system on carbon capture is reviewed. The phase transformation research trends and development prospects of the absorbents are provided, which is to explore the phase transformation mechanism of phase change absorbents, and to solve the problems of the composition and process stability; to research catalytic regenerative technologies of new type absorbents, heat resistant enzyme and solid acid such as microcapsules and polar oscillations.
absorption; carbon dioxide; phase-change absorbent; CO2capture; heat duty for regeneration
TQ028.1
A
2017-06-02;
2017-07-19;责任编辑:张士莹
河北省自然科学基金(B2015208067);河北省高等学校科学技术研究项目(QN2015070)
边阳阳(1992—),男,河北衡水人,硕士研究生,主要从事燃煤烟气CO2捕集方面的研究。
申淑锋教授。E-mail: sfshen@hebust.edu.cn
边阳阳,申淑锋.相变吸收剂捕集二氧化碳的研究进展 [J].河北科技大学学报,2017,38(5):460-468.
BIAN Yangyang, SHEN Shufeng.Research progress in carbon dioxide capture using phase-change absorbents[J].Journal of Hebei University of Science and Technology,2017,38(5):460-468.
