唑基离子液体的脱硫性能研究
2017-11-04程刘备刘硕磊张向京王建英
程刘备,刘硕磊,张向京,2,王建英,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药物化工工程技术研究中心,河北石家庄 050018)
1008-1542(2017)05-0445-08
10.7535/hbkd.2017yx05006
唑基离子液体的脱硫性能研究
程刘备1,刘硕磊1,张向京1,2,王建英1,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药物化工工程技术研究中心,河北石家庄 050018)
为了研究在离子液体阴、阳离子上添加功能基团,达到更好地吸收SO2的效果,以1,1,3,3-四甲基胍和三氮唑为原料,合成了三氮唑胍盐离子液体(简写为[TMG][Triz]),对其脱硫性能进行了系统研究,探讨了离子液体[TMG][Triz]的脱硫性能及脱硫机理。结果表明,离子液体[TMG][Triz]具有良好的脱硫及再生性能。在常压、20 ℃条件下,1 mol离子液体[TMG][Triz]吸收2.964 mol的SO2;随着温度的升高,离子液体[TMG][Triz]的脱硫能力逐渐下降;摩尔吸收比随着SO2分压的增加而增加;130 ℃条件下,对吸收饱和后的离子液体进行解吸,解吸率达到95%以上。研究表明,离子液体[TMG][Triz]对SO2的吸收同时存在化学吸收和物理吸收2种作用,研究结果对提高烟气处理效率具有一定的参考价值。
吸收;三氮唑胍盐;脱硫;解吸;脱硫机理
使用化石燃料导致的空气污染问题一直是人们关注的焦点,其燃烧排放的SO2经空气中的粉尘催化氧化后与水结合形成酸雨,不仅严重破坏了人类赖以生存的生态环境[1-4],导致土壤和水系酸化,腐蚀建筑和设备,还严重危害着人类的健康。此外,SO2也是一种宝贵的资源。所以,捕集工业烟气中的SO2并加以回收利用意义重大[5-6]。离子液体(ILs)作为一种环境友好型溶剂,在酸性气体处理领域的优势日益引起人们的广泛关注,因其具有熔点低、液程宽的特点,故可实现SO2气体的低温吸收和高温解吸;其极低的蒸气压与较高的热稳定性[7-9]可以避免因吸收剂挥发而造成的损失和二次污染;其可设计性优异,通过阴、阳离子的调控可合成性能更好的材料。离子液体的这些优良特性使其与传统脱硫剂相比优势突出,同时符合当今绿色科学发展的大方向,因此离子液体脱硫在烟气处理领域具有广阔的发展前景[10]。
目前,人们致力于研究在离子液体的阴离子或阳离子上添加功能基团,以达到更好吸收SO2的效果[11-15]。WU等[16]合成了四甲基胍乳酸离子液体,并测定了其在 1.2×105Pa,40 ℃条件下的SO2摩尔吸收量为1.7 mol;CUI等[17]设计合成了一系列唑基功能化离子液体[18],并测定了其脱硫性能。研究表明,唑基离子液体可以高容量捕集SO2的原因是其阴离子与SO2之间的多位点作用。
本研究以1,1,3,3-四甲基胍和三氮唑为原料,合成了以1,1,3,3-四甲基胍为阳离子、三氮唑为阴离子的离子液体——三氮唑胍盐离子液体(简写为 [TMG][Triz]),测定了纯离子液体在293.15~333.15 K下的密度、黏度,以及其脱硫前后的密度、黏度变化,系统探讨了离子液体[TMG][Triz]的脱硫性能及其循环使用性能,在此基础上通过核磁、红外等表征手段探讨了其脱硫机理。
1 实验部分
1.1 主要试剂和仪器
1,1,3,3-四甲基胍,三氮唑,无水乙醇(分析纯),SO2气体,N2气体。
DF-101S型集热式恒温加热磁力搅拌器,DZF-6050型真空干燥箱,RE-2000B型旋转蒸发器,FTS135型傅里叶变换红外光谱仪,AVANCE 500 MHz型核磁共振仪,DCAT11EC型表面张力仪,Lovis2000M微量黏度计。
1.2 离子液体[TMG][Triz]的合成
通过一步中和反应得到离子液体[TMG][Triz],合成步骤具体如下。将盛有200 mL无水乙醇的500 mL三口烧瓶置于0 ℃恒温水浴锅中,开启磁力搅拌,加入0.25 mol的1,1,3,3-四甲基胍,然后将0.25 mol的三氮唑分成若干份,分批加入到三口瓶中,在冰水浴下搅拌反应12 h。 反应结束后,将反应后的混合物在80 ℃下通过旋转蒸发仪旋蒸除去溶剂乙醇,再将旋蒸后的微黄色液体置于60 ℃真空干燥箱中干燥24 h,得到离子液体[TMG][Triz],收率为92.8%。[TMG][Triz]:1H NMR(500 MHz,DMSO-d):δ×10-6:2.769 (s,12H,—N=CH),8.080 (d,2H,—N—CH3); IR(cm-1):3 979(s),3 106(s),2 157(s),1 967(s),1 667(s),1 604(s),1 569(s),1 448(s),1 410(s),1 273(s),1 151(s),978(s),681(s)。合成过程如图1所示。
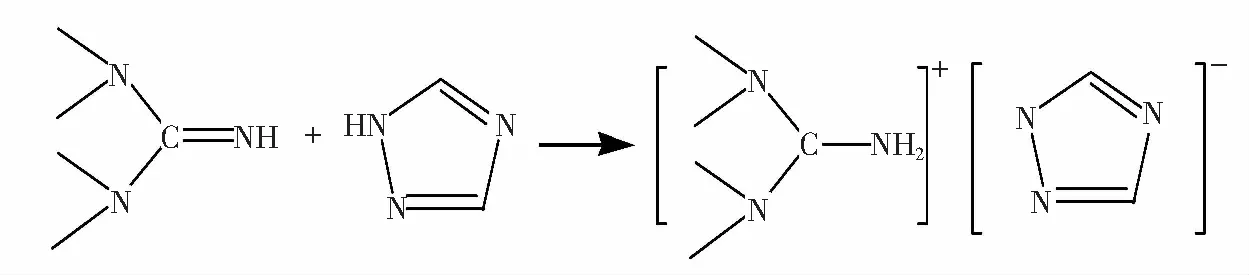
图1 离子液体[TMG][Triz]的合成Fig.1 Synthesis of the [TMG][Triz]
1.3 离子液体[TMG][Triz]脱硫前后物性测定
为降低离子液体中的水分和杂质含量,实验前将离子液体[TMG][Triz]在80 ℃的条件下用N2吹扫48 h,干燥后的离子液体含水量低于0.03%。
本实验采用Anton paar DMA4500N 密度计测定离子液体[TMG][Triz]的密度,仪器的测量精度及重现性为±1×10-5g/cm3,控温精度为±0.01 K,系统温度波动为±0.03 K。黏度则采用Anton paar Lovis2000M 微量黏度计进行测量,仪器的测量精度及重现性为±5.1×10-3mPa·s,控温精度为±0.01 K,系统温度波动为±0.03 K。
1.4 离子液体[TMG][Triz]脱硫实验装置
将离子液体[TMG][Triz]置于吸收管中称量,连接装置,调节恒温水浴锅至指定温度。将吸收管置于水浴锅中,打开SO2钢瓶阀门,通入SO2气体,调节流量为30 mL/min。实验装置如图2所示,每隔5 min取下SO2吸收管,用电子分析天平(精度为±0.000 1 g)对其进行快速称量,然后再将其连接入实验装置,直至SO2吸收管总重达到恒重。三氮唑胍盐离子液体吸收SO2饱和后,将饱和离子液体在油浴130 ℃条件下通入流速为50 mL/min的N2进行解吸,每5 min取下吸收管并称重,直至吸收装置的总重达到恒重。
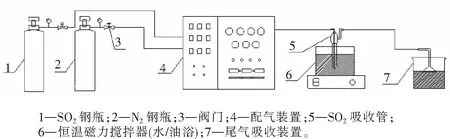
图2 离子液体[TMG][Triz]吸收及解吸实验装置示意图Fig.2 Schemtic diagram of the apparatus for the [TMG][Triz] absorption and desorption
2 结果与讨论
2.1 离子液体[TMG][Triz]脱硫性能评价

图3 离子液体[TMG][Triz]的摩尔吸收比随时间的变化Fig.3 Molar absorption ratio of the [TMG][Triz] at different times
对离子液体[TMG][Triz]的吸收和解吸能力进行测定,探究其在不同温度、SO2分压条件下的脱硫性能。
2.1.1 离子液体[TMG][Triz]对SO2的吸收、解吸能力
将离子液体[TMG][Triz]在20 ℃下吸收纯SO2气体,吸收饱和后在130 ℃通入50 mL/min的N2进行解吸,得到离子液体摩尔吸收比随时间的变化,如图3所示。
由图3可以看出,离子液体[TMG][Triz]对SO2的吸收速率较快,在20 min左右基本达到吸收平衡,SO2的吸收量随时间呈增长趋势,1 mol三氮唑胍盐离子液体可以吸收2.964 mol的SO2,且在130 ℃及N2吹扫条件下,SO2的解吸率在95%以上。
本文合成的离子液体[TMG][Triz]的脱硫性能低于SHANG等[18]合成的以1,1,3,3-四甲基胍为阳离子、以三氟乙醇和咪唑为阴离子的离子液体(即[TMG][TE],[TMG][IM])的脱硫性能,在相同的吸收条件下这2种离子液体脱硫的摩尔吸收比值分别是4.132和3.765,且达到最大摩尔吸收比所需的时间都在150 min,比离子液体[TMG][Triz]达到最大摩尔吸收比吸收速率慢;但高于HUANG等[19]合成的以1,1,3,3-四甲基胍为阳离子、以四氟硼酸和苯并三唑为阴离子的离子液体(即[TMG][BF4],[TMG][BTA])的脱硫性能,后两种离子液体在相同吸收条件下脱硫的摩尔吸收比值分别是1.27和1.18,且达到最大摩尔吸收比所需的时间分别为150 min和120 min,比离子液体[TMG][Triz]达到最大摩尔吸收比时的吸收速率慢。
2.1.2 温度对离子液体[TMG][Triz]脱硫性能的影响
常压下,在温度依次为20,30,40,50,60,70,80 ℃条件下,测定了离子液体[TMG][Triz]的脱硫性能,实验结果如图4所示。
可以看出,压力为1.0×105Pa时,温度对离子液体[TMG][Triz]的脱硫性能影响较大,吸收温度从20 ℃到80 ℃, 离子液体[TMG][Triz]的摩尔吸收比值从2.964降到1.005。随着温度的升高,离子液体[TMG][Triz]的脱硫能力逐渐下降。其原因在于:物理吸收的SO2主要靠SO2与离子液体间的范德华力和较弱的化学键相结合,并不牢固,温度升高时,相互作用力减小,解吸能力逐渐增强[8]。
2.1.3 SO2分压对离子液体[TMG][Triz]脱硫性能的影响
SO2分压依次为0.1×105,0.2×105,0.3×105,0.4×105,0.5×105,0.6×105,0.7×105,0.8×105,0.9×105,1.0×105Pa时,通入SO2和N2混合气,在20 ℃下进行脱硫实验,结果如图5所示。
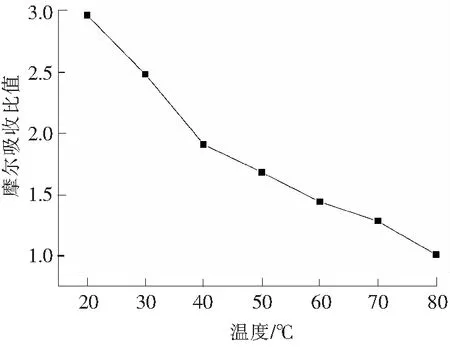
图4 离子液体[TMG][Triz]对SO2的摩尔吸收比随温度的变化Fig.4 Molar absorption ratio of SO2 to [TMG][Triz] at different temperatures
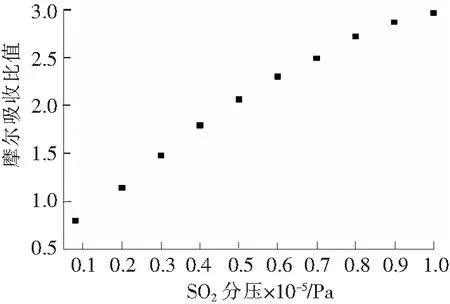
图5 离子液体[TMG][Triz]对SO2的摩尔吸收比随SO2分压的变化Fig.5 Molar absorption ratio of the [TMG][Triz] at different SO2 partial pressures
由图5可以看出, SO2分压为0.08×105Pa时,离子液体[TMG][Triz]对SO2的摩尔吸收比小于1,原因是当离子液体[TMG][Triz]阴离子对应有机酸的pKa小于亚硫酸的pKa时,[TMG][Triz]仅通过物理作用吸收SO2,离子液体[TMG][Triz]为非功能化离子液体[14],对低浓度SO2的吸收量较小。
当SO2分压从0.08×105Pa增加到1.0×105Pa时,离子液体[TMG][Triz]的摩尔吸收比从0.797增加到了2.964。在0.08×105~0.5×105Pa分压范围内,随着SO2分压的增加, 离子液体[TMG][Triz]的脱硫能力呈现近乎线性增长的趋势。SO2分压高于0.6×105Pa时,其吸收能力的增长变得缓慢。分压在0.5×105Pa以下时,以化学吸收为主;随着分压的增大,化学吸收逐渐达到饱和,然后以物理吸收为主,而随着分压的增大,物理吸收的速率增长逐渐变缓。这与SHIFLETT[20]和YOKOZEKI等[21]研究的咪唑类离子液体在不同的SO2分压条件下,离子液体[TMG][Triz]对SO2的摩尔吸收比的变化规律是相同的。
2.2 离子液体[TMG][Triz]脱硫过程中的物性变化
在 20 ℃的条件下,测定了不同SO2吸收量下离子液体的密度及黏度性能的变化。
2.2.1 密度
离子液体[TMG][Triz]的密度随摩尔吸收比的变化见图6。
由图6可以看出,随着SO2吸收量的逐渐增加,离子液体-SO2体系的密度呈现逐渐增大的趋势。纯离子液体的密度为1.110 3 g/cm3,吸收SO2饱和后密度值达到了1.339 8 g/cm3,这一现象与BMIBr脱硫后的密度变化趋势类似[22]。HUANG等[23]认为离子液体相中存在许多空隙,在吸收CO2等气体时可以占据这些空隙,也就是说离子液体溶解了一定量的 CO2之后,其体积并不会发生太大的变化。同理,本研究中离子液体[TMG][Triz]相中也可能存在较多的空隙,在物理溶解SO2时起到了相同的存储作用。即离子液体[TMG][Triz]可通过静电作用将SO2吸收到空隙中,体积基本不变,从而使整个离子液体-SO2体系的密度增大。
2.2.2 黏度
离子液体[TMG][Triz]的黏度随摩尔吸收比的变化见图7。
由图7可知,黏度随着离子液体[TMG][Triz]吸收量的增加呈现出先增加而后逐渐降低的趋势。 这一趋势与REN等[24]研究的[TMG]L和[MEA]L离子液体吸收SO2后的趋势是一致的。 HUANG等[25]研究了传统离子液体[BMIM][BF4]和[TMG][BF4]对SO2的吸收,发现其黏度随着SO2吸收量的增大呈现逐渐降低的趋势,认为这类离子液体对SO2的吸收是通过物理作用的结果。REN等[24]研究的离子液体[BMIM][BF4],[BMIM][PF6]和[TMG][BF4]吸收SO2后黏度也呈现降低的趋势,这也是离子液体与SO2发生物理作用的结果。
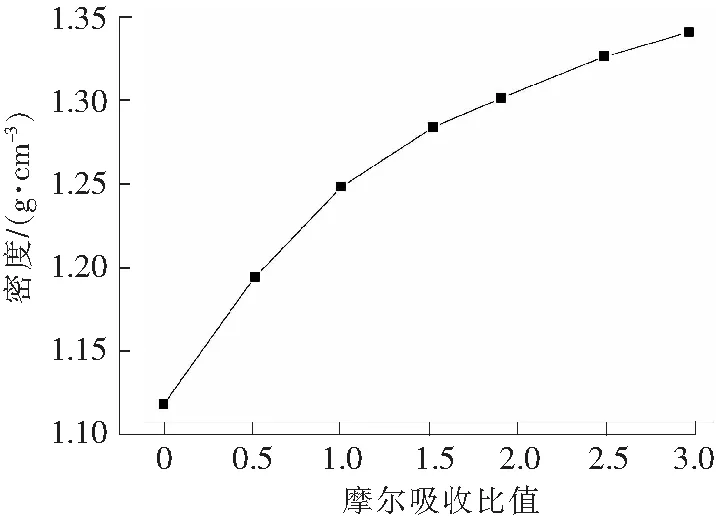
图6 离子液体[TMG][Triz]的密度随摩尔吸收比的变化Fig.6 Density of the [TMG][Triz] at different molar absorption ratios
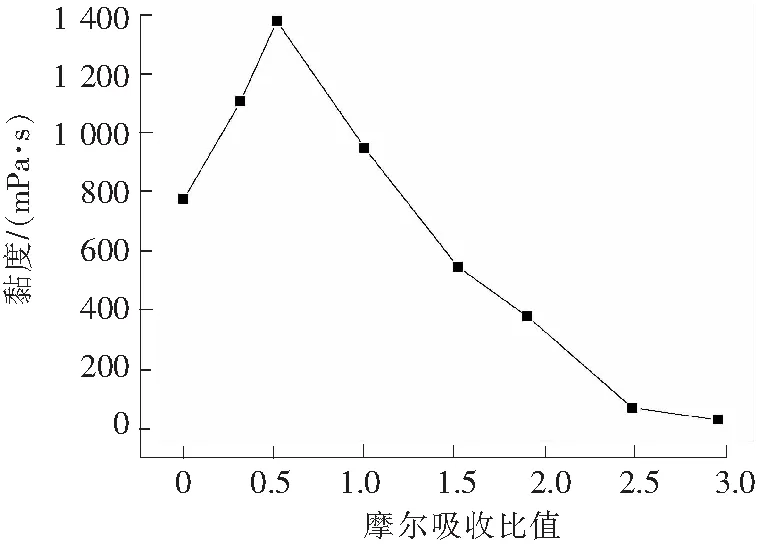
图7 离子液体[TMG][Triz]的黏度随摩尔吸收比的变化Fig.7 Viscosity of the [TMG][Triz] at different molar absorption ratios
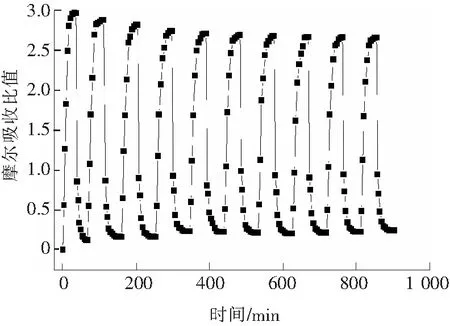
图8 离子液体[TMG][Triz]的摩尔吸收比随时间的变化Fig.8 Molar absorption ratio of the [TMG][Triz] at different time
与传统离子液体物理吸收相比,功能化离子液体化学吸收后黏度的变化趋势大为不同。在吸收初期,化学吸收为主导,离子液体与SO2之间形成化学键,导致体系黏度增大。在SO2与离子液体[TMG][Triz]的摩尔吸收比值达到0.5之前,离子液体[TMG][Triz]的黏度随着摩尔吸收比的增加而逐渐增加,这表明SO2通过化学作用吸收到离子液体[TMG][Triz]中;在SO2与离子液体的摩尔吸收比值大于0.5 时,[TMG][Triz]的黏度随着摩尔吸收比的增加而降低,表明 SO2可以通过物理作用吸收到离子液体[TMG][Triz]中。
2.3 离子液体[TMG][Triz]循环使用性评价
将离子液体[TMG][Triz]在20 ℃下吸收纯SO2气体,吸收饱和后在130 ℃下以50 mL/min通入N2进行解吸,重复吸收、解吸实验。离子液体[TMG][Triz]的摩尔吸收比随时间的变化见图8。
如图8所示,随着离子液体循环吸收次数的增加,其脱硫性能呈现逐渐下降的趋势。经过10次吸收-解吸循环后,[TMG][Triz]的摩尔吸收比从新鲜离子液体的2.964降低到了2.656。循环使用过程中,吸收SO2饱和的离子液体解吸率均大于95%。也就是说,解吸过程中,有将近5%的SO2不能解吸出来,这说明在130 ℃的解吸温度下,少量SO2和离子液体的作用较强。
LEE等[26]合成了一系列咪唑基离子液体,包括[BMIM][CI],[BMIM][Ac],[BMIM][BF4]和[BMIM][MeSO4]。脱硫性能研究结果表明,吸收SO2饱和后的离子液体[BMIM][CI]和[BMIM][Ac]不能解吸完全,循环使用性能较差;而[BMIM][MeSO4]离子液体吸收SO2后能够完全解吸,可以实现重复利用。ZHAI等[27]合成的醇胺类离子液体脱硫性能较高,且吸收饱和之后的解吸率接近100%。
综上,离子液体[TMG][Triz]解吸率较低的原因可能是SO2与离子液体[TMG][Triz]发生化学吸收[28-29],温度越高,解吸越完全。但是这种化学键作用比较强,低温下不易断裂,且高温解吸过程离子液体[TMG][Triz]容易发生质变,不利于重复使用。
2.4 脱硫机理研究
离子液体[TMG][Triz]脱硫前后的FT-IR谱图见图9,1H NMR谱图见图10。从图9可以看出,脱硫后离子液体[TMG][Triz]的IR图谱在1 469 cm-1和953 cm-1处出现了明显的新吸收峰,且分别对应于离子液体[TMG][Triz]吸收SO2后新出现的S=O和S—O—H基团。

图9 离子液体[TMG][Triz]脱硫前后FT-IR谱图Fig.9 FT-IR spectra of [TMG][Triz] and [TMG][Triz]+SO2
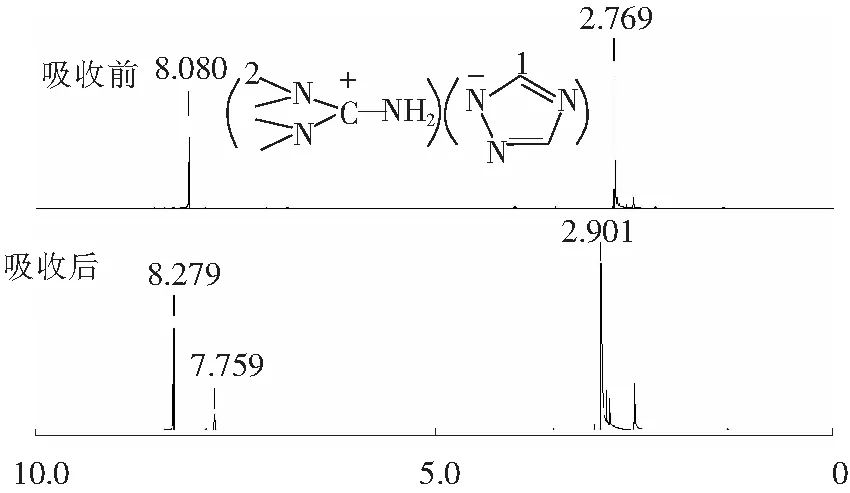
图10 离子液体[TMG][Triz]脱硫前后1H NMR谱图Fig.10 1H NMR spectra of [TMG][Triz] and [TMG][Triz]+SO2 before and after absorption
从图10可以看出,吸收SO2后离子液体[TMG][Triz]阳离子甲基上的H从2.769×10-6向低场移动到2.901×10-6[30-32];[Triz]阴离子咪唑环上1位上的H从8.08×10-6移动到8.279×10-6[35-37],说明吸收SO2后离子液体[TMG][Triz]的阴、阳离子均与SO2发生了相互作用。此外,在7.759×10-6[38]附近处出现新的H,推测该处可能是SO2与—NH2结合生成的S—O—H中的H。
离子液体[TMG][Triz]吸收SO2主要是离子液体中阳离子上的—NH2基团与SO2发生化学反应,产生新的化学键,通过阴离子三氮唑中呈现电负性的氮原子与酸性SO2分子中带正电的硫原子之间的相互作用来实现对SO2的吸收。1 mol离子液体[TMG][Triz]在20 ℃条件下可以吸收2.964 mol的SO2,理论上1 mol的四甲基胍阳离子可以与1 mol的SO2结合,三氮唑阴离子中带负电的氮原子可以与酸性SO2中带正电的硫原子之间相互作用,从而对SO2产生一定量的吸收。从以上分析可以推测离子液体[TMG][Triz]吸收了SO2后发生了如图11所示的变化。
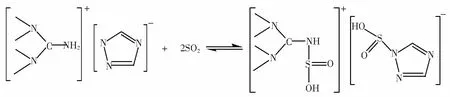
图11 离子液体[TMG][Triz]脱硫反应机理 Fig.11 Mechanism of absorbing SO2 by the [TMG][Triz]
离子液体[TMG][Triz]吸收SO2是通过和其阴、阳离子共同作用的,阳离子上的氮和三氮唑上的带有孤对电子的氮是吸收SO2的活性位点。理论上来看,20 ℃时,1 mol离子液体可以化学吸收2 mol的SO2,而物理吸收的量为0.964 mol。机理分析表明,离子液体[TMG][Triz]吸收SO2有2种方式,即化学吸收与物理吸收同时存在。这一分析与前面离子液体吸收SO2后黏度变化得到的结论一致。
3 结 论
1)以1,1,3,3-四甲基胍、三氮唑为原料,通过一步中和反应得到离子液体[TMG][Triz],在常压、20 ℃条件下,1 mol离子液体[TMG][Triz]吸收2.964 mol的SO2。
2)随着温度的升高,离子液体[TMG][Triz]的脱硫能力逐渐下降。
3)SO2对离子液体的摩尔吸收比随着SO2分压的增加而增加,130 ℃条件下,吸收饱和后的离子液体SO2解吸率达到95%以上,脱硫效果明显,吸收、解吸速率较快,具有较好的循环使用性能。
4)吸收SO2后,[TMG][Triz]的密度随SO2与离子液体摩尔吸收比的增大呈现逐渐增大的趋势。脱硫后离子液体的黏度随SO2与离子液体摩尔吸收比的增大呈现出先增大后降低的趋势。
5)机理研究表明,离子液体[TMG][Triz]对SO2的吸收是化学吸收和物理吸收共同作用的结果。
/
[1] CHEN W H. Dynamics of sulfur dioxide absorption in a raindrop falling[J].Atmospheric Environment,2001,35(28):4777-4790.
[2] WU Linbo, AN Dong,LI Bogeng, et al.Synthesis and SO2absorption/desorption properties of poly(1,1,3,3-tetramethylguanidine acrylate)[J]. Macromolecules, 2007, 40(9):3388-3393.
[3] JIN Meijin, HOU Yucui, WU Weize, et al. Solubilities and thermodynamic properties of SO2in ionic liquids[J]. Journal of Physical Chemistry B, 2011, 115(20):6585-6591.
[4] HONG S Y, IM J, PALGUNADI J, et al. Ether-functionalized ionic liquids as highly efficient SO2absorbents[J]. Energy & Environmental Science, 2011, 4(5):1802-1806.
[5] REN Shuhang, HOU Yucui, WU Weize, et al. Oxidation of SO2absorbed by an ionic liquid during desulfurization of simulated flue gases[J]. Industrial & Engineering Chemistry Research, 2010, 50(2):998-1002.
[6] SHIFLETT M B, YOKOZEKI A. Chemical absorption of sulfur dioxide in room-temperature ionic liquids[J]. Industrial & Engineering Chemistry Research, 2009, 49(3):1370-1377.
[7] PADUSZYNSKI K, DOMANSKA U. A new group contribution method for prediction of density of pure Ionic liquids over a wide range of temperature and pressure[J]. Ind Eng Chem Res, 2012, 51(1):591-604.
[8] WANG Congmin, CUI Guokai, LUO Xiaoyan, et al. Highly efficient and reversible SO2capture by tunable azole-based ionic liquids through multiple-site chemical absorption[J]. Journal of the American Chemical Society, 2011, 133(31):11916-11919.
[9] LEE K Y, KIM C S, KIM H G, et al. Effects of halide anions to absorb SO2in ionic liquids[J]. Bulletin- Korean Chemical Society, 2010, 31(7):1937-1940.
[10] ZHANG Shuguang, ZHANG Z C. Novel properties of ionic liquids in selective sulfur removal from fuels at room temperature[J]. Green Chemistry, 2002, 4(4):376-379.
[11] ANDERSON J L, DIXON J K, AGINNE E J, et al. Measurement of SO2solubility in ionic liquids[J]. Journal of Physical Chemistry B, 2006, 110(31):15059-15062.
[12] YUAN Xiaoliang, ZHANG Suojiang, LU Xingmei. Hydroxyl ammonium ionic liquids: synthesis, properties and solubility of SO2[J]. J Chem Eng Data, 2007, 2: 596-599.
[13] ZHAI Linzhi, ZHONG Qin, HE Chuan,et al. Hydroxyl ammonium ionic liquids synthesized by water-bath microwave: Synthesis and desulfurization[J]. J Hazard Mater, 2010, 177: 807-813.
[14] REN Shuhang, HOU Yucui, WU Weize, et al. Effect of H2O on the desulfurization of simulated flue gas by an ionic liquid[J]. Industrial & Engineering Chemistry Research, 2009, 48(10):4928-4932.
[15] LI Changjia,LI Jingyin,LI Na, et al.Study on microwave-assisted synthesis and performance of imidazole ionic liquids[J].Journal of Hebei University of Science and Technology,2012,33(4):300-304.
[16] WU Weize, HAN Buxing, GAO Haixiang, et al. Desulfurization of flue gas: SO2absorption by an ionic liquid[J]. Angewandte Chemie International Edition, 2004, 43(18):2415-2417.
[17] CUI Guokai, WANG Congmin, ZHENG Junjie, et al. Highly efficient SO2capture by dual functionalized ionic liquids through a combination of chemical and physical absorption[J]. Chemical Communications, 2012, 48(20):2633-2635.
[18] SHANG Ying, LI Hongping, ZHANG Suojiang, et al. Guanidinium-based ionic liquids for sulfur dioxide sorption[J]. Chem Eng J, 2011, 175: 324-329.
[19] HUANG Jun, RIISAGER A, FEHRMANN R, et al. Reversible physical absorption of SO2by ionic liquids[J]. Chemical Communications, 2006, 38:4027-4029.
[20] SHIFLETT M B,YOKOZEKI A. Separation of carbon dioxide and sulfur dioxide using room-temperature ionic liquid [BMIM][MeSO4][J]. Energy & Fuels, 2010, 23(24):1001-1008.
[21] YOKOZEKI A, SHIFLETT M B. Vapor-liquid equilibria of ammonia+ionic liquid mixtures[J]. Applied Energy, 2007, 84(12):1258-1273.
[22] ANDO R A, SIQUEIRA L J ,BAZITO F C, et al. The sulfur dioxide-1-butyl-3-methylimidazolium bromide interaction: Drastic changes in structural and physical properties[J]. J Phys Chem B, 2007, 111: 8717-8719.
[23] HUANG Xuhui, MARGULIS C J, LI Yuhui, et al. Why is the partial molar volume of CO2so small when dissolved in a room temperature ionic liquid? Structure and dynamics of CO2dissolved in [Bmim+][PF6-][J]. Journal of the American Chemical Society, 2005, 127(50): 17842-17851.
[24] REN Shuhang, HOU Yucui, WU Weize, et al. Properties of ionic liquids absorbing SO2and the mechanism of the absorption[J]. Journal of Physical Chemistry B, 2010, 114(6):2175-2183.
[25] HUANG Jun, RIISAGER A, FEHRMANN R, et al. Reversible physical absorption of SO2by ionic liquids[J]. Chemical Communications,2006, 38(38):4027-4035.
[26] LEE K Y, GONG G T, SONG K H, et al. Use of ionic liquids as absorbents to separate SO2, in SO2/O2, in thermochemical processes to produce hydrogen[J]. International Journal of Hydrogen Energy, 2008, 33(21):6031-6036.
[27] ZHAI Lin,ZHONG Qin,DU Hongcai, et al.Hydroxyl ammonium ionic liquids: Synthesis and flue gas desulfurization[J]. CIESC Journal, 2009, 60(2):450-454.
[28] CHEN Kaihong,SHI Guiling, ZHOU Xiuyuan, et al. Highly efficient nitric oxide capture by azole-based ionic liquids through multiple-site absorption[J]. Angewandte Chemie, 2016, 55(46):14364-14368.
[29] 史新乐,刘硕磊,周静雪,等.功能化离子液体脱除烟气中SO2的研究进展[J].河北科技大学学报,2017,38(1):46-51.
SHI Xinle, LIU Shuolei, ZHOU Jingxue, et al.Research progress of SO2removal from flue gas by functionalized ionic liquids[J].Journal of Hebei University of Science and Technology,2017,38(1):46-51.
[30] SHANG Ying, LI Hongping, ZHANG Suojiang,et al . Guanidinium-based ionic liquids for sulfur dioxide sorption[J]. Chem Eng J, 2011, 175: 324-329.
[31] YANG Dezhong, HOU Minqiang, NING Hui, et al. Reversible capture of SO2, through functionalized ionic liquids[J]. Chemsuschem, 2013, 6(7):1191-1195.
[32] CUI Guokai, ZHENG Junjie, LUO Xiaoyan, et al. Tuning anion-functionalized ionic liquids for improved SO2, capture[J]. Angewandte Chemie International Edition, 2013, 52(40):10620-10624.
Desulfurization performance of azole-based ionic liquids
CHENG Liubei1, LIU Shuolei1, ZHANG Xiangjing1,2, WANG Jianying1,2
(1.School of Chemistry and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2.Hebei Pharmaceutical Chemical Engineering Technology Research Center, Shijiazhuang, Hebei 050018, China)
In order to study the addition of functional groups in ionic liquid anion and cation to achieve better absorbing of SO2, the 1,1,3,3-tetramethylguanidine triazole ([TMG][Triz]) is synthesized using 1,1,3,3-tetramethylguanidine and triazole as raw materials. The desulfurization performance of the synthesized [TMG][Triz] is systematically studied. The desulfurization performance and desulfurization mechanism of the [TMG][Triz] are discussed. The results show that the [TMG][Triz] has good performance of desulfurization and regeneration. At the atmospheric pressure, 1 mol of the [TMG][Triz] absorbs 2.964 mol of SO2at 20 ℃. With the increase of temperature, the desulfurization capacity of the [TMG][Triz] decreases gradually. The molar absorption ratio increases with the increase of SO2partial pressure, and under the conditions of 130 ℃, the desorption rate of the ionic liquid after saturated adsorption reaches over 95%. The mechanism investigation results show that the interaction of SO2and [TMG][Triz] is the combination of chemical absorption and physical absorption. The results have a certain reference value to improve the efficiency of flue gas treatment.
absorption;[TMG][Triz];desulfurization;desorption;desulfurization mechanism
O175.8
A
2017-05-23;
2017-09-02;责任编辑:张士莹
河北省自然科学基金(B2016208102);河北省科技厅国际合作与交流项目(16391213D);河北省人社厅留学人员科技活动择优资助项目(CG2015003003)
程刘备(1991—),男,河北邯郸人,硕士研究生,主要从事离子液体脱硫、脱硝方面的研究。
王建英教授。E-mail:jenneywjy@126.com
程刘备,刘硕磊,张向京,等.唑基离子液体的脱硫性能研究[J].河北科技大学学报,2017,38(5):445-452.
CHENG Liubei,LIU Shuolei,ZHANG Xiangjing,et al.Desulfurization performance of azole-based ionic liquids[J].Journal of Hebei University of Science and Technology,2017,38(5):445-452.
