盐胁迫下不同K+吸收抑制剂对小麦根系K+/Na+比和质膜相关蛋白活性的影响
2017-11-04张华宁李孟军郭秀林张艳敏刘子会
张华宁,李孟军,郭秀林,张艳敏,刘子会
(1.河北省农林科学院 遗传生理研究所,河北省植物转基因中心重点实验室,河北 石家庄 050051;2.石家庄市农林科学研究院,河北 石家庄 050000)
盐胁迫下不同K+吸收抑制剂对小麦根系K+/Na+比和质膜相关蛋白活性的影响
张华宁1,李孟军2,郭秀林1,张艳敏1,刘子会1
(1.河北省农林科学院 遗传生理研究所,河北省植物转基因中心重点实验室,河北 石家庄 050051;2.石家庄市农林科学研究院,河北 石家庄 050000)
为了研究不同K+吸收途径在小麦耐盐机理中的作用,以小麦耐盐品种沧6005(C6005)和敏感品种矮抗58(AK58)为材料,通过K+吸收相关抑制剂和NaCl对幼苗进行根系处理,测定并分析了根系K+、Na+含量、比值和质膜K+转运相关蛋白活性的变化。结果表明:与正常条件生长小麦相比,250 mmol/L NaCl处理7 d后,2种耐盐性不同的小麦根系中的K+/Na+比明显降低,同时与敏感品种相比,耐盐品种能保持较高的K+/Na+比;NaCl胁迫下,通过3种抑制剂处理对K+含量及K+/Na+比值的影响发现,与钾离子通道和非选择性阳离子通道途径相比,小麦根系K+吸收主要通过钾载体途径;当该途径被抑制时,沧6005的K+/Na+比下降幅度明显高于矮抗58,表明耐盐品种更依赖该途径;NaCl胁迫下,钾载体途径被抑制时,小麦根系质膜质子泵H+-ATPase和H+-PPase活性明显降低,且沧6005降低幅度相对更大;NaCl胁迫下,钾载体抑制剂处理,对沧6005质膜K+/H+转运蛋白的抑制作用明显强于矮抗58,进一步证明上述结果。研究表明,盐胁迫下小麦主要通过钾载体途径吸收K+,耐盐品种沧6005对钾转运载体的依赖程度更高;高NaCl环境中,细胞质膜质子泵活性和钾载体活性的提高对于维持K+/Na+比具有重要作用。为深入解析小麦耐盐机理提供了理论依据。
小麦;盐胁迫;K+/Na+比;质膜蛋白;K+抑制剂
小麦(TriticumaestivumL.)是我国乃至世界主要粮食作物,往往受到土壤盐渍化影响。土壤盐渍化不仅产生渗透胁迫、离子失衡、营养缺乏、膜结构损伤、新陈代谢紊乱等危害,同时过量ROS造成的氧化损伤、光合作用的减弱还对作物造成二次伤害[1],因此,盐胁迫成为影响农业生产的重要因素之一[2]。
低Na+对植物生长具有促进作用,尤其在缺K+环境中,少量的Na+可以替代K+,参与植物生长发育和新陈代谢;但在高浓度下,大量的Na+进入细胞质,会引起一系列负面反应,其中最主要的是引起K+缺乏,而K+稳态对于维持细胞内多种酶活性和功能所必须[3],其中根系的保K+能力至关重要[4]。胞质K+/Na+平衡是维持细胞新陈代谢、提高耐盐能力的关键[5],植物可以通过维持体内较高的K+/Na+比来减轻毒害。研究表明,100 mmol/L NaCl处理30 d,耐盐小麦植株Na+含量最少,且质膜逆向转运蛋白相关基因SOS1、SOS2和SOS3的表达量、Na+排出量和体内K+/Na+均明显高于盐敏感品种[6];盐胁迫下,耐盐小麦能够将更多的Na+和K+积累在根部,促进K+吸收同时抑制Na+向地上部转运,从而保证叶片较高的K+/Na+[7]。用NaHS预处理水稻发现,植株在增加K+吸收的同时,减少Na+吸收,从而保持更高的K+/Na+和更好的长势[8]。盐胁迫下耐盐性高的甘薯体内K+/Na+下降幅度更小,其质膜SOS1和液泡膜NHX1表达量都明显高于普通品种[1]。Zhang等[9]通过转基因苜蓿研究也表明,盐胁迫下转TaNHX苜蓿植株的K+/Na+比值显著高于野生型,且转基因植株能够选择性吸收K+,减少胞质Na+,增强耐盐性[9];转甜瓜MIRK拟南芥植株的K+/Na+是对照的2倍,相对电导率为对照植株的57.7%,且耐盐性得到显著提高[10]。可见,植物通过调节根部不同的离子吸收途径,保持体内较高的K+/Na+,从而保证植物在高盐环境中更好的生存。
K+吸收主要包括内向整流K+通道KIRCs和外向整流K+通道KORCs[11]。KIRCs被质膜超极化激活,盐胁迫下能介导K+和Na+内流;而KORCs在质膜去极化时被激活,可同时介导K+外流和Na+内流[12]。Schachtman等[13]发现NaCl引起小麦质膜去极化、K+外流,Na+顺电化学势梯度内流,是盐胁迫下Na+进入胞内的重要途径。钾载体蛋白属于高亲和K吸收系统,在根际K+浓度小于0.1 mmol/L时介导K+吸收,最常见的是KUP/HAK/KP家族蛋白,在多种植物中存在,大麦HAK是最早发现的调控K+吸收的高亲和吸收载体蛋白[14]。高亲和系统还包括一些具有钠运输功能或钾钠共转运功能的家族,比如HKT和NHX家族,其中NHX家族是Na+/H+和K+/H+逆向转运体[15-16],HKT家族在植物中表达量较低,可以介导K+、Na+共转运,尤其是在K+缺少时,可以吸收Na+来代替K+的作用。Shen等[17]和Wang等[18]对水稻OsHAK21和OsHKT1的研究发现,HAK定位于根中的木质部薄壁组织和内皮层的通道细胞,高NaCl胁迫诱导表达量明显上升,具有K+吸收特性,在维持盐胁迫下体内K+/Na+中起重要作用;而HKT定位于水稻叶片韧皮部,在盐胁迫下韧皮部中转运Na+,以减少光合组织中的Na+毒害。
无论是离子通道还是转运蛋白,离子转运均依赖膜上H+-ATPase和H+-PPases水解ATP或焦磷酸[19]。H+-PPase广泛存在于多种植物膜上,最早在液泡膜上发现,近年来在质膜上被报道[20]。Yu等[1]对甘薯耐盐性研究发现,耐盐性高的甘薯根中质膜H+-ATPase基因表达水平和H+外流更强,H+-ATPase的上调有助于减少钾离子外流。质膜Na+外流和液泡膜的Na+区隔化均由质膜H+-ATPase、液泡膜H+-ATPase和H+-PPase提供能量[21]。
尽管近年来对盐胁迫下作物膜系统上K+运输途径的研究较多,但是盐胁迫下不同耐盐性小麦K+吸收途径的差异性方面报道不多。为此本试验选取耐盐性不同的2个小麦品种,借助不同离子吸收抑制剂处理,通过测定并分析盐胁迫下不同品种K+、Na+含量及其比值以及质膜相关转运蛋白活性及其变化,以期探明盐胁迫下耐盐性不同的小麦根系K+吸收的异同性。
1 材料和方法
1.1试验材料
供试小麦品种为沧6005(耐盐品种)和矮抗58(盐敏感品种),由沧州市农林科学院提供。
1.1.1 小麦幼苗培养 精选大小一致、籽粒饱满的小麦种子,清水冲洗干净,经0.1%HgCl2浸泡10 min表面消毒后,冲洗干净,室温浸泡12 h,转双层滤纸上于黑暗中催芽,待根长至1 cm时播至塑料盆纱网上,用Hoagland营养液水培,培养室温度22~25 ℃,相对湿度60%~70%,光照时间昼夜16 h/8 h,光照强度300 μmol/(m2·s),通气泵24 h通气。
1.1.2 小麦幼苗处理 小麦幼苗长至二叶一心时,分别进行如下处理:250 mmol/L NaCl根部处理,分别于处理后1,3,5,7 d剪取根部,测定K+和Na+含量,以正常生长的小麦作为对照;先用4 mmol/L四乙基氯化铵(Tetraethylammonium chloride,TEA,钾离子通道抑制剂)、1 mmol/L N-乙基马来酰亚胺(N-Ethylmaleimide,NEM,钾转运载体抑制剂)和2.3 mmol/L Ba(NO3)2(NSCCs抑制剂)[7]分别预处理12 h,再用250 mmol/L NaCl处理,处理后7 d剪取根系,用蒸馏水快速洗去表面培养液,滤纸吸干表面水分,部分烘干用于离子含量测定,剩余部分置于液氮速冻,-80 ℃保存,用于质膜蛋白提取。每个处理均设正常生长的小麦作为对照。
1.2测定指标与方法
1.2.1 钾钠离子含量测定 分别剪取根系,放入105 ℃干燥箱中杀青10 min,再于80 ℃烘箱中烘干至恒重,干样经球磨机(型号:MM400,购自Retsch公司)研成粉末,用原子吸收光谱法测定K+和Na+含量[9]。
1.2.2 质膜蛋白提取和纯化 小麦根系质膜蛋白的提取和纯化参考Zhang等[9]和周小华等[22]的方法,使用Bradford比色法测定质膜蛋白的浓度,测定质膜蛋白H+-ATPase和H+-PPase的活性。称取干净的小麦根5 g,在液氮中迅速研磨成粉末,转入EP管,加入提取液10 mL,4 ℃、5 000 r/min离心20 min,上清液以4 ℃、18 000 r/min离心35 min,弃上清;沉淀用1 mL悬浮液溶解,把悬浮好的匀浆小心平铺到两相液表面,4 ℃、1 150 r/min离心10 min;将上清液转至EP管中,用稀释液稀释5倍,4 ℃、28 800 r/min离心40 min,弃上清;沉淀用稀释液悬浮,即为质膜微囊制剂。检测蛋白浓度,分装并于-80 ℃保存备用。
提取液配制:蔗糖300 mmol/L、Hepes 50 mmol/L、EDTA 8 mmol/L、PMSF 2 mmol/L、DTT 4 mmol/L(使用前加入)、PVPP 1.5%、BSA 0.2%,Tris调pH值为7.0;悬浮液配制:蔗糖300 mmol/L、KH2PO45 mmol/L、KCl 5 mmol/L、EDTA 0.1 mmol/L、DTT 1 mmol/L;两相液配制:DextranT500 6.2%、PEG3350 6.2%,用悬浮液溶解;稀释液配制:蔗糖 300 mmol/L、Hepes 5 mmol/L、DTT 1 mmol/L,用Tris调pH值为7.0。
将50 μL质膜蛋白加入到0.5 mL反应体系中启动反应,反应体系成分包括:100 mmol/L Hepes、20 mmol/L MgSO4、500 mmol/L KNO3、5mmol/L NaN3和1 mmol/L钼酸铵,以50 μL 20 mmol/L ATP-Tris(pH值7.5)启动反应,混匀后于37 ℃反应20 min,再于100 ℃煮沸10 min终止反应,取反应液0.2 mL在黑暗处于5 mL显色体系中进行显色反应15 min,显色体系成分:0.5 mol/L NaHCO30.8 mL、显色剂0.5 mL、ddH2O 3.5 mL,分光光度计在OD600测定H+-ATPase活性,将37 ℃反应条件下、1 min内每毫克质膜蛋白催化ATP分解释放出无机磷酸的微摩尔数作为1个单位的酶活性。将启动反应的20 mmol/L ATP-Tris替换为3 mmol/L Na4PPi即可测定H+-PPase活性。
显色剂配制:在400 mL水中缓慢加入208.3 mL浓硫酸,冷却至室温,同时取20 g钼酸铵溶于60 ℃水中,然后将冷却的硫酸加入钼酸铵溶液中,不断搅拌,再加入100 mL 0.5%的酒石酸锑钾溶液,定容至1 L,保存于棕色瓶中。使用前取100 mL溶解1.5 g抗坏血酸即为显色剂。
1.2.3 K+/H+转运载体活性测定 参考Lin等[23]荧光淬灭法,将100 μg质膜蛋白加入2 mL反应体系中,反应体系内含250 mmol/L蔗糖、100 mmol/L KNO3、1 mmol/L NaN3、3 mmol/L MgSO4、20 mmol/L N-三(羟甲基)甲基甘氨酸和5 μmol/L吖啶橙,用Tris调pH值为7.5,用ATP-Tris启动反应,终浓度为3 mmol/L,用日立F-4600型荧光分光光度计记录荧光淬灭值ΔF,激发光为495 nm,发射光为540 nm,狭缝为2.5 nm。当荧光值稳定时,加入终浓度为3 mmol/L的EGTA,螯合Mg2+清除质膜H+-ATPase活性,迅速加入葡萄糖酸钾使其终浓度为20 mmol/L,记录荧光恢复值ΔF’,用1 μg质膜蛋白每分钟产生的荧光淬灭值ΔF’/ΔF来表示K+/H+转运载体活性。
1.3数据分析
使用Excel对数据进行整理,SPSS 19.0 进行单因素方差分析,Turkey检验法进行多重比较和差异显著性分析(P<0.05)。
2 结果与分析
2.1盐胁迫下不同耐盐小麦根系K+/Na+比值
通过对250 mmol/L NaCl胁迫下不同耐盐小麦根系K+/Na+比值的变化分析发现(图1),正常生长条件下,沧6005根系K+/Na+比值略高于矮抗58;随着NaCl处理时间延长,两品种根系K+/Na+比值均呈逐渐降低趋势,处理第7 天时,沧6005比处理前降低58.91%,矮抗58比处理前降低74.57%,沧6005的K+/Na+比值显著高于矮抗58,说明沧6005在NaCl处理下能保持体内较高的K+/Na+比值。
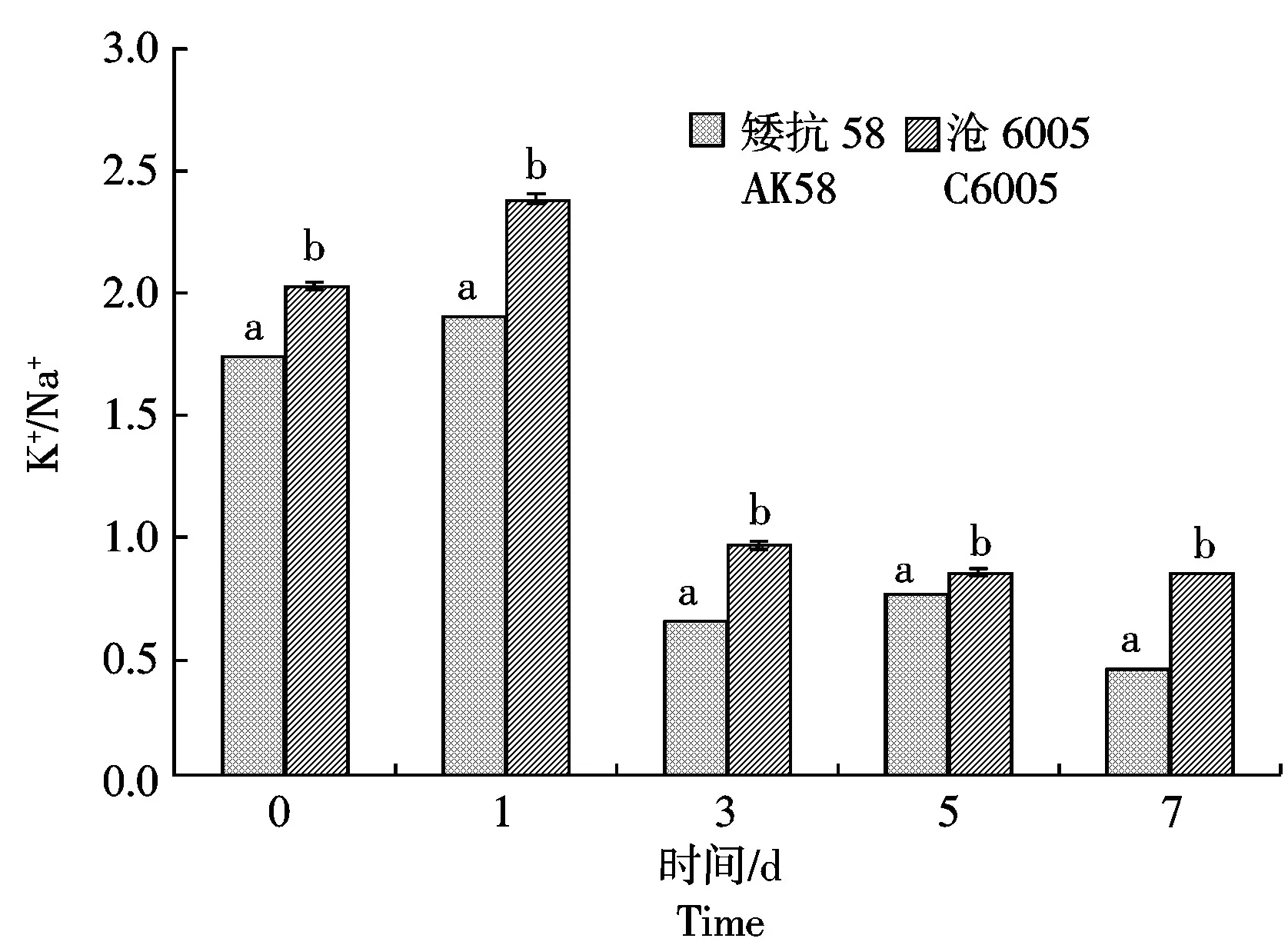
不同小写字母表示差异显著(P<0.05)。表1-2、图2-4同。Different lowercases show the significant difference (P<0.05). The same as Tab.1-2,Fig.2-4.
2.2不同钾离子吸收抑制剂对K+/Na+的抑制率
表1可见,正常条件下,沧6005和矮抗58根系K+/Na+比值约为1.44和1.96,随植株生长逐渐升高,第7天时,分别达到5.32和7.97,变化率为269.85%和306.58%;钾离子通道抑制剂TEA 和NSCCs抑制剂Ba(NO3)2处理,均抑制K+/Na+比值的变化率,Ba(NO3)2抑制效果更明显,矮抗58和沧6005中变化率分别为158.86%和179.01%。当用NEM抑制钾载体活性时,两品种K+/Na+比值的升高幅度却显著高于对照(P<0.05),变化率依次为393.64%,464.42% 。
表2可见,盐胁迫下,当钾离子通道被抑制时,两品种的K+/Na+下降幅度低于单独盐处理(P<0.05);钾载体活性被抑制时,沧6005和矮抗58的K+/Na+的变化率显著高于对照(P<0.05),其中矮抗58比单独盐处理高7.64个百分点,沧6005比对照高12.22个百分点;不同于单独盐处理,当NSCCs途径被抑制时,沧6005的K+/Na+变化幅度显著高于盐处理(P<0.05),而矮抗58的K+/Na+变化幅度显著低于盐处理(P<0.05)。
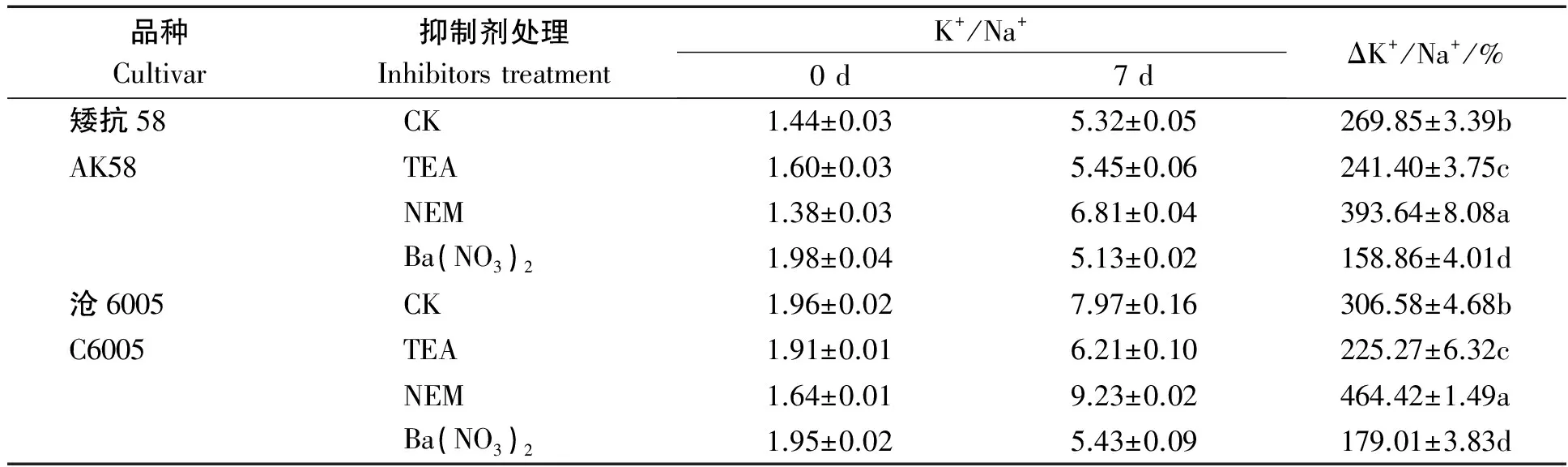
表1 正常条件下不同抑制剂预处理对小麦根系K+/Na+比值的影响Tab.1 Effects of K+ absorption inhibitors treatment on K+/Na+ ratios in wheat roots
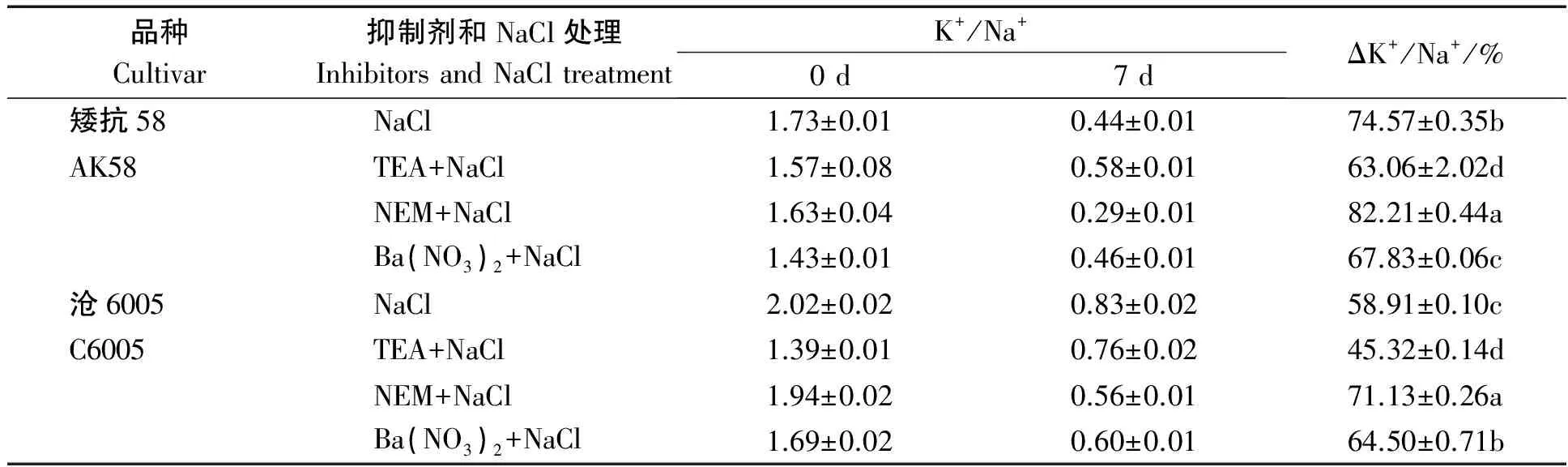
表2 250 mmol/L NaCl胁迫下不同抑制剂预处理对小麦根系K+/Na+比值的影响Tab.2 Effects of K+ absorption inhibitors pretreatment and NaCl treatment on K+/Na+ ratios in wheat roots
2.3不同钾离子吸收抑制剂处理对质膜H+-ATPase活性的影响
从图2-A可见,对于单个品种而言,正常条件下不同处理盆中幼苗根系H+-ATPase活性相当,不同品种比较,小麦沧6005质膜H+-ATPase活性高于矮抗58;随植株生长,H+-ATPase活性均升高,矮抗58上升幅度更大。单独TEA处理可明显降低矮抗58酶活性(P<0.05),而对沧6005酶活性影响不明显;250 mmol/L NaCl处理显著第7天降低两品种质膜H+-ATPase活性(P<0.05),其中沧6005降低58.2%,矮抗58降低76.8%;TEA和NaCl联合处理同时降低两品种质膜H+-ATPase酶活性,但与单独NaCl处理相比差异不明显。
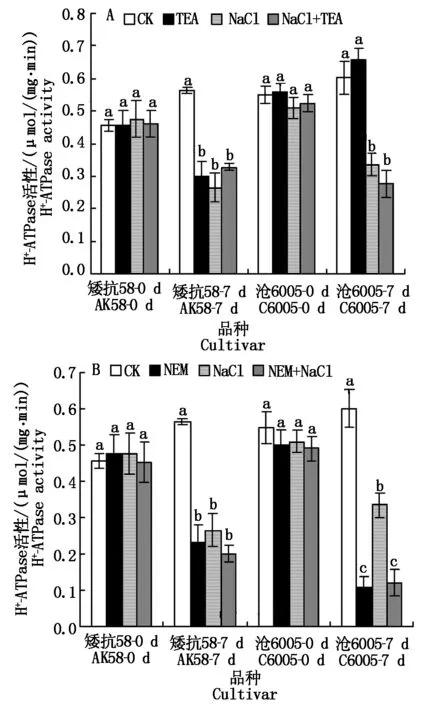
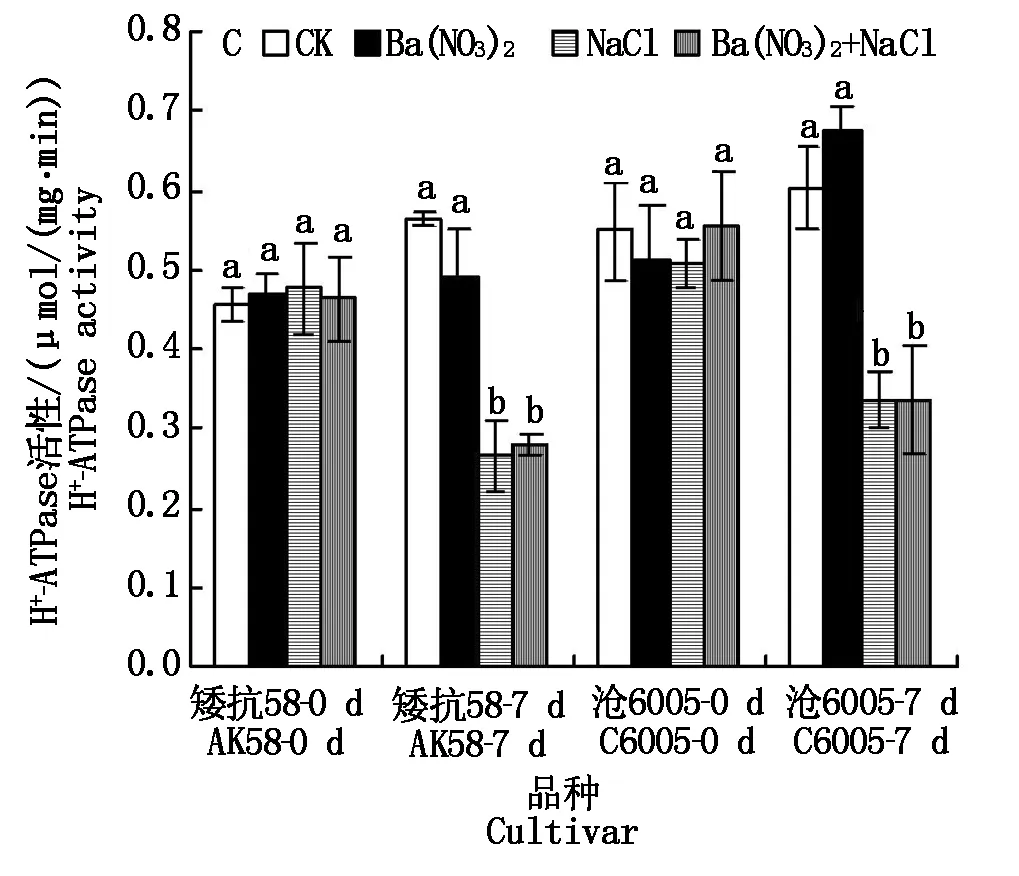
图2 250 mmol/L NaCl胁迫下不同抑制剂处理对不同耐盐性小麦根系质膜H+-ATPase活性的影响Fig.2 Effects of 250 mmol/L NaCl and TEA/NEM/Ba(NO3)2 on the activities of root plasma membrane H+-ATPase in wheat roots of salt-tolerant and sensitive wheat seedlings
单独NEM、NaCl以及NEM和NaCl联合处理(图2-B),均能显著降低两品种根系质膜H+-ATPase酶活性(P<0.05),与单独NaCl处理相比,当NEM和NaCl联合处理后,沧6005酶活性显著降低(P<0.05),矮抗58没有明显差异,与单独NEM处理相比也没有明显差异。
单独Ba(NO3)2处理(图2-C),沧6005和矮抗58的质膜H+-ATPase活性与各自的正常生长对照相比均没有明显的差异;单独NaCl处理以及Ba(NO3)2和NaCl联合处理后,两品种质膜H+-ATPase活性与正常生长对照相比均显著下降(P<0.05),而Ba(NO3)2和NaCl联合处理后的矮抗58和沧6005酶活性与单独NaCl处理无明显差异。
2.4不同抑制剂处理对根系质膜H+-PPase活性的影响
从图3-A可见,对于单个品种而言,处理前不同处理盆中幼苗根系H+-PPase活性相当。正常条件下,两品种根系质膜H+-PPase活性差异不大,随植株生长,酶活性略有升高,沧6005升高幅度较大。TEA处理均使得两品种酶活性升高;250 mmol/L NaCl处理,矮抗58质膜H+-PPase活性显著高于对照(P<0.05),而沧6005酶活性显著低于对照(P<0.05),数值接近处理前对照值;TEA和NaCl联合处理对两品种H+-ATPase酶活性影响不明显。
单独NEM处理显著降低两品种质膜H+-PPase活性(P<0.05),矮抗58酶活性降低约85.4%,沧6005酶活性降低约71.4%(图3-B); NEM和NaCl联合处理后,酶活性显著下降(P<0.05),数值略高于单独NEM处理。
单独Ba(NO3)2处理显著降低矮抗58酶活性(P<0.05)(图3-C);Ba(NO3)2和NaCl联合处理后,矮抗58酶活性接近单独Ba(NO3)2,而沧6005酶活性接近单独NaCl处理,品种间呈现不同的变化规律。
2.5不同抑制剂处理对质膜K+/H+转运蛋白的影响
由图4可见,对于单个品种而言,处理前不同处理盆中幼苗根系K+/H+转运蛋白活性相当。正常条件下,沧6005质膜K+/H+转运蛋白活性高于矮抗58,随植株生长,酶活性略有升高;1 mmol/L NEM处理7 d后,矮抗58小麦根质膜K+/H+转运蛋白活性显著低于正常生长对照(P<0.05),沧6005则与其正常生长的对照组无明显差异;250 mmol/L NaCl处理7 d后,质膜K+/H+转运蛋白活性变化不同,矮抗58品种根蛋白活性在第7天显著低于对照(P<0.05),沧6005品种根蛋白活性显著高于对照(P<0.05);NEM和NaCl联合处理后,两品种质膜K+/H+转运蛋白活性均显著下降(P<0.05),其中与各自单独NaCl处理相比,矮抗58下降约29.1%,沧6005蛋白下降达77.3%。
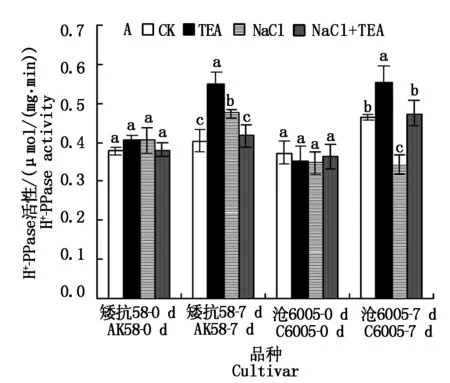
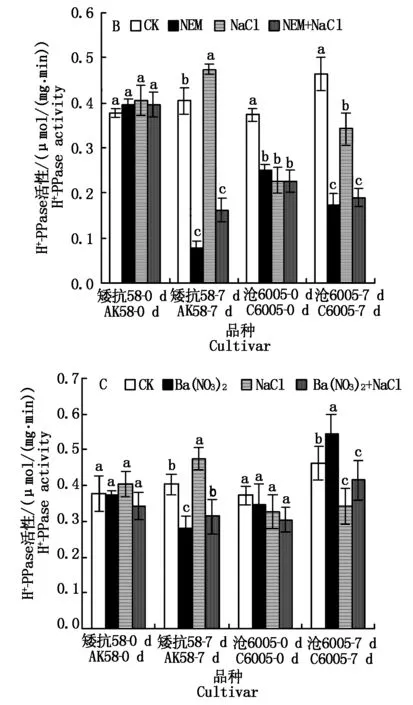
图3 250 mmol/L NaCl胁迫下不同抑制剂处理对不同耐盐性小麦根系质膜H+-PPase活性的影响Fig.3 Effects of 250 mmol/L NaCl and TEA/NEM/Ba(NO3)2 on the activities of root plasma membrane H+-PPase in wheat roots of salt-tolerant and sensitive wheat seedlings
3 讨论
K+/Na+比值是研究植物耐盐性中一个非常重要的指标,在高NaCl环境下,植物体通过一系列应激反应和离子吸收来保证体内足够的K+,维持细胞的新陈代谢[24]。一些耐盐性很高的植物,可能具有更好的保K+排Na+的能力,即使处于高NaCl环境,胞质仍可维持一定的K+/Na+比[25]。
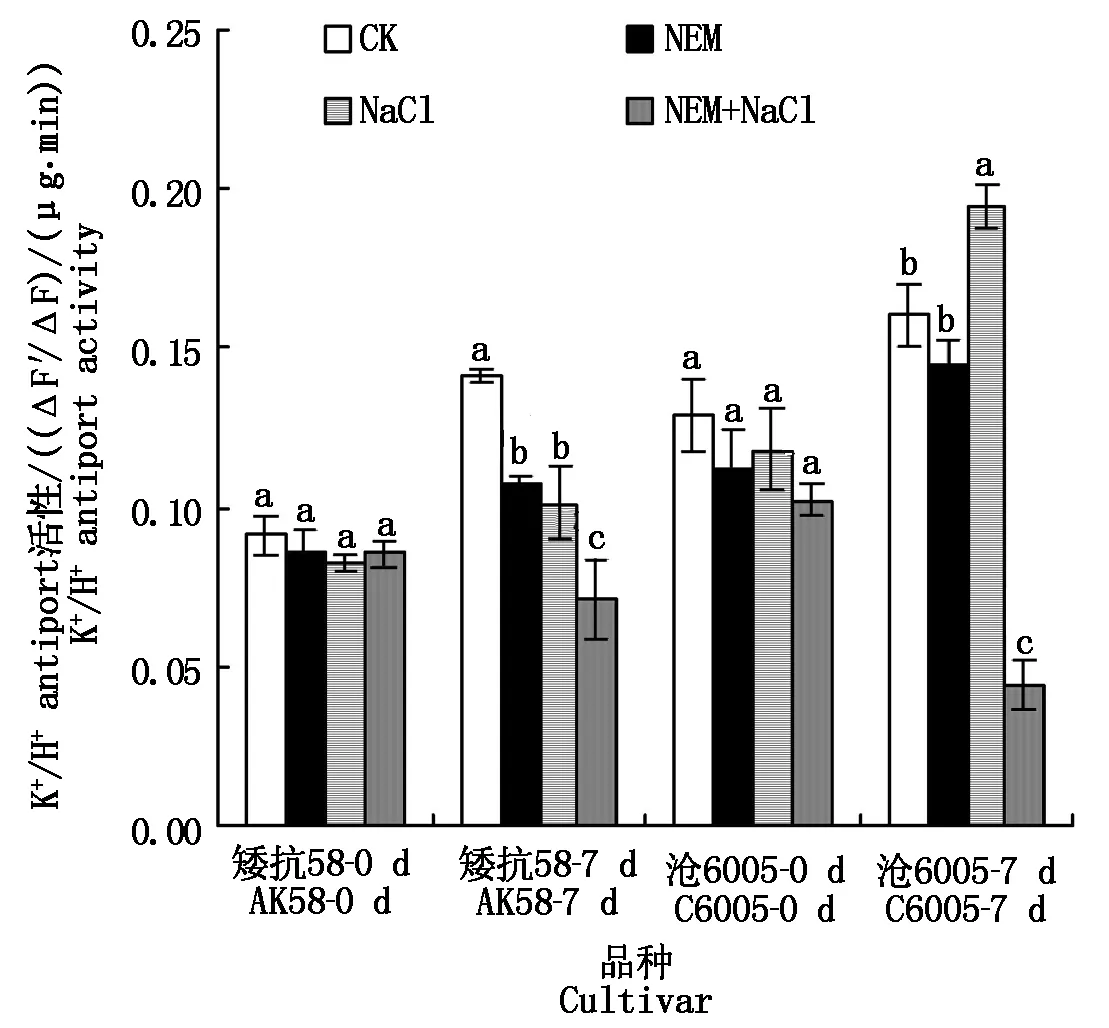
图4 250 mmol/L NaCl和NEM联合处理对小麦根系K+/H+蛋白活性的影响Fig.4 Effects of 250 mmol/L NaCl and NEM on the activities of root K+/H+antiporter in wheat roots of salt-tolerant and sensitive wheat seedlings
很多研究证明,细胞通过Na+外排和液泡Na+区隔化来提高耐盐性。Zhu[26]的研究发现,SOS家族主要参与质膜对Na+的外排和Ca2+介导的耐盐信号转导途径,NHX家族参与液泡膜上Na+的转运,在水稻[27-28]、苜蓿[9]、玉米[29]和小麦[15,30]中对NHX家族的研究发现,液泡膜通过Na+/H+逆向转运体的作用将Na+储存在液泡中,降低细胞质内的Na+浓度,提高耐盐性。与Na+相比,K+是植物必需的大量元素,植物体具有多样且高效的K+吸收途径[31]。处于外界高Na+环境中的植物根系可能更依赖于加强对K+的吸收或者液泡对K+的外排,来维持胞质内的高K+/Na+[32]。本试验结果显示,250 mmol/L NaCl处理后,沧6005根中的K+/Na+比值降低58.91%,明显少于矮抗58的74.57%。比较离子含量测定结果发现,NaCl胁迫下2种小麦根中Na+增加量没有明显区别,沧6005根中的Na+略低于矮抗58,但对K+的吸收却明显高于矮抗58,从而维持较高的K+/Na+比值,可见耐盐品种通过增加K+减少Na+来维持胞内离子平衡,K+增加可能是主要原因。
K+吸收途径主要有钾离子通道、钾转运载体和NSCCs,各个途径对K+的亲和力不同[33]。一般植物根系细胞内都能够聚集高于外界土壤的K+来维持渗透压,这很大程度上依赖细胞质膜上承担主动运输任务的钾转运载体[34]。钾离子通道和NSCCs作为被动运输,依赖跨膜的电位差,当植物根系处于高Na+环境时,低亲和力的离子通道途径对离子的运输更快,可能在维持细胞内正常渗透压过程中发挥作用,但是由于其对阳离子分辨能力较低,会导致胞内K+和Na+的失衡。本试验选择3种不同抑制剂来抑制相应的钾吸收途径,抑制率越高,说明小麦对相应的钾吸收途径越依赖,该途径对钾吸收的贡献越大。对K+/Na+比值研究结果表明,正常条件下盐敏感品种和耐盐品种都主要以钾转运载体作为主要的K+吸收途径,而钾离子通道和NSCCs在钾转运载体途径被抑制时,利用细胞内外的阳离子浓度差大量吸收K+,另外NSCCs可能在敏感品种中更多参与K+吸收[25]。
用抑制剂和NaCl联合处理发现,在钾转运载体被抑制时,两品种均表现出最大的K+/Na+比值下降率,在钾离子通道被抑制时K+/Na+比值下降率最小,说明在NaCl胁迫下小麦的K+吸收主要依赖钾转运载体。对钾载体被抑制时下降率差值的比较发现,耐盐品种下降程度要大于敏感品种,进一步说明耐盐品种中钾载体途径占据着更加重要的地位。对于NSCCs而言,2个品种是不同的,在NSCCs被抑制时,敏感品种K+/Na+比值下降率降低,耐盐品种K+/Na+比值下降率升高,说明敏感品种中NSCCs是Na+进入的途径之一,耐盐品种Na+进入细胞可能主要通过钾离子通道。丁同楼等[7]发现NSCCs是盐胁迫下小麦吸收Na+的主要途径,即NSCCs对K+、Na+区分度要明显低于钾离子通道和转运载体,K+的吸收更依赖于钾离子通道和钾转运载体途径。通过以上分析推测,耐盐品种沧6005可能通过提高钾转运载体途径活性即可维持K+/Na+平衡、进而在NaCl早期维持细胞内的K+稳态;而敏感品种的钾转运载体活性较低,导致体内K+降低,造成质膜内外较大的K+浓度差,而Na+顺着离子浓度梯度通过钾离子通道和NSCCs进入胞内。
植物体吸收K+离不开质膜上质子泵为其提供膜内外的质子梯度和电势差[19]。其中质膜H+-ATPase是一种非常重要的质膜蛋白,被称为“主宰酶”,在维持细胞质pH值、跨膜质子驱动力和细胞伸长生长等方面发挥着关键作用。H+-PPase最早发现于液泡膜上,最近研究发现在拟南芥的质膜上也存在H+-PPase,可能与植物抗逆有关[35],质子泵活性与植物耐盐性存在密切联系。
本试验结果显示,250 mmol/L NaCl处理后小麦根部质膜H+-ATPase活性明显降低,且矮抗58的下降程度要大于沧6005,说明前者对NaCl更加敏感。NEM和NaCl联合处理,两品种的酶活性下降趋势更加明显,但敏感品种下降程度反而小于耐盐品种,与单独NaCl胁迫相反,说明钾转运载体可能在耐盐品种中发挥着更大的作用,一旦该途径被抑制,能量和H+的需求量下降,H+-ATPase活性、H+-PPase活性和K+吸收都会降低,进一步证明了上述结果。另外2种抑制剂处理的结果显示,在NaCl和抑制剂联合作用下酶活性并没有进一步降低,说明钾离子通道和NSCCs对质子泵活性的依赖程度较低,因为正常条件下离子通道运输阳离子主要依赖质子泵提供的胞内外H+浓度差和电位差,而NaCl胁迫下胞外存在大量阳离子,离子通道不再需要胞外H+即可打开,因此,质子泵活性并没有因为这2个途径被抑制而降低。
通过测定质膜上K+/H+转运蛋白活性表明,250 mmol/L NaCl处理7 d后,耐盐品种小麦根部质膜K+/H+转运蛋白活性明显高于正常生长,敏感品种则明显低于正常生长,说明耐盐品种可能通过增加质膜K+/H+转运蛋白活性来保持较高的耐盐能力;而NEM和NaCl联合处理后,沧6005的K+/H+转运蛋白活性下降程度要明显大于矮抗58,说明盐胁迫下抑制剂对沧6005的抑制作用更强,沧6005对钾转运载体途径的依赖程度更大。钾转运载体作为高亲和钾吸收途径,通过主动运输对K+的吸收具有高度的专一性[36]。盐胁迫环境下,植物根系处于一个高Na+(低K+)环境,大量Na+进入根系细胞内,K+/Na+降低,植物体主要通过主动运输来加强对K+的吸收[37-38]。在外界高Na+环境下,离子通道可能会成为Na+进入胞内的一个主要途径[7],同时由于其对K+的亲和性较低,如果通道门控打开,大量Na+迅速进入胞内,会引起胞内Na+浓度过高,破坏胞内离子平衡。因此,在盐胁迫条件下植物体更倾向选择亲和性和分辨能力更高的转运载体途径来增加K+的吸收,从而达到胞质内较高的K+/Na+。
小麦作为一种非耐盐作物,对NaCl比较敏感,本研究通过对不同钾吸收途径的研究发现,小麦主要通过钾转运载体来吸收K+,通过离子通道途径来吸收Na+。在高NaCl环境中,细胞质膜质子泵主要为钾转运载体途径提供能量,而钾转运载体途径活性的提高对于维持K+/Na+具有重要作用。
[1] Yu Y,Xu T,Li X,et al. NaCl-induced changes of ion homeostasis and nitrogen metabolism in two sweet potato (IpomoeaBatatasL.) cultivars exhibit different salt tolerance at adventitious root stage[J].Environmental & Experimental Botany,2016,129:23-36.
[2] Kumar K,Kumar M,Kim S,et al. Insights into genomics of salt stress response in rice[J]. Rice,2013,6(1):1-15.
[3] Shabala S,Pottosin I I. Regulation of potassium transport in plants under hostile conditions:implications for abiotic and biotic stress tolerance[J]. Physiologia Plantarum,2014,151(3):257-279.
[4] Khan A,Shaheen Z,Nawaz M. Amelioration of salt stress in wheat(TriticumaestivumL.)by foliar application of nitrogen and potassium[J]. Science Technology & Development,2016,32(2):85-98.
[5] Chen Z,Pottosin I,Cuin T,et al. Root plasma membrane transporters controlling K+/Na+homeostasis in salt-stressed barley[J]. Plant Physiology,2007,145(4):1714-1725.
[6] Sathee L,Sairam R,Chinnusamy V. Differential transcript abundance of salt overly sensitive SOS pathway genes is a determinant of salinity stress tolerance of wheat[J]. Acta Physiologiae Plantarum,2015,37(8):169.
[7] 丁同楼,贾玉辉,鲍 敬,等.不同耐盐性小麦根Na+和K+的吸收特性[J].植物生理学报,2013,49(1):34-40.
[8] Mostofa M,Saegusa D,Fujita M,et al. Hydrogen sulfide regulates salt tolerance in rice by maintaining Na+/K+balance,mineral homeostasis and oxidative metabolism under excessive salt stress[J]. Frontiers in Plant Science,2015,6(662):1055.
[9] Zhang Y M,Zhang H M,Liu Z H,et al. The wheat NHX antiporter geneTaNHX2 confers salt tolerance in transgenic alfalfa by increasing the retention capacity of intracellular potassium[J]. Plant Molecular Biology,2015,87(3):317-327.
[10] 谢亚丽,张屹东,季凯莉,等.转甜瓜钾离子通道基因MIRK拟南芥植株的耐盐性分析[J].上海交通大学学报,2009,27(5):441-447.
[11] Lebaudy A,Eric H,Simonneau T,et al. Heteromeric K+channels in plants[J]. Plant Journal,2008,54(6):1076-1082.
[12] Szczerba M,Britto D,Kronzucker H. K+transport in plants:Physiology and molecular biology[J]. Journal of Plant Physiology,2009,166(5):447-466.
[13] Schachtman D,Tyerman S,Terry B. The K/Na selectivity of a cationchannel in the plasma membrane of root cells does not differ in salt-tolerant and salt-sensitive wheat species[J]. Plant Physiology,1991,97(2):598-605.
[14] Santa-María G E,Rubio F,Dubcovsky J,et al. TheHAK1 gene of barley is a member of a large gene family and encodes a high-affinity Potassium transporter[J]. The Plant Cell,1997,9(12):2281-2289.
[15] Xu Y,Zhou Y,Hong S,et al. Functional characterization of a wheat NHX antiporter geneTaNHX2 that encodes a K+/H+exchanger[J]. PLoS One,2013,8(11):e78098.
[16] Cao D,Hou W,Liu W,et al. Overexpression ofTaNHX2,enhances salt tolerance of composite and whole transgenic soybean plants[J]. Plant Cell Tissue and Organ Culture,2011,107(3):541-552.
[17] Shen Y,Shen L,Shen Z,et al. The potassium transporterOsHAK21 functions in the maintenance of ion homeostasis and tolerance to salt stress in rice[J]. Plant,Cell & Environment,2015,38(12):631-713.
[18] Wang R,Jing W,Xiao L,et al. The rice high-affinity potassium transporter1;1 is involved in salt tolerance and regulated by an MYB-type transcription factor[J]. Plant Physiology,2015,168(3):1076-1090.
[19] Yan F,Zhu Y,Müller C,et al. Adaptation of H+- pumping and plasma membrane H+- ATPase activity in proteoid roots of white lupin under phosphate deficiency[J]. Plant Physiology,2002,129(1):50-63.
[20] Lin S,Tsai J,Hsiao C,et al. Crystal structure of a membrane-embedded H+- translocating pyrophosphatase[J]. Nature,2012,484(7394):399.
[21] Munns R,Tester M. Mechanisms of salinity tolerance[J]. Plant Biology,2008,59(59):651-681.
[22] 周小华,徐慧妮,谷照虎,等.铝胁迫下质膜H+-ATPase对水稻硝态氮吸收的影响[J].植物生理学报,2016,52(7):1011-1018.
[23] Lin H,Guo Y. A calcium-independent activation of theArabidopsisSOS2-like protein Kinase24 by its interacting SOS3-like Calcium binding protein1[J]. Plant Physiology,2014,164(4):2197-2206.
[24] Zhu J K. Plant salt tolerance[J]. Trends in Plant Science,2001,6(2):66-71.
[25] Wang Y,Wang X,Sheng H,et al. Effects of salt stress on potassium uptake through NSCCs of different wheat cultivars[J].Journal of Yangzhou University,2009,3:1-4.
[26] Zhu J K. Genetic analysis of plant salt tolerance usingArabidopsis[J]. Plant Physiology,2000,124(3):941-948.
[27] Borsani O,Valpuesta V,Botella M. Developing salt tolerant plants in a new century:a molecular biology approach[J]. Plant Cell Tissue and Organ Culture,2003,73(2):101-115.
[28] 崔轩龙. Na/H逆向转运蛋白基因ThNHX1和AtNHX2在转基因水稻中的表达与功能分析[D] .广州:中山大学2006.
[29] Zörb C,Noll A,Karl S,et al. Molecular characterization of Na+/H+antiporters(ZmNHX)of maize(ZeamaysL.)and their expression under salt stress[J]. Journal of Plant Physiology,2005,162(1):55-66.
[30] Cuin T,Bose J,Stefano G,et al. Assessing the role of root plasma membrane and tonoplast Na+/H+exchangers in salinity tolerance in wheat:in planta quantification methods[J]. Plant Cell & Environment,2011,34(6):947-961.
[31] Wang Y,Wu W H. Potassium transport and signaling in higher plants[J]. Annual Review of Plant Biology,2013,64(64):451-476.
[32] Shabala S,Cuin T A. Potassium transport and plant salt tolerance[J]. Physiologia Plantarum,2008,133(4):609-611.
[33] Gierth M,Mäser P. Potassium transporters in plants-involvement in K+acquisition,redistribution and homeostasis[J]. FEBS Letters,2007,581(12):2348-2356.
[34] Gierth M,Mäser P. Potassium transporters in plants-involvement in K+acquisition,redistribution and homeostasis[J]. FEBS Letters,2007,581(12):2348-2356.
[35] Bao A K,Wang S M,Wu G Q,et al. Overexpression of theArabidopsisH+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa(MedicagosativaL.)[J]. Plant Science,2009,176(2):232-240.
[36] 邵 群,丁同楼,韩 宁,等.高亲和K+转运载体(HKT)与植物抗盐性[J].植物生理学报,2006,42(2):175-181.
[37] 房业欣.玉米高亲和钾转运体基因ZmHAK1的功能验证[D].长春:吉林大学,2013.
[38] Mangano S,Silberstein S,Santa-María G. Point mutations in the barleyHvHAK1 Potassium transporter lead to improved K+-nutrition and enhanced resistance to salt stress[J]. FEBS Letters,2008,582(28):3922-3928.
EffectsofK+AbsorptionInhibitorsonK+/Na+RatiosandActivitiesofPlasmaMembraneProteinsunderSaltStressinTriticumaestivumL.
ZHANG Huaning1,LI Mengjun2,GUO Xiulin1,ZHANG Yanmin1,LIU Zihui1
(1.Institute of Genetics and Physiology,Hebei Academy of Agriculture and Forestry Sciences,Plant Genetic Engineering Center of Hebei Province,Shijiazhuang 050051,China;2.Shijiazhuang Academy of Agriculture and Forestry Sciences,Shijiazhuang 050000,China)
In order to examine the effects of different K+uptake pathways on the mechanism of salt-tolerance of wheat. Winter wheat cultivars salt-tolerant C6005 and salt-sensitive AK58 were used to investigate the contents of K+and Na+and K+/Na+ratios and plasma membrane proteins activities under NaCl stress and co-treatments with TEA (Tetraethylammonium chloride,K+passway inhibitor),NEM (N-Ethylmaleimide,transporter inhibitor) and Ba (NO3)2(NSCCs inhibitor)respectively in the study.The major results were as follows:250 mmol/L NaCl treatment for 7 days significantly (P<0.05) decreased the K+/Na+ratios of root both salt-tolerant and sensitive cultivars compared with their controls,and C6005 could retain higher K+/Na+ratios than AK58 under NaCl stress. Comparatively,NEM had greater inhibition on both K+contents and K+/Na+ratios than TEA and Ba(NO3)2in both salt-tolerant and sensitive cultivars. Under NaCl stress,when K+transporters were inhibited,K+/Na+ratios of C6005 were decreased more obviously than that of AK58,the activities of plasma membrane H+- ATPase and H+-PPase in both cultivars were decreased,and the change extend was larger in C6005. Meanwhile,the activities of K+/H+transporters in C6005 were inhibited more violently than that in AK58 when pretreated with NEM under stress. The results suggested that K+transporters were the primary approach for K+absorption under salt stress in wheat,especially in salt-tolerant cultivar,and the energy mainly came from H+-ATPase and H+-PPase of proton pump of plasma membranes under salt stress. This work will provide theoretical basis for further analyzing the mechanism of salt-tolerance of wheat.
Wheat; Salt stress; K+/Na+; Plasma membrane proteins; K+absorption
2017-08-02
河北省自然科学基金项目(C2015301014);河北省现代农业科技创新工程项目(2017038997;F17C10006)
张华宁(1988-),男,河北平山人,助理研究员,硕士,主要从事作物抗逆生理与分子生物学研究。
刘子会(1978-),女,河北枣强人,副研究员,硕士,主要从事作物抗逆生理与分子生物学研究。
S512.01
A
1000-7091(2017)05-0154-09
10.7668/hbnxb.2017.05.024
