普通小麦Trx59基因的克隆及功能验证
2017-11-04张鹏钰王国瑞王同朝刘毓侠
张鹏钰,袁 珍,王国瑞,王同朝,尹 钧,3,卫 丽,3,刘毓侠
(1.河南粮食作物协同创新中心,河南 郑州 450002;2.河南农业大学 农学院,河南 郑州 450002;3.国家小麦工程技术研究中心,河南 郑州 450002;4.河南省农业科学院,河南 郑州 450002)
普通小麦Trx59基因的克隆及功能验证
张鹏钰1,2,袁 珍2,王国瑞2,王同朝1,2,尹 钧2,3,卫 丽2,3,刘毓侠4
(1.河南粮食作物协同创新中心,河南 郑州 450002;2.河南农业大学 农学院,河南 郑州 450002;3.国家小麦工程技术研究中心,河南 郑州 450002;4.河南省农业科学院,河南 郑州 450002)
为进一步挖掘小麦春化相关基因,探明小麦春化发育调控机制,从不同春化发育特性小麦品种春化响应转录组高通量测序结果中筛选并克隆到1个EST序列,命名为Trx59,该基因的开放阅读框为372 bp,编码124个氨基酸,保守结构域分析显示,Trx59基因有1个Thioredoxin结构域。利用qRT-PCR分析了在春化处理过程中Trx59基因在不同春化发育特性小麦品种的表达特性,并利用VIGS技术进行基因功能的初步验证。结果表明:随着春化处理时间的延长,Trx59基因的表达量逐渐升高,从表达量和表达时间来看,Trx59基因的表达量和表达时间表现为春性品种高于且早于冬性品种。构建BSMV:Trx59重组载体并接种于小麦植株,14 d后出现明显的光漂白现象,Trx59基因的表达水平急剧降低,说明Trx59基因已被显著抑制;BSMV:Trx59接种的小麦植株穗分化明显晚于阴性对照组,初步判断Trx59基因与小麦发育有关。
小麦;春化;表达分析;病毒诱导的基因沉默;功能验证
硫氧还蛋白(Thioredoxin,Trx)是一类高度保守的低分子量蛋白。自Andersen等[1-2]在大肠杆菌中发现硫氧还蛋白作为核苷酸还原酶的氢供体以来,人们相继在动、植物中发现硫氧还蛋白并对其功能进行了诸多研究。硫氧还蛋白拥有多种生物学功能,其中包括参与调节细胞生长、基因转录等,对维持体内稳定的氧化还原状态起着十分重要的作用[3-4]。有研究认为,Trxh在谷物种子萌发过程中起非常重要的作用。任江萍等[5-6]通过基因枪法将反义Trxs基因导入普通小麦中,发现在种子萌发过程中转Trxs基因小麦植株的Trxh活性明显低于对照,脱支酶活性也低于对照从而增强小麦抗穗发芽的能力。反义Trxs基因对小麦籽粒淀粉积累也有一定的正效应,转基因株系的总淀粉和支链淀粉的积累速率较对照显著提高[7]。硫氧还蛋白通过还原储藏蛋白和其他胚乳蛋白分子内部的二硫键进而增加储藏蛋白对水解作用的敏感性,同时还直接或间接通过抑制蛋白抑制因子来改变酶的活性[8-10]。任江萍和Guo等[11-12]报道,转反义Trxs基因小麦植株在种子发芽过程中谷蛋白降解速度明显慢于对照植株。Trx与植物抗逆性也密切相关,如抗旱、耐热、抗氧化和低温等胁迫。干旱诱导产生的硫氧还蛋白CDSP32,通过保护叶绿体的结构来对抗由干旱引起的氧化胁迫[13]。夏德习等[14]报道,转硫氧还蛋白M1 型基因能够增强植物对逆境的耐受力,尤其是氧化胁迫。在低温胁迫下,水稻中的Trx23被诱导表达从而抑制了MPK3和MPK6的活性[15]。
普通小麦是我国麦类作物的主要栽培种,其发育特性决定了小麦的种植区域[16-17]。本研究从不同春化发育特性小麦品种辽春10和京841春化响应转录组Illumina高通量测序结果中,筛选到1个Unigene59候选基因,经生物学信息分析该基因含有1个Thioredoxin结构域,暂命名为Trx59。本研究系统分析了该基因在不同发育特性小麦品种中的表达特性;并利用VIGS的方法进行基因初步功能验证,以期为研究硫氧还蛋白在低温胁迫下的作用提供依据。
1 材料和方法
1.1试验材料及处理方法
本试验所用小麦品种为春性品种辽春10号(LC10)和冬性品种京841(J841),均由国家小麦工程技术研究中心提供。
春化材料处理方法:挑取籽粒饱满且大小均一的辽春10号和京841小麦种子,用75%酒精浸泡30 s,重复1次,用蒸馏水浸泡5 min,置于黑暗处25 ℃浸泡12 h,待种子萌动后腹沟朝下置于培养皿中放入4 ℃的春化箱中进行低温处理,分别于春化处理7,14,21,28,35,42,49 d后取小麦叶片,液氮速冻后-80 ℃保存。
BSMV病毒沉默材料处理方法:挑选籽粒饱满且大小均一的京841种子,种子消毒处理同春化材料处理方法,待种子萌动出芽1~2 cm后移植萌动沙土∶草炭土=1∶1的花盆中,并放入光照培养箱中培养(25 ℃/18 ℃、16 h光照/8 h黑暗、光照强度350 μmol/(m2·s),当小麦长至两叶一心时,挑选长势一致的小麦植株进行大麦花叶条纹病毒(BSMV)的接种。
1.2总RNA提取及cDNA第一链合成
取上述保存叶片在液氮中细研,采用TRIzol试剂(Invitrogen)提取叶片总RNA。参照反转录试剂盒PrimerScriptRTreagent Kit with gDNA Eraser(TaKaRa)的操作说明进行cDNA第一链的合成。
1.3目的基因克隆
分别以J841和LC10的cDNA为模板,Trx59-F1和Trx59-R1为引物(表1),进行PCR扩增。反应体系25 μL,包含LATaq(5 U/μL)0.2 μL、2×GC BufferⅡ 2 μL、dNTP Mixture(10 mmol/L) 2 μL,上、下游引物(10 μmol/L)各1 μL、cDNA模板1 μL,用ddH2O补齐至25 μL。PCR反应程序为95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃10 min,4 ℃保存。将PCR扩增产物回收纯化后,连接至pMD18-T载体后转化DH5α,经菌液PCR检测挑取阳性单克隆,送往北京华大基因有限公司测序。
1.4实时荧光定量PCR(qRT-PCR)
将不同春化处理7~49 d所取的辽春10号和京 841 的叶片混合后提取RNA,以反转录的cDNA为模板,Trx59-F2和Trx59-R2为引物(表1)进行实时荧光定量 PCR 分析,参照TaKaRa荧光定量PCR SYBR®Green Ⅰ试剂盒说明书进行操作。反应在 Bio-red CFX96 荧光定量 PCR 仪上运行,PCR反应体系为 20 μL,反应程序:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40 个循环;95 ℃ 15 s。以小麦的β-Actin基因为内参基因,每个样品设3 个重复,采用2-ΔΔCt法进行定量分析。
1.5BSMV病毒沉默载体的构建及接种
1.5.1 BSMV病毒沉默载体的构建 选取J841 的cDNA作为模板,用表1中的引物对Trx59-F3和Trx59-R3扩增出Trx59的cDNA编码区全长,连入pMD18-T载体后转化至DH5α,挑取阳性单克隆,经 PCR 检测为阳性后测序鉴定。测序正确的菌液提取质粒,用NheⅠ 酶切BSMV-Trx59-pMD18-T质粒得到目的片段以及BSMV-γ:GFP载体。然后将目的片段与经NheⅠ酶切后的BSMV-γ:GFP载体大片段连接,转化至大肠杆菌DH5α,挑取白色菌斑置于 37 ℃摇菌,提取质粒酶切检测,选取阳性克隆测序验证。将BSMV-α、BSMV-γ和BSMV-γ重组质粒用MluⅠ进行线性化、BSMV-β载体用SpeⅠ限制性内切酶进行线性化及回收纯化。纯化后的BSMV线性化产物,用Promega公司的RiboMAXTM Large Scale RNA Production System-T7和Ribo m7G Cap Analog的试剂盒进行体外转录,以试剂盒中线性化的DNA template为阳性对照。反应结束后,每个体系取2.5 μL体外转录产物进行1%的凝胶电泳检测。
1.5.2 BSMV病毒接种 取BSMV-α 45 μL,BSMV-β 45 μL,BSMV-γ/重组载体45 μL,2×GKP Buffer 135 μL,混合均匀用于病毒接种。接种液摩擦接种于第2叶片,每株5~10 μL,接种完毕后喷施少量0.1% DEPC水以保持湿润,用保鲜膜覆盖3 d,置于光照培养箱(25 ℃/18 ℃、16 h光照/8 h黑暗、光照强度350 μmol/(m2·s)中。BSMV病毒接种3 d后,揭开保鲜膜,定期浇水,观察接种后小麦植株的表型,并于接种7 d开始每周取新生叶片直至第49天,提取总RNA,用于转录水平的检测。

表1 基因克隆和载体构建引物Tab.1 The primers for gene cloning and vector construction
注:引物序列中下划线标注部分为引入的酶切位点序列。
Note:The underline part in primer sequence is the enzyme loci.
2 结果与分析
2.1Trx59基因的克隆及序列分析
以LC10和J841的cDNA为模板,Trx59-F1和Trx59-R1为引物扩增均得到长度为718 bp的片段,与预期产物大小一致(图1)。将PCR产物用DNA凝胶回收试剂盒进行回收,连接至pMD19-T载体后转化至大肠杆菌DH5α,提取质粒进行测序,结果表明,PCR产物与转录组测序结果一致,且J841和LC10的扩增测序结果完全一致。Trx59基因的ORF为372 bp,编码124个氨基酸,保守结构域分析显示,Trx59基因有1个Thioredoxin结构域,属于Thioredoxin家族。

1.J841;2.LC10;M.DL2000。
2.2Trx59基因编码氨基酸的同源序列及进化树分析
运行NCBI软件进行同源序列比对,搜索出多条与Trx59同源的氨基酸序列,用DNAMAN软件对不同物种的氨基酸序列进行分析,发现所有参比序列均含有1个Thioredoxin结构域,Trx59基因编码的氨基酸序列长度与其他物种Thioredoxin结构域序列长度相近,该结构域在序列上非常保守。Trx59基因编码的氨基酸序列与乌拉图小麦、山羊草、大麦、甘蔗、番薯、三叶草氨基酸序列同源性分别达59.0%,56.6%,50.7%,30.0%,29.0%,26.3%(图2)。
运用MEGA5.1软件对这些序列构建遗传进化树,分析不同物种Trx蛋白的进化关系。结果如图3所示,Trx59与乌拉图小麦和山羊草的Trx蛋白亲缘关系最近,其次是大麦,和三叶草、柑橘、菜豆Trx蛋白亲缘关系相对较远。
2.3Trx59基因在不同春化发育特性小麦品种中的表达特性分析
春化处理过程中,Trx59基因在不同春化发育特性小麦品种中均呈抛物线型趋势(图4)。春化处理第14天,Trx59基因在春性品种LC10中表达量急剧升高,于春化42 d时达到峰值,随后表达量下降;Trx59基因在冬性品种J841中表达量缓慢增加,从第35天时表达量急剧升高,于第49天达到最大值,但其表达量仍低于春性品种LC10。从表达量和表达时间来看,Trx59基因的表达在春性品种要高于且早于冬性品种。

图2 Trx59基因编码的氨基酸序列与其他物种氨基酸序列比对Fig.2 Multiple alignment of the amino acid sequences of Trx59 with other species
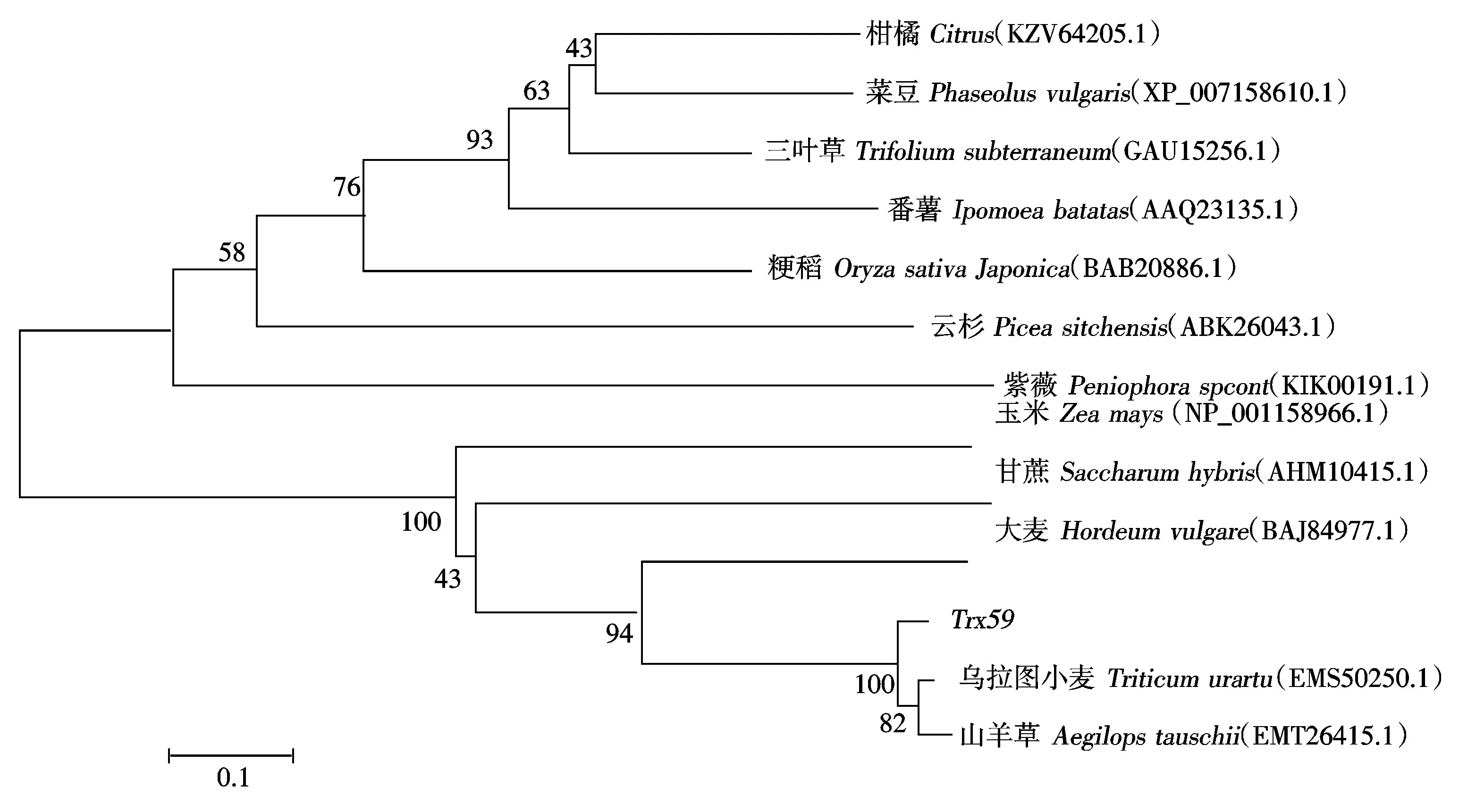
图3 Trx59遗传进化分析Fig.3 A phylogenetic tree analysis of Trx59 with other species
2.4BSMV病毒接种后表型变化及基因表达特性分析
J841小麦植株长到两叶一心时进行BSMV病毒接种,BSMV:Trx59病毒接种后7 d小麦植株第2叶片出现微弱的病毒症状和光漂白现象;接种14 d后,第2叶片光漂白现象明显且进一步扩大,新生出的第3片叶出现白斑,说明病毒已成功侵染小麦植株(图5)。病毒接种21 d后,阴性对照组BSMV:00出现微弱的光漂白现象,BSMV:Trx59接种的小麦植株第2片叶子已完全白化,第3片叶子白化症状非常明显,新生的第4片叶也出现了微弱的失绿表型。BSMV:Trx59病毒接种后第35天,光漂白症状逐渐消失,新生叶片正常生长。

图4 春化处理过程中Trx59基因在LC10和J841中的表达特性分析Fig.4 Relative expression analysis of Trx59 gene in LC10 and J841 under vernalization treatment

图5 BSMV:Trx59接种14 d后小麦植株叶片表型的变化Fig.5 Changes of leaf phenotypes after BSMV:00 and BSMV: Trx59 inoculation at 14 days
BSMV病毒接种后每周挑取生长良好、病毒表型明显的小麦植株叶片,提取总RNA并反转录成cDNA,检测BSMV:Trx59转录本水平表达量变化。定量结果显示:在BSMV病毒接种第7天时,Trx59基因的表达水平急剧降低,约为对照的0.7倍,随着BSMV病毒接种时间的延长,Trx59基因的表达量继续降低;在BSMV病毒接种后第21天,Trx59基因表
达量最低,为对照的36%,说明Trx59基因已被显著抑制(图6)。

图6 BSMV:Trx59病毒接种后Trx59基因表达特性分析Fig.6 Expression analysis of Trx59 genes after the inoculation of BSMV:Trx59 recombinant vector
2.5BSMV-VIGS植株幼穗分化进程分析
小麦幼穗分化受多种因素如品种、光照、温度等的影响。目前人们普遍认为二棱期是小麦通过春化作用的重要指标[18]。BSMV:00和BSMV:Trx59病毒接种14 d后,小麦植株的幼穗分化均处于单棱期;病毒接种21 d后,BSMV:00接种的小麦植株幼穗分化开始进入二棱初期,BSMV:Trx59接种的小麦植株穗分化仍处于单棱期。BSMV:00接种的小麦植株在病毒接种28 d后穗分化进入二棱中期,而BSMV:Trx59接种的小麦植株穗分化刚刚进入二棱初期,明显晚于阴性对照组(表2)。

表2 接种BSMV病毒对小麦幼穗分化的影响Tab.2 Effect of BSMV virus inoculation on spike differentiation process of wheat
3 结论与讨论
硫氧还蛋白广泛存在于生物体内,参与多个生化代谢过程。尽管其有一个保守的活性中心CXXC,但也有不含该基序的蛋白,称为TRX类似蛋白。本研究克隆的Trx59基因不含有CXXC,应归属于TRX类似蛋白。该基因编码124个氨基酸,结构域分析结果显示:该基因有1个Thioredoxin结构域,序列分析表明,不同发育特性小麦品种中该基因序列高度保守,且该基因没有内含子。进化分析结果显示,该基因与乌拉图小麦和山羊草的Trx蛋白亲缘关系最近。
据报道,在各种生物和非生物胁迫下,硫氧还蛋白均被诱导表达。He等[19]发现,马铃薯中的TRXh1基因在4 ℃低温胁迫下表达量升高,从转录水平上调控马铃薯块茎的糖含量。本研究中,Trx59基因在春化处理过程中在不同春化发育特性品种中均呈上调表达趋势,且春性品种早于冬性品种,说明Trx59基因受低温胁迫而被诱导表达,与Xie等[15]和Kocsy等[20]的研究结果一致。
VIGS作为新出现的功能基因组学研究方法,它是利用反向遗传学研究基因的功能,克服了传统功能基因组学研究方法的局限性,操作简单,试验周期短,能够在短时间内产生一个失去目标基因功能的表型,从而进行基因功能验证,所有工作都在一代植物中完成,不需要复杂的突变体筛选,不需要遗传转化,大大降低了成本和劳动强度,而且VIGS能瞬时沉默幼苗或成熟植株靶基因,即使是具有突变致死效应或与生长发育紧密相关的基因,也可用VIGS技术来鉴定功能[21-22]。本研究中采用VIGS方法将Trx59基因沉默后,植株叶片出现白色条纹状带,与空载相比,基因表达量明显降低,进一步说明该基因被沉默。从穗分化进程来看,BSMV:Trx59接种的小麦植株穗分化明显慢于空载,说明Trx59基因沉默后,小麦幼穗分化进程受到抑制,由此可以初步判断Trx59基因与小麦春化发育有关,还需要进行进一步验证。
[1] Andersen J K. Oxidative stress in neurode generation:cause or consequence[J].Nat Med,2004,10 (S1):18-25.
[2] Lillig C H,Holmgren A. Thioredoxin and related molecules-from biology to health and disease[J]. Antioxidants & Redox Signaling,2007,9(1):25-47.
[3] Lu J, Holmgren A.The thioredoxin superfamily in oxidative protein folding[J].Antioxidants & Redox Signaling,2014,27(3):457-470.
[4] Jortzik E, Becker K.Thioredoxin and glutathione systems inPlasmodiumfalciparum[J].International Journalof Medical Microbiology, 2012, 302(4-5):187-194.
[5] 任江萍,王振云,王新国,等. 反义trxs基因导入对小麦籽粒脱支酶活性的影响[J]. 西北植物学报,2007,27(5):926-930.
[6] 任江萍,尹 钧,牛洪斌,等. 反义trxs基因对转基因小麦种子内源trxh基因表达的影[J]. 植物生理与分子生物学学报,2007,33(4):325-332.
[7] 任江萍,王亚英,王新国,等. 反义trxs基因导入对弱筋小麦豫麦18淀粉积累及淀粉合成酶表达的影响[J]. 作物学报,2013,39(10):1856-1863.
[8] Zhou C H, Bian M, Liao H, et al. Identification and immunological characterization of thioredoxin transmembrane-related protein fromClonorchissinensis[J].Parasitology Research, 2013, 112(4):1729-1736.
[9] Wang F B, Kong W L, Niu Y, et al.StTrxF, a potato plastidic thioredoxin F-type protein gene, is involved in starch accumulation in transgenicArabidopsisthaliana[J].Biotechnology & Biotechnological Equipment, 2017, 31(3):486-492.
[10] Li Y B, Han L B, Wang H Y, et al. The thioredoxin GbNRX1 plays a crucial role in homeostasis of apoplastic reactive oxygen species in response toVerticilliumdahliaeInfection in Cotton [J]. Plant Physiology, 2016, 170(4):2392-2406.
[11] 任江萍,李 磊,王新国,等. 反义TrxS基因在小麦中的表达及对小麦种子蛋白酶活性和蛋白组分的影响[J]. 麦类作物学报,2008,28(6):941-945.
[12] Guo H X,Yin J,Ren J P,et al. Changes in proteins within germinating seeds of transgenic wheat with an antisense construct directed against the thioredoxin[J]. Journal of Plant Physiology and Molecular Biology,2007,33(1):18-24.
[13] Sahrawy M,Hecht V,Lopez-Jaramillo J,et al. Intron position as an evolutionary marker of thioredoxins and thioredoxin domains[J]. Journal of Molecular Evolution,1996,42(4):422-431.
[14] 夏德习,管清杰,金淑梅,等. 拟南芥硫氧还蛋白M1型基因(AtTRXm1)与环境逆境之间的关系[J]. 分子植物育种,2007,5(1):21-26.
[15] Xie G S,Kato H,Sasaki K,et al. A cold-induced thioredoxin h of rice,OsTrx23,negatively regulates kinase activities of OsMPK3 and OsMPK6invitro[J].FEBS Letters,2009,583(17):2734-2738.
[16] 尹 钧. 小麦温光发育研究进展I.春化和光周期发育规律[J]. 麦类作物学报, 2016,36(6): 681-688.
[17] 王 翔. 小麦温光反应的分子生物学研究[D]. 北京: 中国农业科学院, 2014.
[18] Jin FF, Wei L. The expression patterns of threeVRNgenes in common wheat (TriticumaestivumL.) in response to vernalization [J]. Cereal Research Communications, 2016, 44(1):1-12.
[19] He T J, Song B T, Liu J,et al.A new isoform of thioredoxin h group in potato, SbTRXh1, regulates cold-induced sweetening of potato tubers by adjusting sucrose content [J]. Plant Cell Reports, 2012, 31(8):1463-1471.
[20] Kocsy G,Kobrehel K,Szalai G,et al. Abiotic stress-induced changes in glutathione and thioredoxin h levels in maize[J]. Environmental and Experimental Botany,2004,52(2):101-112.
[21] Panwar V, Bakkeren G.Investigating gene function in cereal rust fungi by plant-mediated virus-induced gene silencing [J]. Methods in molecular biology, 2017, 1659:115-124.
[22] Bilichak A,Kovalchuk I.Increasing a stable transformation efficiency ofArabidopsisby manipulating the endogenous gene expression using virus-induced gene silencing[J]. Methods MolBiol, 2017, 1456:225-236.
CloningandFunctionalVerificationofTrx59GeneinCommonWheat
ZHANG Pengyu1,2,YUAN Zhen2,WANG Guorui2,WANG Tongchao1,2,YIN Jun2,3,WEI Li2,3,LIU Yuxia4
(1.Collaborative Innovation Center of Henan Grain Crops,Zhengzhou 450002,China;2.School of Agronomy,Henan Agricultural University,Zhengzhou 450002,China;3.National Engineering Research Center for Wheat,Zhengzhou 450002,China;4.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
In order to further excavate the related genes of wheat vernalization,explored the regulation mechanism of wheat vernalization,this study screened and cloned an EST sequence from a high-throughput RNA sequencing analysis comparing the transcriptomes with wheat varieties with different developmental characteristics under vernalization and non-vernalization treatment,and namedTrx59. The open reading frame (ORF) ofTrx59 gene was 372 bp,ecoding 124 amino acids,and contained one thioredoxin domain structure. Expression analysis was conducted by qRT-PCR and the gene function was verification by using VIGS technique. The result showed that the expression level ofTrx59 was gradually up-regulated during vernalizaton process;the expression level and time ofTrx59 gene in spring variety LC10 was higher and earlier than that in winter variety J841. BSMV:Trx59 recombinant vector was built and inoculated wheat plants of J841. After 14 days of inoculation,the leaves appeared visible light bleaching phenomenon,and the expression level ofTrx59 reduced sharply,indicating thatTrx59 gene had been significantly suppressed;the spike differentiation process of plants inoculated by BSMV:Trx59 was later than that of the negative control group,deducing that theTrx59 genes may be related to the wheat developmental characteristics.
Wheat;Vernalization;Expression analysis;VIGS;Functional verification
2017-08-05
国家重点研发计划课题(2017YFD0301106);国家自然科学基金项目(31471452)
张鹏钰(1991-),女,河南郑州人,在读博士,主要从事小麦发育研究。
卫 丽(1966-),女,河南商丘人,研究员,博士,主要从事小麦发育研究。 刘毓侠(1965-),女,河南商丘人,研究员,主要从事作物遗传育种及期刊编辑工作。
Q78;S512.03
A
1000-7091(2017)05-0001-06
10.7668/hbnxb.2017.05.001
