伊立替康载药微球治疗结肠癌肝转移瘤的系统评价
2017-11-04徐新建滕飞杜洪涛
徐新建 滕飞 杜洪涛
·循证医学·
伊立替康载药微球治疗结肠癌肝转移瘤的系统评价
徐新建1滕飞2杜洪涛3
目的:系统评价伊立替康载药微球栓塞(DEBIRI)治疗结肠癌肝转移(CRLM)患者的疗效及安全性。方法:搜索DEBIRI治疗CRLM的相关文献,收集其研究指标包括治疗不良反应、药物代谢动力学、肿瘤治疗反应以及总体生存率等,并进行系统评价综述。结果:共纳入8项观察性研究及2项随机对照试验(RCT)研究,其中观察性研究共纳入578例患者。栓塞后综合征是最常见的治疗不良反应。栓塞治疗后1~2 h血浆内伊立替康水平最高。肿瘤治疗有效率报道差异较大,中位生存期为5.4~25个月不等。2项RCT研究表明DEBIRI治疗CRLM在肿瘤总反应率及无进展生存期方面优于5-氟尿嘧啶/四氢叶酸/伊立替康化疗方案(FOLFOX)。结论:对无手术根治机会的CRLM患者,尤其是对一线治疗无效的患者,DEBIRI是全身化疗或局部治疗无效后的新型替代疗法。
结肠癌肝转移; 伊立替康; 载药微球
经肝动脉化疗栓塞术是目前广泛应用于肝脏恶性肿瘤如肝癌的治疗方法[10-11]。使用载药微球负载伊立替康(drug-eluting beads with irinotecan,DEBIRI)进行肿瘤栓塞治疗后,理论上化疗药物能够在肿瘤微循环内缓慢释放进而提高疗效。自2006年Aliberti等[12]学者首次报道将DEBIRI应用于CRLM的治疗以来,DEBIRI应用于CRLM已经屡见报道,尽管如此,其疗效与安全性尚未得到系统评估。本研究旨在系统评价DEBIRI治疗CRLM的疗效及安全性,以期进行客观、定性评价DEBIRI治疗CRLM的效果。
材料与方法
一、文献检索
在 Pubmed、Embase、Cochrane、万方、中国知网、维普等数据库进行相关文献检索。主要检索词包括以下:肝转移瘤、结肠癌、栓塞、载药微球、伊立替康、liver metastases、colorectal cancer、irinotecan、drugeluting beads、DEBIRI。检索截止日期为2017年3月30日。
二、文献选择
文献选择由两名研究者分别完成:阅读摘要,排除综述、信件、评论、动物试验及其他不相关文献,相关文献阅读全文,通过阅读摘要不能排除的文献也进行阅读全文。当文献出现重复病例报道,只采用最近发表的文献。
三、数据提取
分别由两名研究者单独进行数据提取,提取数据包括患者纳入及排除标准,其他治疗史(包括化疗或手术史)、DEBIRI(载药微球类型、伊立替康剂量及治疗方案)、不良反应、肿瘤治疗反应、生存期及药物代谢动力学。提取数据由两位研究者进行交叉对比。如遇分歧,进行讨论或征求第三方意见解决。由于纳入研究多数缺乏对照组且存在明显异质性,无法行Meta分析,因此本文对表格纳入数据进行定性系统评价。
结 果
一、文献基本资料
共10篇文献[12-21]被纳入本系统评价,其中8篇观察性研究,2篇随机对照性研究(Randomized controlled trial,RCT),文献检索及筛选流程见图 1。8项观察性研究[12-19]共纳入578例患者,2项RCT研究[20-21]被单独分析。纳入标准、排除标准及DEBIRI治疗前化疗史总结于表1。除了2项研究[16,21],其余研究DEBIRI治疗前均接受一种或多种化疗方案。DEBIRI的技术方面(载药微球类型、伊立替康剂量及治疗方案)总结于表2,微球直径以100~300 μm及300~500 μm最为常用,伊立替康浓度以50 g/L最为常用。栓塞技术方面(首次造影、栓塞目标选择及栓塞终点)总结于表3,多数研究均进行了叶/段动脉水平的栓塞,以血流停滞为栓塞终点。
二、治疗不良反应
所有研究均报道相关治疗不良反应。除Eichler等[13]采用药事管理医学词典不良反应标准术语外,其他研究均使用癌症治疗评价系统不良反应通用标准术语(版本 3.0 或 4.0)。多数研究[13-14,16,17-19]均报道不良反应程度较轻(Grade1/2级)。最常见的不良反应是栓塞后综合征(腹痛、恶心、呕吐等)。Mratin等[14]报道栓塞后综合征占所有不良反应的40%~63%。Stutz等[15]研究发现腹痛是最常见的不良反应(59.3%);Aliberti等[12]研究发现栓塞后6 h出现腹痛患者的比例为40%,25%的患者为严重腹痛。严重并发症为1例患者出现呼吸衰竭[18],1例患者死于心肌梗死[14],见表 1。
三、药物代谢动力学
2项研究[13,16]报道了DEBIRI的药物代谢动力学。Eichler等[13]报道伊立替康的血浆半衰期为1.6~7.2 h(平均4.6 h),其代谢产物SN-38的半衰期为7.6~8.5 h(平均 12.4 h)。Martin 等[16]报道血浆内伊立替康及SN-38多于4 h内清除,最迟于24 h内清除。以上2项研究均表明血浆内伊立替康峰值水平于术后1~2h内出现。DEBIRI相关毒性反应未见报道。
四、肿瘤疗效
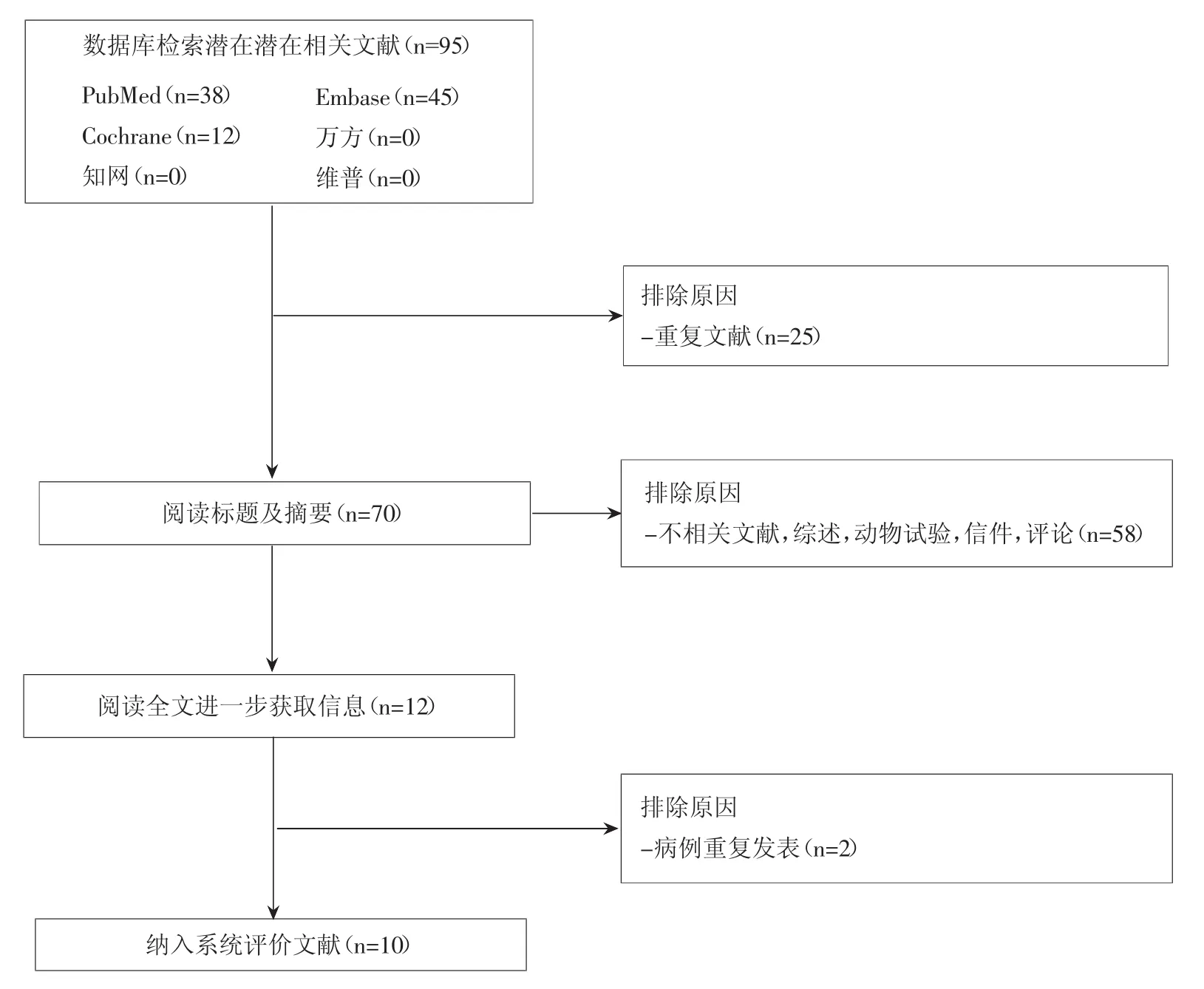
图1 文献检索及筛选流程图
8项研究[12-15,17-19,21]应用改良实体瘤疗效评价标准[22](modif ied response evaluation criteria in solid tumors,RECIST)评价肿瘤疗效。总体反应率(over all response rate,ORR)定义为肿瘤完全缓解(complete response,CR)率及部分缓解(partial response,PR)率之和。治疗后6个月的肿瘤反应率见表1。Eichler等[13]报道治疗后6个月,11例患者中有7例(63%)肝内肿瘤进展,疾病稳定2例(18%),PR 2例(18%)。Vogl等[17]报道治疗前转移瘤平均直径为3.49 cm,治疗后为2.92 cm,缩小了16.3%,差异具有统计学意义。Martin等[14]报道55例术前多次化疗的患者,DEBIRI术后3个月CR率为12%,PR率为53%;术后6个月肿瘤CR率为12%,PR率为38%;术后12个月肿瘤CR率为15%,PR率为25%。Aliberti等[12]报道了82例患者治疗后1月肿瘤体积明显缩小,治疗后3月ORR率为78%;且90%的患者术后生活质量明显提高,平均持续32周(3~39周)。Bhutiani等[18]报道296例接受DEBIRI的患者,术后6个月ORR率为48.3%(143/296),其中127例术前无化疗史的患者术后6个月的ORR率为41.7%(53/127),104例术前接受一线化疗方案的患者术后6个月的ORR率为33.7%(35/104),102例术前接受二线化疗方案的患者术后6个月的ORR率为42.2%(43/102),58例术前接受三线化疗方案的患者术后 6个月的 ORR率为 20.7%(12/58)。
五、总体生存期
6 项研究[12,14-17,19]报道了中位生存期,从 5.4 个月至25个月不等。Eichler等[13]采用Kaplan-Meier曲线计算了患者的疾病进展期。从第1次治疗到疾病进展的中位时间为154 d。Iezzi等[19]报道20例接受DEBIRI治疗的患者中位无进展生存期为4个月,中位生存期为7.3个月。Martin等[14]报道55例患者中位无进展生存期为11个月,55%的患者术后1年仍存活。对于仅合并肝转移瘤的患者,无进展生存期为15个月,1年总体生存率为75%。另外,Bhutiani等[18]报道296例接受DEBIRI治疗的病例,术前未接受及接受一线、二线、三线化疗方案的患者6月总体存活率分别为90%、93%、90%、90%;12月总体存活率分别为76%、71%、77%、87%。
六、RCT研究结果
在Fiorentini等[20]开展的RCT研究中,74例患者被随机分为DEBIRI治疗组(n=36)及8周期的5-氟尿嘧啶/四氢叶酸/奥沙利铂(5-fluorouracil/leucovorin/oxaliplatin,FOLFOX)治疗组(n=28)。2 组患者的基线数据、疾病严重程度及先前治疗方案具有可比性。所有患者均经病理证实为无根治机会的CRLM,且转移瘤占肝脏体积小于50%。DEBIRI组患者24个月及30个月总体生存率分别为56%及34%,而FOLFOX组分别为32%及9%(P=0.031)。DEBIRI组中位生存期及疾病无进展期分别为22个月及7个月,FOLFOX组分别为15个月及4个月。DEBIRI组有4%的患者出现白细胞减少症,而FOLFOX组为44%,差异有统计学意义;DEBIRI组和FOLFOX组的腹泻发生率分别为6%及18%,差异无统计学意义(P=0.073);DEBIRI组黏膜炎发生率(1%)低于FOLFOX组(20%),差异具有统计学意义(P=0.00002);腹痛在DEBIRI组更为常见(30%vs.0)。在总体生存期、疾病无进展期及生活质量评分方面,DEBIRI组显著优于FOLFOX组。

表1 纳入文献资料
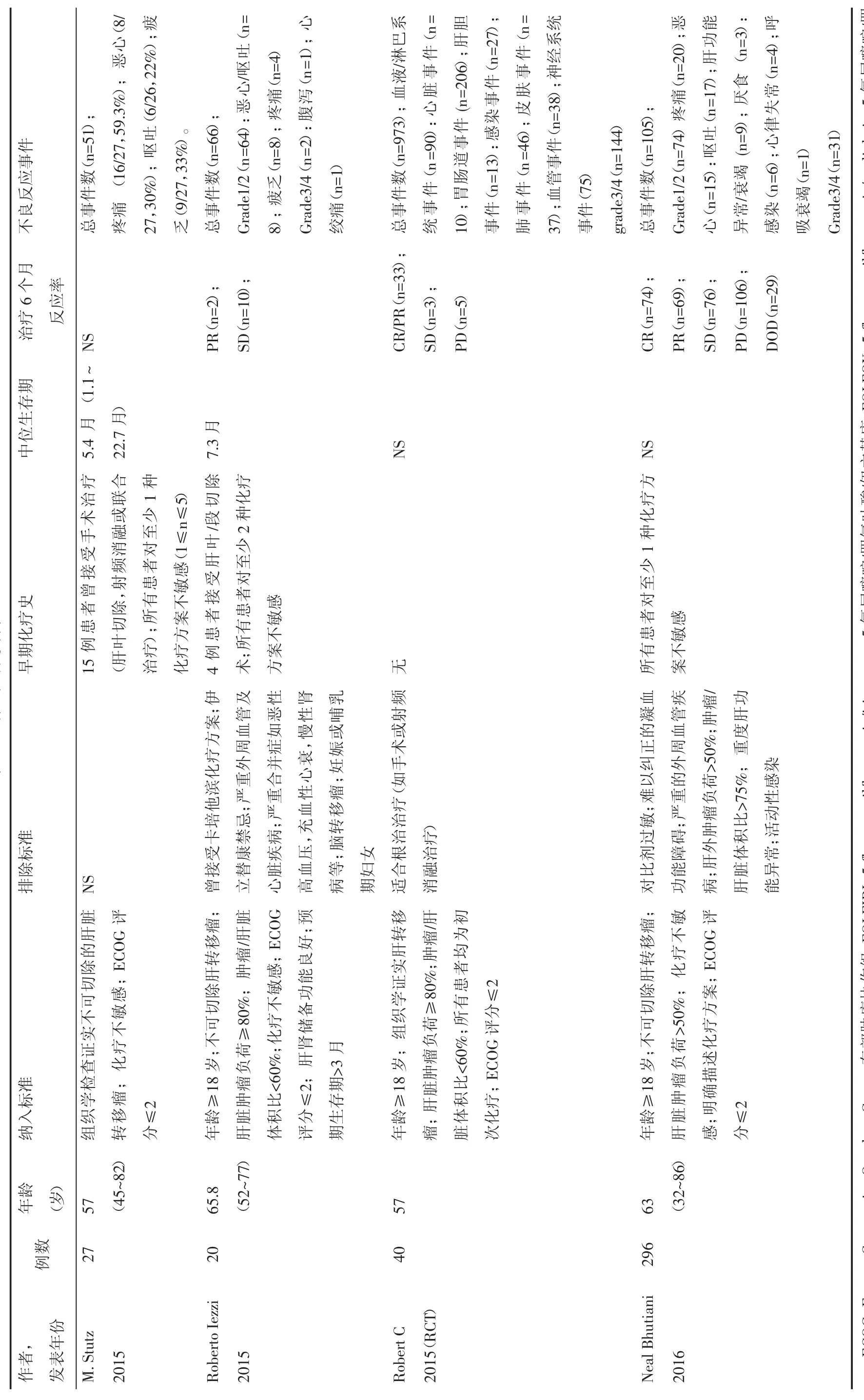
表1 纳入文献资料
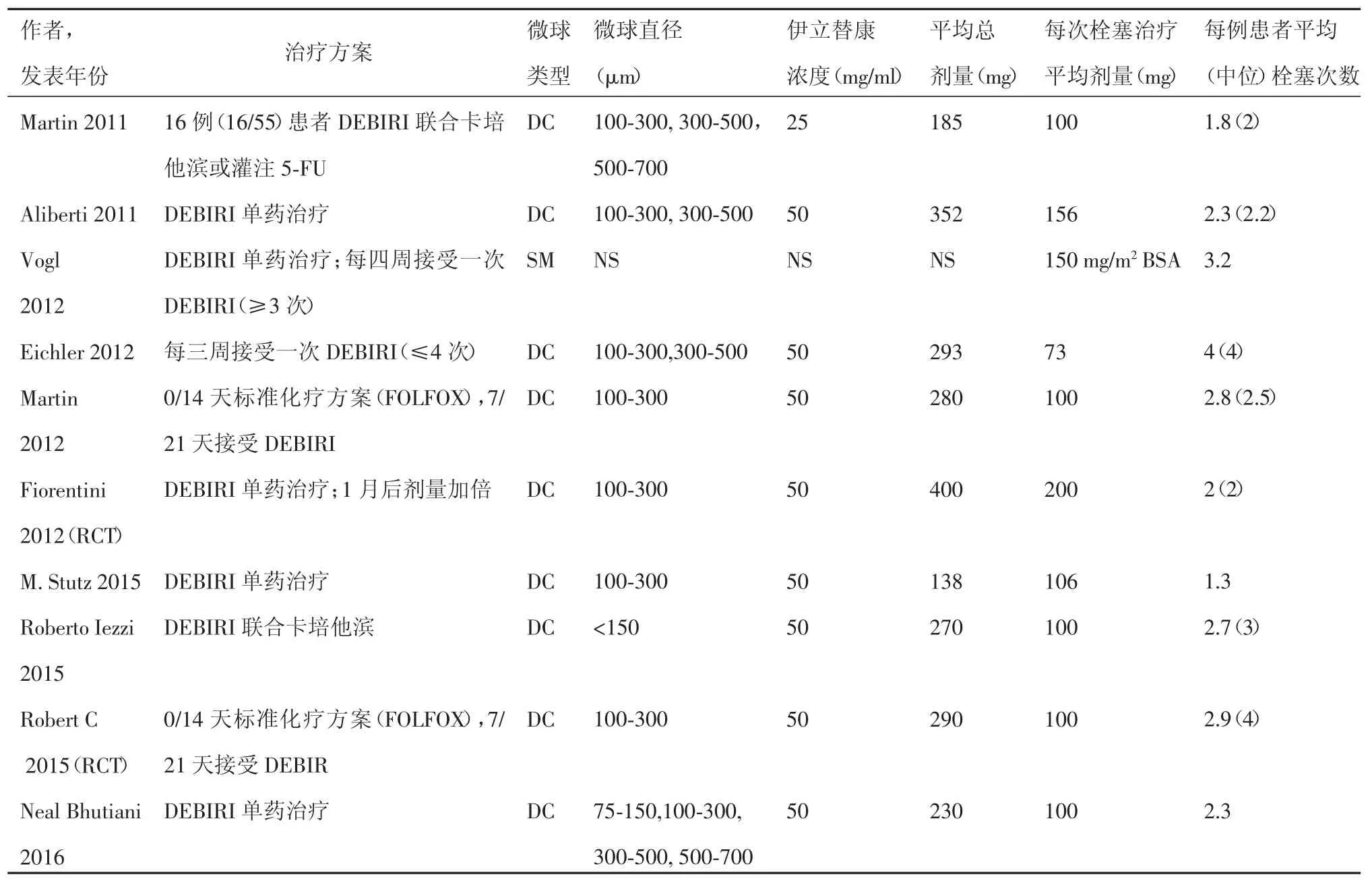
表2 纳入文献伊立替康载药微球资料
在Martin等[21]开展的RCT研究中,70例患者被随机分为FOLFOX+DEBIRI治疗组(n=40)及FOLFOX对照组(n=30)。2组患者基线数据、疾病严重程度及先前治疗方案具有可比性。患者年龄≥18岁,均经组织学证实为肝转移瘤,肝脏肿瘤负荷≥80%,肿瘤/肝脏体积比<60%;所有患者均为初次接受化疗;ECOG评分≤2。治疗组治疗2个月(78%vs.54%,P=0.02)、4 个月(95%vs.70%,P=0.03)及 6个月(76%vs.60%,P=0.05)的ORR率均高于对照组;治疗组在肿瘤降期治疗方面亦显示出高于对照组的趋势(35%vs.16%,P=0.05);治疗组中位疾病无进展期亦长于对照组(15.3个月vs.7.6个月)。尽管治疗组Grade3/4级不良反应发生率高于对照组,但主要为栓塞相关并发症(如腹痛、急性肾功能衰竭、腹水、胆囊炎、高血压、胰腺炎等),而两组化疗相关不良反应发生率无明显差异。作者认为与单纯FOLFOX方案比较,FOLFOX联合DEBIRI方案没有增加化疗毒性,且能够明显提高肿瘤反应率,延长肝脏无进展生存期,在肿瘤降期治疗方面疗效也更显著,是安全有效的治疗方法。
讨 论
手术根治切除仍是CRLM最有效的治疗方法,其五年生存期为30%~70%[23-24]。尽管如此,仅有约25%的患者有机会受手术切除治疗。即使患者接受手术根治治疗,复发率也高达75%[25]。因此,仍需要姑息治疗将肿瘤降期至能够接受根治手术的水平。
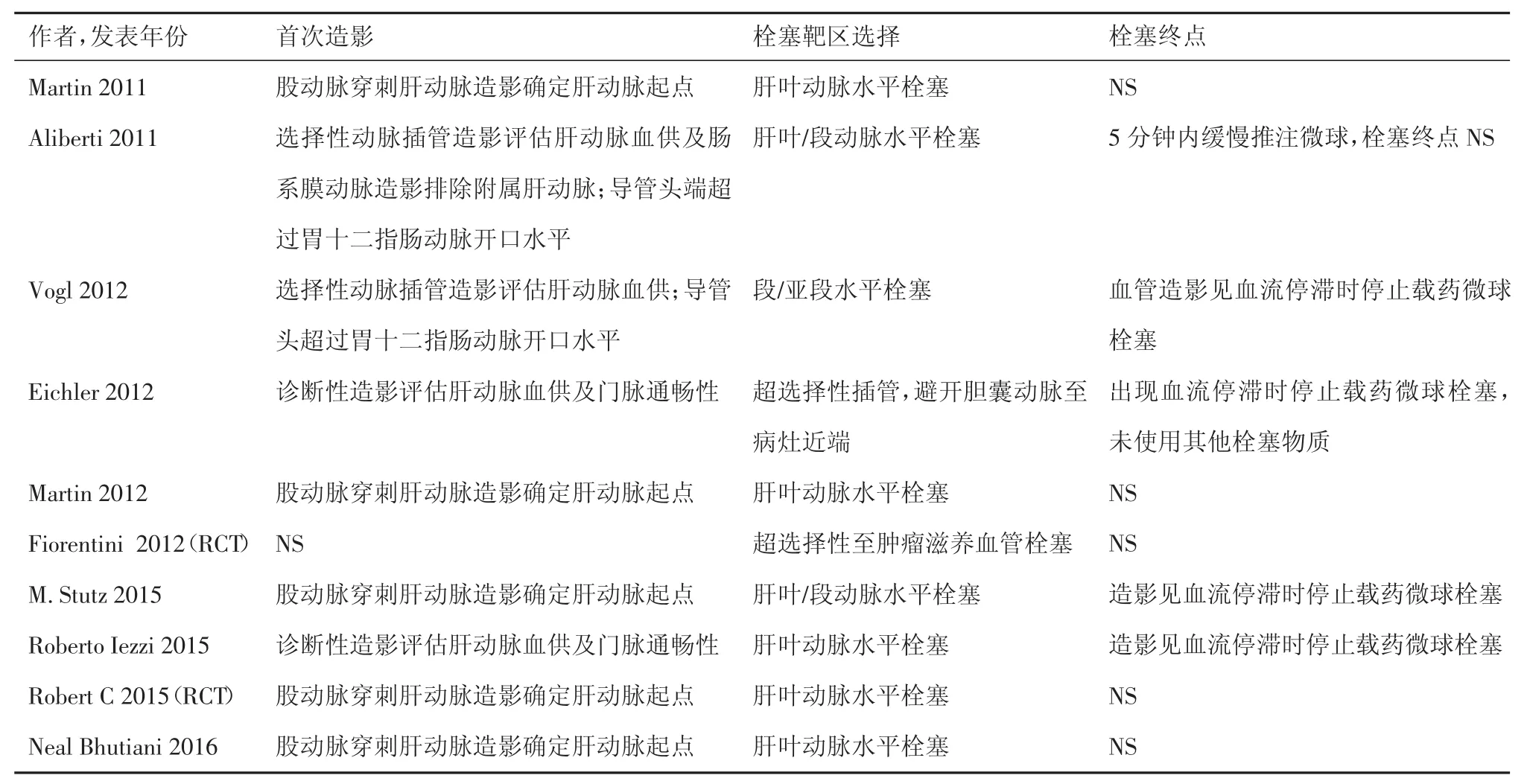
表3 纳入文献栓塞技术方面资料
伊立替康载药微球栓塞治疗CRLM是一种新型替代疗法,通过超选择性插管技术将伊立替康载药微球准确输送至肿瘤血管内,使得伊立替康逐渐释放并直接作用于肿瘤部位[26],2项研究表明血浆内伊立替康及其代谢产物SN-38术后24 h内基本完全代谢。该技术可重复治疗且安全性高,研究表明DEBIRI治疗CRLM的不良反应较少见,最常见反应为栓塞后综合征,对症处理后多可缓解或消失;严重不良反应较罕见,仅有1例患者死于心肌梗死,1例患者出现呼吸衰竭。
本系统评价研究表明DEBIRI治疗CRLM的中位生存期为5.4~25个月,与CRLM采用全身化疗的最好预后指标相似[7]。并且,本研究中多数患者对于一线甚至多线的化疗方案治疗无效,然而DEBIRI却能够显著提高他们的无进展生存期,充分表明了DEBIRI在治疗CRLM的巨大潜力。
本研究中仅有2项RCT研究,虽然分配方法为随机分配,但分配序列、盲法及分配隐藏未明确提及。关于结局指标质量评价及选择性报道偏倚等相关信息也未明确提及。尽管该2项研究纳入样本量均较小,但研究结果显示DEBIRI方案或FOLFOXDEBIRI方案治疗CRLM在肿瘤总反应率及无进展生存期方面均优于FOLFIRI方案。但鉴于这2项研究方法学上存在的缺陷,其研究结果必须被审慎对待,在DEBIRI广泛应用前,尚需要更多大样本、高质量的RCT研究进一步进行验证其临床疗效。
DEBIRI能够对CRLM进行降期治疗使患者重新获得手术机会。近来越来越多的证据表明CRLM化疗后患者接受根治手术的生存获益与早期手术根治切除相似[27-28]。近期对于CRLM一项常规化疗方案表明64%的患者治疗反应有效,其中22.5%的患者最终接受根治手术[29]。Bower[30]等报道了55例DEBIRI治疗CRLM患者,11例(20%)患者最终接受根治切除或消融治疗。另外,Martin等[22]学者近期的一项RCT研究表明,FOLFIRI联合DEBIRI在肿瘤降期治疗方面优于FOLFIRI方案(35%vs.16%),且未明显增加患者的肝肾毒性反应,提示FOLFIRI联合DEBIRI方案可能成为一种很有希望的CRLM降期治疗手段。
生活质量是癌症患者另一项重要评价指标,尤其是对无法治愈的癌症患者和接受姑息治疗的患者。研究显示DEBIRI具有较好的治疗耐受性及较低的副作用发生率;Fiorentini等[21]研究表明DEBIRI的生活质量评分明显高于FOLFIRI化疗方案,且DEBIRI改善生活质量时间也明显长于FOLFIRI方案。该研究也比较了DEBIRI(包括介入治疗费用)及FOLFIRI方案的费用:6个月疗程的FOLFIRI联合贝伐单抗、FOLFIRI方案、FOLFIRI联合西妥昔单抗方案的总医疗费用分别是DEBIRI的11.3倍、4.5倍及10.9倍。
本系统评价结果表明DEBIRI与标准化疗方案比较,中位生存期相似,且有助于CRLM的降期治疗,不良反应相对较低且费用可接受。尽管如此,纳入研究表明DEBIRI治疗CRLM在疗效及不良反应方面存在较大异质性。患者纳入及排除标准的差异、DEBIRI治疗前化疗史、DEBIRI单次使用剂量、每例患者DEBIRI治疗次数、结局指标评价及选择性报道偏倚等均可能是引起异质性的相关因素。另外,除了2项RCT研究,其余研究均为观察性研究且无对照组,且RCT研究的方法学质量也较低,因此仍需大样本、多中心、高质量RCT研究进一步确定DEBIRI疗效。
1 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].Ca A Cancer Journal for Clinicians,2005,55(2):74-108.
2 Slesser AA,Georgiou P,Brown G,et al.The tumour biology of synchronous and metachronous colorectal liver metastases:a systematic review[J].Clin Exp Metastasis,2013,30(4):457-470.doi:10.1007/s10585-012-9551-8.
3 Scheele J,Stang R,Altendorf-Hofmann A,et al.Resection of colorectal metastases[J].World J Surg,1995,19(1):59-71.
4 Gayowski TJ,Iwatsuki S,Madariaga JR,et al.Experience in hepatic resection for metastatic colorectal cancer:analysis of clinical and pathologic risk factors[J].Surgery,1994,116(4):703-710.
5 Ekberg H,Tranberg KG,Andersson R,et al.Determinants of survival in liver resection for colorectal secondaries[J].Br J Surg,1986,73(9):727-731.
6 Manfredi S,Lepage C,Hatem C,et al.Epidemiology and management of liver metastases from colorectal cancer[J].Ann Surg,2006,244(2):254-259.doi:10.1097/01.sla.0000217629.94941.cf
7 Goldberg RM,Sargent DJ,Morton RF,et al.A randomized controlled trial of fluorouracil plus leucovorin,irinotecan,and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer[J].J Clin Oncol,2004,22(22):23-30.doi:10.1200/JCO.2004.09.046.
8 Fyfe GA,Hurwitz H,Fehrenbacher L,et al.Bevacizumab plus irinotecan/5-FU/leucovorin for treatment of metastatic colorectal cancer results in survival benefit in all pre-specified patient subgroups[J].J Clin Oncol,2004,22(14):3617.
9 Sobrero AF,Maurel J,Fehrenbacher L,et al.EPIC:phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer[J].J Clin Oncol,2008,26(14):2311-2319.doi:10.1200/JCO.2007.13.1193.
10 Bruix J,Sherman M,Practice Guidelines Committee,American Association for the Study of Liver Diseases.Management of hepatocellular carcinoma[J].Hepatology,2005,42(5):1208-1236.doi:10.1002/hep.20933.
11 Yao KA,Talamonti MS,Nemcek A,et al.Indications and results of liver resection and hepatic chemoembolization for metastatic gastrointestinal neuroendocrine tumors[J].Surgery,2001,130(4):677-682.doi:10.1067/msy.2001.117377.
12 Aliberti C,Tilli M,Benea G,et al.Trans-arterial chemoembolization(TACE)of liver metastases from colorectal cancer using irinotecaneluting beads:preliminary results[J].Anticancer Res.,2006,26(26):3793-3795.
13 EichlerK,ZangosS,MackMG,etal.Firsthumanstudyintreatmentof unresectable liver metastases from colorectal cancer with irinotecanloaded beads(DEBIRI)[J].Int J Oncol,2012,41(4):1213-1220.doi:10.3892/ijo.2012.1572.
14 Martin RC,Joshi J,Robbins K,et al.Hepatic intra-arterial injection of drug-eluting bead, irinotecan(DEBIRI)in unresectable colorectal liver metastases refractory to systemic chemotherapy:results of multi-institutional study[J].Ann Surg Oncol,2011,18(1):192-198.doi:10.1245/s10434-010-1288-5.
15 Stutz M,Mamo A,Valenti D,et al.Real-life report on chemoembolization using DEBIRIforlivermetastasesfrom colorectal cancer[J].Gastroenterol Res Pract,2015,2015:715102.doi:10.1155/2015/715102.
16 Martin RC 2nd,Scoggins C R,Tomalty D,et al.Irinotecan drugeluting beads in the treatment of chemo-naive unresectable colorectal liver metastasis with concomitant systemic fluorouracil and oxaliplatin:results of pharmacokinetics and phase I trial[J].J Gastrointest Surg,2012,16(8):1531-1538.doi:10.1007/s11605-012-1892-8.
17 Vogl TJ,Jost A,Noureldin NA,et al.Repeated transarterial chemoembolisation using different chemotherapeutic drug combinations followed by MR-guided laser-induced thermotherapy in patients with liver metastases of colorectal carcinoma[J].Br J Cancer,2012,106(7):1274-1279 doi:10.1038/bjc.2012.69.
18 Bhutiani N,Akinwande O,Martin RC 2nd.Efficacy and toxicity of hepatic intra-arterial drug-eluting (Irinotecan)bead(DEBIRI)therapy in irinotecan-refractory unresectable colorectalliver metastases[J].World J Surg,2016,40(5):1178-1190.doi:10.1007/s00268-015-3386-9.
19 Iezzi R, Marsico VA, Guerra A, et al. Trans-arterial chemoembolization with irinotecan-loaded drug-eluting beads(DEBIRI)and capecitabine in refractory liver prevalent colorectal metastases:A phase II single-center study[J].Cardiovasc Intervent Radiol,2015,38(6):1523-1531.doi:10.1007/s00270-015-1080-9.
20 Fiorentini G,Aliberti C,Tilli M,et al.Intra-arterial infusion of irinotecan-loaded drug-eluting beads (DEBIRI)versus intravenous therapy (FOLFIRI)for hepatic metastases from colorectal cancer:final results of a phase III study[J].Anticancer Res,2012,32(4):1387-1395.
21 Martin RC 2nd,Scoggins CR,Schreeder M,et al.Randomized controlled trial of irinotecan drug-eluting beads with simultaneous FOLFOX and bevacizumab for patients with unresectable colorectal liver-limited metastasis[J].Cancer,2015,121(20):3649-3658.doi:10.1002/cncr.29534.
22 Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.doi:10.1016/j.ejca.2008.10.026.
23 Rees M,Tekkis PP,Welsh FK,et al.Evaluation of long-term survival afterhepatic resection formetastatic colorectalcancer:a multifactorial model of 929 patients[J].Ann Surg,2008,247(1):125-135 doi:10.1097/SLA.0b013e31815aa2c2.
24 Smith MD,Mccall JL.Systematic review of tumour number and outcome after radical treatment of colorectal liver metastases[J].Br J Surg,2009,96(10):1101-1113.doi:10.1002/bjs.6735.
25 Bhattacharjya S,Aggarwal R,Davidson BR.Intensive follow-up after liver resection for colorectal liver metastases:results of combined serial tumour marker estimations and computed tomography of the chest and abdomen-a prospective study[J].Br J Cancer,2006,95(1):21-26.doi:10.1038/sj.bjc.6603219.
26 Tang Y,Taylor RR,Gonzalez MV,et al.Evaluation of irinotecan drug-eluting beads:a new drug-device combination product for the chemoembolization of hepatic metastases[J].J Control Release,2006,116(2):e55-e56.doi:10.1016/j.jconrel.2006.09.047.
27 Baize N,Gerard B,Bleiberg H,et al.Long-term survival of patients downstaged by oxaliplatin and 5-fluorouracil combination followed by rescue surgery for unresectable colorectal liver metastases[J].Gastroenterol Clin Biol,2006,30(12):1349-1353.
28 Adam R,Delvart V,Pascal G,et al.Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy[J].Ann Surg,2004,240:644-657.
29 Lam VW,Spiro C,Laurence JM,et al.A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases[J].Ann Surg Oncol,2012,19(4):1292-1301.doi:10.1245/s10434-011-2061-0.
30 Bower M,Metzger T,Robbins K,et al.Surgical downstaging and neo-adjuvant therapy in metastatic colorectal carcinoma with irinotecan drug-eluting beads:a multi-institutional study[J].HPB,2010,12(1):31-36.doi:10.1111/j.1477-2574.2009.00117.x.
A systematic review of transarterial chemoembolization with irinotecan beads in treatment of colorectal liver metastases
Xu Xinjian1, Teng Fei2, Du Hongtao3.1Department of Interventional Radiology, Taizhou Hospital of Zhejiang Province, Taizhou 317000, China;2Department of Interventional Radiology, The No, 1 People's Hospital of Ningbo, Zhejiang Province, Ningbo 315000, China; 3Radiology, XuZhou Central Hospital, Jiangshu Province, Xuzhou 221000 China.
Objective:To systematicly evaluate the efficacy and safety of transarterial embolization with drug-eluting beads of irinotecan (DEBIRI)for treatment of unresectable colorectal liver metastasis(CRLM).Methods:A comprehensive search of medical literature identified the studies describing the use of DEBIRI in treatment of CRLM.Data describing adverse events, pharmacokinetics, tumor response, and overall survival were collected.Results:Eight observational studies and two randomized controlled trials(RCTs)were reviewed.A total of 578 patients were included in the descriptive analysis of observational studies.Postembolization syndrome was the most common adverse event.Peak plasma levels of irinotecan were observed after 1~2 h of administration.Wide variations in tumor response were observed.The median survival time ranged from 5.4 months to 25 months.In the two RCTs, treatment with DEBIRI was superior to systemic chemotherapy with 5-fluorouracil/leucovorin/irinotecan in terms of overall response rate and progression-free survival.Conclusions:For patients with unresectable CRLM,particularly after failure to respond to first-line regimens,DEBIRI represents a novel alternative to systemic chemotherapy alone or other local treatments.
Colorectal liver metastasis; Irinotecan; Drug-eluting beads
结肠癌是世界范围内的第三大恶性肿瘤,15%~20%的患者诊断时即发现合并结肠癌肝转移(colorectal liver metastasis,CRLM),另外有 50%的患者会进展为不可切除CRLM[1-2]。研究认为适合行手术根治的CRLM必须满足以下条件:肝内肿瘤直径<5cm、肝内转移瘤数量<4个且肿瘤为单侧分布[3-5]。尽管约40%的结肠癌患者肝脏是其唯一的转移部位,但适合手术切除的CRLM不到20%[6]。5-氟尿嘧啶联合四氢叶酸是CRLM患者的标准化疗方案,其中位生存期约为12个月。联合应用伊立替康及奥沙利铂能将患者中位生存期增加至20个月[7],再联合应用贝伐单抗及吉西妥昔单抗仅能增加较小的额外获益[8-9],许多CRLM患者仍然没有手术机会,需要其他治疗方法。
Du Hongtao, Email:HongtaoDudht 678@qq.com
10.3877/cm a.j.i ssn.2095-5782.2017.04.015
317000浙江省台州医院血管介入中心1;315000浙江省宁波市第一人民医院放射科2;221000江苏省徐州中心医院放射科3
杜洪涛,Email:dht678@qq.com
2017-01-06)
(本文编辑:闫娟)
徐新建,滕飞,杜洪涛.伊立替康载药微球治疗结肠癌肝转移瘤的系统评价[J/CD].中华介入放射学电子杂志,2017,5(4):273-281.
