泛素特异蛋白酶20在乳腺癌组织中的表达及其临床意义
2017-11-02周方方朱晓华荣欣欣刘家有杨懿候令密谢少利邓世山
周方方,朱晓华,荣欣欣,刘家有,杨懿,候令密,谢少利,邓世山
(1.川北医学院人体解剖学教研室;2.川北医学院附属医院普外科,四川 南充 637000)
泛素特异蛋白酶20在乳腺癌组织中的表达及其临床意义
周方方1,朱晓华1,荣欣欣1,刘家有1,杨懿1,候令密2,谢少利2,邓世山1
(1.川北医学院人体解剖学教研室;2.川北医学院附属医院普外科,四川 南充 637000)
目的通过分析乳腺癌的临床病理特征及观察乳腺癌组织细胞中泛素特异蛋白酶20(ubiquitin-specific proteases 20,USP20)的表达情况,探讨二者间的关系及USP20的临床意义。方法收集经临床病理确诊为浸润性导管癌的乳腺癌组织标本42例,同时选取癌旁相对正常组织作为对照;采用免疫组织化学方法检测USP20在乳腺癌和癌旁组织中的表达情况。结果42例乳腺癌组织中,27例(64.29%)USP20呈阳性表达,与癌旁组织阳性表达(21.43%)相比显著增加(χ2=15.75,P<0.01);病理分型中,低分化与高、中分化的总和比较,USP20阳性表达率明显增加(P<0.05);临床分期越晚,USP20阳性表达率越高(χ2=8.571,P<0.05)。结论乳腺癌组织中USP20阳性表达与肿瘤分化程度、临床分期有密切关系,提示USP20与乳腺癌恶性程度成正相关,这为临床治疗、预后及进一步研究提供重要的实验依据。
乳腺癌;泛素特异性蛋白酶20;临床分期;分化程度
乳腺癌发病率逐年提高,病情严重,死亡率高,严重威胁着女性患者的生命健康,给家庭和社会带来巨大的经济负担。目前研究主要集中在雌激素受体、肿瘤干细胞及各种信号通路[1-2]等,虽然已经取得了一定的成果,但乳腺癌的具体发病机制仍不清楚,而且很难应用于临床。随着科技的发展、预防和防范意识不断提高,乳腺癌的治愈率也有所提高,但是许多乳腺癌患者由于肿瘤的浸润与转移,其治疗效果仍然不理想。泛素特异蛋白酶20(ubiquitin-specific proteases 20,USP20)是泛素特异性蛋白酶家族中的一员,参与调控底物蛋白在人体内的产生与降解的动态平衡,从而维持正常生命活动。目前USP20对肿瘤的作用及相关机制的研究较少,在乳腺癌组织细胞中的表达及相关研究尚未见报道。我们通过免疫组织化学染色与临床病例查阅方法,分析乳腺癌的临床病理特征及观察乳腺癌组织细胞中USP20的表达情况,以探讨二者间的关系及USP20的临床意义。
1 材料方法
1.1标本来源
收集2014年1月至2015年12月在本校附属医院经病理科确诊的浸润性导管乳腺癌石蜡包埋标本42例。由于某些临床资料的缺失,42例患者中能够明确分子分型的共有34例,明确淋巴结转移情况的共有35例,明确WHO分级的共有39例,其它资料完整。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)和KI-67的表达情况将乳腺癌分成4种分子亚型即Luminal A型[ER(+)或PR(+)且HER2(-),KI-67低表达(<14%)],Luminal B型[ER(+)或PR(+)且HER2(-),KI-67高表达(≥14%),或者ER(+)或PR(+)且HER2(+),KI-67任意水平],HER-2过表达型[ER(-)、PR(-)且HER2(+),KI-67任意水平],三阴性[ER(-)、PR(-)且HER2(-)]。本次收集的临床标本Luminal A型有11例,Luminal B型12例,HER-2过表达型5例,三阴性6例。有淋巴转移的13例,无转移的22例。低分化16例,中分化21例,高分化2例。42例患者中男性1例,女性41例;年龄36~88岁,中位年龄49岁。肿瘤大小T1期14例,T2期18例,T3期3例,T4期7例。临床分期I期7例,II期18例,III期14例,IV期3例。同时在42例乳腺癌病例中,选取经病理确诊的癌旁组织42例。
1.2免疫组化试剂及操作
切片常规脱蜡、水化、高压抗原修复,3%H2O2去离子水常温10 min灭活内源性过氧化氢酶活性,PBS漂洗后10%的羊血清37 ℃ 10 min封闭非特异性抗原,滴加兔抗-USP20多克隆抗体(1∶50,Proteintech公司)一抗4 ℃冰箱过夜;PBS漂洗后滴加二抗(山羊抗兔IG,即用液, pv-6001,北京中杉金桥生物技术有限公司),37 ℃恒温箱中40 min,PBS漂洗,DAB显色;苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。最后镜下观察并拍照。
1.3免疫组化结果判断标准
结果判定采用二级计分法[3]。染色强度分级计分标准为:无显色为0分;黄或深黄色为2分;褐或棕褐色为3分。阳性细胞计分标准为≤5%为0分;>5%~25%为1分;>25%~50%为2分;>50%~75%为3分;>75%为4分。两者计分的乘积作为判断标准:0分为阴性(-);1~4分为弱阳性(+);5~8分为阳性(++);9~12分为强阳性(+++)。为了便于统计,将阴性和弱阳性定义为阴性(-),阳性和强阳性定义为阳性(+)。
1.4统计学分析
结果采用SPSS 13.0统计软件进行检验。计数资料采用χ2检验。P<0.05差异具有统计学意义。
2 结果
2.1癌组织和癌旁组织中USP20阳性表达差异比较
USP20免疫组化结果(图1)显示乳腺癌组织中癌巢周围USP20大量表达,并且呈树根状向远处扩散,阳性表达主要定位于细胞质,呈片状、弥散分布,着色深浅程度不一,细胞核中仅有少量表达。与42例癌旁组织比较,42例乳腺癌组织中USP20阳性表达率(27/42,64.29%)显著高于癌旁组织(9/42,21.43%),两者比较差异具有统计学意义(χ2=15.75,P<0.01)。
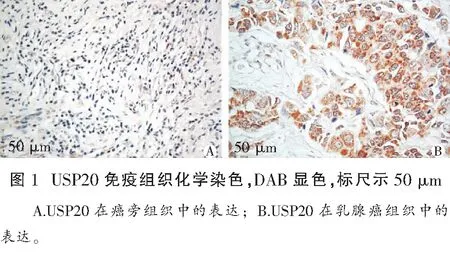
2.2乳腺癌组织中USP20的阳性表达与临床病理特征之间的关系
免疫组织化学统计结果显示,USP20在人乳腺癌中的阳性表达与性别、年龄、T分级、分子分型和有无淋巴结转移无关。与肿瘤分化程度有关,肿瘤分化程度越低,USP20阳性表达率越高,其中低分化与高+中分化比较,差异具有统计学意义(P=0.049);与临床分期有关,临床分期越晚,USP20阳性表达率越高(χ2=8.571,P<0.05)(表1)。
3 讨论
蛋白质的泛素化修饰是一种广泛存在且非常重要的蛋白质翻译后修饰,调控许多生物学功能,包括细胞周期、细胞凋亡、DNA损伤修复、肿瘤生长、炎症过程[4-5]等。蛋白质的泛素化是一个可逆的过程,去泛素化酶(deubiquitinases,DUBs)通过对底物蛋白的去泛素化来调控蛋白质的寿命,稳定泛素蛋白酶体系统的动态平衡,其表达紊乱是诱发多种疾病的主要原因。细胞内广泛存在多种DUBs,按结构的不同可以分为5种类型,其中泛素特异性蛋白酶(ubiquitin-specific proteases,USPs)是DUBs中成员最多且结构最多样的一类[6]。既往研究[4-5,7-8]表明USP2a、USP7、USP22、USP28、USP9x等在多种肿瘤中异常表达,且影响肿瘤的发生发展,其相关作用机制主要与P53、NF-κB、HIF-1α、AKT、STAT、mTOR、Smad、c-MYC等有关。
表1 USP20蛋白阳性表达与乳腺癌临床病理特征之间的关系

临床特征例数阴性表达阳性表达χ2值P值性别1.00b 男性101 女性411526年龄(岁)1.6740.196a ≤6029821 >601376分子分型1.8300.671b LuminalA1147 LuminalB12210 HER-2过表达523 三阴性624WHO分级0.049b* 高211 中211110 低16313T分级0.954a0.329a** T11595 T219513 T3212 T4616临床分期8.571c0.003c I761 II18612 III14311 IV303淋巴结转移0.292b -22616 +1367
a.连续校正卡方检验;b.Fisher 确切概率;c.线性趋势卡方检验;*.低分化与高、中分化总和比较;**.T1、T2总和与T3、T4总和比较。
USP20作为USPs家族中的1员,对肿瘤的作用及相关机制的研究较少,在乳腺癌中尚未见报道。2011年Yasunaga等[9]报道USP20对TRAF6和致癌蛋白TAX具有去泛素化作用,并且可以抑制IL-1β和致癌蛋白TAX诱导的NF-κB信号通路。2015年Kim等[10]最新研究报道中指出USP20对PKM2具有去泛素化作用,并且提出USP20与PKM2的相互作用可能是调节肿瘤代谢的一个新的分子信号通路。本次实验结果显示乳腺癌患者中癌巢周围USP20大量表达,并且呈树根状向远处扩散,提示USP20可能影响乳腺癌的浸润和转移;另外本次实验研究分析发现,人乳腺癌患者中,肿瘤分化程度越低、临床分期越晚USP20阳性表达率越高,表明USP20可能具有促进乳腺癌发展的作用。
低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)作为核转录因子中的一种,调控多种靶向基因的转录表达,对机体内氧平衡的调节起重要作用。常氧状态下HIF-1α受pVHL蛋白依赖的泛素-蛋白酶体系降解而不稳定,缺氧时HIF-1α的降解受到抑制[11]。有研究[12-13]表明HIF-1α在肝癌、乳腺癌、胃癌、前列腺癌等多种肿瘤中高表达,参与癌细胞的生长繁殖、浸润与转移、新血管的生成、和细胞凋亡等过程,具有促进肿瘤发展的作用。2005年Li等[14]研究报道中指出USP20可以将已经泛素化的HIF-1α去泛素化,从而稳定HIF-1α蛋白, 提高HIF-1α水平,进而促进HIF-1α目的基因(eg.VEGF)的表达。随后2013年Park等[15]采用USP20的单克隆和多克隆抗体对USP20的细胞内机制进行进一步研究,报道中指出USP20可通过抑制pVHL蛋白介导的HIF-1α这一降解过程,从而稳定HIF-1α。基于本次实验结果和前期学者研究发现,我们推测USP20可能通过去泛素化HIF-1α,进而促进HIF-1α目的基因的表达,从而影响乳腺癌的浸润和转移,但其具体分子作用机制还有待进一步研究。
本次实验通过收集经临床病理科确诊为浸润性导管癌的乳腺癌组织标本42例,同时选取癌旁相对正常组织作为对照,采用免疫组织化学方法检测USP20在乳腺癌和癌旁组织中的表达情况,发现乳腺癌组织中USP20阳性表达与肿瘤分化程度、临床分期有密切关系,提示USP20与乳腺癌恶性程度成正相关,这为临床治疗、预后及进一步研究提供重要的实验依据。
尽管USP20在乳腺癌中具体作用及相关机制仍不清楚,但是随着USP20在乳腺癌中的研究逐步深入,应用药物或基因工程等技术诱导或者抑制USP20表达作为治疗乳腺癌的新思路具有一定的临床意义。
[1] 朱琳,杨顺娥.乳腺癌雌激素受体相关基因研究进展[J].现代肿瘤医学,2015,23(8):1135-1138.
[2] 许佳慧,柳素玲.乳腺肿瘤干细胞的研究进展[J].中国科学:生命科学,2017,47(1):140-144.
[3] 任媛媛,何妙霞,应明真,等.疱疹病毒相关性泛素特异性蛋白酶在乳腺癌组织中的表达及临床意义[J].中国癌症杂志,2009,19(7):491-496.
[4] 戴陈新,袁健,郑亚新.去泛素化酶与肿瘤发生及发展关系的研究进展[J].中国癌症杂志,2013,23(7):547-550.
[5] 唐时珺,陈松,叶茂.去泛素化酶与肿瘤[J].激光生物学报,2014,23(4):294-300.
[6] 王素霞,刘媛,吴慧娟,等.去泛素化酶的研究及其进展[J].临床与实验病理学杂志,2008,24(6):734-737.
[7] 周芨,邓世山,刘海.USP7蛋白与肿瘤的关系的研究进展[J].川北医学院学报,2016,31(1):130-135.
[8] 许超,史伟峰.去泛素化酶USP22与肿瘤关系的研究进展[J].临床检验杂志,2016,34(5):332-334.
[9] Yasunaga J,Lin FC,Lu X,etal.Ubiquitin-specific peptidase 20 targets TRAF6 and human T cell leukemia virus type 1 tax to negatively regulate NF-kappaB signaling[J].J Virol,2011,85(13):6212-6219.
[10] Kim SR,Kim JO,Lim KH,etal.Regulation of pyruvate kinase isozyme M2 is mediated by the ubiquitin-specific protease 20[J].Int J Oncol,2015,46(5):2116-2124.
[11] 孙微,师永红.去泛素化酶影响低氧诱导因子-1α泛素化过程的研究进展[J].临床与病理杂志,2015,35(11):2018-2022.
[12] 余平,刘晓旺,钟丽菲,等.低氧微环境相关因子HIF-1α与癌症的研究[J].湖南生态科学学报,2015,2(2):52-56.
[13] 李金利.HIF-1α及GLUT-1在前列腺癌中的表达及意义[D].河南:新乡医学院,2014.
[14] Li Z,Wang D,Messing EM,etal.VHL protein-interacting deubiquitinating enzyme 2 deubiquitinates and stabilizes HIF-1alpha[J].EMBO Rep,2005,6(4):373-378.
[15] Park JJ,Yun JH,Baek KH.Polyclonal and monoclonal antibodies specific for ubiquitin-specific protease 20[J].Monoclon Antib Immunodiagn Immunother,2013,32(3):193-199.
ExpressionofUSP20inhumanbreastcanceranditssignificance
ZHOU Fang-fang1,ZHU Xiao-hua1,RONG Xin-xin1,LIU Jia-you1,YANG Yi1,HOU Ling-mi2,XIE Shao-li2,DENG Shi-shan1
(1.DepartmentofAnatomy,NorthSichuanMedicalCollege;2.DepartmentofGeneralSurgery,AffiliatedHospitalofNorthSichuanMadicalCollege,Nanchong637000,Sichuan,China)
Objective:To observer the relationship between the clinical pathological characteristics of breast cancer and the expression of ubiquitin-specific protease 20 (USP20) to clarify the function of USP20 in breast cancer.Methods42 specimens invasive ductal carcinoma from breast cancer patients were selected,and 42 specimens from para-cancer tissue were chosen as control.Expression of USP20 was detected with immunohistochemical staining.ResultsThe positive expression rate of USP20 in breast cancer patients was 64.29%,which was higher than that in para-cancer tissue(21.43%).The difference was significant(χ2=15.75,P<0.01).Compared with the sum of high and medium differentiation,the positive expression rate of USP20 in low differentiated group was higher(P<0.05).Moreover,the later clinical stage,the higher rate was the positive expression of USP20(χ2=8.571,P<0.05).ConclusionThe high expression rate of USP20 in human breast cancer is associated with differentiation and clinical stage of the cancer,suggesting that USP20 is positively correlated with the malignancy of breast cancer,which may provide important experimental basis for clinical treatment,prognosis and further research.
Breast cancer;Ubiquitin-specific proteases 20;Clinical stage;Differentiation
10.3969/j.issn.1005-3697.2017.05.003
四川省教育厅一般项目(17ZB0175);四川省教育厅科研创新团队(17TD0016);川北医学院校级发展项目(CBY15-A-2017)
2017-06-08
周方方(1987-),女,硕士,助教。
邓世山,E-mail:805206372@qq.com
时间: 2017-10-10 02∶27
http://kns.cnki.net/kcms/detail/51.1254.R.20171010.0227.008.html
1005-3697(2017)05-0659-04
R737.9
A
(学术编辑刘红)
本刊网址:http://www.nsmc.edu.cn作者投稿系统http://noth.cbpt.cnki.net邮箱xuebao@nsmc.edu.cn
本刊网址:http://www.nsmc.edu.cn作者投稿系统http://noth.cbpt.cnki.net邮箱xuebao@nsmc.edu.cn
