蛋白激酶D1及其磷酸化位点在皮肤鳞状细胞癌、Bowen病及光线性角化病组织中的表达
2017-11-02顾静刘保国周萌苗国英吕超柴小磊
顾静 刘保国 周萌 苗国英 吕超 柴小磊
067000河北,承德医学院研究生学院(顾静、周萌);河北工程大学附属医院皮肤科(刘保国、苗国英、吕超),输血科(柴小磊)
蛋白激酶D1及其磷酸化位点在皮肤鳞状细胞癌、Bowen病及光线性角化病组织中的表达
顾静 刘保国 周萌 苗国英 吕超 柴小磊
067000河北,承德医学院研究生学院(顾静、周萌);河北工程大学附属医院皮肤科(刘保国、苗国英、吕超),输血科(柴小磊)
目的探讨蛋白激酶D1(PKD1)及其磷酸化位点pPKD1⁃tyr463和pPKD1⁃ser916在鳞状细胞癌(SCC)、Bowen病和光线性角化病(AK)中的表达及意义。方法收集新鲜SCC、Bowen病、AK及正常皮肤组织各10份,RT⁃PCR法检测各组样本中PKD1在基因水平的表达,Western印迹法检测各组样本中PKD1及其磷酸化位点在蛋白水平的表达。另收集蜡块组织SCC 50份、Bowen病20份、AK 20份及正常表皮组织10份,免疫组化检测PKD1、pPKD1⁃tyr463及pPKD1⁃ser916的表达情况。结果正常皮肤组织、SCC、Bowen病和AK组织中PRKD1 mRNA的表达量分别为0.64± 0.09、5.37±1.06、2.69±0.72和2.43±0.46,4组间差异有统计学意义(F=21.37,P<0.05),且SCC、Bowen病和AK组织的表达水平均显著高于正常组织(P<0.05),SCC组织又显著高于AK和Bowen病组织(均P<0.05),而Bowen病与AK组织的表达量差异无统计学意义(P>0.05)。PKD1总蛋白及pPKD1⁃tyr463在SCC和Bowen病组织中主要表达在棘层细胞及异形细胞的细胞质和细胞膜,且阳性表达率均显著高于正常皮肤组和AK组(均P<0.01);pPKD1⁃ser916仅在部分高分化SCC癌巢中少量表达,而低分化鳞癌、AK、Bowen病及正常皮肤组织中均未见表达;SCC组中PKD1阳性表达率随鳞癌病理分级的提高而增加,且PKD1与pPKD1⁃tyr463的表达呈正相关(rcc=0.479,P<0.05)。Western印迹检测结果与免疫组化检测结果大致相符。结论PKD1及其磷酸化位点Tyr463可能参与复层鳞状上皮来源的皮肤肿瘤的形成和进一步发展分化,在皮肤SCC形成进程中PKD1可能通过Tyr463位点活化而发挥促进作用。
癌,鳞状细胞;Bowen病;角化病,光化性;蛋白激酶D1
蛋白激酶D(PKD)是一种新发现的钙离子/钙调蛋白依赖性丝氨酸/苏氨酸蛋白激酶[1],有3个家族成员,其中PKD1广泛表达于各组织和器官中,参与调控细胞内多条信号传导通路,在调节一系列细胞生物学行为、维持细胞功能方面发挥十分重要的作用[2⁃3]。PKD1基因(PRKD1)位于人类染色体14qll位置,已被证实在多种肿瘤组织中异常表达[4⁃6],对表皮角质形成细胞的增殖和分化具有重要影响,可能参与表皮肿瘤的形成,其Ser916位点的磷酸化被认为是衡量PKD1激酶活性的关键指标。有研究表明,皮肤黑素瘤细胞中PKD1可能以此途径活化[7]。在氧化应激等条件下酪氨酸激酶的活性增强,使PKD1的Tyr463位点发生磷酸化,结合目前的研究,我们认为在皮肤非黑素瘤中PKD1可能通过该途径活化[8]。本文从基因和蛋白水平检测PKD1及其两个磷酸化位点pPKD1⁃tyr463和pPKD1⁃ser916在皮肤鳞状细胞癌(SCC)、Bowen病、光线性角化病(AK)及正常表皮组织中的表达,探讨PKD1在皮肤鳞状细胞癌逐步形成和发展中发挥的作用和意义。
材料与方法
一、材料与试剂
用于RT⁃PCR和Western印迹检测的SCC、Bowen病、AK及正常皮肤组织标本各10份,均选自河北工程大学附属医院皮肤外科2015年12月至2016年5月手术切除的组织,标本离体后立即液氮处理,超低温冰箱保存待检。用于免疫组化检测的石蜡包埋组织标本选自本院皮肤科2010年1月至2015年12月行病理检查而确诊,且临床和病理资料均完整的患者,包括SCC 50例、Bowen病20例、AK 20例。50例SCC按照Border分级法分为高分化SCC(Ⅰ级)31例、中分化SCC(Ⅱ级)12例、低分化SCC(Ⅲ~Ⅳ级)7例。收集本院美容整形外科手术切除的无任何皮肤疾病或外伤瘢痕的正常皮肤组织10例,制成石蜡标本作为对照,PKD1总蛋白的阳性对照来自病理科已确诊的乳腺癌组织蜡块。
总RNA提取试剂RNAiso Plus、反转录试剂盒、实时荧光定量试剂盒、引物及内参均为宝生物工程(大连)有限公司产品,浓缩型兔抗人PKD1/PKC mu多克隆抗体、兔抗人PKD1/PKC mu(phosphoY463,pPKD1⁃tyr463)多克隆抗体、兔抗人PKD1/PKC mu(phospho S916,pPKD1⁃ser916)单克隆抗体为美国Abcam公司产品,PV6001免疫组化染色试剂盒及DAB显色剂为北京中杉金桥生物技术有限公司产品,总蛋白提取试剂盒、BCA蛋白浓度测定试剂盒为北京索莱宝科技有限公司产品,其余试剂均由河北工程大学医学院中心实验室提供。
二、RT⁃PCR法检测各组样本中PKD1在基因水平的表达
冻存组织置于预冷的研钵中加入液氮研磨至粉末状,依照总RNA提取试剂说明书提取RNA。核酸蛋白检测仪检测RNA纯度(A260/A280范围为1.7~2.1),按照反转录试剂盒要求的条件合成cDNA,所得反转录产物采用ABI 7500型荧光定量PCR仪(美国ABI公司)扩增,引物及内参合成于宝生物工程(大连)有限公司。PRKD1引物上游5′⁃AATGCAGC TTTCATGTATCCACCA⁃3′,下游5′⁃GCATTCCAGCT CTCGCAAATCTA⁃3′,产物177 bp;内参GAPDH引物上游5′⁃AGAAGGCTGGGGCTCATTTG⁃3′,下游5′⁃AGGGGCCATCCACAGTCT TC⁃3′,产物258 bp。反应结束后分析PCR扩增曲线及熔解曲线,用2⁃△△Ct法进行相对定量分析,并进行2%琼脂糖凝胶电泳检测扩增特异性。
三、Western印迹法检测各组样本中PKD1及其磷酸化位点在蛋白水平的表达
用RIPA裂解液提取蛋白,BCA法测定样品蛋白质浓度,SDS⁃聚丙烯酰胺凝胶电泳后转移到PVDF膜上,清洗后置于5%脱脂奶粉液中室温封闭。加一抗4℃过夜后加二抗,避光条件下摇床振荡1 h,清洗后应用UVP凝胶成像分析系统采集图像,ImageJ软件分析灰度值,以GAPDH作为内参,计算目的条带与内参的灰度比值作为最终结果。
四、免疫组化染色检测目标蛋白PKD1及其磷酸化位点在各组样本中的表达
石蜡标本4 μm连续切片后,60℃烘烤1 h,常规脱蜡至水,抗原修复,3%H2O2封闭内源性过氧化物酶活性,滴加一抗,4℃过夜,滴加二抗(PV6001),37℃温箱孵育20 min,以上各步骤结束后均以磷酸酸缓冲液(PBS)冲洗3遍。DAB显色,自来水充分冲洗,苏木素复染,氨水返蓝,乙醇脱水,二甲苯透明,中性树胶封片。用0.01 mol/L PBS(pH7.4)代替一抗作为阴性对照,已知PKD1表达阳性的浸润性乳腺导管癌组织作为阳性对照。
免疫组化染色结果判定:PKD1、PKD1/pPKD1⁃ser916、PKD1/pPKD1⁃tyr463免疫组化结果均以细胞质和(或)细胞膜出现棕黄色或棕褐色颗粒为阳性。由两位高年资病理诊断医师采用双盲法分别独立阅片,遵循统一的诊断标准,选择免疫染色最多的区域,每个标本随机取10个高倍视野,计数所有细胞及其中阳性细胞数。着色程度计分:基本无染色为0分,浅棕黄色为1分,棕色为2分,棕褐色为3分。着色细胞百分率计分:着色细胞占计数细胞百分率<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。最终评分=着色程度得分×着色细胞百分率得分,<2分为阴性(-),≥2分为阳性(+),≥4分为强阳性(++)。
五、统计学分析
结果
一、实时定量PCR分析PRKD1 mRNA在各组中的表达
正常皮肤组织、SCC、Bowen病和AK组织中PRKD1 mRNA的表达量分别为0.64±0.09、5.37± 1.06、2.69±0.72和2.43±0.46,4组间差异有统计学意义(F=21.37,P<0.05)。两两间多重比较显示,SCC、Bowen病和AK组织中PRKD1 mRNA的表达水平均显著高于正常组织(均P<0.05),且SCC组中PRKD1 mRNA的表达量明显高于Bowen病和AK组(均P<0.05),Bowen病和AK组间差异无统计学意义(P>0.05)。
二、免疫组化分析PKD1及其磷酸化位点在各组中的表达
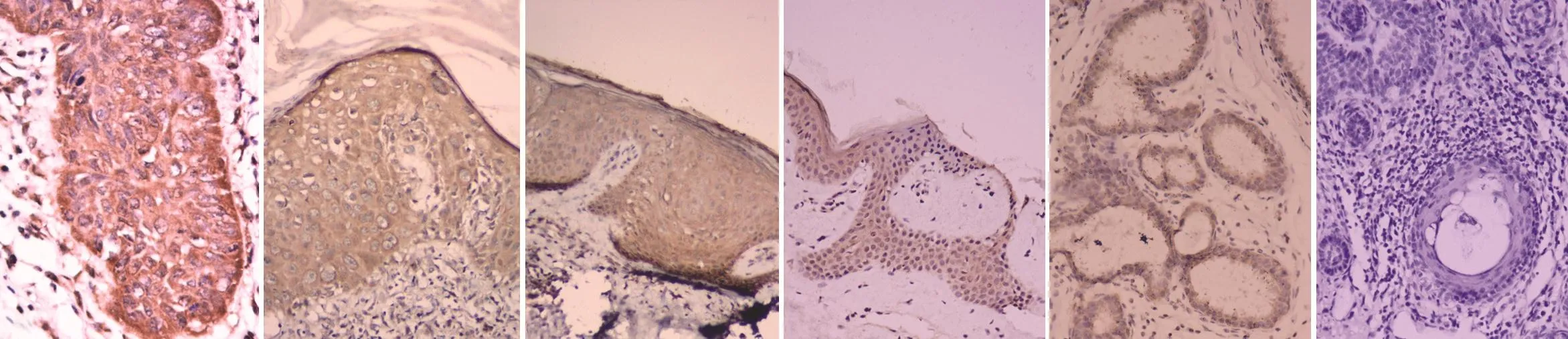
图1 免疫组化分析蛋白激酶D1(PKD1)在各组织中的表达(×200) 1A:皮肤鳞状细胞癌组织中PKD1主要集中在基底层、棘层细胞及异形细胞的细胞质和细胞膜;1B:Bowen病组织中PKD1主要集中在下延的基底细胞带和增厚的棘层细胞的细胞质和细胞膜部位;1C:光线性角化病组织中PKD1主要集中基底细胞带和棘层细胞的细胞质和细胞膜部位;1D:正常表皮组织中PKD1少量表达于基底部位及部分棘层细胞的细胞质和细胞膜部位;1E:阳性对照PKD1主要集中在癌细胞的细胞质和细胞膜部;1F:阴性对照
PKD1在SCC和Bowen病组中主要表达在棘层细胞及异形细胞的细胞质和细胞膜(图1),且其阳性表达率明显高于正常对照组(χ2Bowen病=4.29,χ2SCC=12.96,均P<0.01),而AK组和正常对照组之间PKD1阳性表达率差异无统计学意义(χ2=1.20,P>0.05),见表1。此外,SCC组中PKD1的阳性表达率随鳞癌病理分级的提高而增加(表2)。pPKD1⁃ser916仅在部分高分化SCC癌巢中少量表达,而低分化SCC、AK、Bowen病及正常组织中均未见表达,各组中pPKD1⁃ser916阳性表达率差异无统计学意义(P>0.05)。pPKD1⁃tyr463仅在SCC和Bowen病组织少量表达,在AK和正常对照组织中均未见表达(图2)。SCC组和Bowen病组中pPKD1⁃tyr463阳性表达率均明显高于AK组和正常对照组(均P<0.01),但SCC组与Bowen病组间,及AK组与正常对照组间差异均无统计学意义(均P>0.01),见表1。此外,在SCC组中PKD1与pPKD1⁃tyr463的表达呈正相关(rcc=0.479,P<0.05),见表3。

表1 PKD1及其磷酸化位点在各组皮损中的表达[例(%)]

表2 蛋白激酶D1(PKD1)在皮肤鳞状细胞癌(SCC)各病理分级组织中的表达情况(例)

表3 蛋白激酶D1(PKD1)和磷酸化位点pPKD1⁃tyr463在皮肤鳞状细胞癌组织中表达的相关性分析

图2 蛋白激酶D1磷酸化位点pPKD1⁃tyr463在各组织中的表达(×200) 2A:皮肤鳞状细胞癌组织中阳性表达主要集中在棘层细胞及异形细胞的细胞质和细胞膜部位;2B:Bowen病组织中阳性表达主要集中在增厚的棘层鳞状细胞细胞质和细胞膜,以细胞膜为主;2C:光线性角化病组织呈阴性表达;2D:正常皮肤呈阴性表达
三、Western印迹测定结果
PKD1及pPKD1⁃ser916和pPKD1⁃tyr463在各组中的表达与免疫组化结果大致相符。与GAPDH内参蛋白相比,PKD1仅在SCC和Bowen病组中高表达,pPKD1⁃tyr463仅在SCC组织中高表达,而pPKD1⁃ser916在各组中表达量均较低。见图3和表4。
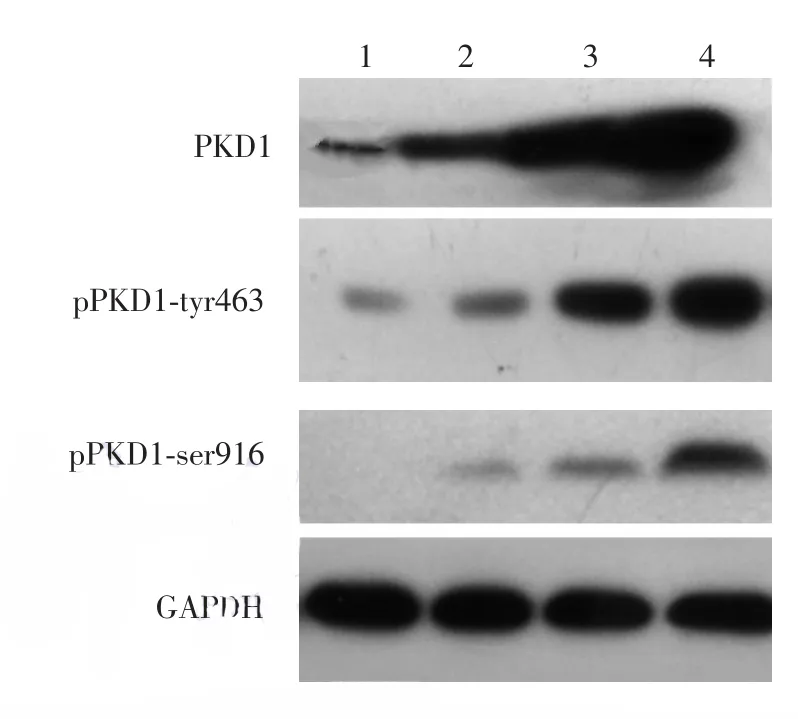
图3 Western印迹法检测各组蛋白激酶D1(PKD1)及其磷酸化位点Ser916和Tyr463的表达 1:正常皮肤;2:光线性角化病;3:Bowen病;4:皮肤鳞状细胞癌
表4 蛋白激酶D1(PKD1)及其磷酸化位点pPKD1⁃ser916、pPKD1⁃tyr463在正常皮肤、光线性角化病(AK)、Bowen病、皮肤鳞状细胞癌(SCC)组织中的表达(±s)

表4 蛋白激酶D1(PKD1)及其磷酸化位点pPKD1⁃ser916、pPKD1⁃tyr463在正常皮肤、光线性角化病(AK)、Bowen病、皮肤鳞状细胞癌(SCC)组织中的表达(±s)
注:a:SNK⁃q检验,与正常皮肤对照组相比,P<0.05;b:与AK组相比,P<0.05
组别正常皮肤组AK组Bowen病组SCC组F值P值例数10 10 10 10 PKD1 0.100±0.074 0.307±0.098 1.664±0.102ab 2.075±0.722ab 2 432.044<0.001 pPKD1⁃ser916 0.105±0.022 0.101±0.058 0.107±0.033 0.115±0.045ab 1 377.308<0.001 pPKD1⁃tyr463 0.061±0.004 0.153±0.007 0.819±0.021ab 1.704±0.006ab 44 250.782<0.001
讨论
PKD1在静息状态的细胞中主要分布在细胞质内,处于低活性状态,受到相关刺激而活化后被募集到细胞膜、细胞核或高尔基体等位置,参与调控细胞功能和多条细胞内信号传导通路[9]。相关研究证实,PKD1具有促进角质形成细胞增殖,抑制其分化的作用[10⁃11],在伤口愈合过程中可促进表皮细胞的增殖和迁移[12],PKD1信号通路对维持表皮平衡具有至关重要的作用。Chiou等[13]研究证实,在皮肤肿瘤干细胞标记CD34阳性的细胞系中,通过抑制PKD1相关的信号通路可有效预防皮肤肿瘤的发生。Kempkes等[14]在黑素瘤细胞中下调PKD1的表达,发现肿瘤细胞增殖明显下降,推测PKD1相关通路的失活可能有助于抑制黑素瘤细胞的增殖及对肿瘤微环境的维护。Ristich等[15]利用免疫组化的方法证实PKD1在正常皮肤、银屑病和基底细胞癌中表达,初步推测其在增殖性皮肤病如银屑病和皮肤肿瘤中可能发挥作用。
SCC与AK、Bowen病同为复层鳞状上皮细胞来源的皮肤病变,这些皮肤疾病的发生发展都与日光中的紫外线有密切联系,相关实验证实,UVB通过Tyr463位点激活细胞中的PKD1,帮助遭受紫外线损伤而发生DNA突变的角质形成细胞避免凋亡,且最终可能发展为皮肤肿瘤[8]。我们在实验中发现,SCC组织中PRKD1 mRNA的表达量显著高于正常皮肤组织、AK及Bowen病组织,而后两者中PRKD1 mRNA含量也较正常皮肤组织高。PKD1总蛋白和pPKD1⁃tyr463在SCC和Bowen病的表达明显高于正常皮肤对照组和AK组,且主要分布在细胞异形性明显的部位,表现出随着细胞异形性的增加表达量增多的趋势。PKD1在皮肤侵袭性鳞癌、原位鳞癌及癌前病变的表达情况国内外尚未见相关报道,我们的研究提示,PKD1及pPKD1⁃tyr463可能参与复层鳞状上皮来源的皮肤肿瘤的形成和进一步发展,在SCC形成进程中PKD1可能通过Tyr463位点活化而发挥促进作用,有望成为SCC治疗的新靶点。
氧化应激条件下PKD1活化通过PKD1⁃IKK⁃NF⁃κB途径帮助表皮角质形成细胞存活,Ser916位点是该途径中PKD1的最终活化位点,在PKD1结构修饰上发挥重要作用[16]。而我们仅通过免疫组化法检测到部分高分化SCC组织的癌巢中有少量pPKD1⁃ser916的表达,低分化SCC组织中反而未发现,且Western印迹显示,各组织中该位点条带灰度值均很低。Ser916位点在SCC发生发展中的作用有待进一步探究。
[1]Rozengurt E.Protein kinase D signaling:multiple biological functions in health and disease[J].Physiology(Bethesda),2011, 26(1):23⁃33.DOI:10.1152/physiol.00037.2010.
[2]Ellwanger K,Hausser A.Physiological functions of protein kinase Din vivo[J].IUBMB Life,2013,65(2):98⁃107.DOI:10.1002/ iub.1116.
[3]Tandon M,Salamoun JM,Carder EJ,et al.SD⁃208,a novel protein kinase D inhibitor,blocks prostate cancer cell proliferation and tumor growthin vivoby inducing G2/M cell cycle arrest[J].PLoS One,2015,10(3):e0119346.DOI:10.1371/journal.pone.0119346.
[4]Sundram V,Chauhan SC,Jaggi M.Emerging roles of protein kinase D1 in cancer[J].Mol Cancer Res,2011,9(8):985⁃996. DOI:10.1158/1541⁃7786.MCR⁃10⁃0365.
[5]Karam M,Legay C,Auclair C,et al.Protein kinase D1 stimulates proliferation and enhances tumorigenesis of MCF⁃7 human breast cancer cells through a MEK/ERK⁃dependent signaling pathway[J].Exp Cell Res,2012,318(5):558⁃569.DOI:10.1016/j. yexcr.2012.01.001.
[6]Liou GY,Storz P.Protein kinase D enzymes:novel kinase targets in pancreatic cancer[J].Expert Rev Gastroenterol Hepatol,2015, 9(9):1143⁃1146.DOI:10.1586/17474124.2015.1069706.
[7]Jensen DD,Zhao P,Jimenez⁃Vargas NN,et al.Protein kinase D and Gβγ subunits mediate agonist⁃evoked translocation of protease⁃activated receptor⁃2 from the golgi apparatus to the plasma membrane[J].J Biol Chem,2016,291(21):11285⁃11299.DOI:10.1074/jbc.M115.710681.
[8]Arun SN,Kaddour⁃Djebbar I,Shapiro BA,et al.Ultraviolet B irradiation and activation of protein kinase D in primary mouse epidermal keratinocytes[J].Oncogene,2011,30(13):1586⁃1596.DOI:10.1038/onc.2010.540.
[9]Zugaza JL,Waldron RT,Sinnett⁃Smith J,et al.Bombesin, vasopressin,endothelin,bradykinin,and platelet⁃derived growth factor rapidly activate protein kinase D through a protein kinase C⁃dependent signal transduction pathway[J].J Biol Chem,1997, 272(38):23952⁃23960.DOI:10.1074/jbc.272.38.23952.
[10]Bollag WB,Dodd ME,Shapiro BA.Protein kinase D and keratinocyte proliferation[J].Drug News Perspect,2004,17(2): 117⁃126.DOI:10.1358/dnp.2004.17.2.829045.
[11]Choudhary V,Olala LO,Kaddour⁃Djebbar I,et al.Protein kinase D1 deficiency promotes differentiation in epidermal keratinocytes[J].J Dermatol Sci,2014,76(3):186⁃195.DOI:10.1016/j. jdermsci.2014.09.007.
[12]Rashel M,Alston N,Ghazizadeh S.Protein kinase D1 has a key role in wound healing and skin carcinogenesis[J].J Invest Dermatol,2014,134(4):902⁃909.DOI:10.1038/jid.2013.474.
[13]Chiou YS,Sang S,Cheng KH,et al.Peracetylated(⁃)⁃epigallocatechin⁃3⁃gallate(AcEGCG)potently prevents skin carcinogenesis by suppressing the PKD1⁃dependent signaling pathway in CD34+skin stem cells and skin tumors[J]. Carcinogenesis,2013,34(6):1315⁃1322.DOI:10.1093/carcin/ bgt042.
[14]Kempkes C,Rattenholl A,Buddenkotte J,et al.Proteinase⁃activated receptors 1 and 2 regulate invasive behavior of human melanoma cells via activation of protein kinase D1[J].J Invest Dermatol,2012,132(2):375⁃384.DOI:10.1038/jid.2011.314.
[15]Ristich VL,Bowman PH,Dodd ME,et al.Protein kinase D distribution in normal human epidermis,basal cell carcinoma and psoriasis[J].Br J Dermatol,2006,154(4):586⁃593.DOI:10. 1111/j.1365⁃2133.2005.07073.x.
[16]Rybin VO,Guo J,Steinberg SF.Protein kinase D1 autophosphory⁃lation via distinct mechanisms at Ser744/Ser748 and Ser916[J].J Biol Chem,2009,284(4):2332⁃2343.DOI:10.1074/jbc. M806381200.
Expression of protein kinase D1 and its phosphorylation at tyr463 and ser916 in squamous cell carcinoma,Bowen′s disease and actinic keratosis
Gu Jing,Liu Baoguo,Zhou Meng,Miao Guoying, Lyu Chao,Chai Xiaolei
Graduate School of Chengde Medical University,Chengde 067000,Hebei,China(Gu J,Zhou M); Department of Dermatology,Affiliated Hospital of Hebei University of Engineering,Handan 056002,Hebei, China(Liu BG,Miao GY,Lyu C);Department of Blood Transfusion,Affiliated Hospital of Hebei University of
Liu Baoguo,Email:lbg66@163.com
ObjectiveTo measure the expression of protein kinase D1(PKD1),tyr463⁃phos⁃phorylaed PKD1(pPKD1⁃tyr463)and ser916⁃phos⁃phorylaed PKD1(pPKD1⁃ser916)in squamous cell carcinoma(SCC),Bowen′s disease(BD)and actinic keratosis(AK),and to explore their significance.MethodsFresh tissue samples were resected from lesions of patients with SCC(SCC group),BD(BD group)and AK(AK group),as well as from normal skin of healthy human controls(control group),and each group had a sample size of 10.Real⁃time RT⁃PCR was performed to measure the mRNA expression of protein kinase D1 gene(PRKD1),and Western blot analysis to determine the protein expression of PKD1, pPKD1⁃tyr463 and pPKD1⁃ser916.In addition,immunohistochemical study was conducted to determine the expression of PKD1,pPKD1⁃tyr463 and pPKD1⁃ser916 in another 50 paraffin⁃embedded skin samples of SCC,20 samples of BD,20 samples of AK and 10 normal skin samples.Results PRKD1 mRNA expression significantly differed among the control group(0.64±0.09),SCC group(5.37±1.06),BD group(2.69± 0.72)and AK group(2.43±0.46)(F=21.37,P<0.05),and was significantly higher in the SCC,BD and AK groups than that in the control group(P<0.05),as well as in the SCC group than that in the AK and BD groups(bothP<0.05).However,no significant difference in the PRKD1 mRNA expression was observed between the BD group and AK group(P>0.05).Immunohistochemical study showed that the total PKD1 protein and pPKD1⁃tyr463 in the SCC and BD groups were mainly expressed in the cytoplasm and cell membrane of spinous layer cells and atypical cells,and their expression rates were significantly higher than those in the AK group and control group(allP<0.01).The pPKD1⁃ser916 was only slightly expressed in some cancer nests of well⁃differentiated SCC tissues,but not in poorly⁃differentiated SCC,AK, BD tissues and normal skin tissues.In the SCC group,the expression rate of PKD1 increased with the increase of the pathological grade of SCC,and the PKD1 expression was positively correlated with pPKD1⁃tyr463 expression(rcc=0.479,P<0.05).Western blot results were consistent with immunohistochemical findings.ConclusionPKD1 and pPKD1⁃tyr463 may be involved in the development and differentiation of skin tumors derived from stratified squamous epithelium,and PKD1 may exert promotive effects on the formation of cutaneous SCC by activating the Tyr463 phosphorylation site.
Carcinoma,squamous cell;Bowen′s disease;Keratosis,actinic;Protein kinase D1
刘保国,Email:lbg66@163.com
10.3760/cma.j.issn.0412⁃4030.2017.04.004
河北省2016年度科技支撑计划(16277724D);河北省政府资助临床医学优秀人才培养项目(361037)
Engineering,Handan 056002,Hebei,China(Chai XL)
Fund programs:Science Supply Plan of Hebei Province in 2016(16277724D);Talents Training Program in Clinical Medicine Sponsored by Hebei Government(361037)
2016⁃08⁃01)
(本文编辑:周良佳 颜艳)
