Notch信号相关受体/配体在皮肤恶性黑素瘤中的表达
2017-11-02刘白俞婉婷程伟邵雪宝姜祎群
刘白 俞婉婷 程伟 邵雪宝 姜祎群
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科
Notch信号相关受体/配体在皮肤恶性黑素瘤中的表达
刘白 俞婉婷 程伟 邵雪宝 姜祎群
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科
目的检测Notch信号通路中Notch1、Notch4、Jagged1以及Dll4在皮肤恶性黑素瘤组织中的表达,初步探讨Notch信号通路在黑素瘤发病机制中的作用。方法免疫组化SP法检测40例恶性黑素瘤及15例色素痣石蜡标本中Notch1、Notch4、Jagged1以及Dll4的表达模式和表达强度。采用SPSS21.0软件进行卡方检验及Spearman秩相关分析。结果在40例黑素瘤组织(31例阳性表达)及15例色素痣组织(3例阳性表达)Notch1的表达率差异有统计学意义(χ2=15.281,P=0.000),原位(18例)及侵袭性黑素瘤(22例)间Notch1表达强度差异无统计学意义(χ2=0.631,P=0.427)。Notch4、Jagged1以及Dll4的表达率在恶性黑素瘤与色素痣之间差异均有统计学意义(均P<0.05),三者表达强度在原位与侵袭性黑素瘤之间差异亦均有统计学意义(P<0.05)。在黑素瘤组织中,Notch1与Jagged1的表达呈正相关(rs=0.350,P=0.027),与Dll4的表达亦呈正相关(rs=0.562,P=0.000),但是Jagged1与Dll4的表达呈负相关(rs=-0.734,P=0.000)。结论Notch信号通路异常可能是黑素瘤的发病机制之一,但具体作用机制有待进一步研究。
痣和黑素瘤;受体,Notch;免疫组织化学;Jagged 1;Dll4
Notch信号通路是一个进化保守的信号通路,在生物体发育成熟过程中影响细胞的增殖、分化、凋亡,调控细胞周期,起到决定细胞命运、组织模式及形态转化的作用。研究发现,Notch信号通路在肿瘤的发生机制中发挥重要作用,许多肿瘤都与此通路的异常相关,目前已经成为研究的热点之一。有报道在肝癌[1⁃2]、肺癌[3⁃4]、乳腺癌[5⁃6]、胃癌[7]、皮肤肿瘤(如基底细胞癌、鳞状细胞癌)[8⁃9]等中均发现Notch信号通路异常表达。Massi等[10]首次报道,人类恶性黑素瘤组织标本中Notch蛋白及其配体的表达上调,提示Notch信号通路激活可能与黑素瘤发生相关。我们利用免疫组化的方法,研究Notch1、Notch4、Jagged1以及Dll4在黑素瘤中的表达情况及其相互之间的关系,希望能够初步了解Notch信号通路在黑素瘤发生、发展中的作用。
材料和方法
一、样本选取
选用中国医学科学院皮肤病研究所病理科2011—2015年存档的皮肤恶性黑素瘤标本40份及色素痣标本15份,均经4%甲醛固定,常规石蜡包埋。皮肤黑素瘤40例中,男21例,女19例,年龄24~86岁,平均59.78岁;病程0.5个月至20年;皮损位于肢端者32例,非肢端者8例。原位黑素瘤18例,侵袭性黑素瘤22例,Clark分级Ⅰ~Ⅱ级27例,Ⅲ~Ⅴ级13例。15例色素痣均为皮内痣,其中男7例,女8例;年龄8~59岁,平均29.733岁;皮损位于面部12例,胸部1例,四肢2例。
二、主要试剂
兔单克隆抗体抗Notch1抗体、抗Jagged1抗体、抗Dll4抗体,小鼠单克隆抗体抗Notch4抗体均来自英国Abcam公司;二抗为Alexa Flour®488标记山羊抗小鼠IgG,来自南京福麦斯生物技术有限公司;显色剂二氨基联苯胺(DAB)、S100、HMB⁃45、Melan⁃A、Ki67均来自丹麦Dako公司。
三、方法
1.免疫组化染色:石蜡包埋组织经4 μm厚连续切片,60℃干烤1 h,分别进行HE和免疫组化染色。免疫组化染色采用SP法,DAB显色,用磷酸盐缓冲液代替一抗作阴性对照。
2.甲苯胺蓝双重复染法[11]:将切片常规脱蜡至水,按免疫组化染色常规步骤进行,苏木素复染,1%盐酸乙醇分化、水洗;滴加甲苯胺蓝工作液,覆盖全部组织,室温孵育30 min,水洗;用1∶500冰醋酸分化,镜下观察,黑素颗粒呈现墨绿色,与DAB染色阳性棕黄色颗粒区别明显,水洗终止反应;常规脱水、封固。
3.免疫组化阳性判读:HE染色、免疫组化染色切片由两位高年资病理医师采用双盲法进行诊断及染色结果判读。每张切片随机选取5个高倍视野(×200),每个高倍视野计数50个肿瘤细胞,观察阳性细胞染色强度,计数阳性细胞百分比。染色强度计分标准:不着色0分,弱着色(浅黄色)1分,中等着色(棕黄色)2分,强着色(深褐色)3分。阳性细胞百分比计分标准:按平均每视野所见阳性细胞计数,无细胞着色0分,<25%为1分,25%~75%为2分,>75%为3分。表达强度为染色强度计分与阳性细胞百分比计分相乘得出最终积分:计0分为阴性表达,>0分为阳性表达;0~4分为低表达,>4分为高表达。蛋白表达率=阳性表达例数/总例数×100%。
4.统计学方法:采用SPSS21.0软件对实验数据进行统计学分析,计数资料比较采用卡方检验,等级资料采用Spearman秩相关分析。以P<0.05为差异有统计学意义。
结果
一、Notch1表达情况
Notch1广泛表达于细胞胞质,少量表达于细胞核,细胞核表达均出现在胞质阳性的细胞中。40例原发性黑素瘤中,31例阳性表达;15例色素痣中,3例阳性表达(图1)。侵袭性黑素瘤与原位黑素瘤比较,Notch1表达强度差异无统计学意义(P= 0.427),但恶性黑素瘤与色素痣比较,Notch1表达率差异有统计学意义(P=0.000),见表1、2。Notch1在肿瘤周边正常皮肤处呈阴性表达。不论在原发性黑素瘤还是侵袭性黑素瘤中,Notch1的表达在肿瘤的中心及边缘位置均无差别。
二、Notch4表达情况
Notch4在细胞质/细胞膜中均表达。40例原发性黑素瘤患者中36例阳性表达;15例色素痣中6例为阳性表达(图1)。侵袭性黑素瘤与原位黑素瘤之间Notch4表达强度差异有统计学意义(P=0.033),恶性黑素瘤与色素痣之间Notch4表达率差异亦有统计学意义(P=0.000)。见表1,2。Notch4在肿瘤周围正常组织血管内皮细胞、毛囊及汗腺中可见阳性表达。在原发性黑素瘤和侵袭性黑素瘤中,Notch4的表达在肿瘤的中心及边缘之间均无差别。
三、Jagged1表达情况
Jagged1表达于细胞膜中。40例原发性黑素瘤患者中34例阳性;15例色素痣中1例为阳性表达(图1)。侵袭性黑素瘤与原位黑素瘤之间Jagged1表达强度差异有统计学意义(P=0.011),恶性黑素瘤与色素痣之间Jagged1表达率差异亦有统计学意义(P=0.000)。见表1、2。Jagged1在肿瘤周围正常组织无表达。在原发性黑素瘤和侵袭性黑素瘤中,Jagged1的表达在肿瘤的中心及边缘之间均无差别。
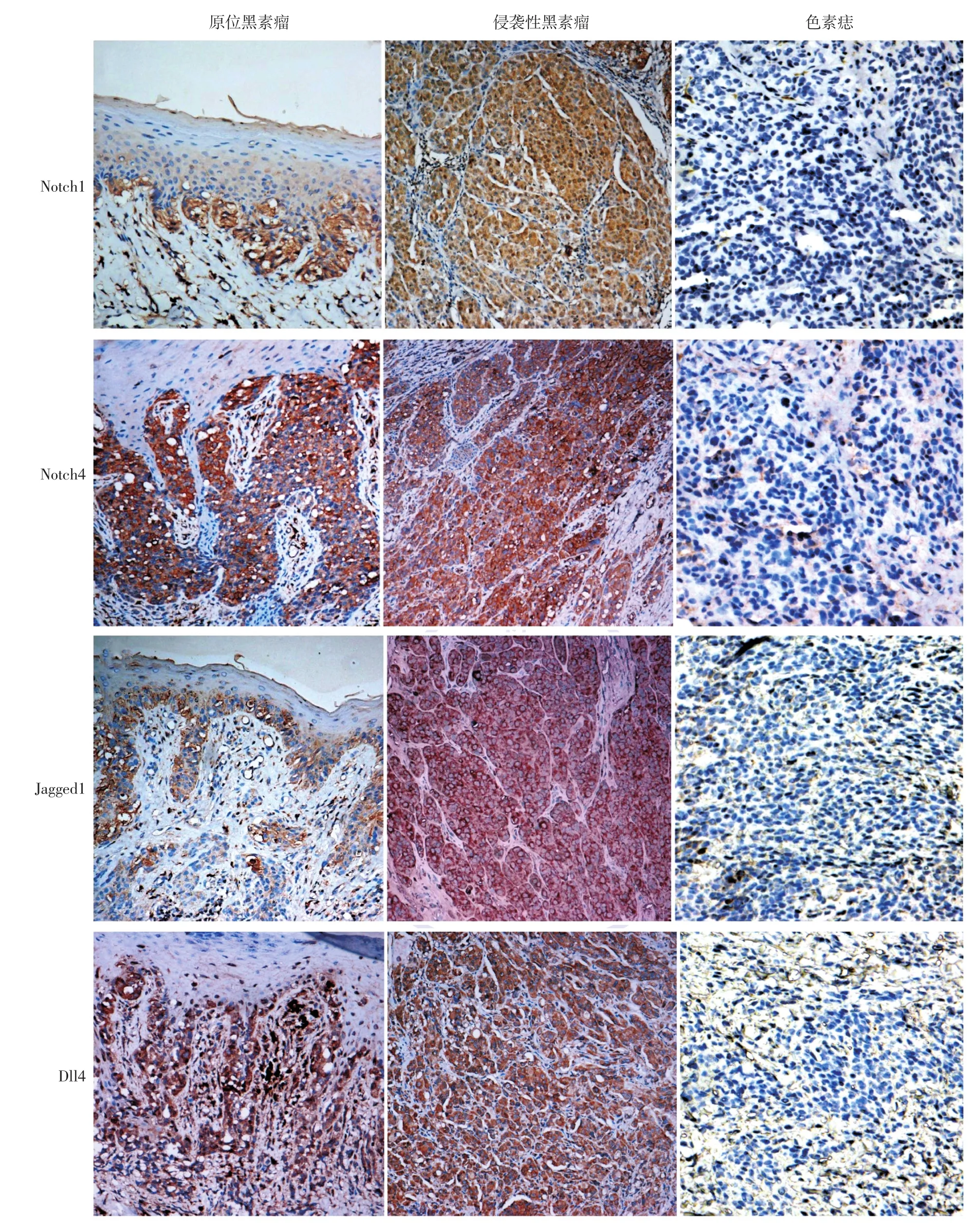
图1 Notch1、Notch4、Jagged1、Dll4在原发性恶性黑素瘤及色素痣中的表达(免疫组化×100) Notch1、Notch4、Jagged1、Dll4在色素痣中不表达。Notch1在原位黑素瘤及侵袭性黑素瘤中广泛表达于肿瘤细胞胞质,少量表达于细胞核;Notch4主要表达于原位黑素瘤及侵袭性黑素瘤细胞胞质/胞膜;Jagged1表达于原位黑素瘤及侵袭性黑素瘤细胞胞膜;Dll4表达于原位黑素瘤及侵袭性黑素瘤细胞胞膜/胞质
四、Dll4表达情况
Dll4表达于细胞膜/质中。40例原发性黑素瘤标本中38例阳性;15例色素痣标本均为阴性,见图1。侵袭性黑素瘤与原位黑素瘤之间Dll4表达强度差异有统计学意义(P=0.002),恶性黑素瘤与色素痣之间Dll4表达率差异亦有统计学意义(P= 0.000)。见表1、2。Dll4在肿瘤周围正常皮肤组织血管内皮细胞中可见阳性表达。在原发性黑素瘤和侵袭性黑素瘤中,Dll4的表达在肿瘤的中心及边缘之间均无差别。
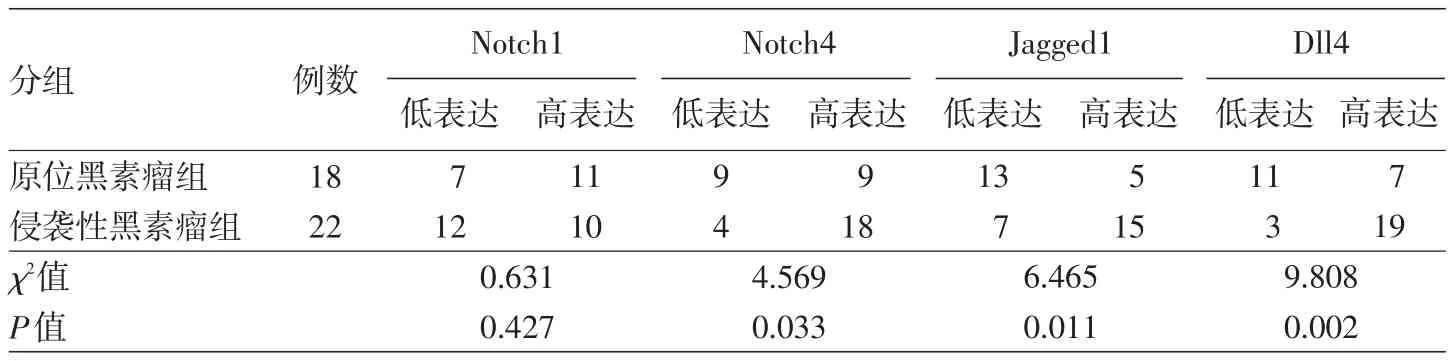
表1 Notch信号相关受体/配体在原位及侵袭性黑素瘤组织中的表达强度比较(例)
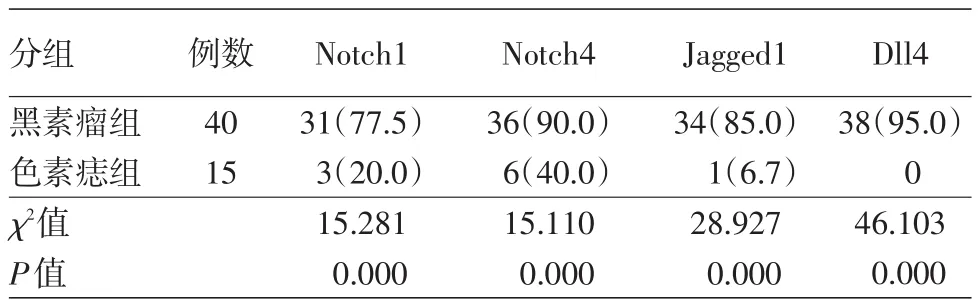
表2 Notch信号相关受体/配体在原发性黑素瘤及色素痣中的表达率比较[例(%)]
五、黑素瘤中Notch1、Jagged1、Dll4表达的相关性
Notch1表达与Jagged1表达呈正相关(rs= 0.350,P=0.027),与Dll4表达呈正相关(rs=0.562,P=0.000);Jagged1和Dll4的表达呈负相关(rs= -0.734,P=0.000)。
讨论
人类恶性黑素瘤组织标本中Notch蛋白及其配体表达失调,提示Notch信号通路的激活可能与黑素瘤发生、发展相关,已有研究表明,Notch信号通路的上调是黑素瘤发病的早期事件[10,12]。我们利用免疫组化检测40例原发性黑素瘤及15例色素痣组织标本中Notch1、Notch4、Jagged1以及Dll4的表达及相互联系,希望能够初步了解Notch信号通路在黑素瘤发生、发展中所发挥的作用。
多项研究表明,黑素瘤发生、发展依赖于Notch1信号的表达,Notch1信号通过自身加工和调节蛋白酶(如furin蛋白)进行自我激活[13⁃14]。我们的研究发现,Notch1在肿瘤中的表达明显高于色素痣,但是在原位黑素瘤与侵袭性黑素瘤中表达强度无明显差异,提示Notch1在黑素瘤的发生过程中可能发挥重要作用,同时其他机制对黑素瘤中Notch1表达的影响可能导致其对恶性黑素瘤侵袭能力的影响较小。
我们还发现,Notch4不但在黑素瘤中阳性表达,在肿瘤周围正常皮肤处血管、毛囊及汗腺中也不同强度地表达。考虑肿瘤周围内皮细胞出现Notch信号的阳性表达,提示其可能影响肿瘤的侵袭及转移活性。Hardy等[15]研究揭示,Notch4和Nodal在侵袭性黑素细胞系中多重表达与肿瘤侵袭性相关,说明同时表达Notch4和Nodal的细胞亚群可能会保留特殊的性质,如细胞可塑性增强[15],并且对Notch4血管生成拟态的形成起到部分作用[16]。Notch4功能抑制会下调Nodal信号的表达,而且破坏、削弱侵袭性黑素细胞中的血管生成拟态网络[17]。在我们所检测的40例黑素瘤组织标本中,Notch4呈强弱不等的阳性表达,明显高于色素痣,且在原位和侵袭性黑素瘤中的表达有统计学差异。表明Notch4表达上调可以促进黑素瘤发生、进展,上调的Notch4信号可能通过自身信号或者对其他相关信号通路的影响发挥促癌作用。
在原发性胶质母细胞瘤中,Jagged1和Dll4在微血管形成过程中起到相反的作用,但对疾病的预后具有一致性[18]。那么在黑素瘤中是否具有类似情况呢?有文献报道,Dll4通过Notch1信号抑制内皮细胞活化,而Jagged1不但抑制Notch1/Dll4信号,同时保持血管生长与成熟的平衡[19],二者在肿瘤血管形成过程中具有相反作用[20⁃22]。在我们的研究中,Notch1的表达与Jagged1、Dll4的表达呈正相关,Jagged1的表达与Dll4的表达呈负相关,并且具有统计学意义,与文献研究结果一致,提示Notch1和Jagged1、Dll4两两之间具有协同表达效应,并形成负反馈回路,调节肿瘤血管生成途径,从而增加侵袭和转移活性,但具体作用机制需要进一步探讨。
总之,在原发性皮肤恶性黑素瘤中Notch信号通路表达失调,Notch1、Notch4、Jagged1以及Dll4均呈阳性表达,初步提示Notch信号通路异常可能是黑素瘤的发病机制之一,但具体作用机制有待进一步的研究探索。本文仅通过免疫组化的方法证明Notch信号通路参与黑素瘤的发生、发展,方法单一,具有一定的局限性。今后可通过运用q⁃PCR等方法进一步证实实验结果,并可通过体外培养黑素细胞系检测上述调控关系。
[1]Gao J,Song Z,Chen Y,et al.Deregulated expression of Notch receptors in human hepatocellular carcinoma[J].Dig Liver Dis, 2008,40(2):114⁃121.DOI:10.1016/j.dld.2007.08.001.
[2]Gramantieri L,Giovannini C,Lanzi A,et al.Aberrant Notch3 and Notch4 expression in human hepatocellular carcinoma[J].Liver Int,2007,27(7):997⁃1007.DOI:10.1111/j.1478⁃3231.2007. 01544.x.
[3]Konishi J,Kawaguchi KS,Vo H,et al.Gamma⁃secretase inhibitor prevents Notch3 activation and reduces proliferation in human lung cancers[J].Cancer Res,2007,67(17):8051⁃8057.DOI: 10.1158/0008⁃5472.CAN⁃07⁃1022.
[4]Donnem T,Andersen S,Al⁃Shibli K,et al.Prognostic impact of Notch ligands and receptors in nonsmall cell lung cancer: coexpression of Notch⁃1 and vascular endothelial growth factor⁃A predicts poor survival[J].Cancer,2010,116(24):5676⁃5685. DOI:10.1002/cncr.25551.
[5]Chen J,Imanaka N,Chen J,et al.Hypoxia potentiates Notch signaling in breast cancer leading to decreased E⁃cadherin expression and increased cell migration and invasion[J].Br J Cancer,2010,102(2):351⁃360.DOI:10.1038/sj.bjc.6605486.
[6]Peng GL,Tian Y,Lu C,et al.Effects of Notch⁃1 down⁃regulation on malignant behaviors of breast cancer stem cells[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(2):195⁃200. DOI:10.1007/s11596⁃014⁃1258⁃4.
[7]Brzozowa M,Mielańczyk L,Michalski M,et al.Role of Notch signaling pathway in gastric cancer pathogenesis[J].Contemp Oncol(Pozn),2013,17(1):1⁃5.DOI:10.5114/wo.2013.33765.
[8]Nowell C,Radtke F.Cutaneous Notch signaling in health and disease[J].Cold Spring Harb Perspect Med,2013,3(12): a017772.DOI:10.1101/cshperspect.a017772.
[9]South AP,Purdie KJ,Watt SA,et al.NOTCH1 mutations occur early during cutaneous squamous cell carcinogenesis[J].J Invest Dermatol,2014,134(10):2630⁃2638.DOI:10.1038/jid.2014.154.
[10]Massi D,Tarantini F,Franchi A,et al.Evidence for differential expression of Notch receptors and their ligands in melanocytic nevi and cutaneous malignant melanoma[J].Mod Pathol,2006, 19(2):246⁃254.DOI:10.1038/modpathol.3800526.
[11]吴琼,李阿梅,邵雪宝,等.甲苯胺蓝染色在黑素瘤免疫组化复染中的应用[J].临床与实验病理学杂志,2015,(8):941⁃942. DOI:10.13315/j.cnki.cjcep.2015.08.029.
[12]Murtas D,Piras F,Minerba L,et al.Activated Notch1 expression is associated with angiogenesis in cutaneous melanoma[J].Clin Exp Med,2015,15(3):351⁃360.DOI:10.1007/s10238⁃014⁃0300⁃y.
[13]Qiu H,Tang X,Ma J,et al.Notch1 autoactivation via transcriptionalregulation offurin,which sustains Notch1 signaling by processing Notch1⁃activating proteases ADAM10 and membrane type 1 matrix metalloproteinase[J].Mol Cell Biol, 2015,35(21):3622⁃3632.DOI:10.1128/MCB.00116⁃15.
[14]Basak A,Chen A,Scamuffa N,et al.Blockade of furin activity and furin⁃induced tumor cells malignant phenotypes by the chemi⁃cally synthesized human furin prodomain[J].Curr Med Chem, 2010,17(21):2214⁃2221.DOI:10.2174/092986710791331040.
[15]Hardy KM,Kirschmann DA,Seftor EA,et al.Regulation of the embryonic morphogen Nodal by Notch4 facilitates manifestation of the aggressive melanoma phenotype[J].Cancer Res,2010,70(24):10340⁃10350.DOI:10.1158/0008⁃5472.CAN⁃10⁃0705.
[16]Bedogni B.Notch signaling in melanoma:interacting pathways and stromal influences that enhance Notch targeting[J].Pigment Cell Melanoma Res,2014,27(2):162⁃168.DOI:10.1111/pcmr. 12194.
[17]Kirschmann DA,Seftor EA,Hardy KM,et al.Molecular pathways: vasculogenic mimicry in tumor cells:diagnostic and therapeutic implications[J].Clin Cancer Res,2012,18(10):2726⁃2732. DOI:10.1158/1078⁃0432.CCR⁃11⁃3237.
[18]Qiu XX,Chen L,Wang CH,et al.The vascular notch ligands delta⁃like ligand 4(DLL4)and Jagged1(JAG1)have opposing correlations with microvascularization but a uniform prognostic effect in primary glioblastoma:a preliminary study[J].World Neurosurg,2016,88:447⁃458.DOI:10.1016/j.wneu.2015.10.058.
[19]Pedrosa AR,Trindade A,Fernandes AC,et al.Endothelial Jagged1 antagonizes Dll4 regulation of endothelial branching and promotes vascular maturation downstream of Dll4/Notch1[J]. Arterioscler Thromb Vasc Biol,2015,35(5):1134⁃1146.DOI: 10.1161/ATVBAHA.114.304741.
[20]Benedito R,Rocha SF,Woeste M,et al.Notch⁃dependent VEGFR3 upregulation allows angiogenesis without VEGF⁃VEGFR2 signal⁃ling[J].Nature,2012,484(7392):110⁃114.DOI:10.1038/ nature10908.
[21]Siekmann AF,Affolter M,Belting HG.The tip cell concept 10 years after:new players tune in for a common theme[J].Exp Cell Res,2013,319(9):1255⁃1263.DOI:10.1016/j.yexcr.2013.01. 019.
[22]Zhang J,Ye J,Ma D,et al.Cross⁃talk between leukemic and endothelial cells promotes angiogenesis by VEGF activation of the Notch/Dll4 pathway[J].Carcinogenesis,2013,34(3):667⁃677.DOI:10.1093/carcin/bgs386.
Expression of Notch pathway receptors and ligands in cutaneous malignant melanoma
Liu Bai,Yu Wanting,Cheng Wei,Shao Xuebao,Jiang Yiqun
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union
Jiang Yiqun,Email:yiqunjiang@qq.com
ObjectiveTo determine the expression of Notch pathway receptors(Notch1 and Notch4)and ligands(Jagged1 and Dll4)in cutaneous malignant melanoma(CMM)tissues,and to preliminarily explore the role of the Notch signaling pathway in the pathogenesis of CMM.MethodsImmunohistochemical study was performed to determine the expression pattern and intensity of Notch1, Notch4,Jagged1 and Dll4 in 40 paraffin⁃embedded CMM specimens and 15 paraffin⁃embedded pigmented nevus specimens.Statistical analysis was carried out by chi⁃square test and Spearman rank correlation analysis with the SPSS 21.0 software.ResultsNotch1 was detected in 31(77.5%)of 40 CMM specimens, as well as in 3 of 15 pigmented nevus specimens,and the positive rates significantly differed between the two groups(χ2=15.281,P<0.001).However,no significant difference in the expression intensity of Notch1 was observed between 18in situmelanoma tissues and 22 invasive melanoma tissues(χ2=0.631,P=0.427).In addition,the positive rates of Notch4,Jagged1 and Dll4 were also significantly higher in the CMM group than those in the pigmented nevus group(allP<0.05),and the expression intensity of Notch4, Jagged1 and Dll4 significantly differed betweenin situand invasive melanoma tissues(allP<0.05).In CMM tissues,the expression of Notch1 was positively correlated with that of Jagged1(rs=0.350,P= 0.027)and Dll4(rs=0.562,P<0.001),while the expression of Jagged1 was negatively correlated with that of Dll4(rs=-0.734,P<0.001).ConclusionAbnormality of the Notch signaling pathway may be involved in the pathogenesis of melanoma,but further researches are still needed to elucidate the detailed mechanism.
Nevi and melanomas;Receptors,Notch;Immunohistochemistry;Jagged1;Dll4
姜祎群,Email:yiqunjiang@qq.com
10.3760/cma.j.issn.0412⁃4030.2017.04.005
Medical College,Nanjing 210042,China
2016⁃07⁃20)
(本文编辑:尚淑贤)
