白细胞介素2基因转染细胞因子诱导的杀伤细胞对恶性黑素瘤细胞的杀伤作用
2017-11-02芦兰谢丛华张浩中许绿叶师幸伟谢君车彪丁雯
芦兰 谢丛华 张浩中 许绿叶 师幸伟 谢君 车彪 丁雯
430071武汉大学中南医院肿瘤放化疗科(芦兰、谢丛华);长江航运总医院内科(张浩中、许绿叶、师幸伟、丁雯),外科(谢君、车彪)
白细胞介素2基因转染细胞因子诱导的杀伤细胞对恶性黑素瘤细胞的杀伤作用
芦兰 谢丛华 张浩中 许绿叶 师幸伟 谢君 车彪 丁雯
430071武汉大学中南医院肿瘤放化疗科(芦兰、谢丛华);长江航运总医院内科(张浩中、许绿叶、师幸伟、丁雯),外科(谢君、车彪)
目的探讨白细胞介素2(IL⁃2)基因转染细胞因子诱导的杀伤细胞(CIK)对恶性黑素瘤的杀伤能力。方法提取小鼠脾细胞,分离淋巴细胞,培养CIK细胞,用携带IL⁃2的质粒PEGF⁃N1⁃IL⁃2转染CIK细胞,荧光显微镜观察质粒转染情况,反转录⁃聚合酶链反应(RT⁃PCR)鉴定IL⁃2基因的表达。将效应细胞(CIK细胞或IL⁃2转染CIK细胞)和靶细胞(B16黑素瘤细胞)分别按照效靶比10∶1、20∶1和40∶1混合培养,采用4 h乳酸脱氢酶释放测定法,检测两种CIK细胞对B16细胞的细胞毒活性。按照效靶比40∶1混合,采用酶联免疫吸附测定法(ELISA)检测两种CIK细胞IL⁃2、干扰素γ(IFN⁃γ)和肿瘤坏死因子α(TNF⁃α)水平。建立小鼠黑素瘤模型,将28只模型小鼠平均分为4组:对照组(瘤旁注射0.2 ml生理氯化钠溶液)、IL⁃2组(瘤旁注射100 IU IL⁃2)、CIK组(瘤旁注射细胞数约1×106CIK细胞悬液)、IL⁃2转染CIK组(瘤旁注射细胞数约1×106IL⁃2转染CIK细胞悬液),通过肿瘤形态学和抑瘤率、细胞凋亡率来评价荷瘤小鼠肿瘤生长情况。两组正态分布计量资料的比较行t检验,多组计量资料的比较采用方差分析,两两间多重比较采用LSD⁃t检验。结果荧光显微镜及RT⁃PCR均显示IL⁃2转染CIK细胞成功。效靶比实验显示,40∶1时IL⁃2转染CIK细胞对B16细胞的毒性最强,IL⁃2转染CIK细胞组分泌IL⁃2(1107.26±6.49 pg/ml)、IFN⁃γ(50.01±3.35 pg/ml)和TNF⁃α(39.86±3.25 pg/ml)的能力明显高于CIK细胞组(分别为51.09±3.85、32.71±2.43、30.11±3.08 pg/ml),两组比较,t值分别为442.60、14.93和6.89,差异均有统计学意义(P<0.01)。动物实验显示,与干预前相比,干预后对照组小鼠肿瘤体积明显增大(P<0.05),而IL⁃2组、CIK组和IL⁃2转染CIK组小鼠肿瘤体积明显减小(P<0.001),且IL⁃2转染CIK组肿瘤体积显著小于其他3组(均P<0.01),但IL⁃2组和CIK组差异无统计学意义(P>0.05)。CIK组、IL⁃2组和IL⁃2转染CIK组的细胞凋亡率均显著大于对照组(P<0.01),IL⁃2转染CIK组的细胞凋亡率及抑瘤率均显著大于IL⁃2组和CIK组(P<0.01),而IL⁃2组和CIK组细胞凋亡率及抑瘤率差异无统计学意义(P>0.05)。结论IL⁃2转染CIK细胞对恶性黑素瘤有更强的杀伤作用。
白细胞介素2;细胞因子诱导杀伤细胞;转染;黑色素瘤
近年来,肿瘤过继免疫治疗成为生物治疗中最活跃的研究领域,如白细胞介素2/淋巴因子激活杀伤细胞(IL⁃2/LAK)、CD3AK细胞、肿瘤浸润性淋巴细胞(TIL)、自然杀伤细胞(NK细胞)、树突细胞、细胞因子诱导的杀伤细胞(CIK细胞)等,在临床上已成功用于治疗多种恶性肿瘤。由于恶性黑素瘤有较强的免疫原性,免疫疗法成为其治疗领域热点[1⁃2]。但同时又发现许多问题,如治疗恶性黑素瘤时IL⁃2剂量过大、CIK细胞低效、简单联合效果差等,导致临床应用受到极大限制[3⁃4]。为此,我们通过将IL⁃2基因转染至CIK细胞来增强CIK的细胞毒性,观察其对荷瘤鼠的抑瘤和促细胞凋亡作用,探讨IL⁃2基因转染CIK细胞对恶性黑素瘤的杀伤能力。
材料与方法
一、材料
B16黑素瘤细胞株由华中科技大学同济医学院附属协和医院皮肤免疫实验室保种传代;清洁级近交系C57BL/6小鼠购于湖北省实验动物中心[动物合格证号SCXK(鄂)2008⁃0005],在华中科技大学同济医学院附属协和医院动物饲养中心恒温恒湿条件下饲养,垫料、饲料和饮水均经灭菌处理;取6~8周龄雌性实验鼠(体重15~20 g)备用。胎牛血清(杭州四季青生物工程材料有限公司),脂质体2000(美国Invitrogen公司),pEGFP⁃N1质粒(湖南科爱医疗器械有限公司),质粒DNA提取与纯化试剂盒(上海华舜生物技术有限公司),细胞因子IL⁃2、干扰素γ(IFN⁃γ)及肿瘤坏死因子α(TNF⁃α)ELISA试剂盒(上海元象医疗器械有限公司);FACS⁃420型流式细胞仪(美国BD公司),荧光显微镜(日本Olympus公司)。
二、制备CIK细胞[5]
切取C57BL/6小鼠脾脏,分离脾细胞,分离淋巴细胞,无血清1640培养基洗涤2次,调整细胞为1× 106/ml。加入1 000 IU/ml IFN⁃γ,在含10%胎牛血清的1640培养液中于37℃、5%CO2条件下培养24 h。第2天加入50 ng/ml抗CD3单抗、100 IU/ml IL⁃1α、300 IU/ml IL⁃2。以后每2 d更换1次培养基并加300 IU/ml IL⁃2,第13天收获CIK细胞,分为CIK细胞组和CIK细胞备用组。
三、IL⁃2转染CIK细胞[6⁃7]
转染前1 d,将CIK备用组细胞按1×106/ml接种于不含青霉素、链霉素、庆大霉素的1640培养液中培养,用1 ml无血清Opti⁃MEM重悬。无菌条件下取C57BL/6小鼠脾脏,用RNA提取试剂盒提取总RNA。采用Genbank提供的小鼠IL⁃2引物序列,上游引物5′⁃CCTTGCTAATCACTCCTCAC⁃3′,下游引物5′⁃TATGTGTTGTAA GCAGGAGG⁃3′,产物510 bp,由生工生物工程(上海)股份有限公司设计合成。按反转录试剂盒和PCR试剂盒说明进行扩增,得到PCR扩增产物,经过1%琼脂糖凝胶电泳鉴定PCR产物为IL⁃2 cDNA;通过凝胶DNA回收试剂盒回收PCR产物中的IL⁃2 cDNA。经纯化后,在多种酶切酶及连接酶作用下与质粒pEGFP⁃N1(可发绿色荧光)融合形成pEGFP⁃N1⁃IL⁃2。用质粒提取试剂盒提取质粒,将1 μg融合质粒用无血清Opti⁃MEM稀释,与2 μl脂质体2000在室温下孵育,然后与前1 d接种好的CIK细胞混匀,最后加入2 ml含10%胎牛血清的1640培养液继续培养待用。24 h后收集CIK细胞作为IL⁃2转染CIK细胞组,取部分转染后的细胞悬液在倒置荧光显微镜下观察,取部分转染后的CIK细胞悬液进行RT⁃PCR,1%琼脂糖凝胶电泳,确定IL⁃2基因是否转染至CIK细胞。
四、CIK细胞毒性检测
取CIK细胞组和IL⁃2转染CIK细胞组样本各10个备用,以B16黑素瘤细胞株为靶细胞,CIK细胞为效应细胞,调整靶细胞和效应细胞均为1×106/ml,按照效靶比10∶1、20∶1和40∶1加入96孔细胞培养板中,置于37℃5%CO2培养箱中培养4 h,同时设自然释放组(0.1 ml效应细胞或靶细胞)和最大释放组(0.1 ml靶细胞+0.1 ml 1%NP⁃40液),每组设3复孔。采用4 h乳酸脱氢酶(LDH)释放测定法[8],检测两组CIK细胞对黑素瘤细胞的细胞毒活性,酶标仪检测490 nm处吸光度(A值)代表LDH释放水平。细胞毒活性(%)=(实验孔A值-效应细胞自然释放A值-靶细胞自然释放A值)/(靶细胞最大释放A值-靶细胞自然释放A值)×100%。
五、CIK细胞分泌的细胞因子检测
效应细胞与靶细胞按照40∶1混合48 h后,采用双抗体夹心ELISA法检测CIK细胞组和IL⁃2转染CIK细胞组IL⁃2、IFN⁃γ和TNF⁃α水平。取100 μl混合样本离心后的上清液和标准品分别加入酶标板,通过孵育、加抗、洗涤、显色等步骤,最后用酶标仪在450 nm处测定A值,计算各样品中IL⁃2、IFN⁃γ和TNF⁃α浓度。
六、建立动物模型[9]
体外培养B16黑素瘤细胞株,分别取对数生长期细胞悬液0.1 ml(1×106个细胞)接种于28只C57BL/6小鼠背部皮下。接种9d后出现直径6~9mm肿瘤。按随机数字表法将28只小鼠平均分为4组,每组7只,分别于瘤旁注射0.2 ml生理氯化钠溶液(对照组)、0.2 ml 500 IU/ml IL⁃2(IL⁃2组)、0.1 ml 1× 107/ml CIK细胞悬液(CIK组)、0.1 ml 1×107/ml IL⁃2转染CIK细胞悬液(IL⁃2转染CIK组),每隔3 d注射1次,连续3次。
七、计算抑瘤率和细胞凋亡率
在小鼠接种B16细胞9 d后,使用游标卡尺于体外测量肿瘤直径。肿瘤近似体积=ab2/2(a为最大直径,b为最小直径),单位mm3。各组小鼠均于最后1次注射治疗3 d后断颈取瘤,测量肿瘤重量(g)。抑瘤率(%)=(1-实验组平均瘤重/对照组平均瘤重)×100%。然后将瘤组织分解、研磨、离心,经高浓度碘化丙锭(PI)染色后,荧光倒置显微镜下观察黑素瘤细胞的形态,流式细胞仪检测细胞凋亡情况,根据PI荧光直方图上亚二倍体峰(凋亡峰)来计算各样本凋亡细胞百分率。
八、统计学方法
采用SPSS18.0统计软件,两组正态分布计量资料的比较行t检验,多组计量资料的比较采用方差分析,两两间多重比较采用LSD⁃t检验,P<0.05为差异有统计学意义。
结果
一、IL⁃2转染CIK细胞和鉴定
转染融合质粒pEGFP⁃N1⁃IL⁃2的CIK细胞在倒置荧光显微镜下观察,转染有目的基因的细胞发出绿色荧光(图1A)。转染过的CIK细胞经过RT⁃PCR,琼脂糖凝胶电泳可见510 bp的DNA条带,符合小鼠IL⁃2 cDNA的电泳迁移率,表明IL⁃2转染成功(图1B)。
二、CIK细胞的细胞毒性检测
随效靶比的增大,CIK细胞和IL⁃2转染的CIK细胞对B16细胞的细胞毒活性皆逐渐增大,均在效靶比为40∶1时最强(P<0.01)。在相同效靶比下,IL⁃2转染CIK组对B16细胞的细胞毒活性皆强于CIK组,两组差异均有统计学意义(P<0.01),见表1。

图1 白细胞介素2(IL⁃2)转染细胞因子诱导的杀伤细胞(CIK细胞)的鉴定 1A:携带质粒pEGFP⁃N1⁃IL⁃2的CIK细胞显示绿色荧光;1B:IL⁃2转染CIK细胞的RT⁃PCR,1:标准参照物(100~15 000 bp),2~7:IL⁃2 cDNA
表1 不同CIK细胞对B16黑素瘤细胞株的毒性(%,±s)

表1 不同CIK细胞对B16黑素瘤细胞株的毒性(%,±s)
注:CIK:细胞因子诱导的杀伤细胞;IL⁃2:白细胞介素2
组别CIK组IL⁃2转染CIK组t值P值n 10 10效应细胞∶靶细胞10∶1 33.02±2.51 38.11±2.54 4.51 0.001 20∶1 39.85±2.62 50.01±3.35 7.55<0.001 40∶1 51.27±3.54 72.07±3.89 12.51<0.001 F值99.26 271.52 P值<0.001<0.001
三、细胞因子的表达
在效靶比40∶1时IL⁃2转染CIK组IL⁃2、IFN⁃γ和TNF⁃α浓度均明显高于CIK组,差异均有统计学意义(P<0.01),见表2。
表2 效应细胞与靶细胞比40∶1时不同CIK细胞细胞因子表达水平比较(±s) pg/ml

表2 效应细胞与靶细胞比40∶1时不同CIK细胞细胞因子表达水平比较(±s) pg/ml
注:CIK:细胞因子诱导的杀伤细胞;IL⁃2:白细胞介素2;IFN⁃γ:干扰素γ;TNF⁃α:肿瘤坏死因子α
组别CIK组IL⁃2转染CIK组t值P值n 10 10 IL⁃2 51.09±3.85 1107.26±6.49 442.60<0.001 IFN⁃γ 32.71±2.43 50.98±3.01 14.93<0.001 TNF⁃α 30.11±3.08 39.86±3.25 6.89<0.001
四、荷瘤小鼠形态学比较
干预治疗前可见对照组、IL⁃2组、CIK组和IL⁃2转染CIK组荷瘤小鼠背部皮下有大小近乎一致的肿瘤结节。干预治疗9 d后,4组小鼠的肿瘤形态发生了不同的变化,其中对照组肿瘤变大,其他3组肿瘤均变小,IL⁃2转染CIK组肿瘤变小最明显,见图2。
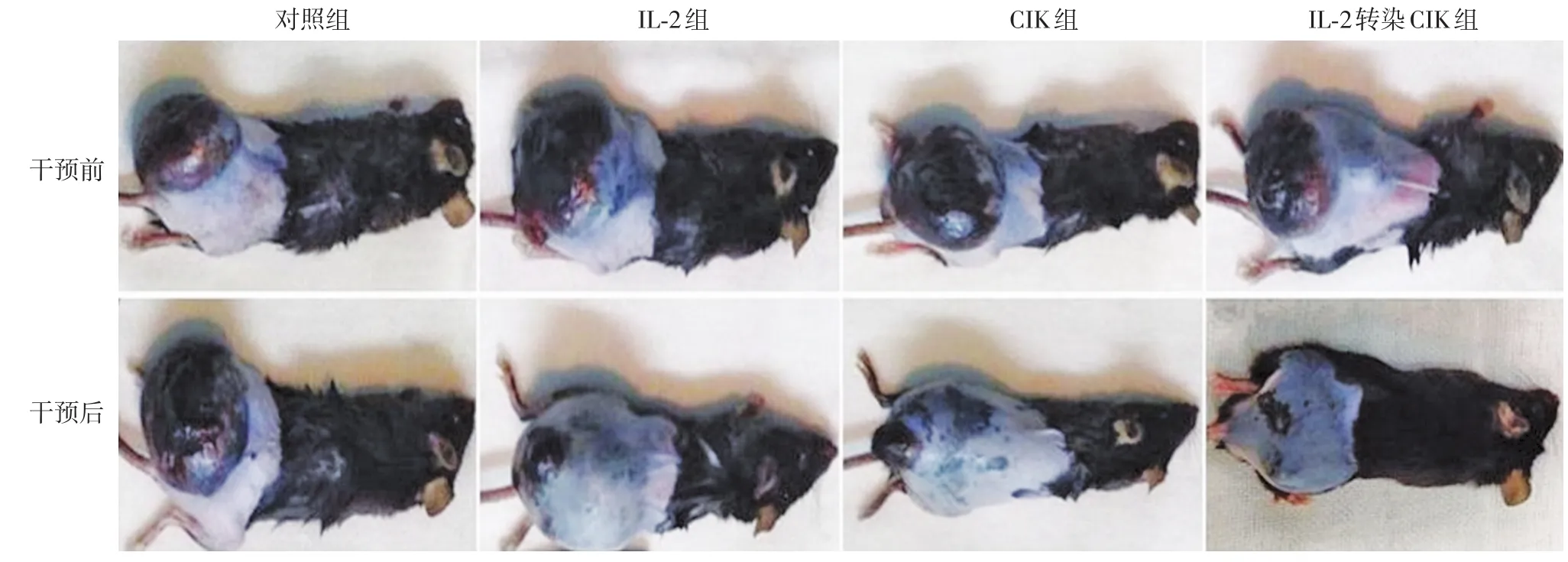
图2 四组荷瘤小鼠干预治疗前后肿瘤形态变化 干预治疗前,4组荷瘤小鼠背部皮下肿瘤结节大小近乎一致;干预治疗9 d后,对照组肿瘤变大,其他3组肿瘤变小,IL⁃2转染CIK组肿瘤变小最明显。IL⁃2:白细胞介素2;CIK:细胞因子诱导的杀伤细胞
五、四组抑瘤效果评价
干预前,4组小鼠肿瘤体积比较,差异无统计学意义(F=0.08,P>0.05)。干预后,对照组小鼠肿瘤体积与干预前相比明显增大(P<0.05),而IL⁃2组、CIK组和IL⁃2转染CIK组明显减小(均P<0.001)。干预后4组小鼠肿瘤体积比较,差异有统计学意义(P<0.001);LSD⁃t检验显示,IL⁃2组、CIK组、IL⁃2转染CIK组小鼠肿瘤体积明显小于对照组(均P<0.01),IL⁃2转染CIK组小于IL⁃2组和CIK组(均P<0.01),而IL⁃2组和CIK组比较差异无统计学意义(P>0.05)。见表3。
干预后4组瘤重比较差异有统计学意义(P<0.001);LSD⁃t检验显示,IL⁃2组、CIK组和IL⁃2转染CIK组瘤重均显著低于对照组(均P<0.01),IL⁃2转染CIK组低于IL⁃2组和CIK组(均P<0.01),而IL⁃2组和CIK组比较差异无统计学意义(P>0.05)。此外,IL⁃2组、CIK组和IL⁃2转染CIK组抑瘤率比较,差异有统计学意义(P<0.001),其中IL⁃2转染CIK组显著大于IL⁃2组和CIK组(均P< 0.01),而IL⁃2组和CIK组差异无统计学意义(P>0.05)。见表3。
表3 四组荷瘤小鼠不同干预措施抑瘤效果的评价(±s)
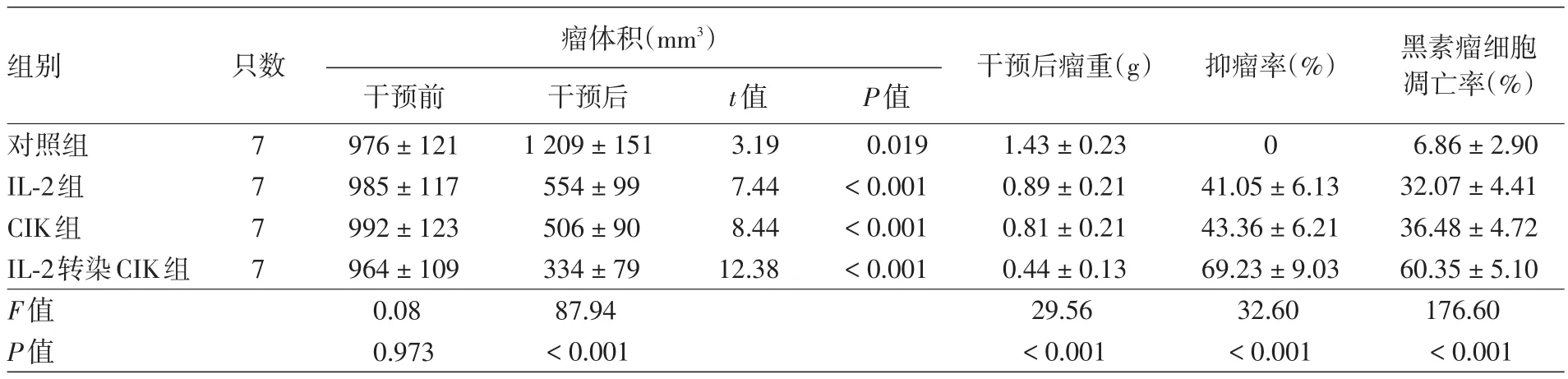
表3 四组荷瘤小鼠不同干预措施抑瘤效果的评价(±s)
注:IL⁃2:白细胞介素2;CIK:细胞因子诱导的杀伤细胞
组别 只数 瘤体积(mm3) 干预后瘤重(g) 抑瘤率(%)对照组IL⁃2组CIK组IL⁃2转染CIK组F值P值7 7 7 7干预前976±121 985±117 992±123 964±109 0.08 0.973干预后1 209±151 554±99 506±90 334±79 87.94<0.001 t值3.19 7.44 8.44 12.38 P值0.019<0.001<0.001<0.001 0 1.43±0.23 0.89±0.21 0.81±0.21 0.44±0.13 29.56<0.001 41.05±6.13 43.36±6.21 69.23±9.03 32.60<0.001黑素瘤细胞凋亡率(%)6.86±2.90 32.07±4.41 36.48±4.72 60.35±5.10 176.60<0.001
六、检测细胞凋亡
荧光显微镜下凋亡细胞核呈红色,可见4组出现不同程度核固缩等细胞凋亡征象:对照组有少量的细胞凋亡,其余3组的凋亡征象均较对照组明显,IL⁃2转染CIK组的凋亡征象尤为明显。见图3。
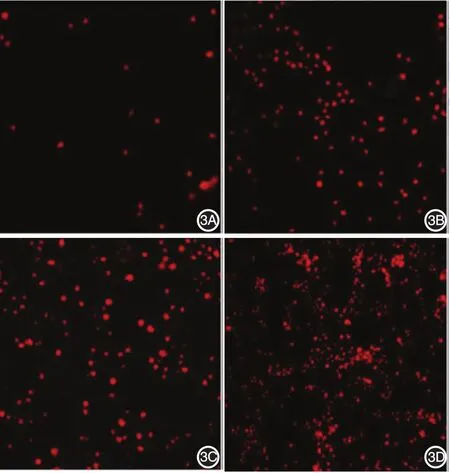
图3 碘化丙锭(PI)染色检测各组黑素瘤细胞凋亡情况 对照组有少量的细胞凋亡,其余3组的凋亡均较对照组明显,白细胞介素2(IL⁃2)转染细胞因子诱导的杀伤细胞(CIK)组的凋亡尤为明显。3A:对照组;3B:IL⁃2组;3C:CIK组;3D:IL⁃2转染CIK组
流式细胞仪检测经PI染色的各组样本,结果显示,4组细胞凋亡率差异有统计学意义(P<0.001),CIK组、IL⁃2组和IL⁃2转染CIK组细胞凋亡率均显著大于对照组(P<0.01),IL⁃2转染CIK组亦显著大于IL⁃2组和CIK组(均P<0.01),而IL⁃2组和CIK组差异无统计学意义(P>0.05)。见表3。
讨论
细胞过继免疫治疗是通过输注免疫活性细胞增强肿瘤患者的免疫功能以达到抗肿瘤的效果。近年来,体内外研究发现,细胞过继免疫治疗的疗效并不理想,如何使过继的免疫活性细胞在体内发挥持续的作用,从而引起体内肿瘤免疫记忆并激发新一轮抗肿瘤效应,是目前迫切需要解决的问题,也是提高肿瘤生物治疗疗效的关键。
IL⁃2由活化的T细胞分泌,半衰期短,以自分泌方式发挥作用,通过增强免疫细胞的细胞毒性和抗原特异性,促进细胞增殖,增强颗粒酶和细胞穿孔素等的表达来发挥抗肿瘤作用[10]。研究发现[11],单纯IL⁃2在体外并不具有杀瘤作用,但联合应用或在体内时可增强免疫效应细胞的杀瘤活性,并延长免疫效应细胞的存活时间。肿瘤患者的IL⁃2含量低于健康人,细胞毒性T淋巴细胞(CTL)、NK细胞、LAK、CIK等免疫细胞难以被活化和增殖,不能有效清除逃逸的肿瘤细胞。因此,提供外源IL⁃2可提高肿瘤患者的免疫监视功能。1998年FDA批准IL⁃2用于不能手术切除的恶性黑素瘤治疗,随后的研究发现,IL⁃2在有效剂量范围内的毒副作用较大,从而限制了其在临床上的应用[12]。目前研究聚焦在IL⁃2与其他治疗联合应用上,联合方式有局部注射、静脉滴注、基因转染等,其中基因转染最受推崇。基因转染有电穿孔、脂质体转染、病毒转染、纳米转染等,目前脂质体和纳米转染应用较多[13⁃14]。
CIK兼有T淋巴细胞强大的抗瘤活性和NK细胞的无组织相容性限制的杀瘤特点,被称为NK样T淋巴细胞。CIK治疗被认为是新一代抗肿瘤过继免疫治疗首选,是继手术、化疗、放疗治疗肿瘤的第4种模式[14]。但CIK细胞在健康人外周血中极其罕见,仅1%~5%,其增殖、细胞毒性的强度、持续时间等问题成为制约其临床疗效的关键。CD3+CD56+为CIK的主要表型,且细胞毒活性仅存于CD3+CD56+细胞中,其比例增加预示CIK细胞毒活性增强。如何提高CIK细胞中CD3+CD56+细胞的比例是目前研究的热点[15]。CIK体外增殖需要外源性细胞因子如IL⁃2、IL⁃12、IL⁃7等的辅助,其中IL⁃2加入的时间和方式对CIK的增殖及细胞毒活性意义重大[16]。外源性IL⁃2诱导的免疫反应都是非肿瘤特异性的,毒副反应大,但将IL⁃2基因转染免疫细胞,在转染细胞的局部分泌IL⁃2,不仅可以避免全身性副作用,而且可以诱导机体产生抗肿瘤免疫反应。
本研究显示,IL⁃2基因转染的CIK细胞在荧光显微镜下可见绿色荧光,提示质粒转染成功,转染后的CIK细胞基因经过RT⁃PCR扩增后,琼脂糖凝胶电泳可见510 bp的DNA条带,再次证明IL⁃2转染成功。3种效靶比评价IL⁃2转染的CIK对B16恶性黑素瘤细胞的细胞毒活性,显示效靶比为40∶1时其细胞毒活性最强;且IL⁃2转染的CIK细胞分泌IL⁃2等细胞因子的能力要强于单纯CIK细胞。动物实验显示,转染IL⁃2的CIK细胞具有更强的抑瘤和促凋亡作用,且显著强于单纯IL⁃2或CIK细胞的治疗。
综上所述,IL⁃2转染CIK细胞可被成功构建,效靶比40∶1时IL⁃2转染CIK细胞对恶性黑素瘤细胞毒活性增大,IL⁃2转染的CIK细胞能分泌更多的IL⁃2、IFN⁃γ和TNF⁃α,促进CIK细胞的成熟,增强CIK细胞的肿瘤杀伤能力。通过IL⁃2转染可以增强CIK细胞对恶性黑素瘤的杀伤作用。同时我们也关注到其他学者应用IL⁃12、IFN⁃γ等替代或联合IL⁃2来增强CIK细胞的杀瘤作用,这将是我们以后努力的方向。
[1]CSCO黑色素瘤专家委员会.中国黑色素瘤诊治指南(2015版)[M].北京:人民卫生出版社,2015,40⁃41.
[2]Olszanski AJ.Current and future roles of targeted therapy and immunotherapy in advanced melanoma[J].J Manag Care Spec Pharm,2014,20(4):346⁃356.DOI:10.18553/jmcp.2014.20.4. 346.
[3]Otáhal P,Trněný M.Current approaches in cancer immuno⁃therapy[J].Klin Onkol,2015,28 Suppl 3:3S105⁃111.DOI:10.14735/ amko20153S105.PMID:26489509.
[4]钱其军,吴孟超.肿瘤精准细胞免疫治疗:梦想照进现实[J].中国肿瘤生物治疗杂志,2015,22(2):151⁃158.DOI:10.3872/j. issn.1007⁃385X.2015.02.003.
[5]Huang X,Cui S,Shu Y.Cisplatin selectively downregulated the frequency and immunoinhibitory function of myeloid⁃derived suppressor cells in a murine B16 melanoma model[J].Immunol Res,2016,64(1):160⁃170.DOI:10.1007/s12026⁃015⁃8734⁃1.
[6]张家模,吴小候,张翾,等.白细胞介素2锚定的exosomes的制备及其对膀胱癌细胞的诱导杀伤效应[J].中华肿瘤杂志, 2011,33(8):564⁃569.DOI:10.3760/cma.j.issn.0253⁃3766.2011. 08.002.
[7]李安娜.IL⁃2基因转染的CIK细胞联合树突状细胞的抗肝癌实验研究[D].南宁:广西医科大学,2008.
[8]张蕾,李芳秋,张士新,等.LDH释放法检测肿瘤患者PBMC和CIK细胞的细胞毒活性[J].现代检验医学杂志,2008,23(6): 27⁃29.DOI:10.3969/j.issn.1671⁃7414.2008.06.008.
[9]钱悦,蒋苹,褚淑娟,等.携带MIA基因单核细胞增生性李斯特菌抑制恶性黑素瘤的研究[J].中华皮肤科杂志,2009,42(6): 399⁃401.DOI:10.3760/cma.j.issn.0412⁃4030.2009.06.011.
[10]Carmenate T,Pacios A,Enamorado M,et al.Human IL⁃2 mutein with higher antitumor efficacy than wild type IL⁃2[J].J Immunol, 2013,190(12):6230⁃6238.DOI:10.4049/jimmunol.1201895.
[11]Vacca P,Martini S,Garelli V,et al.NK cells from malignant pleural effusions are not anergic but produce cytokines and display strong antitumor activity on short⁃term IL⁃2 activation[J]. EurJImmunol,2013,43(2):550⁃561.DOI:10.1002/eji.201242783.
[12]Hughes T,Klairmont M,Broucek J,et al.The prognostic significance of stable disease following high⁃dose interleukin⁃2(IL⁃2)treatment in patients with metastatic melanoma and renal cell carcinoma[J].Cancer Immunol Immunother,2015,64(4): 459⁃465.DOI:10.1007/s00262⁃014⁃1652⁃6.
[13]刘秋霞.真核表达载体PEGFP⁃N1⁃IL⁃2构建及CIK细胞的体外扩增[D].承德:承德医学院,2007.
[14]Rossowska J,Pajtasz⁃Piasecka E,Rysnik O,et al.Generation of antitumor response by IL⁃2⁃transduced JAWS II dendritic cells[J].Immunobiology,2011,216(10):1074⁃1084.DOI:10.1016/j. imbio.2011.05.006.
[15]Guo Y,Han W.Cytokine⁃induced killer(CIK)cells:from basic research to clinical translation[J].Chin J Cancer,2015,34(3): 99⁃107.DOI:10.1186/s40880⁃015⁃0002⁃1.
[16]Wang W,Meng M,Zhang Y,et al.Global transcriptome⁃wide analysis of CIK cells identify distinct roles of IL⁃2 and IL⁃15 in acquisition of cytotoxic capacity against tumor[J].BMC Med Genomics,2014,7:49.DOI:10.1186/1755⁃8794⁃7⁃49.
Cytotoxic effects of cytokine⁃induced killer cells transfected with the interleukin⁃2 gene on malignant melanoma cells
Lu Lan,Xie Conghua,Zhang Haozhong,Xu Lyuye,Shi Xingwei,Xie Jun,Che Biao,Ding Wen
Department of Radiation and Chemotherapy,Zhongnan Hospital of Wuhan University,Wuhan 430071, China(Lu L,Xie CH);Department of Internal Medicine,General Hospital of the Yangtze River Shipping, Wuhan 430010,China(Zhang HZ,Xu LY,Shi XW,Ding W);Department of Surgery,General Hospital of
Xie Conghua,Email:chxie_65@whu.edu.cn
ObjectiveTo evaluate cytotoxic effects of cytokine⁃induced killer cells(CIK cells)transfected with the interleukin⁃2(IL⁃2)gene on malignant melanoma cells.MethodsMouse spleen cells were extracted,lymphocyte cells were separated,and CIK cells were prepared from these lymphocyte cells. PEGF⁃N1 plasmids containing IL⁃2 gene(PEGF⁃N1⁃IL⁃2)were transfected into CIK cells.Fluorescence microscopy was used to observe transfection products,and reverse transcriptase⁃polymerase chain reaction(RT⁃PCR)was conducted to determine the IL⁃2 mRNA expression.Then,effector cells such as CIK cells and IL⁃2⁃transfected CIK cells were separately co⁃cultured with target cells(B16 melanoma cells)at effector⁃target ratios of 10∶1,20∶1 and 40∶1,then 4⁃hour lactate dehydrogenase release assay was performed to evaluate cytotoxic effects of the two kinds of CIK cells on B16 cells.After effector cells were co⁃cultured with target cells at the effector⁃target ratio of 40∶1 for 48 hours,enzyme⁃linked immunosorbent assay(ELISA)was conducted to detect levels of IL⁃2,interferon⁃γ(IFN⁃γ)and tumor necrosis factor⁃α(TNF⁃α)in the supernatant of the two kinds of CIK cells.Finally,mouse models of melanoma were established,and a total of 28 melanoma⁃bearing mice were divided into 4 groups to be peritumorally injected with 0.2 ml sodium chloride physiological solution(control group),100 IU IL⁃2 solution(IL⁃2 group),CIK cell suspension at a cell density of 1×106cells per milliliter(CIK group)and IL⁃2⁃transfected CIK cell suspension at a cell density of 1×106cells per milliliter(IL⁃2⁃transfected CIK group)respectively.Tumor morphology,tumor inhibition rate and cell apoptosis rate were used to evaluate tumor growth in the above groups.If data were normally distributed,t⁃test was used for comparing means between two groups,and analysis of variance and least significant difference(LSD)⁃ttest were used for comparing means among multiple groups.ResultsFluorescence microscopy and RT⁃PCR both showed that IL⁃2 was successfully transfected into CIK cells.The cytotoxic effect of IL⁃2⁃transfected CIK cells on B16 cells was strongest at the effector⁃target ratio of 40∶1.Levels of IL⁃2,IFN⁃γ and TNF⁃α were also significantly higher in the supernatant of IL⁃2⁃transfected CIK cells[(1107.26±6.49)pg/ml,(50.01±3.35)pg/ml,(39.86± 3.25)pg/ml]than those in that of CIK cells[(51.09±3.85)pg/ml,(32.71±2.43)pg/ml,(30.11±3.08)pg/ml,t=442.60,14.93,6.89,allP<0.01].Animal experiments showed that the tumor volume obviously increased in the control group(P<0.05),but significantly decreased in the IL⁃2 group,CIK group and IL⁃2⁃transfected CIK group(allP<0.001)after intervention compared with those before intervention. Furthermore,the tumor volume in the IL⁃2⁃transfected CIK group was significantly less than that in the other three groups(allP<0.01),but no significant difference was observed between the IL⁃2 group and CIK group(P>0.05).In addition,the apoptosis rate was significantly higher in the IL⁃2 group,CIK group, and IL⁃2⁃transfected CIK group than that in the control group(allP<0.01).The apoptosis rate and tumor inhibition rate were significantly higher in the IL⁃2⁃transfected CIK group than those in the IL⁃2 group and CIK group(allP<0.01),but insignificantly different between the IL⁃2 group and CIK group(P>0.05).ConclusionIL⁃2⁃transfected CIK cells had stronger killing effects on malignant melanoma.
Interleukin⁃2;Cytokine⁃induced killer cells;Transfection;Melanoma
谢丛华,Email:chxie_65@whu.edu.cn
10.3760/cma.j.issn.0412⁃4030.2017.04.006
武汉市卫计委临床医学科研课题(WX13D16)
the Yangtze River Shipping,Wuhan 430010,China(Xie J,Che B)
Fund program:Clinical Research Project of Health and Family Planning Commission of Wuhan Municipality(WX13D16)
2016⁃08⁃03)
(本文编辑:周良佳 颜艳)
