二甲双胍对转化生长因子β1诱导黑素瘤1205Lu细胞上皮-间质转化及侵袭的影响
2017-11-02梁美琪梁官钊郭健段昕所陆洁
梁美琪 梁官钊 郭健 段昕所 陆洁
067020河北,承德医学院附属医院皮肤科(第二作者现在中国医学科学院 北京协和医学院 皮肤病研究所)
二甲双胍对转化生长因子β1诱导黑素瘤1205Lu细胞上皮-间质转化及侵袭的影响
梁美琪 梁官钊 郭健 段昕所 陆洁
067020河北,承德医学院附属医院皮肤科(第二作者现在中国医学科学院 北京协和医学院 皮肤病研究所)
目的探讨二甲双胍在转化生长因子β1(TGF⁃β1)诱导下,对黑素瘤1205Lu细胞上皮-间质转化(EMT)过程及侵袭的影响。方法体外培养1205Lu细胞,分3组处理:空白对照组、TGF⁃β1(5 ng/ml)组、TGF⁃β1(5 ng/ml)+ 二甲双胍(1 mmol/L)组。处理48 h后,显微镜下观察各组细胞形态变化并采集照片。Transwell侵袭实验检测细胞侵袭能力,采用蛋白质印迹法和实时荧光定量RT⁃PCR技术分别测定细胞内N⁃钙黏蛋白及基质金属蛋白酶9(MMP⁃9)在蛋白质和mRNA水平上的表达,通过单因素方差分析及LSD⁃t法对结果进行统计学分析。结果与空白对照组相比,TGF⁃β1诱导1205Lu细胞向成纤维细胞样形态转变(同上皮-间质转化样改变),联合二甲双胍可逆转上述形态改变。3组穿膜细胞数为空白对照组194.1± 8.295、TGF⁃β1组412.2± 13.427、TGF⁃β1+ 二甲双胍组175.3±8.693。N钙黏蛋白水平3组分别为0.603±0.029、1.963±0.016、0.207±0.009,mRNA水平3组分别为1.000±0.000、6.678±0.043、1.035±0.015。MMP⁃9蛋白水平3组分别为0.575±0.009、1.243±0.027、0.629±0.008,mRNA水平3组分别为1.000±0.000、5.351±0.604、0.930±0.130。结果经方差分析显示,3组差异有统计学意义(P<0.05)。结论二甲双胍可显著抑制TGF⁃β1诱导的黑素瘤1205Lu细胞EMT样形态改变、细胞侵袭及N钙黏蛋白、MMP⁃9在蛋白和mRNA水平上的表达。
黑色素瘤;二甲双胍;转化生长因子β1;上皮-间质转化;侵袭
恶性黑素瘤是高致命性皮肤肿瘤,其侵袭、转移能力强,一旦远处转移中位生存期为4~6个月,5年生存率 < 10%[1]。上皮-间质转化(EMT)即上皮型细胞向更具侵袭性的间质型细胞转化过程,被认为是肿瘤细胞获得恶性表型的关键机制,在肿瘤运动、侵袭等方面发挥重要作用。基底膜降解和间质样细胞形成标志着EMT的完成[2⁃3]。基质金属蛋白酶(MMP)可降解细胞外基质和基底膜主要成分,参与肿瘤EMT过程,与肿瘤侵袭密切相关。N钙黏蛋白为间质型细胞标志物,其表达上调标志EMT过程[4⁃6]。作为EMT的主要诱导因子,转化生长因子β(TGF⁃β)通过诱导EMT、生成血管及抑制免疫等促进肿瘤运动、侵袭及转移[7]。在前列腺癌、乳腺癌及肺癌研究中发现,降糖药二甲双胍能够抑制TGF⁃β1诱导产生的EMT,而在黑素瘤领域尚无报道。为此,本研究探讨二甲双胍对TGF⁃β1诱导下黑素瘤细胞EMT过程及侵袭的影响。
资料与方法
一、资料
人黑素瘤1205Lu细胞株(第四军医大学西京医院皮肤科实验室惠赠),TGF⁃β1(美国Peprotech公司),二甲双胍(批号BCBP0558V,纯度≥97%,美国Sigma公司)、MCDB153培养基(美国Sigma公司),L15培养基、Transwell小室(美国Coning公司),胎牛血清(杭州四季青生物公司),胰蛋白酶(美国Gibcol公司),N钙黏蛋白、MMP⁃9、GAPDH正反向引物(大连Takara公司设计并合成),兔抗人N钙黏蛋白单克隆抗体、兔抗人MMP⁃9单克隆抗体(英国Abcam公司),TRIzol(北京索莱宝科技有限公司),Fast Quant反转录试剂盒(天根生化科技有限公司),SYBR Green实时荧光定量PCR检测试剂盒(美国Invitrogen公司),BCA蛋白定量试剂盒(杭州联科生物技术有限公司)。
二、方法
1.细胞培养:1205Lu细胞株用含4%胎牛血清的W489合成培养基(由75%MCDB153培养基和25%L15培养基组成),37℃、5%CO2条件下培养,每2~3天更换1次培养液,待细胞融合至80%~90%丰度时,磷酸盐缓冲液(PBS)漂洗1次,0.25%胰蛋白酶消化,完全培养基终止消化并将细胞调整至适宜密度后传代培养或用于后续实验。
2.分组及处理:实验分为空白对照组、TGF⁃β1组、TGF⁃β1+二甲双胍组3个组。取对数生长期1205Lu细胞,以5×105个/孔细胞数接种于6孔板,细胞单层铺满后弃去培养基并按分组给予如下处理:空白对照组加入无血清培养基;TGF⁃β1组加入含5 ng/ml TGF⁃β1的无血清培养基;TGF⁃β1+ 二甲双胍组加入含5 ng/ml TGF⁃β1及1 mmol/L二甲双胍的无血清培养基,培养48 h后观察细胞形态并收集细胞进行蛋白质及mRNA检测。
3.蛋白质印迹:细胞分组处理48 h后用预冷PBS漂洗2次,加入RIPA裂解液置于冰上裂解30 min,24 000×g离心15 min,取上清按BCA法测定各组蛋白浓度,每组取25 μg蛋白上样,用8%SDS⁃PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)分离总蛋白,并转印至PVDF(聚亚乙烯双氧化物)膜上,5%脱脂奶粉封闭1.5 h,分别加入一抗即抗N钙黏蛋白抗体(1∶1 000)、抗MMP⁃9抗体(1∶1 000)、抗β肌动蛋白抗体(1∶10 000)4℃孵育过夜,TBST清洗3次后加入辣根过氧化物酶标记的二抗(1∶5 000)室温振荡1.5 h,TBST清洗3次后加ECL发光液于暗室压片曝光。实验重复3次取均值。采用Gel⁃pro analyzer4图像分析软件测定条带IOD值。目的蛋白N钙黏蛋白及MMP⁃9与内参照β肌动蛋白IOD的比值反映其蛋白相对表达水平。
4.实时荧光定量RT⁃PCR:细胞分组处理48h后采用TRIzol法提取各组细胞总RNA,测定RNA纯度及浓度,每组取等量RNA按反转录试剂盒说明书步骤合成cDNA,实时荧光定量PCR扩增目的基因N钙黏蛋白、MMP⁃9和内参基因GAPDH。PCR反应体系(25 μl):荧光染料12.5 μl,正、反向引物各1 μl,cDNA 模板 2 μl,无 RNA 酶水 8.5 μl,反应条件:50℃ 2 min,95℃ 2 min;95℃变性15 s,60℃退火30 s,72℃延伸30 s,共45个循环。引物序列如下:N钙黏蛋白正向引物:5′⁃CATCATCATCCTGCTTACCT TGT⁃3′,反向引物:5′⁃GGTCTTCTCCTCCACCTTCT T⁃3′;MMP⁃9正向引物:5′⁃ACGCACGACGTCTTCCA GTA⁃3′,反向引物:5′⁃CCACCTGGTTCAACTCACTC C⁃3′;GAPDH正向:5′⁃GCACCGTCAAGGCTGAGAA C⁃3′,反向:5′⁃TGGTGAAGACGCCAGTGGA⁃3′。实验重复3次取均值。用2-△△Ct法分析目的基因N钙黏蛋白、MMP⁃9的相对表达量。
5.Transwell侵袭试验:将Transwell小室(孔径8 μm)置于24孔板中,取50 μl Matrigel基质胶(PBS稀释至0.1 mg/ml)包被小室膜,37℃孵育3 h,室温风干16 h后每室加入50 μl无血清W489培养基37℃孵育24 h,使基质胶充分水化并弃去残留培养基。取对数生长期细胞消化、计数,按分组制成含不同药物(即5 ng/ml TGF⁃β1及其与1 mmol/L二甲双胍联合)的无血清细胞悬液(5×104个/ml),各取200 μl加入小室上层,小室下层加入600 μl含0.1%胎牛血清的W489培养基,培养48 h后棉签拭去小室上层基质胶及细胞,无水甲醇固定15 min,0.1%结晶紫染色30 min,PBS漂洗2次。显微镜下观察,每组随机选取5个高倍(200×)视野计数,其平均值为每组细胞穿膜数目,每组实验重复3次取均值。
6.统计学分析:结果采用SPSS19.0统计软件处理且以±s表示,多组比较采用单因素方差分析,两两比较采用LSD⁃t检验,P<0.05为差异有统计学意义。
结 果
一、二甲双胍逆转TGF⁃β1诱导下黑素瘤1205Lu细胞EMT样形态改变
显微镜(×100)下观察各组细胞形态:空白对照组细胞生长状态良好,细胞呈多角形且分布均匀;TGF⁃β1诱导后细胞呈长梭形,似成纤维细胞,按平行、放射或旋涡状排列分布,同EMT样改变,说明1205Lu细胞在TGF⁃β1诱导下经历EMT样改变;加入二甲双胍干预后细胞失去上述典型的间质型细胞形态,更接近空白对照组细胞形态,说明TGF⁃β1诱导的上述EMT样形态改变在二甲双胍作用下发生逆转,即经历MET样改变。见图1。
二、二甲双胍抑制TGF⁃β1诱导下黑素瘤1205Lu细胞N钙黏蛋白、MMP⁃9蛋白表达
TGF⁃β1诱导下N钙黏蛋白、MMP⁃9蛋白相对表达水平显著升高,与空白对照组相比差异有统计学意义(P<0.05),即TGF⁃β1促进1205Lu细胞EMT及侵袭相关分子的蛋白表达,说明TGF⁃β1诱导下细胞经历EMT过程;联合二甲双胍使N钙黏蛋白、MMP⁃9蛋白表达较TGF⁃β1组明显下降,差异有统计学意义(P<0.05)。见表1,图2。

图1 二甲双胍对TGF⁃β1诱导黑素瘤1205Lu细胞形态变化的影响(×100) 空白对照组(1A)细胞呈多角形且分布均匀;TGF⁃β1组(1B)细胞呈狭长梭形,似成纤维细胞形态,呈平行、放射状或旋涡状排列;TGF⁃β1+二甲双胍组(1C)细胞形态及分布介于两者之间,更接近空白对照组
三、二甲双胍抑制TGF⁃β1诱导下黑素瘤1205Lu细胞N钙黏蛋白、MMP⁃9mRNA表达
LSD⁃t法两两比较显示:TGF⁃β1组N钙黏蛋白、MMP⁃9 mRNA相对表达量较空白对照组显著升高(P<0.05),即TGF⁃β1可促进上述EMT及侵袭相关分子mRNA表达;加入二甲双胍干预后N钙黏蛋白、MMP⁃9 mRNA表达下降,与TGF⁃β1组相比差异有统计学意义(P<0.05),说明二甲双胍抑制TGF⁃β1介导的1205Lu细胞EMT及侵袭相关分子在mRNA水平的表达,并与其蛋白质相对表达水平吻合。见表1。
四、二甲双胍抑制TGF⁃β1诱导下黑素瘤1205Lu细胞侵袭
各组每高倍镜(×200)视野下平均穿膜细胞数:空白对照组 194.1± 8.295,TGF⁃β1组 412.2±13.427,TGF⁃β1+ 二甲双胍组175.3± 8.693。方差分析显示各处理组差异有统计学意义(P<0.05)。组间两两比较得出:TGF⁃β1组穿膜细胞数较空白对照组明显增多(P< 0.05),提示TGF⁃β1诱导后细胞侵袭性增强;与二甲双胍联合作用后穿膜细胞数明显减少,与TGF⁃β1组相比差异有统计学意义(P<0.05),故二甲双胍可抑制TGF⁃β1诱导下1205Lu细胞侵袭。见图3。
表1 二甲双胍对TGF⁃β1诱导黑素瘤1205Lu细胞N钙黏蛋白、MMP⁃9蛋白及mRNA表达的影响(±s)
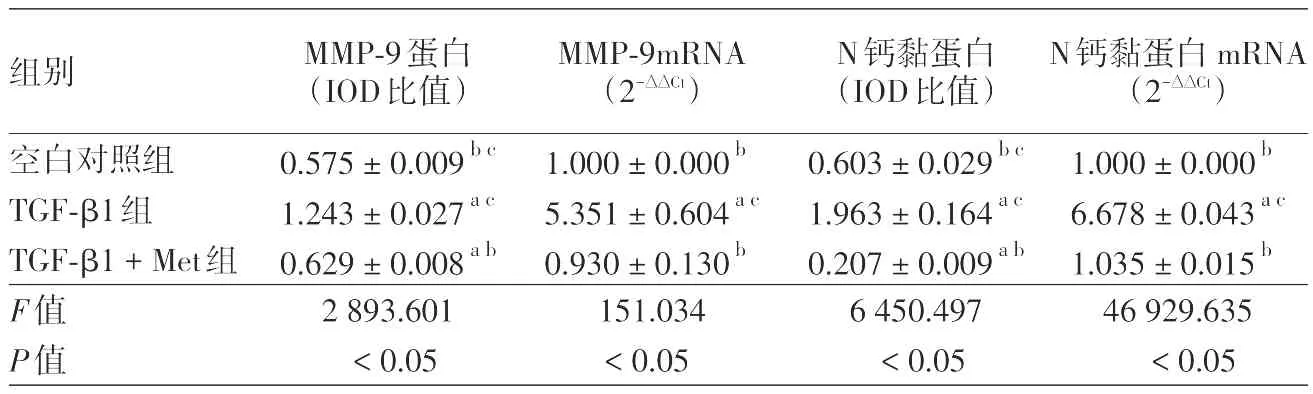
表1 二甲双胍对TGF⁃β1诱导黑素瘤1205Lu细胞N钙黏蛋白、MMP⁃9蛋白及mRNA表达的影响(±s)
注:n=3。MMP⁃9:基质金属蛋白酶9;TGF⁃β1:转化生长因子⁃β1;Met:二甲双胍。a:与空白对照组比较,P<0.05;b:与TGF⁃β1组比较,P< 0.05;c:与TGF⁃β1+Met组比较,P < 0.05
组别空白对照组TGF⁃β1组TGF⁃β1+Met组F值P值MMP⁃9蛋白(IOD比值)0.575±0.009bc 1.243±0.027ac 0.629±0.008ab 2 893.601<0.05 MMP⁃9mRNA(2-∆∆Ct)1.000±0.000b 5.351±0.604ac 0.930±0.130b 151.034<0.05 N钙黏蛋白(IOD比值)0.603±0.029bc 1.963±0.164ac 0.207±0.009ab 6 450.497<0.05 N钙黏蛋白mRNA(2-∆∆Ct)1.000±0.000b 6.678±0.043ac 1.035±0.015b 46 929.635<0.05
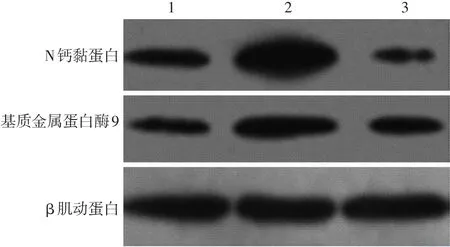
图2 二甲双胍对TGF-β1诱导的黑素瘤1205Lu细胞N钙黏蛋白、基质金属蛋白酶9表达的影响(蛋白印迹结果) 1:空白对照组;2:TGF-β1组;3:TGF-β1+ 二甲双胍组
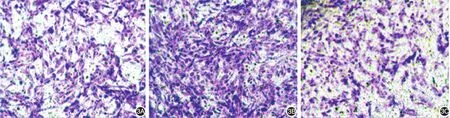
图3 二甲双胍对TGF⁃β1诱导黑素瘤1205Lu细胞侵袭的影响(×200) 与空白对照组(3A)相比,TGF⁃β1组(3B)细胞穿过小室膜细胞数明显增多;TGF⁃β1+二甲双胍组(3C)穿膜细胞数较TGF⁃β1组明显减少,与空白对照组比较,差异无统计学意义
讨 论
黑素瘤由黑素细胞恶性转化形成,其侵袭、转移性强,一旦转移治疗方法有限,预后差,近30年发病速度在实体肿瘤中居首位,黑素瘤治疗除早期发现和积极预防外亟待找到新的方法和作用靶点[1⁃2]。近年来,肿瘤细胞EMT过程已成为国内外研究热点。EMT被认为是启动肿瘤转移的关键机制。其通过下调上皮细胞标记物(如E钙黏蛋白),上调间质细胞标记物(如N钙黏蛋白)以及MMP的表达使细胞间连接消失,细胞外基质降解,细胞运动及侵袭性增强[4]。MMP(尤其是MMP⁃2、MMP⁃9)能够降解细胞外基质成分,促进细胞运动及侵袭,与肿瘤进展及EMT过程密切相关[6]。作为EMT主要诱导因子,TGF⁃β经Smad信号通路激活下游转录因子Snail,其通过下调E⁃钙黏蛋白、上调MMPs(如MMP⁃9)表达,进而诱导 EMT 过程[4⁃5]。Javelaud等发现,阻断1205Lu细胞TGF⁃β/Smad通路后MMP⁃9表达减少,细胞侵袭力下降,肿瘤生长及骨转移速度减慢[8⁃9]。推测:TGF⁃β经Smad信号通路上调1205Lu细胞MMP⁃9表达,诱导EMT过程,促进细胞侵袭和转移。故抑制TGF⁃β诱导的EMT及细胞侵袭为本次实验的研究目标。
近年来,二甲双胍抗肿瘤作用被人们广泛认知及探讨。流行病学研究显示,服用二甲双胍的糖尿病患者癌症罹患风险明显降低[10]。Cerezo等[11]证实,二甲双胍能够降低黑素瘤细胞中Snail、Slug及N钙黏蛋白的表达,抑制肿瘤侵袭和转移。此外,在前列腺癌、乳腺癌及肺癌研究中发现,二甲双胍能够抑制TGF⁃β1诱导的EMT过程[12⁃14]。本实验旨在验证二甲双胍能否抑制黑素瘤细胞中TGF⁃β1诱导的EMT及细胞侵袭。我们选取黑素瘤1205Lu细胞作为实验对象,其对外源性TGF⁃β存在强大的转录应答能力;具有配体介导下高度自主的TGF⁃β/Smad信号通路;并在Matrigel实验中表现出高侵袭性[8]。通过检测EMT及侵袭相关分子表达(N钙黏蛋白、MMP⁃9),从分子水平论证药物对EMT及侵袭的影响;同时检测细胞形态和体外侵袭能力,从现象层面论证EMT过程及细胞侵袭。结果显示:TGF⁃β1诱导后1205Lu细胞经历EMT样形态改变,N钙黏蛋白、MMP⁃9表达上调,且细胞侵袭性增强,即TGF⁃β1诱导黑素瘤细胞EMT且伴随细胞侵袭性增强;与二甲双胍联合作用可逆转上述EMT样形态变化,抑制N钙黏蛋白、MMP⁃9表达及细胞侵袭。说明TGF⁃β1、EMT及MMP⁃9与黑素瘤细胞侵袭密切相关,故二甲双胍可能通过抑制TGF⁃β1诱导的EMT过程及MMP⁃9表达从而降低1205Lu细胞侵袭性。
综上所述,我们证实TGF⁃β1能够诱导黑素瘤1205Lu细胞EMT并增强细胞侵袭性。继前列腺癌、乳腺癌、肺癌之后,证实二甲双胍能够抑制TGF⁃β1诱导的黑素瘤细胞EMT及侵袭。为二甲双胍抗黑素瘤提供新的依据,然而通过何种途径抑制上述过程尚待进一步研究。
[1]Boyle GM.Therapy for metastatic melanoma:an overview and update[J].Expert Rev Anticancer Ther,2011,11(5):725⁃737.DOI:10.1586/era.11.25.
[2]Davey RJ,van der Westhuizen A,Bowden NA.Metastatic melanoma treatment:combining old and new therapies[J].Crit Rev Oncol Hematol,2016,98:242⁃253.DOI:10.1016/j.critrevonc.2015.11.011.
[3]Kalluri R,Weinberg RA.The basics of epithelial⁃mesenchymal transition[J].J Clin Invest,2009,119(6):1420⁃1428.DOI:10.1172/JCI39104.
[4]Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial⁃mesenchymal transition[J].Nat Rev Mol Cell Biol,2014,15(3):178⁃196.DOI:10.1038/nrm3758.
[5]Lin CY,Tsai PH,Kandaswami CC,et al.Matrix metalloproteinase⁃9 cooperates with transcription factor Snail to induce epithelial⁃mesenchymal transition[J].Cancer Sci,2011,102(4):815⁃827.DOI:10.1111/j.1349⁃7006.2011.01861.x.
[6]Orlichenko LS,Radisky DC.Matrix metalloproteinases stimulate epithelial⁃mesenchymal transition during tumor development[J].Clin Exp Metastasis,2008,25(6):593 ⁃600.DOI:10.1007/s10585⁃008⁃9143⁃9.
[7]Massagué J.TGFbeta in Cancer[J].Cell,2008,134(2):215⁃230.DOI:10.1016/j.cell.2008.07.001.
[8]JavelaudD,MohammadKS,McKennaCR,etal.Stable overexpression of Smad7 in human melanoma cells impairs bone metastasis[J].Cancer Res,2007,67(5):2317 ⁃2324.DOI:10.1158/0008⁃5472.CAN⁃06⁃3950.
[9]Javelaud D,Delmas V,Möller M,et al.Stable overexpression of Smad7 in human melanoma cells inhibits their tumorigenicityin vitroandin vivo[J].Oncogene,2005,24(51):7624⁃7629.DOI:10.1038/sj.onc.1208900.
[10]Ben SI,Le MY,Tanti JF,et al.Metformin in cancer therapy:a new perspective for an old antidiabetic drug?[J].Mol Cancer Ther,2010,9(5):1092⁃1099.DOI:10.1158/1535⁃7163.MCT⁃09⁃1186.
[11]Cerezo M,Tichet M,Abbe P,et al.Metformin blocks melanoma invasion and metastasis development in AMPK/p53⁃dependent manner[J].Mol Cancer Ther,2013,12(8):1605 ⁃1615.DOI:10.1158/1535⁃7163.MCT⁃12⁃1226⁃T.
[12]Zhang J,Shen C,Wang L,et al.Metformin inhibits epithelial⁃mesenchymal transition in prostate cancer cells:involvement of the tumor suppressor miR30a and its target gene SOX4[J].Biochem Biophys Res Commun,2014,452(3):746⁃752.DOI:10.1016/j.bbrc.2014.08.154.
[13]Cufí S,Vazquez⁃Martin A,Oliveras⁃Ferraros C,et al.Metformin against TGFβ ⁃induced epithelial⁃to⁃mesenchymal transition(EMT):from cancer stem cells to aging⁃associated fibrosis[J].Cell Cycle,2010,9(22):4461 ⁃4468.DOI:10.4161/cc.9.22.14048.
[14]Lin H,Li N,He H,et al.AMPK inhibits the stimulatory effects of TGF⁃β on Smad2/3 Activity,cell migration,and epithelial⁃to⁃mesenchymal transition[J].Mol Pharmacol,2015,88(6):1062⁃1071.DOI:10.1124/mol.115.099549.
奇正青鹏软膏有奖征文通知
为了更好地发挥藏药在皮肤病治疗中的作用,西藏奇正藏药股份有限公司与《中华皮肤科杂志》编辑部、中国中西医结合学会皮肤性病专业委员会环境与职业性皮肤病学组共同开展2017年奇正青鹏软膏有奖征文活动,欢迎皮肤科医师踊跃参加。
一、征文范围
①单用奇正青鹏软膏治疗各种湿疹皮炎临床疗效的经验总结(有对照组);②观察单用奇正青鹏软膏治疗皮炎湿疹等皮肤科常见瘙痒症状的起效时间和疗效的研究(有对照组);③观察青鹏软膏保护皮肤屏障的作用及其在湿疹治疗中的意义(有对照组)。
二、活动形式
论文提交截稿日期2018年3月1日。在此期间完成的研究论文均可参加活动,并在2018年中国中西医结合学会皮肤性病专业委员会年会期间进行评比和颁奖。本次征文共设如下奖项:第1~3名将分别获得8 000元、5 000元、3 000元的研究基金;优秀征文奖20名,分别获得1 000元研究基金,以上获奖者均颁发中国中西医结合学会皮肤性病专业委员会环境与职业性皮肤病学组研究基金获奖证书。
请将论文Word电子版发至Email:wwz1602@qzh.cn或jiangli0828@163.com,主题注明奇正青鹏软膏征文。
西藏奇正藏药股份有限公司有权使用征文稿件,并拥有此次活动的解释权。
Effects of metformin on transforming growth factor⁃beta1⁃induced epithelial⁃mesenchymal transition and invasion in the human melanoma cell line 1205Lu
Liang Meiqi,Liang Guanzhao,Guo Jian,Duan Xinsuo,Lu Jie
Department of Dermatology,Affiliated Hospital of Chengde Medical University,Chengde 067020,Hebei,China(Liang MQ,Liang GZ[current affiliation:Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China],Guo J,Duan XS,Lu J)
Lu Jie,Email:chengdejiel@163.com
ObjectiveTo evaluate the effects of metformin on transforming growth factor⁃beta1(TGF⁃β1)⁃induced epithelial⁃mesenchymal transition(EMT)in and invasion of the human melanoma cell line 1205Lu.MethodsIn vitrocultured 1205Lu cells were divided into 3 groups to be treated with serum⁃free culture medium(blank control group),serum⁃free culture medium containing 5 ng/ml TGF⁃β1(TGF⁃β 1 group)and serum⁃free culture medium containing 5 ng/ml TGF⁃β1 and 1 mmol/L metformin(TGF⁃β1+metformin group),respectively.After 48⁃hour treatment,morphological changes of 1205Lu cells in the above groups were observed by using a microscope,and photos were taken at the same time.Transwell invasion assay was performed to estimate cellular invasive activity,Western blot analysis and real⁃time fluorescence⁃based quantitative RT⁃PCR were conducted to determine the mRNA and protein expression of N⁃cadherin and matrix metalloproteinase⁃9(MMP⁃9),respectively.Statistical analysis was carried out by one⁃way analysis of variance(ANOVA)and least significant difference(LSD)test.ResultsCompared with the blank control group,the stimulation of TGF⁃β1 could induce the epithelial⁃mesenchymal transition(EMT)⁃like morphological changes in 1205Lu cells,while TGF⁃β1 combined with metformin could reverse the EMT⁃like morpho⁃logical changes.The number of 1205Lu cells crossing the transwell Matrigel per high⁃power field(× 200)was significantly higher in the TGF⁃β1 group(412.2 ± 13.427)than in the blank control group(194.1 ± 8.295)and TGF⁃β1+metformin group(175.3 ± 8.693).Compared with the blank control group and TGF⁃β1+metformin group,the TGF⁃β1 group also showed significantly increased mRNA and protein expression of N⁃cadherin(mRNA:6.678±0.043vs.1.000±0.000,1.035±0.015;protein:1.963±0.016vs.0.603±0.029,0.207±0.009)andMMP⁃9(mRNA:5.351±0.604vs.1.000±0.000,0.930±0.130;protein:1.243±0.027vs.0.575±0.009,0.629±0.008).ConclusionMetformin can obviously inhibit TGF⁃β1⁃induced EMT⁃like morphological changes in,the capacity to penetrate Matrigel⁃coated transwell chambers of and the mRNA and protein expression of N⁃cadherin and MMP⁃9 in 1205Lu cells.
Melanoma;Metformin;Transforming growth factor⁃beta1;Epithelial⁃mesenchymal transition;Invasion
陆洁,Email:chengdejiel@163.com
10.3760/cma.j.issn.0412⁃4030.2017.06.009
2016⁃09⁃18)
(本文编辑:吴晓初)
