微生物修复重金属污染土壤探究
2017-11-01邓秋穗许瀚月张睿韬李冰洁李司晨
邓秋穗, 唐 霞, 蔡 润, 许瀚月, 张睿韬, 李冰洁, 李司晨, 徐 恒, 汪 红
(四川大学 生命科学学院, 四川 成都 610064)
微生物修复重金属污染土壤探究
邓秋穗, 唐 霞, 蔡 润, 许瀚月, 张睿韬, 李冰洁, 李司晨, 徐 恒, 汪 红
(四川大学 生命科学学院, 四川 成都 610064)
利用微生物对重金属的钝化作用,制备微生物钝化剂并应用于重金属污染土壤的治理。通过研究重金属污染土壤中微生物的性质,筛选出能有效处理土壤中重金属污染的优良菌种CQ7与FQ2;对筛选出的菌株进行表征,并测定其生长曲线,鉴定FQ2为革兰氏阴性杆菌。进一步对筛选出的菌种进行理化条件测定,测定得CQ7与FQ2的最适生长条件均为pH=5、转速180 r/min、温度25 ℃。经金属耐受和吸附实验,选定FQ2为工程菌,测序确定其为沙雷氏菌属(Serratiamarcuscens)。将筛选所得菌种与相应理化条件相结合,制备微生物钝化剂,设计自动化重金属污染土壤修复设备,对其应用前景进行了初步规划。
微生物钝化剂; 重金属污染; 自动化修复仪
随着现代社会的进步,土壤重金属(As、Cd、Hg、Pb等)污染日益严重,如何修复重金属污染土壤成为人类不可忽视的问题[1-3]。镍铅铬等重金属是某些低等生物和植物的必需微量营养元素之一,同时也是一种致癌的毒性元素[4]。
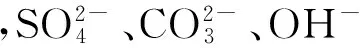
细菌尺寸小,对环境适应能力强,可以用来作为生物吸附剂[7], 2010年, Polti报道从铬铁矿中分离并鉴定了一株Bacillusamyloliquefaciens(CSB 9) 。该菌可以耐受900 mg/L Cr(VI),在最佳条件下具有较快的还原速度(2.22 mg Cr(VI)/(L·h)[8-10]。2014年,Yang 等考察了PannonibacterphragmitetusBB在强化铬污染修复过程中的作用,并且考察了土壤土著微生物群落变化的规律。结果表明,在Cr(VI) 浓度为518.84 mg /kg、pH 8.64 的条件下,P.PhragmitetusBB可以在2 d内将Cr(VI)全部还原。该菌在接入土壤后的48 h 内数量显著上升,相对比例由35.5%上升至74.8%,并维持稳定[11]。
已有研究人员针对微生物修复,做出了菌种对部分重金属污染土壤修复的研究[12],但是国内外对于重金属污染土壤的综合高效修复微生物设备仍鲜有报道[13],缺少微生物钝化剂的自动化产品。本课题综合前人相关研究经验,设计了针对重金属污染土壤的高效微生物钝化剂,并且计划最终形成工业产品,该成果将可能成为治理重金属污染土壤的有效途径。
1 材料与方法
1.1高效修复重金属污染土壤的菌种筛选及扩大培养
1.1.1 污泥稀释液的制备
称取污泥样品5 g,加入到含有45 mL无菌水的锥形瓶中(放少许玻璃珠),恒温摇床室温振荡30 min;然后取1 mL污泥悬液加入到含有9 mL无菌水的试管中,充分混匀,逐级稀释至10-5的污泥悬液[14]。
1.1.2 平板涂布
取10 mL实验室的水样,采用系列稀释涂布法(10-5倍),将10-3、10-4、10-5稀释度的水样分别涂布于相应的培养基上,每个稀释度涂布3个培养皿,37 ℃,培养1~2 d后观察[15]。对部分优势菌继续在选择培养基上划线分离,直至得到单一菌落。
1.1.3 菌株筛选
挑取菌落特征明显不同的菌株,分别采用三线法划线移接到含重金属离子、浓度逐步提高的LB平板上继续培养,得到菌株后再经过多次分离纯化,4 ℃保存[16],记录单一菌落的特征。
1.2 菌株最适生长理化条件选择
1.2.1 基础LB培养基正常条件下生长曲线测定
提前12 h取1%菌液于1 mL的LB培养基中进行活化;分别取1 mL活化菌液于100 mL的LB培养基中,温度37 ℃、转速180 r/min 培养两株菌0~24 h及24~48 h,每间隔2 h测定一次600 nm下的吸光值,记为OD600,绘制0~48 h的菌株生长曲线,每组实验重复做2次。
1.2.2 最适生长的pH条件筛选
提前12 h取1%菌液于1 mL的LB培养基中进行活化;分别取1 mL活化菌液于100 mL的LB培养基中,温度37℃、转速180 r/min,pH分别设置为4、5、6、7、8、10,分别培养两株菌0~24 h及24~33 h,每间隔4~5 h测定一次600 nm处的OD值,绘制0~33 h的菌株生长曲线,每一组实验重复2瓶,取样2次作对照,比较不同pH条件下菌株的生长情况。
1.2.3 最适生长的温度条件筛选
提前12 h取1%菌液于1 mL的LB培养基中进行活化;分别取1 mL活化菌液于100 mL的LB培养基中,转速180 r/min,温度分别设置为25、37、40 ℃,分别培养两株菌0~24 h及24~33 h,每间隔4~5 h测定一次600 nm处的OD值,绘制0~33 h的菌株生长曲线,每一组实验重复2瓶,取样2次作对照,比较不同温度条件下菌株的生长情况。
1.2.4 最适生长的转速条件筛选
提前12 h取1%菌液于1 mL的LB培养基中进行活化;分别取1 mL活化菌液于100 mL的LB培养基中,温度 37℃,设置转速分别为140、180 r/min;分别培养2株菌0~24 h及24~33 h,每间隔4~5 h测定一次600 nm处的OD值,绘制0~33 h的菌株生长曲线,每一组实验重复2瓶,取样2次作对照,比较不同温度条件下,菌株的生长情况。
1.2.5 菌对重金属耐受力的测定
提前12 h取1%菌液于1 mL的LB培养基中进行活化;分别取2 mL活化菌液涂布于含重金属离子,浓度逐步提高的LB平板上继续培养(通常培养5 d左右),观察菌落生长情况。
1.2.6 16S rDNA序列测定
活化工程菌株生长至对数期,利用天根试剂盒提取基因组DNA,利用PCR扩增16S rDNA序列,将产物送至成都飞腾博川生物技术有限公司测序,在NCBI数据库中进行比对,鉴定工程菌种属。
1.2.7 扫描电镜观察
活化工程菌株生长至对数期,送往四川大学分析测试中心,使用扫描电镜对FQ2菌株扫描观察,电子能谱分析,对其吸附重金属能力进行检测。
1.3 自动化重金属污染微生物修复仪初步设计
产品以现有类似机械(插秧机)为蓝本,根据所需的微生物吸附(分泌)处理土壤中重金属这一目的加以重新设计与定向改造,并基于模块化设计理念,主要有自动化重金属检测连动装置、微生物钝化装置、菌种保藏装置、负重轮和发动机5大主要部件。通过借鉴现有成熟农用机械系统,降低非必需成本,以达到较高的安全性和实用性,同时间接降低维护与升级成本。
2 结果与分析
2.1高效修复重金属污染土壤的菌种筛选及扩大培养
实验共筛选出2株优良菌株,CQ7与FQ2。对筛选出的菌株进行表征测定,观察其菌落形成。CQ7菌落呈圆形,形状规则,菌落直径约为2~3 mm,颜色为乳白色,正面与背面颜色相同,菌落表面粗糙、干燥、半透明,边缘整齐(见图 1(a))。FQ2菌落呈圆形,形状规则,菌落直径约为1~2 mm;颜色为乳白色,正面与背面颜色相同,菌落表面光滑、湿润、半透明,边缘整齐(见图 1(b));放于25 ℃左右培养时,菌表面产生红色素(见图1(c)),革兰氏染色显示为革兰氏阳性杆菌(见图1(d))。
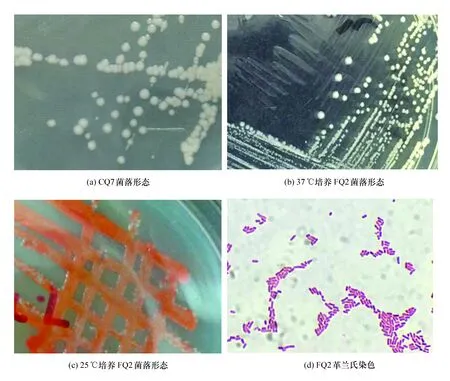
图1 CQ7及FQ2菌落形态与革兰氏染色
2.2 菌株最适生长理化条件选择
2.2.1 基础LB培养基默认筛选条件下生长曲线测定
实验结果(见图2)表明,FQ2和CQ7 2 h后开始较快增殖,5~20 h平稳较快增殖,20 h后FQ2数目趋于稳定,CQ2数目少许增长。可见FQ2的对数生长期为5~20 h,CQ7对数生长期为5~30 h。
2.2.2 最适生长的pH条件筛选
比较对数期(FQ2为5~20 h,CQ7为5~30 h)FQ2和CQ7的生长情况可知,pH=5更有利于CQ7增殖(见图3(a));pH=5至pH=8都有利于FQ2增殖(见图3(b))。pH=10时,CQ7和FQ2增殖情况较差,这两种菌均不耐受碱性环境。pH=4时,CQ7不增殖,FQ2正常增殖。可见,FQ2比CQ7更能适应酸性环境。
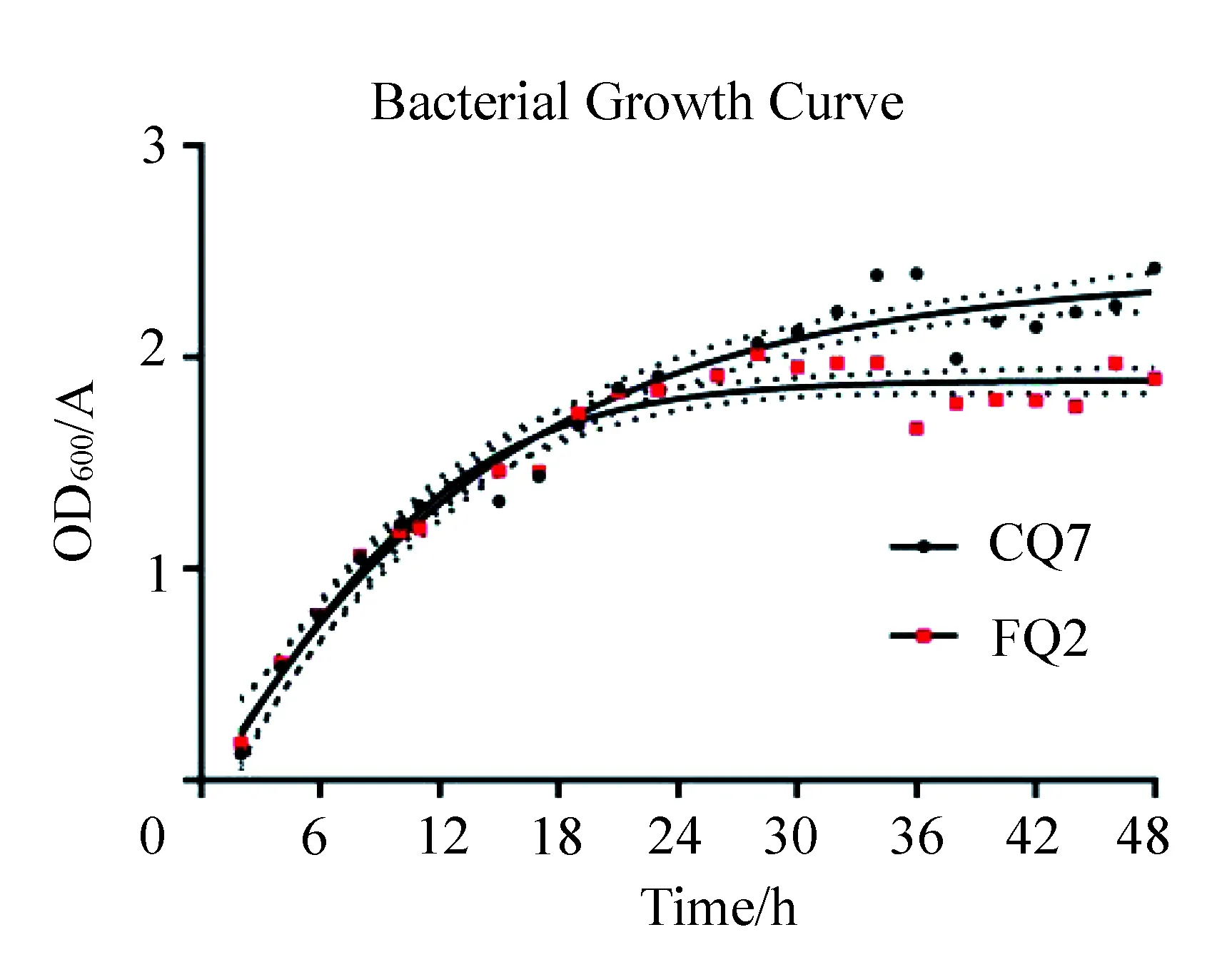
图2 基础LB培养基正常条件下生长曲线
2.2.3 最适生长的温度条件筛选
比较对数期时FQ2和CQ7的生长情况可知,CQ7和FQ2的最适生长温度都为25 ℃(见图4)。
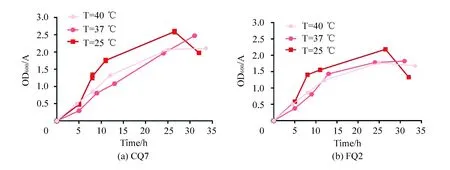
图4 CQ7和FQ2的最适温度条件筛选
2.2.4 最适生长的转速条件筛选
比较对数期时FQ2和CQ7的生长情况可知,CQ7的最适转速为180 r/mi,转速对FQ2的影响不大(见图5)。
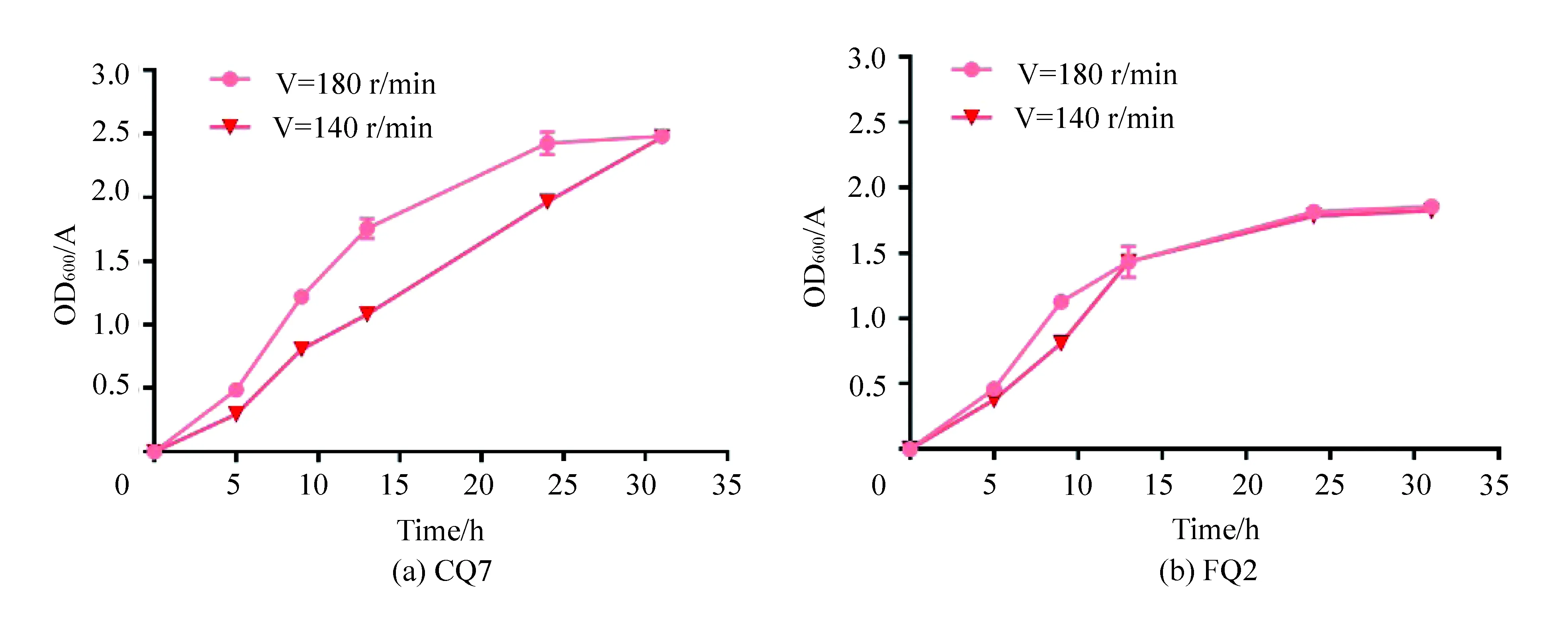
图5 CQ7和FQ2的最适生长转速筛选
2.3 微生物菌株钝化剂设计
2.3.1 菌对重金属耐受力的测定
对获得的菌株钝化剂进行重金属耐受力检测,检测结果:CQ7抗镍浓度为100 mg/L,抗铅浓度为250 mg/L,在镍和铅同时存在的情况下最高耐受30 mg/L,耐受重金属的能力太弱,故放弃该菌株;FQ2抗镍浓度为500 mg/L,抗铅浓度为900 mg/L,在镍和铅同时存在的情况下最高耐受100 mg/L的镍和100mg/L的铅。此外,还测定了CQ7和FQ2的溶磷、产IAA能力(见表1)。比较可见,FQ2具有高效修复多种重金属污染土壤的能力。

表1 CQ7与FQ2的溶磷能力与产IAA能力
2.3.2 FQ2 16S rDNA序列测定
待活化菌株生长至对数期,提取菌株基因组DNA,PCR扩增16SrDNA序列,将产物送至成都飞腾博川生物技术有限公司测序,得FQ2菌株16S RNA序列。在NCBI数据库中进行比对,该菌株为沙雷氏菌属Serratiamarcuscens。菌株的16S rDNA序列如下:
2.3.3 菌株扫描电镜观察检测
待活化菌株生长至对数期,取FQ2菌液进行扫描电镜检测。结果显示:FQ2为杆菌表面粗糙(见图 6(a)),加入重金属后FQ2细胞变大,出现破裂(见图6(b));选定部分区域,进一步进行电子能谱分析,发现FQ2对重金属铅表现出较高的吸附作用(见图6(c)和6(d),表2)

图6 FQ2电镜扫描检测
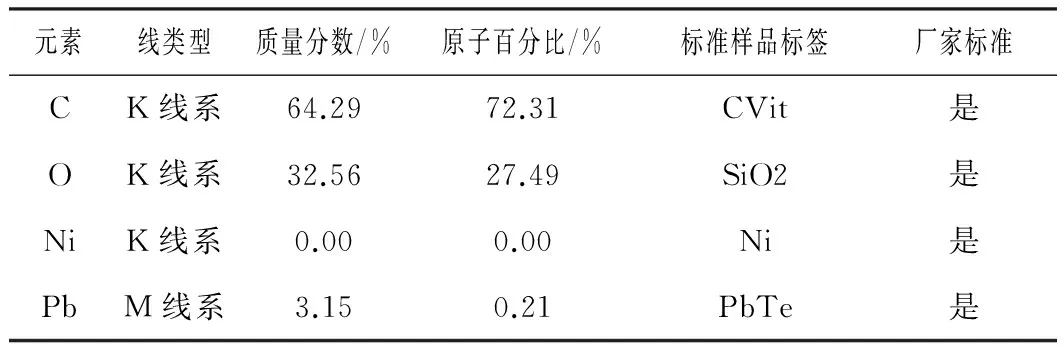
元素线类型质量分数/%原子百分比/%标准样品标签厂家标准CK线系64.2972.31CVit是OK线系32.5627.49SiO2是NiK线系0.000.00Ni是PbM线系3.150.21PbTe是
2.4 自动化重金属污染微生物修复仪初步设计
2.4.1 自动化重金属检测连动装置
该修复仪整体构型如一辆自动驾驶农用车(见图7(a)),尺寸大小可根据实际需要处理的土壤面积需求而定。修复仪只需开启便可自动运行。该修复仪中后部设置有重金属检测装置,底板处检测孔(见图 7(c))接触土壤,由后部的检测装置自动检测,数据输出于后上方显示屏,当达到一定污染值时,启动土壤pH检测装置,匹配对应土壤pH启动菌种保藏箱选择该pH最适生长的菌种,将菌种输入插入式重金属污染处理装置对土壤进行处理,否则修复仪继续向前移动。
2.4.2 菌种保藏箱
修复仪的中部为大规模的菌种保藏箱(见图7(e)),采用最适条件培养有筛选出的具有优秀处理土壤重金属污染能力的菌种。培养箱(保藏箱)内分多个培养空间,有两大类使用方式。方式一:多个培养空间分别培养有不同最适pH的菌种,该菌种保藏箱与底部伸缩底盘连接,在接到pH检测装置的指令时,可将对应土壤pH范围最适生长的菌种经过下行装置排放至底板(图 7(e)),准备对土壤进行处理;方式二:其一培养空间培养文中菌种,另有空间储藏有石灰水等调节pH的试剂,可在土壤pH检测后,根据菌种生存所需最适pH,先投放pH调节剂调节土壤pH至菌种生存范围,再投放菌种。
经多方研究,补充可适用于该装置的菌株,最适生长pH覆盖范围为pH 4~pH 10,范围广泛(见表3)。
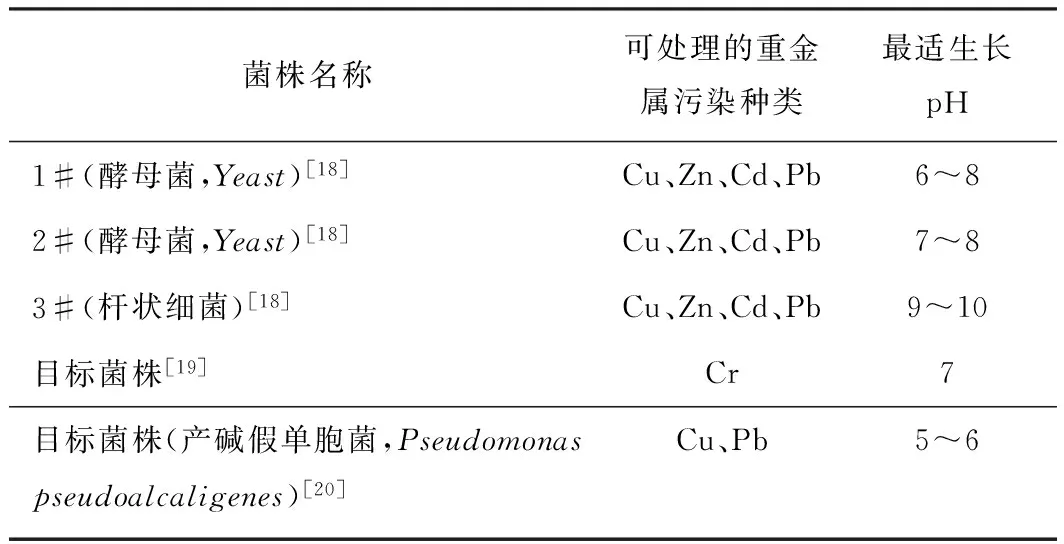
表3 可适用于自动化土壤重金属污染修复仪的菌株补充

表3(续)
2.4.3 插入式重金属污染处理装置
修复仪参照扦插装置,在修复仪底部设置了大面积可伸缩底盘,底盘下为多排伸缩高压枪头(见图7(b))。枪头配备有防土壤堵塞的开关装置,进入土壤过程中开关关闭,进入土壤后开关打开,可释放菌液。修复仪可根据对该处土壤的重金属检测情况来选择是否打开底盘伸出枪头进行处理,节约微生物资源。当接收到处理土壤的指令时,对应土壤pH的最适菌种进入底盘,底盘伸出,携带菌株至枪头,枪头开关打开,经压力装置使菌液进入土壤中。枪头实现可伸缩,使其对土壤的作用深度较深,由表及里,达到立体去除约1 m深的土壤中主要重金属离子的效果。
2.4.4 负重轮和发动机
由现有的拖拉机等大型农用机械的履带式负重轮改装,机动性较强,可适应四川地区的多种农田作业。
采用农用机械常用的15~73.5 kW中型柴油发动机。
3 结论
实验获得沙雷氏菌属Serratiamarcuscens菌株FQ2,测定得FQ2对数生长期为培养开始5 h至20 h,最适条件为pH=5、温度25℃,转速180 r/min与140 r/min无明显区别。重金属耐受实验检测发现,FQ2具有较强的重金属耐受力,其抗镍浓度为500 mg/L,抗铅浓度为900 mg/L,在镍和铅同时存在的情况下最高耐受100 mg/L镍和100mg/L铅。电镜检测发现FQ2对铅有吸附作用。
References)
[1] 刘小飞,杭颖.生物钝化技术修复重金属污染土壤的研究进展[J].化工管理,2015(10):102.
[2] 徐粲然,卢滇楠,刘永民.生物钝化修复镉污染土壤研究进展[J].化工进展, 2014(8):2174-2179.
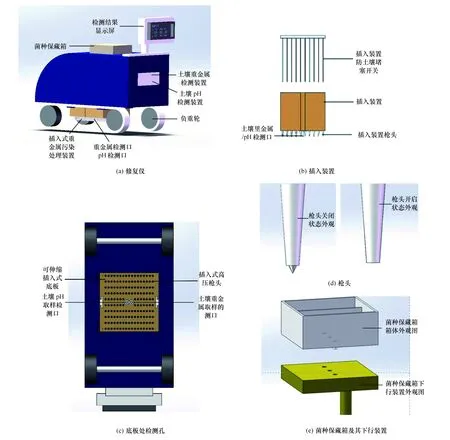
图7 自动化重金属污染微生物修复仪初步设计
[3] Srivastava S, Prakash S, Srivastava M M. Chromium mobilization and plant availability-the impact of organic complexing ligands[J]. plant & soil,1999(2):203-208.
[4] 蔡信德,仇荣亮,陈桂珠.镍污染对土壤微生物的生态效应[J].生态科学,2004(8):273-277.
[5] 王立群,罗磊,马义兵,等.重金属污染土壤原位钝化修复研究进展[J].应用生态学报,2009,20(5):1214-1222.
[6] 徐磊辉,黄巧云,陈雯莉. 重金属污染的细菌修复与检测[J].应用与环境生物学报,2004,10(2):256-262.
[7] 王建龙,陈灿. 生物吸附法去除重金属离子的研究进展[J].环境科学学报,2010,30(4):673-701.
[8] Poltia M A, Aparicioa J D, Benimelia C S, et al. Simultaneous bioremediation of Cr(VI) and lindane in soil by actinobacteria[J].International Biodeterioration&Biodegradation,2014,88:48-55.
[9] 张彩丽.微生物修复重金属污染土壤的研究进展[J].安徽农业科学,2015,43(16):225-229.
[10] 张欣,范仲学,郭笃发,等.3种微生物制剂对轻度镉污染土壤中菠菜生长的影响[J].天津农业科学,2011(1):81-87.
[11] Wang Y,Peng B,Yang Z H,et al. Bacterial community dynamics during bioremediation of Cr( VI)-contaminated soil[J].Applied Soil Ecology,2015,85:50-55.
[12] 杜爱雪,曹理想,张仁铎.高抗铜青霉素的筛选及其对重金属的吸附[J].应用与环境生物学报,2008,14(5):650-653.
[13] 苏少华,张玉秀,朱凌峰,等. 近十年我国耐重金属细菌研究文献分析[J].农业图书情报学刊,2011,23(5):64-67.
[14] 叶锦韶,尹华,张娜. 生物吸附剂的制备及其对铬的吸附性能[J].环境化学,2002,21(2):144-148.
[15] 水和溶液监测分析方法编委会.水和溶液检测分析方法[M]. 北京:中国环境科学出版社,2002:344-351.
[16] 吕晶华,郑先强,唐运平,等 高浓度难降解工业废水菌种筛选及其降解特性[J].城市环境与城市生态,2011,24(3):30-33.
Research on microbial remediation of heavy metal contaminated soil
Deng Qiusui, Tang Xia, Cai Run, Xu Hanyue, Zhang Ruitao, Li Bingjie, Li Sichen, Xu Heng, Wang Hong
(College of Life Sciences, Sichuan University, Chengdu 610064, China)
Inactivation of heavy metals by microorganisms is used for preparing the microbial passivating agent and applying it to the treatment of heavy metal contaminated soil. Through the study on the properties of microorganisms in heavy metal contaminated soil, the fine strains CQ7 and FQ2 which can effectively deal with heavy metal pollution in soil are screened out. The screened strains are characterized, their growth curves are measured, and FQ2 is identified as gram negative bacillus. The physical and chemical conditions of the screened strains are further determined. The optimum conditions for the growth of CQ7 and FQ2 are pH=5, the rotational speed is 180 r/min and the temperature is 25℃. Through the metal tolerance and adsorption experiments, FQ2 is selected as the engineering bacteria and identified as the Serratia marcuscens by the sequence test. In combination of the screened strains with the corresponding physical and chemical conditions, the microbial passivator is prepared, and the automatic remedial equipment for the heavy metal contaminated soil is designed whose application prospect is primarily planned.
microbial passivator; heavy metal contamination; automatic remedial instrument
X53
A
1002-4956(2017)10-0043-07
10.16791/j.cnki.sjg.2017.10.013
2017-08-04
国家科技支撑计划项目(2015BAD05B01-5); 四川省科技支撑项目(2016NZ0050)
邓秋穗(1996—),女,广西北海,本科生,主要从事微生物治理重金属污染土壤研究
汪红(1961—),女,四川成都,高级实验师,主要从事微生物实验的教学和科研工作.
E-mail:wh002008@163.com
