克氏梭菌和酿酒酵母混合培养提高己酸产量
2017-11-01穆晓清葛向阳
嵇 翔 , 徐 岩 *, 穆晓清 , 葛向阳
(1.江南大学 工业微生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
克氏梭菌和酿酒酵母混合培养提高己酸产量
嵇 翔1,2, 徐 岩*1,2, 穆晓清1,2, 葛向阳1,2
(1.江南大学 工业微生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
为了提高克氏梭菌8022产己酸的能力,缩短发酵周期,作者将该株菌与酿酒酵母进行了混合培养,并进一步分析混合培养体系提高己酸产量的机理。研究表明:在用发酵罐对己酸菌进行纯培养时己酸菌产量可达6.35 g/L,与酿酒酵母共培养时,产酸达到7.09 g/L,产酸提高了12.5%,且到达最大产酸的周期缩短了约48 h。相关参数的分析表明,酿酒酵母在共培养过程中主要通过提高乙酸到丁酸的转化速率,从而提高己酸的产量。通过分析溶氧值和微生物生长参数,表明引起这一变化的主要原因是共培养时酿酒酵母的生长提高了共培养体系的厌氧水平,促进丁酸的生成和转化,从而提高了己酸的产量。
克式梭菌;酿酒酵母;纯培养;共培养;己酸
目前文献报道的己酸菌[1-3],主要是克鲁氏梭状芽孢杆菌(Clostridium kluyveri)[4],简称克氏梭菌。 是我国主要香型之一的浓香型白酒中主要产酸微生物,由它代谢产生的己酸与发酵产生的乙醇作用生成己酸乙酯,构成了浓香型大曲酒的主体香气物质,是影响白酒品质的重要因素之一[5-6]。所以克氏梭菌的产酸能力直接影响着浓香型白酒的产品品质。克氏梭菌是一类绝对厌氧的细菌,细胞呈现杆状,带芽孢,革兰氏染色阳性,在乙酸钠培养基中可利用乙醇和乙酸合成丁酸和己酸并产生氢气[7]。通常可采用厌氧培养箱培养,简单的液态发酵则可通过深层培养或提高装液量的方式来保证其厌氧环境。
目前,浓香型白酒生产工艺主要是采用固态发酵,发酵工艺和体系较为复杂,不方便模拟研究。而采用新型的“无土发酵”即液态发酵产酸,可以简化发酵流程,缩短周期,对研究混合菌种产酸非常有效。此前一些研究者报道了液态发酵提高己酸产量的策略,如洋河酒厂将克氏梭菌8022及异常汉逊酵母1295巴氏AS1.41混合培养可使己酸产量达到4.4 g/L。三井酒业通过对发酵车间窖泥的己酸菌分离纯化,筛选到8株己酸菌,最高一株产己酸可达3.0 g/L。早前的山东曲阜酒厂曾简要介绍了通过生香酵母和己酸菌共同发酵能促进己酸菌生长和产酸,产酸最高可达4.5 g/L。一般国内的产己酸水平在4~6 g/L,如何通过调控己酸合成代谢途径,进一步提高己酸产量,是当前己酸发酵的研究重点[8]。
近年来,混合培养体系,特别是与酵母菌混合培养的产酸、产酶体系引起了广泛的关注。研究表明,在与酵母菌共培养的混合发酵体系中,通过其中的协同作用机制,达到促进目标产物合成的目的。而关于和酿酒酵母共培养提高产酸却少见报道。为了进一步提高克氏梭菌的己酸合成能力,作者将己酸菌和酿酒酵母进行了混合培养,明显提高了该株菌的己酸合成速率,通过发酵罐液态发酵的方法比较了在己酸菌纯培养和与酵母共培养[9-12]的情况下,其产酸和其他参数的变化情况,通过实验数据分析,初步探究了产酸提高的机理,为进一步研究和优化提供了参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种 克氏梭菌8022:江苏洋河酒厂股份有限公司窖泥中分离得到,江南大学酿造微生物与应用酶学实验室保藏;酿酒酵母(Saccharomyces cerevisiae):江南大学酿造微生物与应用酶学实验室筛选并保藏。
1.1.2 培养基 乙酸钠改良培养基(g/dL):NaAc 0.6,酵母膏 0.5,K2HPO30.04,MgSO40.02,(NH4)2SO40.05;乙醇体积分数2%(培养基灭菌后加入),pH 7.0,121℃灭菌20 min。
YPD 培养基(g/dL):酵母膏 1,蛋白胨 2,葡萄糖2,115℃灭菌 30 min。
1.1.3 主要试剂 叔戊酸(GR):美国SIGMA公司;乙酸钠 (AR):国药集团化学试剂有限公司;乙醇(GR):上海安普科学仪器有限公司;正己酸(GR):美国SIGMA公司;正丁酸(GR):美国SIGMA公司;磷酸氢二钾(AR):国药集团化学试剂有限公司;硫酸镁(AR):国药集团化学试剂有限公司;硫酸铵(AR):国药集团化学试剂有限公司。
1.1.4 主要设备和仪器 天平:梅特勒-托利多仪器(上海)有限公司;超净台:苏州安泰空气技术有限公司;台式离心机:上海安亭科学仪器厂;恒温培养箱:华粤行仪器有限公司;高压蒸汽灭菌锅:日本TOMY KOGYO公司;气相色谱仪 7890A:安捷伦公司;紫外可见分光光度计:光尼柯(上海)仪器有限公司;漩涡混合器:上海琪特分析仪器有限公司;发酵罐(7L):New Brunswick,Eppendorf BioFlo/CelliGen 115。
1.2 试验方法
1.2.1 己酸菌发酵培养 将己酸菌发酵液以体积分数10%接入乙酸钠培养基中,于37℃下恒温培养。由于己酸菌是厌氧菌,发酵液装瓶量应控制在90%以上并使锥形瓶密闭。己酸菌扩大培养:将己酸菌发酵液以体积分数10%接入乙酸钠培养基中,于37℃下恒温培养4 d后,保藏在4℃冰箱中。
1.2.2 酵母培养方法 挑单菌落接入经灭菌的YPD培养基100 mL/500 mL三角瓶,温度30℃,转速250 r/min,发酵16 h,加无菌水稀释使得酵母菌液浓度为108~2×108CFU/mL,取适量菌液离心后加入醋酸钠培养基,接种体积分数20%。
1.2.3 气相法测挥发酸条件 GC[13]条件:柱型号CP-WAX57CB(50 m长,内径0.25 mm,膜厚0.2 mm);柱温:采用程序升温,初始温度为50℃,保持2 min,升温速率为15℃/min,终止温度为230℃,保持15 min;进样器温度为150℃,检测器温度为250℃;载气(高纯氮)流速为44 mL/min,氢气流速为30 mL/min,空气的流速为400 mL/min;进样量为1 μL。前处理方法为取适量发酵液,加0.1 mol/L稀硫酸调至pH 2,膜滤(0.22 μL水系)加1%内标叔戊酸,振荡混匀放入1 mL离心管,存于4℃冰箱。
1.2.4 高效液相色谱测乙醇 检测器:示差折光检测器;流动相:0.05 mmol/L浓硫酸,流速0.6 mL/min,洗脱时间30 min。前处理方法为:取样品0.5 mL加1 mL 三氯乙酸,4 ℃沉淀 30 min,过膜(0.22 μL 水系)[15-16]。
2 结果与讨论
2.1 己酸菌纯培养条件下的产酸情况
如图1所示,克氏梭菌8022纯培养时,前体物质丁酸大约第96 h开始产生,从第120 h开始合成己酸,此时,丁酸的生成速率大于其消耗速率,故此阶段丁酸浓度逐步上升,直至约120 h。而己酸产生直至240 h左右趋于稳定。产物丁酸从开始产生到第130 h左右达到峰值,约4.5 g/L。此后,丁酸的消耗速率大于生成速率,开始呈现下降趋势,大约144 h左右趋于稳定。从图中可以看出,本菌株在纯培养条件下的己酸最大产量可达6.35 g/L。
2.2 克氏梭菌8022与与酿酒酵母共培养条件下己酸合成
如图2所示,克氏梭菌8022与酿酒酵母共同培养后,前体物质丁酸的产酸时间由原来的第96 h变为第48 h,最大己酸产量也由原来的120 h提前为96 h左右。最大己酸产量提高到约7.09 g/L左右。
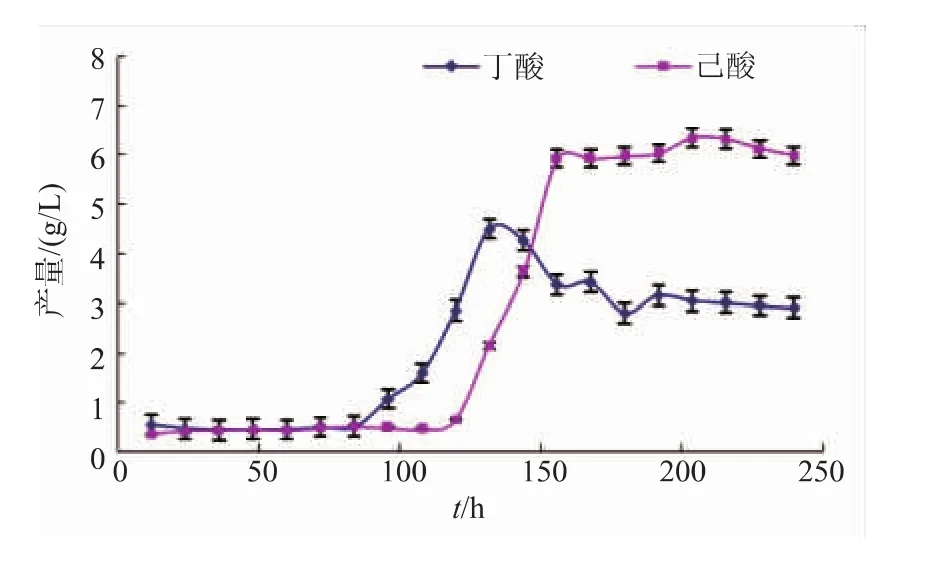
图1 克氏梭菌纯培养产酸过程曲线Fig.1 Acid yield curve of pure culture
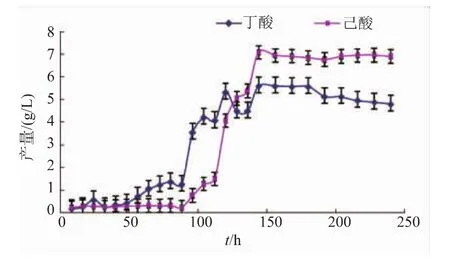
图2 共培养对产酸水平的影响Fig.2 Acid yield curve of co-culture
2.3 共培养提高产酸的作用机制初步分析
为了进一步分析混合培养体系提高己酸产量的机理,作者进一步分析了共培养过程中克氏梭菌与酿酒酵母菌数的变化及整体生物量的关系。
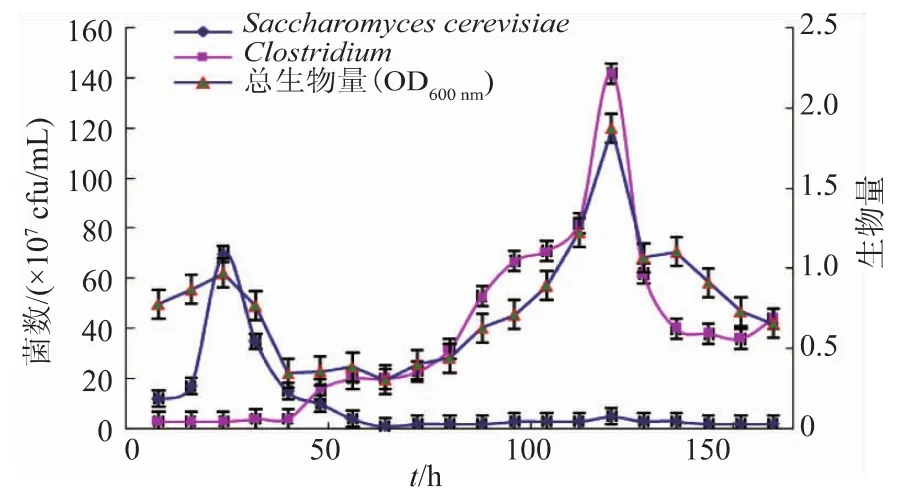
图3 共培养对生物量和菌数的影响Fig.3 Biomass and microbial content of co-culture
从图3可以看出,前期由于酵母接种体积分数较大,因此酵母数量占优势,镜检发现大量圆球状酵母以及梭状己酸菌。随后酿酒酵母菌数量开始逐步减少,而且前72 h左右数量迅速递减,这可以归结于酿酒酵母难以利用培养基中碳源。而此时,己酸菌开始生长,镜检结果显示到48 h时能观察到游动的梭状杆菌,并且数量逐步增加。此后己酸菌进入对数生长期开始大量增殖,并于120 h左右菌数达到最大值,约1.4×108cfu/mL,之后己酸菌进入稳定期,此时酵母已基本趋于稳定,镜检显示始终有少量酵母存在发酵液体系中。这也说明了己酸菌改良培养基不适合酵母菌的生长,但是在共培养的条件下能少量存活,而且外加的酵母对己酸菌的生长没有明显负面影响。
前期三角瓶实验已初步验证酵母共培养提高产酸不是由于乙醇和营养物质的缘故 (数据未提供),我们用发酵罐在线监测手段观测其发酵过程的参数变化,主要包括pH和溶氧值DO的变化,见图4-5。可以看出,克氏梭菌8022纯培养的溶氧值波动较大,实验结果表明共培养的溶氧普遍低于纯培养时的值,整个厌氧环境的不同很可能导致了产酸和代谢上的差异,这也说明深层发酵产酸明显优于低装液量发酵。无论哪种培养方式,两种培养方式的pH都呈现较缓慢的下降趋势,并最终稳定在5.9左右,这与在500 mL小三角瓶中的预实验结果基本相同。
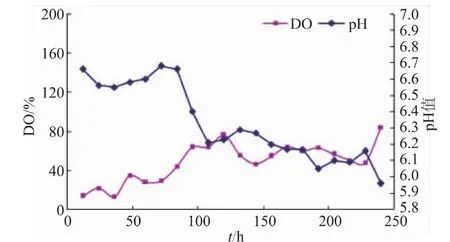
图4 发酵罐纯培养的溶氧和pH变化曲线Fig.4 DO and pH curve of pure culture

图5 发酵罐共培养溶氧和pH变化曲线Fig.5 DO and pH curve of co-cuture
从图6可以看出,初始乙醇质量浓度约为16 g/L,此后因消耗而逐步下降,但是无论纯培养还是共培养,乙醇的变化趋势没有明显差异。结果表明酵母无氧呼吸产生的乙醇不是提高己酸产量的主要因素。图7表明了底物乙酸的消耗情况。当克氏梭菌8022纯培养的时候,乙酸作为底物在前240小时呈现整体下降中间略有回升的趋势,这主要归结于部分乙醇被氧化为乙酸的缘故。克氏梭菌8022与酿酒酵母共培养时,乙酸消耗速率和最终向己酸的转化率都有所提高,第80小时开始乙酸快速消耗转化为丁酸,由此可见厌氧环境的改善也一定程度促进了乙酸的转化率[17]。
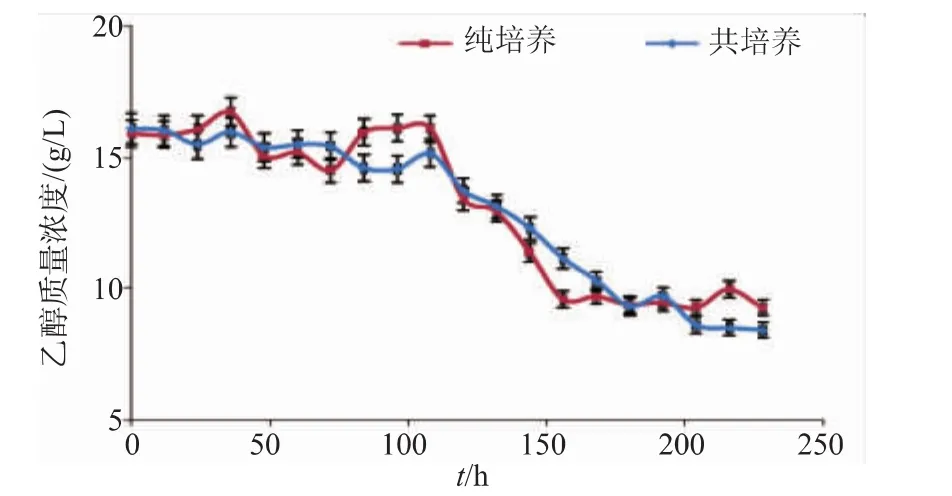
图6 培养方式对乙醇消耗量的影响Fig.6 Effect of culture mode on ethanol consumption

图7 培养方式对乙酸消耗量的影响Fig.7 Effect of culture mode on acetic acid consumption
为了进一步明确共培养体系中己酸的合成代谢机制,我们以发酵前240小时底物产物皆基本趋于稳定时为终点,计算了纯培养和共培养条件下,乙醇、乙酸、丁酸、己酸的平均消耗速率[18]和最大值。

从表1可以看出,纯培养体系中己酸的合成速率普遍低于共培养的速率。其中,乙酸和丁酸的转化速率有明显差异,共培养比纯培养提高了50%以上,乙醇的转化速率有较小影响,最终的结果是促进了己酸的产生,由原来的6.35 g/L提高到7.09 g/L,产酸速率从 0.60 g/(L·d)提高到 0.69 g/(L·d)。 这说明厌氧环境对乙酸转化为丁酸,丁酸转化为己酸这一代谢途径有比较大的影响,而乙醇不是主要影响因素。
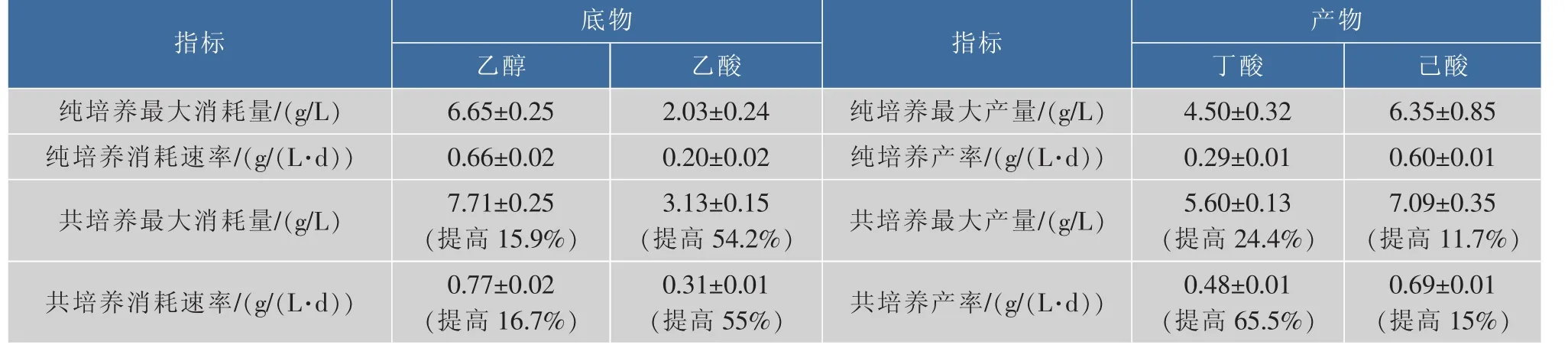
表1 纯培养和共培养产(底)物反应速率及峰值Table 1 Reaction rate and peak of product(substrate)when pure colture and co-colture
3 结 语
克氏梭菌是绝对厌氧细菌,在传统白酒窖池体系中,它是以混合菌种形式存在于窖泥中。传统白酒很早就提出“以糟养窖、以窖养糟”的说法,其实质就是窖泥中克氏梭菌与酒醅中酵母的协同作用机制。作者将克氏梭菌和酿酒酵母共同培养,并通过发酵罐试验,在线监测DO、pH等值,并通过气相液相色谱离线测定产物底物的质量浓度以及混合培养体系生物量的分析,初步证明了酵母对克氏梭合成己酸的提高机制:主要是改善了厌氧环境,促进了乙酸及丁酸的转化率,而不是乙醇的转化率,即乙酸到丁酸和丁酸到己酸的代谢途径通过厌氧环境的改善得到了强化,最终使己酸的最大产量从6.35 g/L提高到7.09 g/L,提高了11.7%,到达最大产酸的周期缩短了48 h。本研究为白酒液态发酵技术的改造与提升提供重要的参考依据。
[1]QIAO Lin.The characteristics of caproic acid bacteria and their culture[J].Liquor Making,1997,2:27-28.(in Chinese)
[2]XIE Guopai.Culture methods of caproic acid bacteria&the formation of its main linked product[J].Liquor Making Science and Technology,1997,2:27-28.(in Chinese)
[3]GUO Yishan,ZHEN Da,CHEN Maobing.Optimization for industrial amplification cultural conditions of caproic acid mixed culture[J].Liquor Making,2010,37(1):39-42.(in Chinese)
[4]DING Xuesong,ZHAO Hui.Research progress in Clostridium kluyveri[J].Science and Technology of Food Industry,2012,33(15):401-405.(in Chinese)
[5]MIAO Zijian,WANG Xingchu,LIU Xiaoning.Isolation and purification ofcaproic acid bacteria from pit mud&study of its acid-producting capacity[J].Science and Technology of Food Industry,2012(11):79-81.(in Chinese)
[6]XU Jun.Application of caproic acid bacteria functional liquid in luzhou-flavor liquor production[J].Science and Technology of Food Industry,2012(1):77-78.(in Chinese)
[7]HONG B D,GIIN Y A T,JING Y W.Caproate formation in mixed-culture fermentative hydrogen production[J].Bioresource Technology,2010(101):9550-9559.
[8]REN Jing,MA Rongshan,GUAN Wei,et al.Studies of acid produce by caproic acid bacteria in pit mud[J].Liquor Making,2006,33(1):41-43.(in Chinese)
[9]GE Xiangyang,HE Qian,ZHANG Weiguo.Enhancement of L-Lactic acid production in lactobacillus casei from jerusalem artichoke tubers by kinetic optimization and citrate metabolism[J].Microbiol Biotechnol,2010,20(1):101-109.
[10]KENEALY W R,CAO Y,WEIMER P J.Production of caproic acid by cocultures of ruminal cellulolytic bacteria and Clostridium kluyveri grownon cellulose and ethanol[J].Appl Microbiol Biotechnol,1995,44:507-513.
[11]LeiXu,ULRIKE T.Immobilized anaerobic fermentation for bio-fuel productionby Clostridium co-culture[J].Biosystems and Bioproducts Engineering,2014(37):1551-1559.
[12]CHEN Xiang,WANG Yaqing,SHAO Haiyan.Application of pure and mixed culture technologies for caproic acid bacteria[J].Liquor Making,2009,3(36):35-36.(in Chinese)
[13]LIU Kun.Deterimination on the main components in Chinese liquor by gas chromatography[J].Hebei Chemical Industry,2012,35(3):58-60.(in Chinese)
Improvement of Caproic Acid Production in the Mixed Culture of Clostridium kluyveri and Saccharomyces cerevisiae
JI Xiang1,2, XU Yan*1,2, MU Xiaoqing1,2, GE Xiangyang1,2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
In order to enhance the caproicacid productionof Clostridium kluyveri and shorten thefermentation period,this strain was co-colturedwith Saccharomyces cerevisiae and themechanism of enhancing caproic acid production in the mixed culture system was furtherly analyzed.Studies have revealed that:caproicacid yieldin the fermentation tank with pure colture of Clostridium kluyveri reached 6.35 g/L.However,caproic acid production with co-cultured system reached 7.09 g/L,which was 12.5%higher than that of the pure culture system and thetime reaching peak of caproic acid production was shortenedfor approximately 48 h.Relative data indicated that when co-culture wit Saccharomyces cerevisiae,thecaproic acid production of Clostridium kluyveriwas improved byincreasing the conversion rate of acetic acid to butyric acid.Analysis of dissolved oxygen values and microbial growth parameters indicated that the main reason for this change was that the growth of Saccharomyces cerevisiae improved the anaerobiclevel of co-culture system,whichpromoted the formation and transformation of butyric acid,hence the caproic acid production was enhanced.
Clostridium kluyveri,Saccharomycescerevisiae,purecolture co-culture,caproic acid
TS 261.1
A
1673—1689(2017)09—0922—05
2015-02-06
国家自然科学基金项目(31530055)。
*通信作者:徐 岩(1962—),男,浙江慈溪人,工学博士,教授,博士研究生导师,主要从事酿造微生物学与工业酶学方面的研究。E-mail:yxu@jiangnan.edu.cn
嵇翔,徐岩,穆晓清,等.克氏梭菌和酿酒酵母混合培养提高己酸产量[J].食品与生物技术学报,2017,36(09):922-926.
