缺血预处理和缺血后处理对脑缺血再灌注损伤保护作用的实验研究*
2017-11-01张李娜
种 莉,陈 丽,张李娜,唐 鹏,刘 玥
陕西省人民医院神经内三科(西安710068)
缺血预处理和缺血后处理对脑缺血再灌注损伤保护作用的实验研究*
种 莉,陈 丽,张李娜,唐 鹏,刘 玥
陕西省人民医院神经内三科(西安710068)
目的:比较缺血预处理和缺血后处理对大鼠脑缺血再灌注时神经功能缺损及MMP-9表达的影响。方法:SD大鼠随机分为四组,分别是假手术组(S组),缺血再灌注组(I/R组),缺血预处理组(IPC组)和缺血后处理组(IPost组),观察各组神经行为学,测定脑组织含水量、TTC染色观察脑梗死体积,免疫组化染色测定脑组织中基质金属蛋白酶-9(MMP-9)的表达。结果:与S组相比,I/R组大鼠的神经功能损害评分明显升高,脑组织出现大面积梗死,且脑组织含水量明显增加,MMP-9的表达升高;而IPC组及IPost组大鼠的经功能损害较I/R组有明显改善,且脑组织梗死面积减小,脑组织含水量降低,MMP-9的表达强度降低。结论:缺血预处理及缺血后处理均能降低大鼠脑缺血再灌注大脑损伤,改善大鼠的神经行为学。
脑血管疾病是目前人类疾病三大死亡原因之一,在我国,脑血管病已上升为首位死亡原因[1],并且存活者会遗留瘫痪、失语、认知障碍等严重残疾[2]。缺血性脑血管病是最常见的脑血管疾病,最有效的治疗措施是早期溶栓,但溶栓后再灌注引起的再灌注损伤、脑水肿等严重并发症限制着溶栓治疗的推广应用。探寻防治脑缺血-再灌注损伤的策略是缺血再灌注研究领域的热点问题。近年来,出现了一系列预防与治疗脑缺血-再灌注损伤的方法,包括缺血预处理(IPC)、缺血后处理(IPost)、药物预处理等。缺血预处理能有效的改善缺血-再灌注损伤,但其在临床中的可操作性却低于缺血后处理,本研究通过建立大鼠局灶性脑缺血模型,拟比较缺血预处理和缺血后处理对大鼠脑缺血再灌注时血-脑屏障(BBB)通透性及MMP-9的影响,旨在探讨两种干预措施脑保护效应的机制,为缺血后处理在临床中应用提供新的思路和实验基础。
材料和方法
1 材 料 SD大鼠由西安交通大学医学部实验动物中心提供,兔抗MMP-9单克隆抗体购自武汉三鹰生物技术有限公司。SP广谱超敏试剂盒、DAB 酶底物显色试剂等均购于上海生工生物工程有限公司。
2 实验方法 ①脑缺血大鼠模型制备:健康雄性SD大鼠72只,体重280~300 g。动物随机分为四组,分别是假手术组(S组),缺血再灌注组(I/R组),缺血预处理组(IPC组)和缺血后处理组(IPost组),每组18只。假手术组:仅手术暴露、分离颈总、颈内、颈外动脉,不予插线阻断大脑中动脉血流,术后22 h断头取脑。I/R组:线栓法阻塞大鼠大脑中动脉血流,于栓塞后2 h给予血流再灌注,再灌注后22 h断头取脑。IPC组:线栓法阻塞大脑中动脉,阻塞5 min后再灌注5 min,重复3次,恢复再灌注24 h后再予缺血2 h再灌注22 h后处死。IPost组:线栓法阻塞大脑中动脉,阻塞2 h后行缺血后处理,再灌注20 s,而后再阻塞20 s,重复3次,其后实现完全再灌注,22 h后断头取脑。②神经功能缺损评分:大鼠再灌注22 h后参照改良Bederson评分标准进行神经功能缺损评分[3]。③氯化三苯基四氮唑(TTC)染色和梗死体积计算:每组取6只大鼠,断头取脑,迅速置于-20 ℃冰箱中速冻10 min左右。放入鼠脑槽中,去除嗅球,小脑和低位脑干。从额极向后作冠状切片,切成5~6片,每片厚2 mm。将切片置于2%TTC溶液中,37 ℃温箱避光染色30 min。玫红色为正常脑组织,白色为梗死脑组织。蒸馏水冲洗后4%多聚甲醛固定,24 h后数码相机照相。利用图像处理软件Image-Pro Plus 6.0计算机图像分析系统,算出各个脑片梗死区域的体积和缺血侧的总体积,求出梗死体积占大脑半球总体积的百分比。④脑含水量测定:每组取6只大鼠,断头取脑,将大脑半球左右分开,缺血侧半球组织称湿重后,置110 ℃电烤箱烘烤24 h,再迅速测干重。脑组织水含量=[(湿重-干重)/湿重]×100%。⑤MMP-9免疫组化染色:每组取6只大鼠,用水合氯醛深度麻醉动物后心脏灌注生理盐水和4%多聚甲醛各约200 ml,断头取脑,切取视交叉前缘至垂体后缘组织块,4%多聚甲醛溶液固定后脱水、透明、浸蜡、包埋、切片,然后置于经明胶处理的干净载玻片上,烤片12 h后进行染色。免疫组化SP法及DAB显色操作步骤均严格按照说明书进行。

结 果
1 神经功能缺损评分 S组大鼠没有神经功能缺损,评分为0。I/R组神经功能缺损评分(3.40±0.55)分,显著高于S组(P<0.05)。IPC组及IPost组评分分别为(2.00±0.71)分及(1.8±0.45)分,组间比较显示IPC组及IPost组的神经功能损伤评分虽高于S组,但与I/R组相比,评分明显降低(P<0.05)。
2 TTC染色和梗死体积计算 TTC染色结果显示,S组大鼠脑组织无梗死,I/R组大鼠脑组织出现明显的梗死灶,梗死体积占全脑总体积的(35.12±6.65)%,IPC组及IPost组的梗死体积占全脑总体积的(15.60±2.89)%及(11.38±1.11)%,较I/R组相比明显减小(P<0.05),见图1。
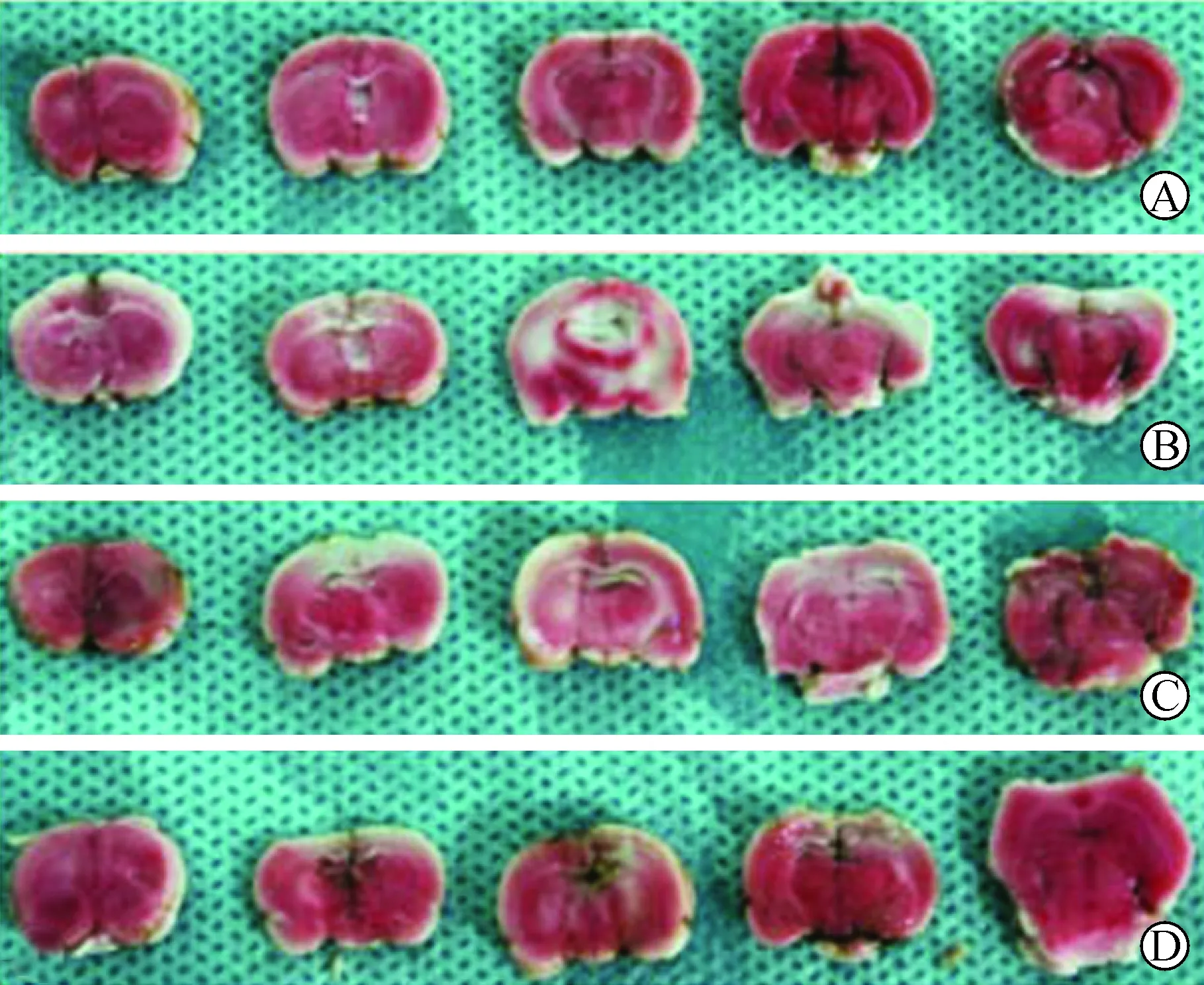
A:S组;B:I/ R组;C:IPC组;D:IPost组
3 脑组织含水量测定 S组大鼠的脑组织含水量为(76.49±1.72)%,而I/R组大鼠脑组织的含水量同S组相比,明显增加,达(83.57±1.13)%(P<0.05);IPC组及IPost组大鼠脑组织的含水量分别为(81.14±0.85)%及(81.29 ± 0.80)%,与I/R组相比,均有不同程度的降低(P<0.05)。
4 MMP-9免疫组化染色 S组MMP-9表达呈阴性,而I/R组大鼠脑组织MMP-9表达明显升高,阳性细胞计数达(25.28±3.13)个/视野;IPC组及IPost组大鼠脑组织MMP-9阳性细胞计数分别为(20.14±2.85)个/视野及(21.29±2.90)个/视野,表达强度虽较S组有所升高,但明显低于I/R组(P<0.05),见图2。

A:S组;B:I/ R组;C:IPC组;D:IPost组
讨 论
治疗脑缺血的前提和基础是迅速恢复缺血脑组织的血流灌注,但再灌注过程中会继发脑水肿等多种脑组织损伤,这也是病情加重的一个重要因素。中枢神经系统内环境的稳定,得益于血-脑屏障(BBB)的存在。正常状态下,除了气体及脂溶性小分子,其他大分子物质难以通过BBB。而急性脑缺血后,BBB破坏,通透性增加,水和血浆成分漏出到周围脑组织,形成脑水肿,同时大量炎性因子释放和炎性细胞渗出,加剧炎性反应和细胞凋亡[4],加重脑组织缺血再灌注损伤。
毛细血管基底膜(BM)是维持BBB完整性的重要结构基础,细胞外基质(ECM)构成BM的支架,急性脑梗死后多种蛋白水解酶活性上升,其中基质金属蛋白酶家族(MMPs)几乎能降解除多糖外ECM的所有成分,在脑水肿的发生中发挥重要作用。MMPs家族中以MMP-9对BBB通透性的变化影响最大[5]。脑缺血后MMP-9激活的一个早期的病理作用就是促进血管源性脑水肿形成[6]。其可能的机理为急性脑缺血时血管内皮细胞表达MMP-9,增高的MMP-9可破坏基底膜和BBB内皮细胞之间的紧密连接而导致BBB受损,通透性增加,产生脑水肿,使病情迅速恶化[7]。研究证实,MMP-9亦会加重脑缺血后炎性反应的损伤,脑缺血后中性粒细胞等可分泌MMP-9,后者又进一步促进白细胞浸润,并且破坏BBB,造成脑内微血管的二次损伤,导致神经元坏死[5]。因此,BBB通透性的改变以及血管源性水肿的发生和发展可以通过监测MMP-9水平的变化来预测。
缺血预处理是一种已被公认的有效的抗缺血-再灌注损伤措施,指脏器在经受多次短暂缺血和再灌注后,能耐受随后长时间的缺血-再灌注损伤。大量研究证实,这一现象存在于不同种属的不同组织器官中[8],包括脑组织。缺血预处理可诱导内源性保护机制,抵御其后发生的较严重的甚至致死性脑缺血事件。而缺血后处理,即在缺血后给予几个短暂的灌注/再缺血循环的处理措施。后处理对心肌等组织再灌注损伤的保护作用也在一些动物实验和临床研究中得到证实[9]。目前缺血后处理对脑缺血-再灌注损伤的作用也引起了学者们的重视。
本研究显示,缺血再灌注后大鼠出现不同程度神经行为学异常,脑组织有明显的梗死灶,脑组织的含水量显著增加,MMP-9的表达升高,而经过缺血预处理及缺血后处理后,神经功能缺损评分、梗死灶体积、脑组织含水量及MMP-9表达虽高于假手术对照组,但与缺血再灌注组大鼠相比,则显著降低,提示缺血预处理及缺血后处理均可以在一定程度上减轻脑水肿,降低缺血再灌注对大鼠神经的损伤。
临床上脑缺血的发生通常是不可知的,而预处理必须在缺血前实施,因此在临床上无法掌握缺血预处理的时机,故其临床应用受到了很大限制。也有研究认为缺血预处理具有减轻脑组织损伤的作用,但对于改善远期神经功能缺损意义不大[10]。如上所述,针对已缺血的脑组织采取更为合理的处理措施以减轻再灌注的近期和远期损伤,无疑具有更重要的临床价值。在急性缺血后给予缺血后处理,可以激发机体内源性保护机制,可操作性大,并且已在部分临床研究中证实其保护效果确切,因此缺血后处理具有更好的临床应用前景和实用价值。
[1] 马振国,刘敏君.针药结合治疗脑血管疾病恢复期190例[J].陕西中医,2002,23(2):157-158.
[2] Go AS, Mozaffarian D, Roger VL,etal.Hearl disease and stroke statistics-2014 update: a report from the American Heart Association[J].Circulation,2014,129(3): 399-410.
[3] Bederson JB,Pitts LH,Tsuji M,etal.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[4] Khanna A,Walcott BP,Kahle KT,etal.Effect of glibenclamide on the prevention of secondary brain injury following ischemic stroke in humans[J].Neurosurg Focus,2014,36(1): E11.
[5] Wu Y,Wang YP,Guo P,etal.A lipoxin A4 analog ameliorates blood-brain barrier dysfunction and reduces MMP-9 expression in a rat model of focal cerebral ischemia-reperfusion injury[J].J Mol Neurosci,2012,46(3):483-491.
[6] Lenglet S,Monteeucco F,Mach F,etal.Analysis of the expression of nine secreted matrix metalloproteinases and their endogenous inhibitors in the brain of mice subjected to ischaemic stroke[J].Thromb Haemost,2014,112(2):363-378.
[7] Yousuf S,Sayeed I,Atif F,etal.Delayed progesterone treatment reduces brain infarction and improves functional outcomes after ischemic stroke:a time-window study in middleaged rats[J].J Cereb Blood Flow Metab,2014,34(2):297-306.
[8] Hirayama Y,Ikeda-Matsuo Y,Notomi S,etal.Astrocyte-mediated ischemic tolerance[J].J Neurosci, 2015,35(9):3794-3805.
[9] Han Q,Zhang HY,Zhong BL,etal.Antiapoptotic effect of recombinant HMGB 1 A-box protein via regulation of microRNA-21 in myocardial ischemia-repefusion injury model in rats[J].DNA Cell Biol,2016,35(4): 192-202.
[10] Hua Y,Wu J,Pecina S,etal.Ischemic preconditioning procedure induces behavioral deficits in the absence of brain injury[J].Neurol Res,2005,27(3): 261-267.
Effectsofischemicpreconditioningversusischemicpostconditioningonischemia-reperfusioninjury
Chong Li,Chen Li,Zhang Lina,et al.
Department of Neurology,Shaanxi Provincial People’s Hospital(Xi’an 710068)
Objective: To Compare the influence of the neuroethology and the expression of MMP-9 after ischemic preconditioning and ischemic postconditioning on ischemia-reperfusion in rats. Methods: SD rats were randomly divided into four groups: control group (S), ischemia reperfusion group (I/R group), ischemic preconditioning (IPC) and ischemic postconditioning group (IPost), to Observe the neuroethology, the ischemia scope by TTC staining, the expression of MMP-9 by Immunohistochemical staining. Results: Compared with the S group, neurologic impairment scores in I/R group were increased significantly, large area of infarction was detected,the brain water content increased obviously,and the expression of MMP-9 was higher. Compared with the I/R group, neurologic impairment scores in IPC and IPost group were lower,inftact volume decreased, the brain water content decreased,and the expression of MMP- 9 was lower. Conclusion: Ischemic preconditioning and ischemic postconditioning can reduce the damage of brain ischemia reperfusion and improve neural function in rats.
Brain ischemia Ischemic preconditioning Ischemic postconditioning Reperfusion injury
*陕西省自然科学基础研究计划项目(2012JM4003)
脑缺血 缺血预处理 缺血后处理 再灌注损伤
R743.32
A
10.3969/j.issn.1000-7377.2017.10.015
(收稿:2017-01-03)
