Nrf2及P62在卵巢癌组织中的表达及临床意义*
2017-11-01李亚玲王丰艳王宝玲
李亚玲,王丰艳,李 欢,王宝玲
西安市第四医院(西安710004)
△通讯作者
Nrf2及P62在卵巢癌组织中的表达及临床意义*
李亚玲,王丰艳,李 欢△,王宝玲
西安市第四医院(西安710004)
目的:探讨Nrf2及P62在卵巢癌及相应的正常组织中的阳性表达情况,为卵巢恶性肿瘤恶性程度及预后的判断提供理论参考。方法:收集70例卵巢癌组织及正常组织,采用RT-PCR检测组织中Nrf2 mRNA与P62 mRNA的表达情况;免疫组化法检测组织中P62和Nrf2蛋白的表达情况。结果:在卵巢癌组织中,Nrf2与P62蛋白及mRNA的表达量均明显高于正常组织(P<0.05)。Nrf2 蛋白阳性表达和肿瘤的MDACC分型(P=0.003)、IFGO分期(P=0.036)、大网膜转移(P=0.036)密切相关;而P62蛋白的阳性表达和MDACC分型(P=0.008)、组织学分级(P=0.021)、IFGO分期 (P=0.018)相关。Nrf2和P62的表达在卵巢癌组织中呈明显的相关性(r=0.274,P<0.05)。而Nrf2+/P62+分组中位生存时间28个月,相较于其他分组的患者预后更差。结论:Nrf2和P62的异常表达与卵巢癌的进展密切相关,两者在卵巢癌的发生发展中存在协同作用,Nrf2和P62的共表达往往预示着卵巢癌患者的不良预后。
NF-E2相关因子2(Nrf2)是一种高度保守的关键性核转录因子,对细胞内氧化还原状态非常敏感,并发挥着保护细胞内环境稳定的作用[1]。P62是一种的自噬底物连接蛋白,当自噬发生时它可以与多种待降解蛋白结合,形成复合体并将其运送至自噬小体,进一步与溶酶体结合而被降解[2-5]。本课题初步探讨卵巢癌组织中Nrf2及P62的表达及其与临床病理特征之间的联系。
资料与方法
1 一般资料 选取2010年11月至2011年12月间我院确诊的卵巢癌患者70例,所有患者术前均未接受任何治疗,年龄 29~72 岁,中位年龄 51.7 岁;组织学类型:浆液性囊腺癌48例,子宫内膜样腺癌10例,粘液性囊腺癌12例;FIGO分期:I、II期33例,III、IV期37例;淋巴结转移40例,无淋巴结转移30例。对照组取自同期70例正常卵巢组织(子宫肌瘤、子宫腺肌症、宫颈上皮内瘤变行手术切除子宫及双附件的患者),年龄28~70 岁,中位年龄 50.7 岁。所有标本置入液氮迅速冷冻,-80℃保存。用于免疫组化的标本离断后在4%的多聚甲醛中固定24 h。
2 检测方法 ①实时荧光定量PCR检测:利用TRIzol试剂提取标本中的总RNA,之后迅速应用目的基因特异性上下游引物(P62,上游5'-GAGCAGCATCCAACCAAA-3',下游5'-CGTCTCCTGGAGGCATA-3';Nrf2,上游5'-CCAACACACGGTCCACAGCT-3',下游5'-TCCGTCGCTGACTGAAGTCAA-3'),SYBR Premix Ex TaqTMII (Takara)和iQ5 Multi-color RT-PCR 反应系统对目的基因片段进行扩增。引物均由TaKaRa生物技术公司(Dalian,China)设计合成。用ABI prime 7000 SDS软件分别测出每个样品Nrf2、P62 mRNA的CT值,2-△△Ct方法计算该基因的相对表达量。②免疫组化法检测:用免疫组化检测P62和Nrf2的表达情况。一抗购自Abcam公司:Nrf2 (ab62352,1∶200,HK)、CXCR4(ab2074,1∶50,HK)。石蜡标本使用3% H2O2在室温下作用30 min以完全除去过氧化物酶的活性,用20%的山羊血清结合非特异性蛋白。在4°C条件下孵育一抗过夜。第2天用TBS洗标本3次并在室温条件下用孵育生物素标记的二抗作用30 min。对10个随机视野阳性细胞的百分比计数,分数分级如下:1分,<25%;2分,26%~50%;3分,51%~75%;4分,>76%。染色强度所得分数如下分级:0分,无染色;1分,弱表达染色;2分,中度表达染色;3分,强表达染色。将上述两种评分值相加,并根据总分值将标本分为4组:6~7分,强表达组();4~5分,中等表达组();1~3 分,弱表达组(+);阴性组 (-),0分。出现阴性和弱表达情况则判定为该基因阴性表达,而中等和强表达则判定该基因阳性表达。
3 统计学方法 数据统计应用SPSS 20.0统计学软件,相关性应用参数统计中 Spearman 等级相关进行分析。P<0.05表示差异有统计学意义。
结 果
1 Nrf2 mRNA和蛋白表达情况 Nrf2 mRNA在肿瘤组织中的相对表达量较正常组织明显增高[(3.2543±0.7727)与(1.6463±0.2966)P< 0.01)。肿瘤组织中Nrf2阳性表达率为61.4%(43/70),明显高于正常组织中的(25/70,35.7%) (P<0.05)。结合临床病例特征,Nrf2 阳性表达和肿瘤的MDACC分型(P=0.003)、IFGO分期(P=0.036)、大网膜转移(P=0.036)密切相关。
2 P62 mRNA和蛋白表达情况 P62 mRN在肿瘤组织中的表达量明显高于正常组织[ (3.0345±0.7767) 与(1.3232±0.5988)P<0.01]。P62蛋白在肿瘤组织中的阳性表达率为54.3%(38/70),高于正常组织的(28/70,40.0%) (P<0.01)。结合临床病例特征,P62蛋白的阳性表达和与MDACC分型(P=0.008)、组织学分级(P=0.021)、IFGO分期 (P=0.018)相关。
3 Nrf2和P62表达在卵巢癌组织中的相关性 见表1。将标本分为4组: Nrf2+/P62+,Nrf2-/P62+,Nrf2+/P62-和Nrf2-/P62-。发现Nrf2和P62的表达存在显著相关性(r=0.274,P<0.05)。提示在卵巢癌组织中P62表达上调可能受到Nrf2蛋白表达水平的影响。正常组织中未观察到明显的相关性。

表1 Nrf2与P62蛋白表达在卵巢癌组织中的相关性
4 Nrf2 和P62表达与卵巢癌患者生存时间的关系 见图1。
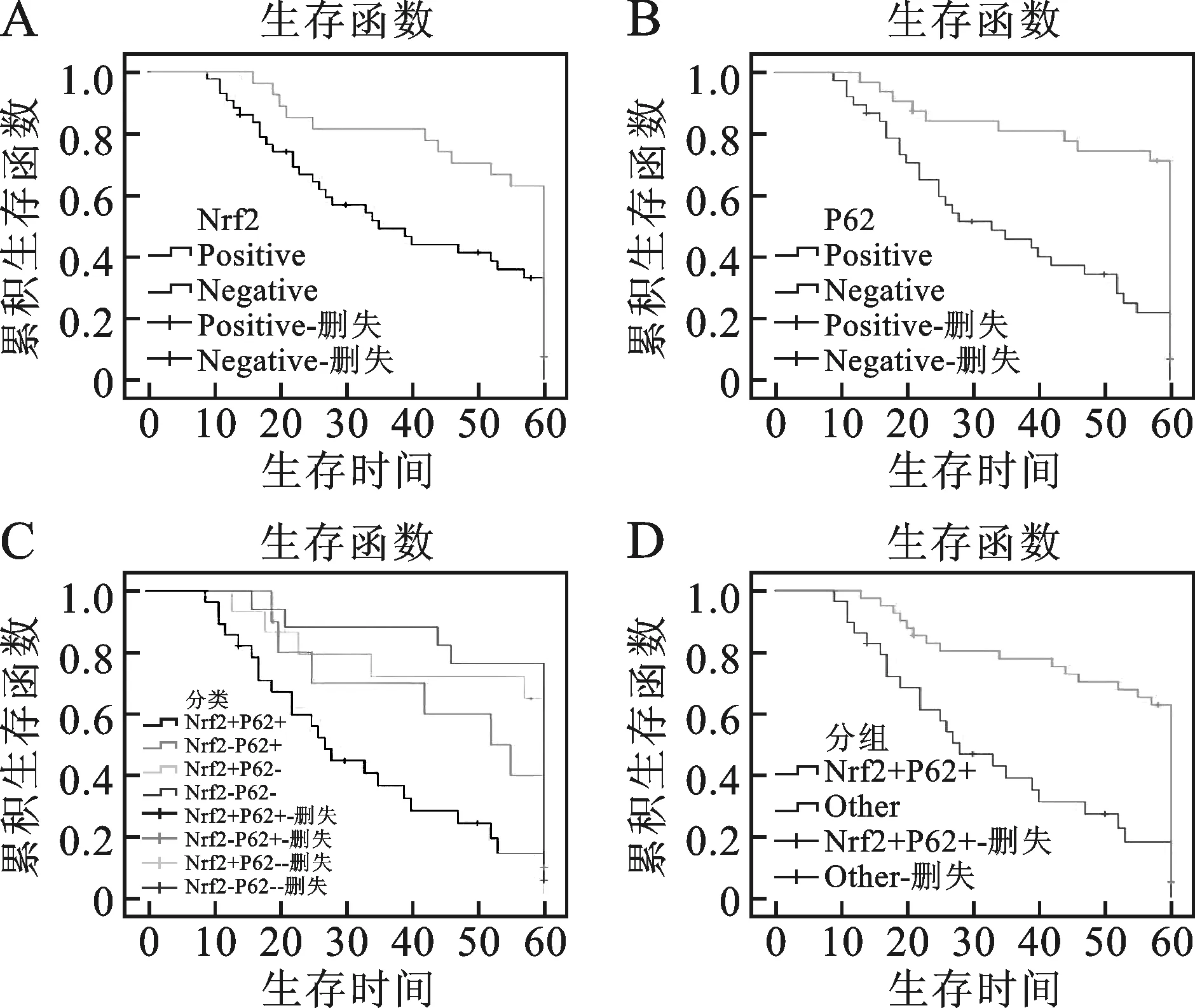
A:Nrf2的表达与预后;B:P62的表达与预后;
70例随访持续到2016年12月,42例在随访期间死亡,生存时间9~60个月,中位生存时间52.9个月。卵巢癌患者不同分组(Nrf2+/P62+,Nrf2-/P62+,Nrf2+/P62-和Nrf2-/P62-)的生存情况,其中Nrf2+/P62+组的中位生存时间为28.0个月,相较于其他分组病人的预后更差(P<0.01)。
讨 论
本研究探讨了卵巢癌患者临床标本中Nrf2和P62的表达对临床病理数据和生存情况的影响。结果表明Nrf2和P62基因的mRNA和蛋白在肿瘤组织中的表达要明显高于正常组织,Nrf2的高表达和肿瘤的MDACC分型(P=0.003)、IFGO分期(P=0.036)、大网膜转移(P=0.036)密切相关,与此同P62高表达和MDACC分型(P=0.008)、组织学分级(P=0.021)、IFGO分期 (P=0.018)相关。同时表明在卵巢癌患者临床标本中Nrf2和P62的表达之间有很强的相关性。同时生存分析表明二者双阳性表达组往往意味着更差的预后。
在肿瘤生长的过程中,肿瘤细胞的生长增值过程中会产生大量的ROS,最终激活Nrf2通路[6]。作为一种核转录因子,Nrf2可以特异性的识别抗氧化反应元件ARE,从而激活下游ARE依赖的相关酶类[5]。近来相关证据表明,Nrf2有助于肿瘤细胞维持干性及抵抗放化疗[7]。Nrf2无论是在正常细胞还是恶性细胞中都扮演了保护者的角色。
卵巢癌标本中的Nrf2表达相对较高,同时Nrf2的高表达与肿瘤大小密切相关。肿瘤越大往往意味着缺氧越严重,细胞压力越高,在这种情况下Nrf2通路将被广泛激活。同时我们发现Nrf2与肿瘤分期关系密切,这提示Nrf2通路在卵巢癌的进展中十分重要,与患者的预后评价密不可分[7-8]。
综上所述,Nrf2和P62的过表达在卵巢癌进展中扮演了重要的角色,两者之间可能存在着某种密切的联系,且与患者不良预后相关。因此针对两者的研究可能帮助我们发现新的治疗卵巢癌的靶点。
[1] Sporn MB.NRF2 and cancer:the good,the bad and the importance of context[J].Nat Rev Cancer,2012,12(8):564-571.
[2] Sirota R,Gibson D,Kohen R.The role of the catecholic and the electrophilic moieties of caffeic acid in Nrf2/Keap1 pathway activation in ovarian carcinoma cell lines[J]. Redox Biol,2015,4:48-59.
[3] Manandhar S,Choi BH,Jung KA,etal. NRF2 inhibition represses ErbB2 signaling in ovarian carcinoma cells: implications for tumor growth retardation and docetaxel sensitivity[J].Free Radic Biol Med,2012,52(9):1773-1785.
[4] Efeyan A,Comb WC,Sabatini DM.Nutrient-sensing mechanisms and pathways[J].Nature,2015,517(7534):302-310.
[5] Jiang X,Overholtzer M,Thompson CB.Autophagy in cellular metabolism and cancer[J].J Clin Invest,2015,125(1):47-54.
[6] 李兴媚.抑制ERK1/2通路对卡铂诱导人卵巢癌细胞凋亡的影响[J].陕西医学杂志,2016,45(5):522-523.
[7] Martinet W,De Meyer GR. Autophagy in atherosclerosis: a cell survival and death phenomenon with therapeutic potential[J]. Circ Res,2009,104(3):304-317.
[8] Kim YC,Guan KL.Mtor:a pharmacologic target for autophagy regulation[J]. J Clin Invest,2015,125(1):25.
*西安市科研教育项目(2013013)
卵巢肿瘤 基因表达调控,肿瘤 预后 NF-E2相关因子2 @P62
R737.31
A
10.3969/j.issn.1000-7377.2017.10.011
(收稿:2017-02-17)
