microRNA217逆转人宫颈癌细胞顺铂耐药及其作用机制
2017-11-01张婷婷彭慧霞
张婷婷,彭慧霞
西安交通大学第二附属医院妇产科(西安710004)
△通讯作者
microRNA217逆转人宫颈癌细胞顺铂耐药及其作用机制
张婷婷,彭慧霞△
西安交通大学第二附属医院妇产科(西安710004)
目的:探讨microRNA217(miR-217)与宫颈癌顺铂耐药的关系及其可能作用机制。方法:建立具有不同顺铂耐药性的细胞株Siha及Siha/CDDP,采用实时荧光定量PCR法检测miR-217在其中的表达差异。采用实时定量PCR及Western blot法分别在核酸和蛋白水平检测果蝇zeste 基因增强子同源物2(EZH2)在Siha及Siha/CDDP细胞系的表达差异。通过转染miR-217模拟物 (miR-217mimics) 检测其对宫颈癌耐药的作用及其可能作用靶点。结果:相较于Siha细胞,Siha/CDDP细胞中miR-217呈低表达,而EZH2在核酸和蛋白水平均相对高表达 (P<0.05)。Siha/CDDP细胞转染miR-217 mimics后,EZH2在核酸及蛋白水平均明显下降(P<0.05),对顺铂的敏感性显著增强 (P<0.05)。结论: 在Siha/CDDP中上调其表达可部分逆转顺铂耐药性,这可能为宫颈癌耐药的临床前期研究提供新的靶点,miR-217可能通过作用于EZH2参与宫颈癌顺铂耐药的调控。
microRNAs(miRNAs)是一组非编码保守小RNAs,可通过与同源性mRNA靶点上的3'未翻译区(UTRs) 进行序列特异性的结合[1]。近年来,已有大量研究发现miRNAs可通过调控癌基因/抑癌基因继而调控肿瘤的发生、发展及放化疗敏感性等生物学行为。miR-217位于染色体2P16.1上,目前已有部分研究表明其在肿瘤进展过程中可能起到重要作用[2]。本研究旨在探讨miR-217在宫颈癌顺铂耐药细胞中的作用及其机制。
材料和方法
1 材 料 人宫颈癌细胞株Siha(ATCC公司)。RNAiso 小RNA 提取试剂、PrimeScript miRNA 反转录试剂盒、SYBRPremix Ex Taq 试剂盒、miR-217引物(TaKa-Ra) ; 6 孔板、24 孔板、96 孔板(Costar) ; MTT(南京凯基) ; 二甲基亚砜(DMSO)(Sigma) ; 酶标仪(Invitrogen) 。EZH2单克隆抗体(Cell Signaling Technology,USA); β-actin 单克隆抗体(sc-130756,Santa Cruz); 羊抗鼠抗体(sc-130656,Santa Cruz)。
2 实验方法 ①宫颈癌耐顺铂细胞株的诱导:利用低浓度加量持续诱导法产生人宫颈癌耐 CDDP细胞株[3]。诱导方法如下: 0. 1μg/ml 顺铂处理宫颈癌细胞Siha 2 周,0. 5 μg/ml 处理 6 周,1 μg/ml 处理12 周,2 μg/ml 处理8 周,4 μg/ml 处理 12 周。经过总共 40 周的诱导,Siha细胞可在含CDDP (4 μg/ml) 的培养液中稳定生长且正常传代,成功建立了人宫颈癌耐顺铂细胞株Siha/CDDP。②细胞培养:Siha细胞培养于DMEM 培养液(Gibco 公司)中加入 5%的小牛血清(Gibco 公司)以及100 U/ml青霉素和100 μg/ml 链霉素,在5% CO2培养箱中培养。 耐顺铂细胞株Siha/CDDP 常规培养于含5%胎牛血清以及100 U/ml青霉素和100 μg/ml 链霉素的DMEM培养液中,置于37℃、5% CO2培养箱中。每传两代在培养基中加入终浓度为4 μmol/L的顺铂以维持其耐药性。③细胞转染:取对数生长期细胞,胰酶消化并计数,每孔接种5×104细胞,温箱孵育细胞至70%丰度,分别取成熟miR-217的mimics/ inhibitors和NC(阴性对照) 各100 pmol与脂质体混匀后室温下放置30 min,同时将细胞用无血清培养基漂洗2遍,将混匀后的脂质体用无血清培养基稀释后小心加入漂洗过的细胞,之后将转染后细胞置于温箱中孵育24 h后换新鲜完全培养基。具体操作按 Lipofectamine2000 说明书进行。④实时荧光定量PCR:用TRIzol试剂提取细胞总RNA,检测浓度与质量,OD值在1.8~2.2之间方可使用。用TaKaRa PrimeScript miRNA 反转录试剂盒合成cDNA。qRT-PCR检测各组细胞中miR-217表达水平。反应条件: 95℃ 10 min预变性,95 ℃ 10 s、55 ℃ 30 s、70 ℃ 20 s 共40个循环。反应所得样本和内参 U6 的结果分析采用 2-ΔΔCT方法。2-ΔΔCT表示各标本实验组与对照组比较的相对表达量,每组实验重复 3 次。⑤Western blot:收集细胞样本,用RIPA裂解液提取细胞总蛋白。4 ℃离心机离心弃去沉淀,收集蛋白后BCA法定量分析蛋白浓度。制备10%SDS-PAGE胶,上样于泳道后100 V恒压分离后转PVDF膜,接着在PBS/Tween-20中用5%脱脂牛奶封闭2 h,加鼠抗人EZH2单克隆抗体和鼠抗人β-actin 单克隆抗体4 ℃过夜。加辣根过氧化物酶标记的羊抗鼠抗体(sc-130656,Santa Cruz) ,室温孵育1 h 洗膜后显影。用BandScan图像分析系统扫描图像的光密度,以各组目的蛋白条带光密度值与内参蛋白(β-actin) 光密度值计算相对比值。⑥MTT实验:取对数生长期细胞,胰酶消化后用培养基调整其浓度至5×104/ml。按每孔100 μl细胞悬液(约每孔5000个细胞)接种于96孔板。将96孔板置于培养箱24 h后,细胞贴壁,弃去原培养基后加入终浓度为 1、10、 20、50、100 μmol/L的顺铂,每个浓度设6个复孔,同时设调零孔(即不加细胞组)、对照孔(即仅加入最大浓度药物溶解介质的细胞孔)。 48 h后加 20 μl/孔 MTT(5 mg/ml),温箱孵育3 h,终止培养后小心吸去孔内培养液,每孔加150 μl DMSO。置于温箱孵育10 min后用酶标仪检测。在 490 nm 波长处读数。绘制药物剂量反应曲线,计算细胞半数抑制浓度(IC50) ,每个实验重复3次。⑦细胞生长及存活性检测:取转染后Siha/CDDP细胞,加10 μmol/L顺铂作用5 d。在不同时间点用胰酶消化细胞后制成细胞悬液。细胞悬液与0.5% Trypan Blue溶液以9∶1混合均匀,调节其终浓度为0.05%。在3 min内用细胞计数器分别计数活细胞及死细胞。镜下观察,活细胞呈无色透明状,死细胞被染成蓝色。统计细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。每个实验重复3次。
3 统计学方法 用 SPSS 16.0 统计学软件处理数据,两组数据比较采用 Student'st检验,多组间资料比较采用 One-way ANOVA 单因素方差分析(LSD法) 。P<0.05 为差异有统计学意义。
结 果
1 miR-217在宫颈癌细胞中的表达 见图1。在宫颈癌细胞Siha及宫颈癌耐药细胞Siha/CDDP中miR-217均有表达,实时荧光定量PCR结果显示miR-217在Siha/CDDP细胞中低表达,相对表达水平较Siha细胞降低约50%,两者比较有统计学差异(P<0.05)。

*P<0.05
2 EZH2在宫颈癌耐药细胞株Siha/CDDP中的表达 实时荧光定量PCR检测显示:在Siha/CDDP细胞中EZH2 mRNA表达水平高于Siha细胞株(P<0.05),见图2A。Western blot蛋白水平检测显示:Siha/CDDP细胞中EZH2蛋白表达高于Siha细胞株(P<0.05),见图2B。
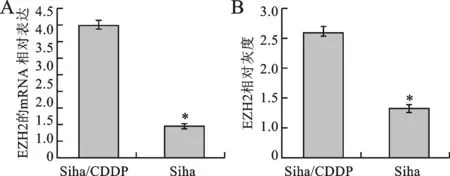
A:实时荧光定量PCR检测;B:Western blot 检测
3 转染miR-217mimic 后Siha/CDDP细胞中EZH2的表达情况 见图3。转染miR-217mimic后Siha/CDDP细胞中EZH2的mRNA及蛋白表达水平均显著下降,与Siha相比有统计学差异(P<0.05)。

A:实时荧光定量PCR检测;B:Western blot 检测
4 转染miR-217mimic后Siha/CDDP细胞耐药性变化 miR-217 组IC50为12.98 μmol/L,较对照组(23.21 μmol/L)显著下降(P<0.05),见图4A。转染miR-217mimic 后的Siha/CDDP细胞用顺铂作用48 h后存活率较对照组显著降低(P<0.05),见图4B。
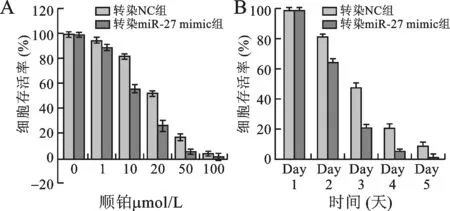
A:MTT 法检测转染miR-217 后Siha/CDDP细胞的耐药性;B:顺铂转染miR-217的Siha/CDDP细胞存活率
讨 论
目前已有研究表明miR-217过表达可通过调控PTEN信号通路参与肝癌耐药及其侵袭转移[4];在肺癌中,miR-217作为抑癌基因参与肿瘤顺铂耐药[5];在胃癌中,miR-217通过调控EZH2从而抑制肿瘤进展及转移[6]。但目前关于miR-217在宫颈癌细胞中对顺铂耐药性的调控尚未见报道。本研究发现,miR-217在宫颈癌顺铂耐药细胞株Siha/CDDP中的表达降低,而在耐药株中过表达miR-217可增强其对顺铂的耐药性。
EZH2是多硫基因(PcG)家族的重要成员,可通过过位点特异性地将组蛋白H3上第27位赖氨酸残基(H3-K27)甲基化而改变染色质的构象,促进肿瘤的增殖、抑制肿瘤细胞的凋亡[7-8]。目前已有大量研究认为EZH2在多种肿瘤中过表达,在肿瘤的发生发展及预后等过程中起重要作用[9]。Cai等[10]发现EZH2可逆转宫颈癌的肿瘤化疗抵抗。本研究通过靶基因预测软件发现EZH2可能是miR-217的潜在靶基因之一,因此我们推测miR-217在EZH2高表达的宫颈癌顺铂耐药细胞株(Siha/CDDP)中的异常表达可能与肿瘤耐药相关。本研究结果显示,在Siha/CDDP细胞中过表达 miR-217后,EZH2在mRNA水平及蛋白水平的表达均明显下降。这些结果表明miR-217可能通过负调控EZH2而增强Siha/CDDP细胞的顺铂敏感性。
综上所述,miR-217在宫颈癌铂类耐药细胞株Siha/CDDP中低表达,而在Siha/CDDP中上调其表达可部分逆转顺铂耐药性,这可能为宫颈癌耐药的临床前期研究提供新的靶点。此外,miR-217可能通过作用于EZH2 参与宫颈癌顺铂耐药的调控,其具体调控机制尚待进一步研究。
[1] Guo Z,Shu Y,Zhou H,etal.Identification of diagnostic and prognostic biomarkers for cancer: Focusing on genetic variations in microRNA regulatory pathways (Review)[J].Molecular Medicine Reports,2016,13(3):1943-1952.
[2] 卢燕华. miR-217与MAPK1在胃癌中的表达及调控研究[D].南华大学,2015.
[3] 陈新莲,王 和,张雪梅,等.人宫颈癌顺铂耐药细胞系 SiHa/cDDP 的建立[J].四川大学学报: 医学版,2012,43(2):151-155.
[4] Xia H,Ooi LLPJ,Hui KM.MicroRNA-216a/217-induced epithelial-mesenchymal transition targets PTEN and SMAD7 to promote drug resistance and recurrence of liver cancer[J].Hepatology,2013,58(2):629-641.
[5] Guo J,Feng Z,Huang Z,etal.MicroRNA-217 functions as a tumour suppressor gene and correlates with cell resistance to cisplatin in lung cancer[J]. Molecules and Cells,2014,37(9):664-671.
[6] Chen DL,Zhang DS,Lu YX,etal.microRNA-217 inhibits tumor progression and metastasis by downregulating EZH2 and predicts favorable prognosis in gastric cancer[J].Oncotarget,2015,6(13):10868-10879.
[7] Jiang T,Wang Y,Zhou F,etal.Prognostic value of high EZH2 expression in patients with different types of cancer: a systematic review with meta-analysis[J]. Oncotarget,2016,7(4):4584-4597.
[8] Han LC,Chen Y.Targeting EZH2 for cancer therapy: progress and perspective[J].Current Protein & Peptide Science,2015,16(6):559-570.
[9] Volkel P,Dupret B,Le Bourhis X,etal.Diverse involvement of EZH2 in cancer epigenetics[J].American Journal of Translational Research,2015,7(2):175-193.
[10] Cai L,Wang Z,Liu D.Interference with endogenous EZH2 reverses the chemotherapy drug resistance in cervical cancer cells partly by up-regulating Dicer expression[J].Tumour biology,2016,37(5):6359-6369.
(收稿:2017-04-25)
子宫颈肿瘤 顺铂 抗药性,肿瘤 微RNAs 分子药理作用机制
R737.33
A
10.3969/j.issn.1000-7377.2017.10.010
