吡格列酮对链脲佐菌素诱导的糖尿病大鼠骨生物力学性能的影响
2017-11-01邱明才
邸 倩,邱明才,张 鑫,杨 静
(1山西医科大学第一临床医学院内分泌科,太原 030001;2天津医科大学总医院内分泌科)
吡格列酮对链脲佐菌素诱导的糖尿病大鼠骨生物力学性能的影响
邸 倩1,邱明才2,张 鑫2,杨 静1
(1山西医科大学第一临床医学院内分泌科,太原 030001;2天津医科大学总医院内分泌科)
目的 探讨不同剂量吡格列酮(PIO)对链脲佐菌素诱导的糖尿病大鼠股骨和腰椎生物力学性能的影响。 方法 大鼠尾静脉1次注射STZ(45 mg/kg)建立糖尿病大鼠模型,28只造模成功的大鼠被随机分为PIO低剂量组[4 mg/(kg·d)](n=10)、PIO高剂量组[20 mg/(kg·d)](n=10)和模型组(n=8)。10只未造模大鼠为对照组。PIO治疗组每日吡格列酮混悬液灌胃,连续干预16周,股动脉放血法处死大鼠,立即分离右侧股骨行三点弯曲实验、腰椎行压缩实验,检测并分析各组生物力学有关指标。 结果 与对照组相比,模型组及各PIO治疗组股骨最大载荷、弹性载荷、弯曲应力、弯曲能量、弯曲刚性系数、弹性模量、弯曲韧性系数均不同程度减少(P<0.01),最大挠度均不同程度增加(P<0.01);腰椎最大载荷、弹性载荷、比例极限、强度极限、弹性模量、能量吸收均不同程度地减少(P<0.01)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组股骨最大挠度增加,而最大载荷、弹性载荷、弯曲应力、弯曲能量、腰椎最大载荷、弹性载荷、比例极限、弹性模量和能量吸收均减少(P<0.01)。 结论 高剂量PIO[20 mg/(kg·d)]可能造成糖尿病大鼠骨力学性能减低,骨质量减低,低剂量PIO[4 mg/(kg·d)]未引起糖尿病大鼠骨生物力学性改变。
吡格列酮; 链脲佐菌素; 糖尿病; 骨生物力学
噻唑烷二酮类药物(TZDs)主要通过激活过氧化物酶酶体增殖受体(PPAR-γ),增加多种基因编码蛋白的表达,从而提高胰岛素敏感性,降低血糖。吡格列酮是噻唑烷二酮类的主要药物之一。既往研究表明,PPAR-γ可增加骨折的风险[1]。也有研究认为,骨髓干细胞膜上的PPAR-γ被配体激活后可在骨髓微环境中阻断破骨细胞的生成[2]。目前,对于PPAR-γ影响糖尿病大鼠骨代谢和骨转换的机制还不是十分清楚。在之前的文章[3,4]中已经讨论了PIO干预影响糖尿病大鼠骨密度、骨转换及骨形态计量学的状况,发现低剂量PIO干预糖尿病大鼠骨密度,骨计量均无影响,高剂量PIO干预可使糖尿病大鼠骨密度减低[3],骨量减少,可能通过使糖尿病大鼠骨形成速率减低的途径[4]。本研究将进一步探讨不同剂量PIO干预对糖尿病大鼠股骨和腰椎生物力学性能的影响。
1 材料与方法
1.1 实验动物
8周龄雄性SD大鼠38只,清洁级,体质量240 g±13 g,由军事医学科学院卫生学环境医学研究所实验动物中心提供。实验动物质量合格证编号:SGCK(京)2008-0001。标准颗粒饲料喂养,自然照明,室内室温20-25 ℃,相对湿度40%-70%。实验期间动物自由采食和饮水。
1.2 主要试剂和仪器
链脲佐菌素(美国Sigma公司)、微量血糖试纸(罗氏诊断有限公司)、PIO(北京太洋有限公司)、ACCT-CHECK Active血糖仪(罗氏诊断有限公司)、ELF 3200力学实验机(美国BOSE公司)。
1.3 糖尿病大鼠模型建立与PIO治疗
28只造模成功的大鼠被随机分为PIO低剂量组[4 mg/(kg·d)](n=10)、PIO高剂量组[20 mg/(kg·d)](n=10)和模型组(n=8)。10只未造模大鼠为对照组。造模前夜,大鼠自由进食饮水。造模方法为将大鼠置于鼠盒,尾静脉1次注射STZ 45 mg/kg。给药72 h和7 d分别测定大鼠尾静脉血糖,两次测定血糖均大于16.7 mmol/L判定为糖尿病造模成功。尾静脉注射STZ大鼠糖尿病成模率为96.4%,全部动物于成模后干预16周,股动脉放血处死。干预期间未应用吡格列酮之外的降糖药物。干预方法为每日上午9时给药,吡格列酮混悬液灌胃服用。干预期间无因血糖原因死亡大鼠。
1.4 动物处死和获取标本

1.5 股骨三点弯曲实验
将股骨标本缓慢解冻,保持其湿度,自由放置在ELF 3200力学实验机支架上,曲面向下,使股骨中点、两支点中心与加载点重合,匀速加载至标本断裂,描记出载荷-变形(挠度)曲线(Load-Deformaion Curve)。测试温度23 ℃,实验机载荷测量精度0.01 N,位移(挠度)测量精度0.001 mm,支座跨距20 mm,压头直径近似为1.5 mm,加载速度5 mm/min,选用200 N以内的小载荷量程。用游标卡尺测量断骨内径和壁厚,记录并分析实验数据。
测试指标:最大载荷(maximal loading,ML)(N),弹性载荷(elastic loading,EL)(N),最大挠度(break deflection,BD)(mm),弯曲能量(bending energy,BE)(N.mm)。最大弯曲应力(maximal bending stress,MBS)(N/mm2),弯曲弹性模量(modulus of bending elasticity,MBE)(GPa),弯曲刚性系数(coefficient of bending stiffness,CBS)(N·mm2),弯曲韧性系数(coefficient of bending ductility,CBD)(mm/N)。
1.6 腰椎压缩实验
将椎体上下端磨平,修整为高度4-6 mm,具有两个平行平面的类圆柱体。用螺旋测微仪测量椎体的高度,显微镜下计算椎骨横截面积。将湿润的腰椎标本置于ELF 3200力学实验机上,加载速度为2 mm/min,记录实验数据,绘制载荷-变形曲线,其他测试条件同股骨三点弯曲实验。
测试指标:最大载荷(ML)(N),弹性载荷(EL)(N),强度极限(maximal stress,MS)(N/mm2),比例极限(elastic stress,ES)(N/mm2),弹性模量(elastic modulus,EM)(Gpa),能量吸收(energy absorbability,EA)(N·mm)
1.7 统计学分析
2 结果
2.1 大鼠股骨三点弯曲实验数据比较
与对照组相比,STZ诱导的糖尿病大鼠模型组及各PIO治疗组股骨最大载荷、弹性载荷、弹性模量、弯曲应力、弯曲能量、弯曲韧性系数、弯曲刚性系数均不同程度地减少,最大挠度均不同程度地增加(均P<0.01,见表1)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组股骨最大载荷、弹性载荷、弯曲应力、弯曲能量减少(P<0.01),最大挠度增加(P<0.01)。而两组间弹性模量、弯曲韧性系数,弯曲刚性系数无显著性差异。与低剂量组相比,高剂量组股骨最大载荷、弹性载荷、弯曲能量减少(均P<0.01),弯曲应力减少(P<0.05),而最大挠度、弹性模量、弯曲刚性系数、弯曲韧性系数无统计学差异(见表1)。
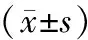
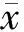
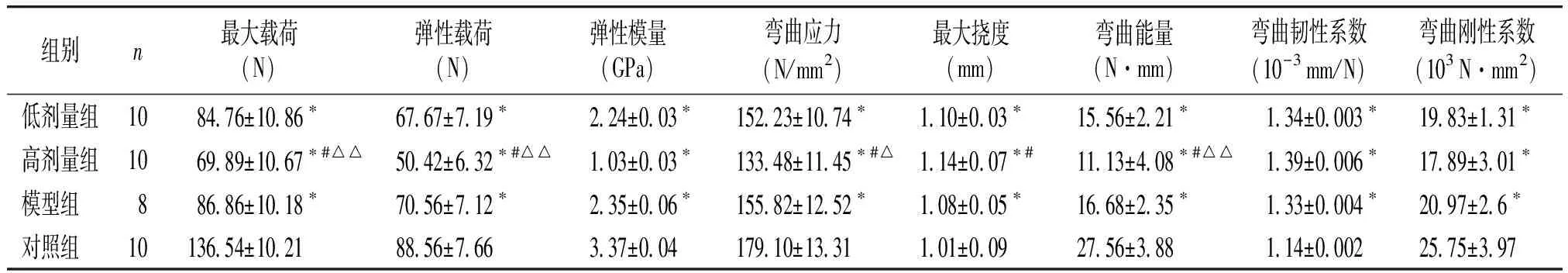
组别n最大载荷(N)弹性载荷(N)弹性模量(GPa)弯曲应力(N/mm2)最大挠度(mm)弯曲能量(N·mm)弯曲韧性系数(10-3mm/N)弯曲刚性系数(103N·mm2)低剂量组108476±1086∗6767±719∗ 224±003∗15223±1074∗ 110±003∗1556±221∗ 134±0003∗1983±131∗高剂量组106989±1067∗#△△5042±632∗#△△ 103±003∗13348±1145∗#△ 114±007∗#1113±408∗#△△ 139±0006∗1789±301∗模型组 88686±1018∗7056±712∗ 235±006∗15582±1252∗ 108±005∗1668±235∗ 133±0004∗2097±26∗对照组 1013654±10218856±766 337±00417910±1331 101±0092756±388 114±00022575±397
与对照组相比,*P<0.01;与模型组相比,#P<0.01;与低剂量组相比,△P<0.05,△△P<0.01
2.2 各组大鼠腰椎压缩实验数据比较
与对照组相比,STZ诱导的糖尿病大鼠模型组及各PIO治疗组最大载荷、弹性载荷、比例极限、强度极限、弹性模量、能量吸收均不同程度地减少(均P<0.01,见表2)。与模型组相比,低剂量组各参数均差异无统计学意义,高剂量组最大载荷、弹性载荷、比例极限、弹性模量、能量吸收减少(均P<0.01),强度极限无显著性差异。与低剂量组相比,高剂量组最大载荷、弹性载荷、比例极限、能量吸收减少(均P<0.01),而强度极限和弹性模量无统计学差异(见表2)。
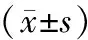
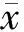
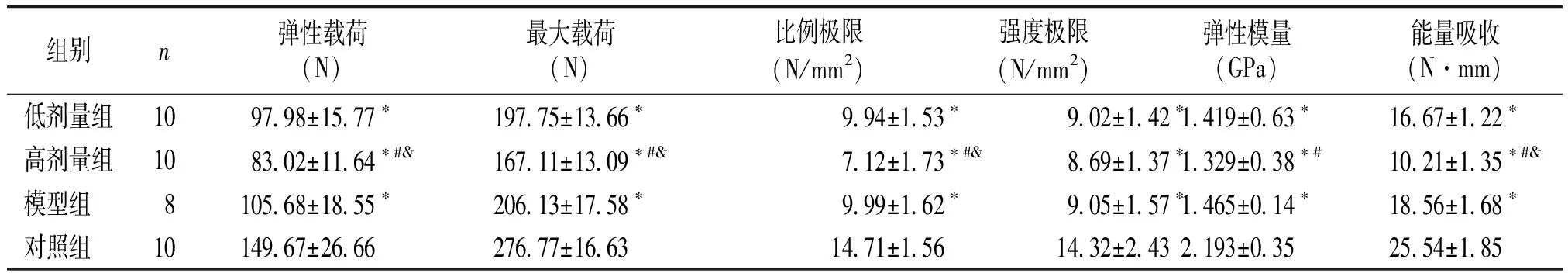
组别n弹性载荷(N)最大载荷(N)比例极限(N/mm2)强度极限(N/mm2)弹性模量(GPa)能量吸收(N·mm)低剂量组109798±1577∗19775±1366∗994±153∗902±142∗1419±063∗1667±122∗高剂量组108302±1164∗#&16711±1309∗#&712±173∗#&869±137∗1329±038∗#1021±135∗#&模型组 810568±1855∗20613±1758∗999±162∗905±157∗1465±014∗1856±168∗对照组 1014967±266627677±16631471±1561432±2432193±0352554±185
与对照组相比,*P<0.01;与模型组相比,#P<0.01;与低剂量组相比,&P<0.01
3 讨论
骨生物力学是骨量和骨结构的综合反映[5-7],直接反映骨组织的抗骨折能力。对骨质量进行准确评估以及骨质疏松骨折危险度准确预测是非常必要的。大量动物实验和临床研究结果表明单纯骨量增加,骨质量不一定相应增加,有时反而下降[8],仅仅依靠骨密度检查不能全面地反映骨代谢的情况,骨的生物力学性能是反映骨质量的重要指标。各种力学测试中,长骨三点弯曲实验及椎体压缩试验最为常用。
三点弯曲实验测定包括结构力学、材料力学和骨骼刚度等三项指标。结构力学指标包括最大载荷、弹性载荷、最大挠度和弯曲能量,主要反映骨的结构力学特征的变化[9,10]。材料力学指标包括最大弯曲应力、弯曲弹性模量。弹性模量反映骨质的内在硬度。骨骼的刚度以弯曲刚性系数和韧性系数来表示,在单位面积不变时,刚性系数越大,单位面积骨所承受载荷的能力越大,韧性系数越大说明骨的韧性越好。本实验指标表明,与模型组相比,高剂量组最大载荷减少,弹性载荷减少,弯曲能量减少,最大挠度增加;低剂量组各参数均无显著性差异。提示高剂量组大鼠股骨微结构破坏,骨强度下降;低剂量吡格列酮干预对糖尿病大鼠力学性能无显著影响。与前述关于大鼠骨密度、骨形态学参数的变化一致[3,4]。
骨组织受外力作用后其载荷-变形曲线分为弹性变形阶段和塑形变形阶段,在弹性变形阶段,变形随载荷增加而呈线性增加,如去除外力,变形的骨组织可恢复到初始状态。塑形变形阶段,载荷与变形失去线性关系,骨组织结构破坏发生永久变形直至骨折。即使去除外力也不能恢复到初始状态。两者交界处为屈服点,弹性弯曲应力和最大弯曲应力反映的是单位面积骨组织在弹性变形阶段和塑形变形阶段所承受的最大载荷,反映了骨组织抵抗外力变形和抗骨折的能力。与模型组相比,高剂量组股骨弯曲应力减少,低剂量组无显著性差异。提示高剂量组抗变形能力和大鼠股骨抗骨折能力减低。压缩实验测定最大载荷直接反映松质骨骨小梁的骨质、结构的连续性和皮质骨的强度、骨的横截面积的大小等,是对骨质量的综合反映[11]。与模型组相比,高剂量组最大载荷减少,弹性载荷减少,提示高剂量组大鼠腰椎松质骨量丢失。腰椎以松质骨为主,受外力作用断裂前的应变量减小,易发生压缩骨折。弹性模量是反映骨材料力学特性的重要参数,与骨的微结构和构成成分密切相关。与模型组相比,高剂量组弹性模量减少,也提示其对于大鼠骨力学性质的消极作用。综合众多测试指标的结果可以看出,高剂量组与模型组相比,大鼠骨组织骨力学性能减低,骨质量减低,抗压性能减低。而低剂量组干预无明显影响。与近期部分国外研究结果一致[12,13]。
总之,上述结果提示,吡格列酮可能减低骨量,减低骨力学性能,宜小剂量使用。骨的空间微结构破坏如骨小梁变细,断裂和骨构成成分变化如骨盐丢失,骨胶原性能下降都是导致骨力学性能下降的重要因素。在治疗中,不仅要注意提高骨矿含量,而且要重视提高骨的力学性能。
[1] Choi HJ,Park C,Lee YK,etal.Risk of fractures and diabetes medications: a nationwide cohort study[J].Osteoporos Int,2016,27(9):2709-2024.
[2] Christie MR,Molvig J,Hawkes CJ,etal.IA-2 antibody-negative status predicts remission and recovery of C-peptide levels in type 1 diabetic patients treated with cyclosporin[J].Diabetes Care,2002,25(7):1192-1197.
[3] 邸倩,邱明才,张鑫,等.吡格列酮对链脲佐菌素诱导的糖尿病大鼠 骨代谢指标及骨密度的影响[J].山西医科大学学报,2015,46(9):870-873.
[4] 邸倩,邱明才,张鑫,等.吡格列酮对链脲佐菌素诱导的糖尿病大鼠 骨形态计量学的影响[J].山西医科大学学报,2016,47(10):901-904.
[5] Oftadeh R, Perez-Viloria M, Villa-Camacho JC,etal. Biomechanics and mechanobiology of trabecular bone: a review [J]. J Biomech Eng, 2015, 137(1): 010802-1-010802-15.
[6] Chapman VM, Albright M, Grottkau BE,etal. Multidetector computed tomography of fracture-separation of the distal humeral epiphysis[J].J Comput Assist Tom-ogr,2005,29(3):336-338.
[7] Oh CW,Park BC,Ihn JC,etal.Fracture separation of the distal humeral epiphysis in children younger than three years old[J].J Pediatr Orthop,2000,20(2):173-176.
[8] Thurner PJ, Chen CG, Ionova-Martin S,etal. Osteopontin deficiency increases bone fragility but preserves bone mass [J]. Bone, 2010, 46(6):1564-1573.
[9] Jungmann R, Szabo ME, Schitter G,etal. Local strain and damage mapping in single trabeculae during three-point bending tests[J].J Mech Behav Biomed Mater,2011,4(4): 523-534.
[10] Fleischli JG, Laughlin TJ, Athanasiou K,etal.Effect of diabetes mellitus on the material properties of the distal tibia[J].J Am Podiatr Med Assoc, 2006,96(2):91-95.
[11] Lacey DL,Timms E,Tan HL,etal.Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation[J].Cell,1998, 93(2):165-176.
[12] Tsirella E1,Mavrakanas T,Rager O,etal.Low dose pioglitazone does not affect bone formation and resorption markers or bone mineral density in streptozocin-induced diabetic rats[J].J Physiol Pharmacol, 2012,63(2):201-204.
[13] Syversen U,Stunes AK,Gustafsson BI,etal.Different skeletal effects of the peroxisome proliferator activated receptor (PPAR) alpha agonist fenofibrate and the PPARgamma agonist pioglitazone[J].BMC Endocr Disord,2009,9(6):10.
EffectsofpioglitazoneonbonebiomechanicalcharacteristicsinSTZ-induceddiabeticrats
DI Qian1,QIU Mingcai2,ZHANG Xin2,YANG Jing1
(1DepartmentofEndocrinology,FirstClinicalMedicalCollege,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofEndocrinology,GeneralHospitalofTianiinMedicalUniversity)
ObjectiveTo explore the effect of pioglitazone on bone biomechanical characteristics in streptozocin(STZ)-induced diabetic rats.MethodsThe diabetes mellitus(DM) rat models were established by intravenous injection of STZ(45 mg/kg) and then were randomly divided into low-dose group[4 mg/(kg·d)](n=10), high-dose group[20 mg/(kg·d)](n=10) and model group(n=8).Another 10 normal rats were chosen as control group. The rats in pioglitazone(PIO) groups were gavaged with PIO liquid every day for 16 weeks. Then the rats were killed, and the right femora were taken immediately for the three-point bending test and the lumbar vertebrae were taken for the compression test.ResultsCompared with control group, the femora maximal loading(ML), elastic loading(EL), maximal bending stress(MBS), bending energy(BE), coefficient of bending stiffness(CBS), modulus of bending elasticity(MBE), coefficient of bending ductility(CBD) all decreased(P<0.01),while break deflection(BD) increased(P<0.01), the lumbar vertebrae maximal loading(ML), elastic loading(EL), elastic stress(ES), maximal stress(MS), elastic modulus(EM), energy absorbability(EA) all decreased in the other groups(P<0.01). Compared with model group, all indexes showed no significant change in low-dose group, while the femora BD increased in high-dose group, but femora ML, EL, MBS, BE, and lumar vertebrae ML,EL,ES,EM,EA all decreased(P<0.01).ConclusionThe low-dose PIO may have no effect on bone biomechanics in diabetic rats, while high-dose PIO may reduce the biomechanics and decrease the bone quality.
pioglitazone; streptozocin; diabetes; bone biomechanics
R587.1
A
1007-6611(2017)09-0926-04
10.13753/j.issn.1007-6611.2017.09.013
邸倩,女,1975-08生,博士,副主任医师,E-mail:diqian2008@126.com
2017-04-24
