供体骨髓细胞在放射损伤肠道中的迁移定植和促修复作用研究
2017-11-01刘登群王锋超王军平史春梦冉新泽粟永萍
刘登群, 王锋超, 王军平, 史春梦, 李 蓉, 冉新泽, 粟永萍
第三军医大学军事预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆 400038
其他论著
供体骨髓细胞在放射损伤肠道中的迁移定植和促修复作用研究
刘登群, 王锋超, 王军平, 史春梦, 李 蓉, 冉新泽, 粟永萍
第三军医大学军事预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆 400038
目的研究供体骨髓细胞(donor bone marrow cells,dBMCs)在全身放射损伤小鼠肠道内的迁移定植规律和对肠道放射损伤的促修复作用。方法将60只6~8周龄C57BL/6小鼠进行10 Gy全身照射后随机分为移植组和对照组。比较两组小鼠的存活率,免疫组化分析dBMCs在骨髓和肠道内的定植规律,免疫荧光双染鉴定早期植入肠道内的dBMCs表型。HE染色和Brdu免疫组化分析dBMCs对放射损伤肠道的促修复作用。结果实验后第14天,移植组小鼠的存活率为95%。dBMCs同时向受体骨髓和肠道迁移定植。移植早期dBMCs首先定植于肠道固有层底部并向上迁移,最终填充全部固有层。早期植入的骨髓细胞中含有Sca-1阳性造血干细胞。dBMCs可缓解放射所致肠黏膜固有层水肿,促进肠道干细胞增殖并增加肠隐窝密度。移植早期dBMCs不形成肠上皮细胞,稳定嵌合后可形成骨髓来源肠上皮细胞。结论dBMCs在移植后早期即向肠道迁移定植并促进放射所致肠道损伤的修复重建过程。
放射损伤;肠道;骨髓移植;干细胞
肠道上皮是机体吸收营养物质和隔离肠道致病菌的重要屏障,同时肠上皮是机体内更新最快的组织之一,肠上皮的快速更新有赖于肠道干细胞及其微环境细胞的共同作用[1-2]。肠道是电离辐射敏感脏器之一,大剂量电离辐射暴露可导致肠道干细胞和固有层微环境细胞同时受到损伤从而破坏肠上皮屏障[3]。目前骨髓移植是救治大剂量放射损伤患者的有效手段。以往国内外都曾报道过供体骨髓细胞(donor bone marrow cells,dBMCs)能够参与肠上皮更新[4-6],但移植后早期骨髓细胞在肠道内的迁移规律,特别是早期定植细胞的特性及其对肠道放射损伤修复的影响尚未完全阐明,因此,本文中我们对移植早期dBMCs在放射损伤肠道内的迁移特点和促修复作用进行了研究。
1 材料与方法
1.1实验动物与试剂正常C57BL/6小鼠购自第三军医大学实验动物中心,EGFP转基因小鼠购自南京大学模式动物研究所,所用动物均饲养于SPF环境中,6~8周龄。DMEM/F12培养基购自Hyclone公司,一次性70 μm孔径细胞筛购自BD公司。兔和小鼠来源GFP抗体购自碧云天公司,大鼠抗CD45、Sca-1和小鼠抗Brdu抗体为Biolegend公司产品,兔抗Ki67抗体购自Thermofisher公司,小鼠抗PCK抗体购自武汉博士德公司。封闭用正常山羊血清和HRP免疫组化试剂盒购自北京中杉公司,Alex Fluor 488和594荧光二抗购自Molecular Probes公司。
1.2dBMCs分离与制备颈椎脱臼法处死EGFP转基因小鼠并浸入750 g/L酒精浸泡消毒3 min,无菌条件下分离其股骨和胫骨。用眼科剪和眼科镊剔除肌肉剪开骨髓腔,使用1 ml 一次性注射器吸取DMEM/F12培养基于冰浴中反复冲洗骨髓腔。用1 ml移液器反复吹打含骨髓细胞的培养基以形成单细胞悬液。细胞悬液经70 μm细胞筛过滤后1 500 r/min离心3 min并去除上清,加入红细胞裂解液作用1 min,加入5倍体积培养基终止裂解,离心弃上清后加入培养基重悬细胞。计数并调整细胞悬液体积使骨髓单个核细胞浓度达到5×107ml-1。制备好的单细胞悬液置于冰浴中备用。
1.3动物照射及细胞移植60只正常C57BL/6小鼠作为骨髓移植受体在实验前1周开始饮用含320 g/L庆大霉素和280 g/L红霉素的灭菌水进行肠道消毒。实验时使用第三军医大学辐照研究中心60Co放射源对小鼠进行γ射线全身照射,照射过程中使用PTW UNIDOS(德国)监测照射剂量率和照射剂量,总照射剂量为10 Gy。照射后小鼠随机分组,30只作为对照组,30只作为移植组。移植组小鼠经尾静脉移植0.2 ml含EGFP转基因小鼠骨髓单个核细胞的细胞悬液,所接受的骨髓单个核细胞总量为1×107,对照组小鼠经尾静脉注射同等体积的空培养基。
1.4动物取材及组织染色分别在移植后第1天、第3天、第5天、第7天、第90天取材移植组和对照组小鼠的股骨和小肠组织标本,取材前90 min腹腔注射Brdu,使用40 g/L中性甲醛固定过夜后进行常规病理包埋并切片。4 μm石蜡切片经二甲苯和梯度酒精脱蜡至水后分别进行HE染色和免疫组化染色。免疫组化染色切片使用0.01 mol/L枸橼酸缓冲液(pH=6.0)进行热修复 20 min,自然冷却后使用PBS冲洗5 min,滴加30 g/L过氧化氢阻断内源性过氧化物酶,正常山羊血清封闭30 min,加入兔抗GFP抗体(1∶200稀释)或小鼠抗Brdu抗体(1∶200稀释)4 ℃孵育过夜,后续染色按照试剂盒操作说明进行。免疫荧光双染时,使用对应的GFP抗体和相应一抗共同孵育过夜,充分漂洗后加入相应荧光二抗并复染DAPI封片。使用Olympus BX51或LCS SP5共聚焦显微镜进行图像采集,使用Image J进行图像分析。
1.5统计学分析采用SPSS 16.0软件进行统计学分析,两组之间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1移植骨髓细胞可促进10Gy全身放射损伤小鼠存活全部小鼠在受到全身照射后均出现活动减少、精神萎靡、食欲下降及脱毛等急性放射损伤表现,实验后第3~5天开始出现腹泻、血便等肠道放射损伤症状,体质量较照射前明显下降。对照组小鼠整体损伤不断加重,移植组小鼠自第5天起逐渐好转。实验后第14天,对照组小鼠存活率仅为10%,移植组小鼠存活率为95%。
2.2dBMCs在重建造血的同时即开始参与肠道重建成年小鼠骨髓组织对γ射线损伤高度敏感,10 Gy照射后第3天可见对照组小鼠骨髓腔有核细胞较正常对照显著减少,骨髓腔严重空虚(见图1E~1F)。移植组小鼠骨髓腔内可见输注的EGFP转基因小鼠dBMCs在实验后第1~7天内数量逐渐增加(见图1A~1D),提示dBMCs促进受照小鼠骨髓造血功能重建。成年小鼠肠道同样是电离辐射的敏感脏器。实验中GFP阳性dBMCs自移植后第3天即进入移植受体小鼠的肠道固有层,并逐渐向上迁移进而填充整个固有层,最终肠黏膜固有层细胞几乎全部被GFP阳性dBMCs替换(见图2)。全身放射损伤后dBMCs同时参与骨髓造血功能重建和肠道放射损伤修复,两者不存在先后顺序,而是同步进行。
2.3骨髓造血干细胞可在移植后早期植入肠道固有层移植后第3天肠道固有层内存在GFP+/CD45-细胞(见图3,GFP与CD45叠加图中箭头所指),提示早期植入细胞并非全部为成熟血细胞。进一步染色发现,早期植入细胞中存在少量GFP+/Sca-1+细胞(见图3,GFP与Sca-1叠加图中箭头所指)和GFP+/Ki67+增殖性细胞(见图3,GFP与Ki67叠加图中箭头所指)。由于Sca-1是小鼠造血干细胞标志之一,因此本部分结果证实,移植后早期骨髓造血干细胞可定植于肠道固有层,并参与肠道放射损伤修复。
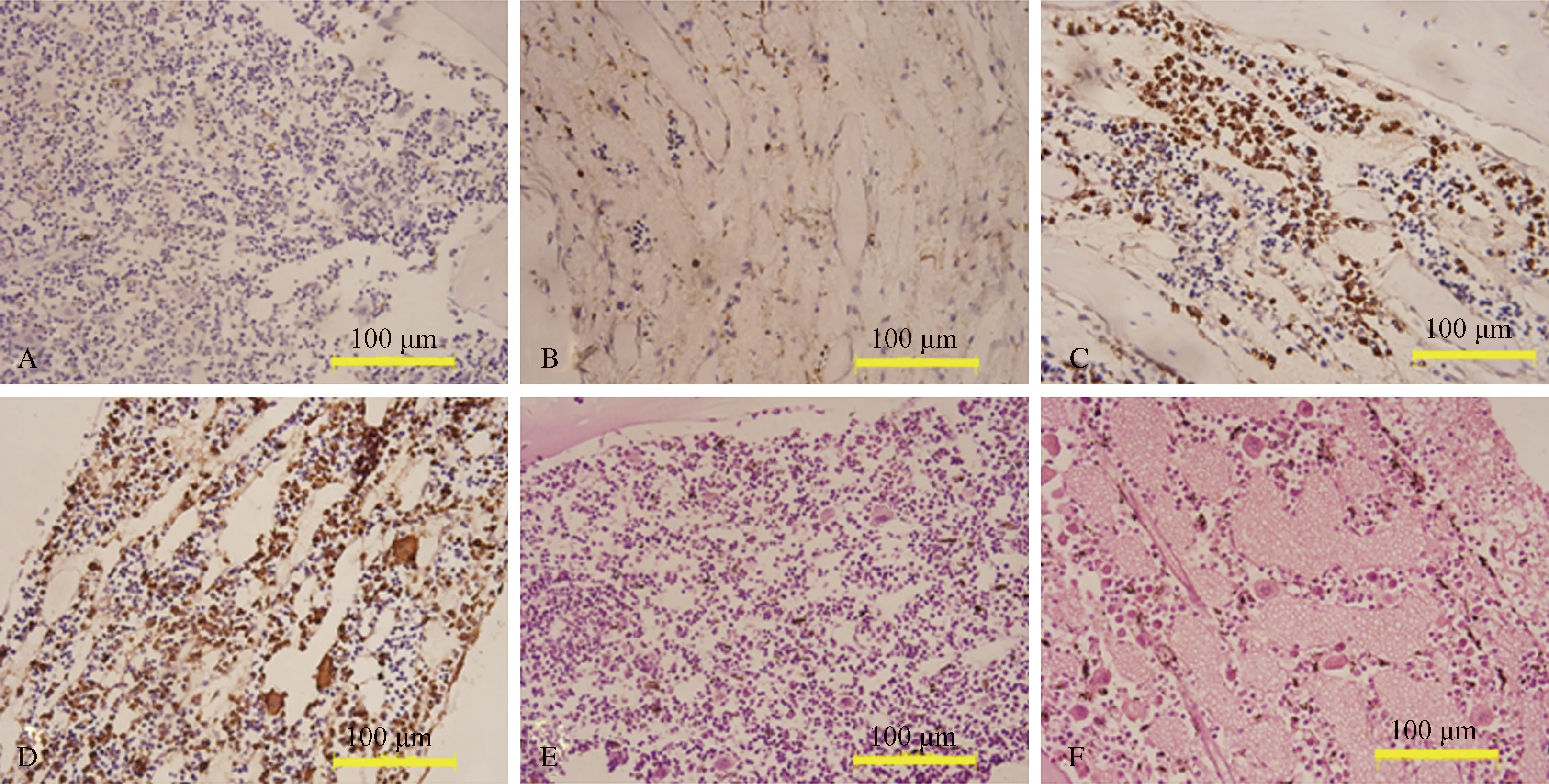
图1GFP阳性dBMCs在受体骨髓中的动态分布A~D: 移植后第1天、第3天、第5天、第7天骨髓中GFP阳性细胞分布;E: 正常小鼠骨髓HE染色;F: 照射后第3天骨髓HE染色
Fig1DynamicdistributionofGFP+dBMCsinrecipientbonemarrowA-D: GFP+cells in bone marrow on the 1st, 3rd, 5th, 7th day after transplantation; E: bone marrow HE image of normal mice; F: bone marrow HE staining on the 3rd day after radiation
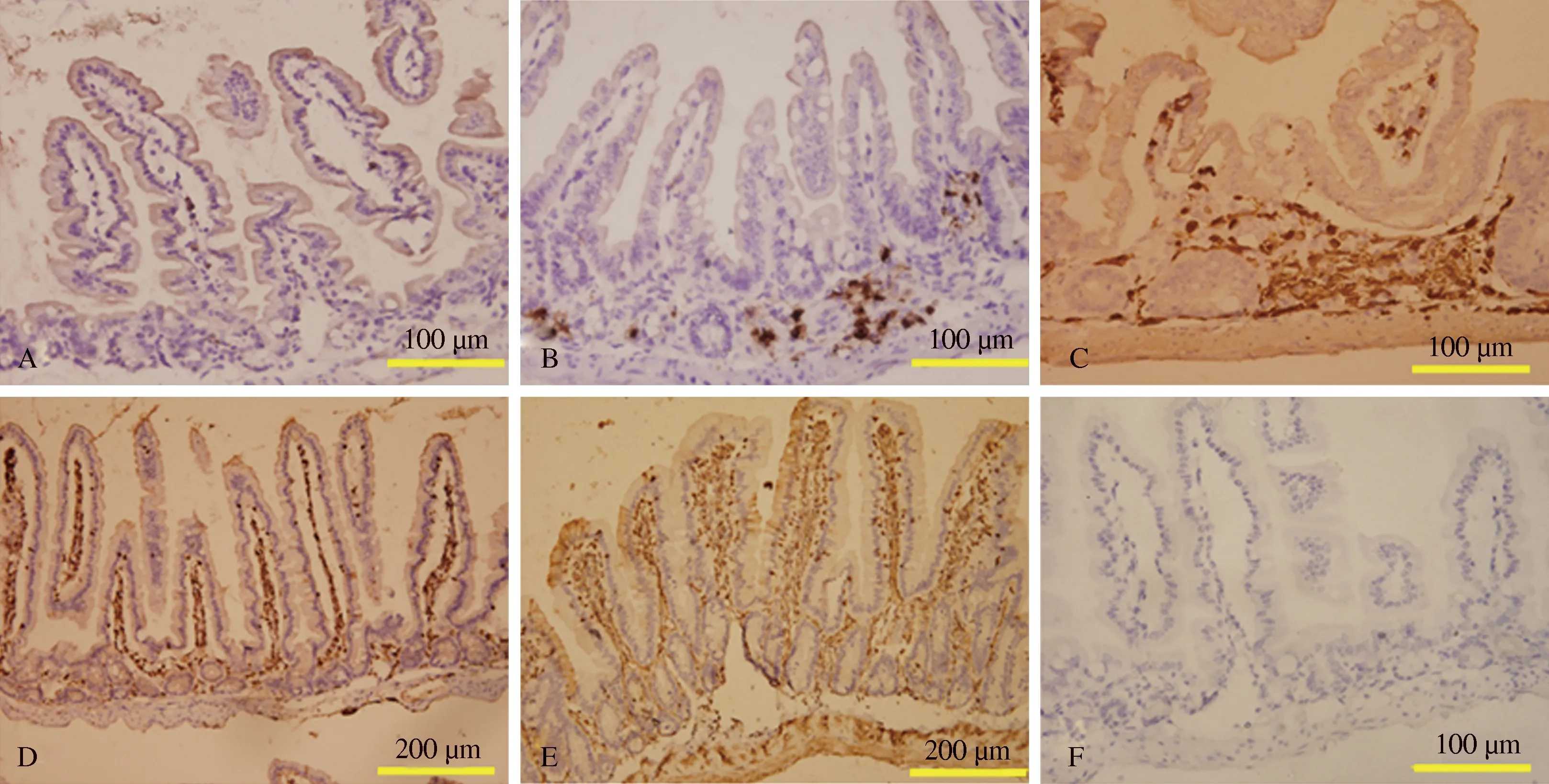
图2GFP阳性dBMCs在受体肠道内的迁移及动态分布A~D: 移植后第1天、第3天、第7天、第30天肠道中GFP阳性细胞分布;E: 正常EGFP小鼠肠道GFP免疫组化染色;F: 正常C57BL/6小鼠肠道GFP免疫组化染色
Fig2MigrationanddynamicdistributionofGFP+dBMCsinsmallintestineofrecipientmiceA-D: GFP+dBMCs in small intestine on the 1st, 3rd, 7th, 30th day after transplantation; E: GFD staining on normal intestine of EGFP mice; F: GFP staining on small intestine of normal C57BL/6 mice
2.4早期植入的dBMCs促进肠道放射损伤修复HE染色显示,移植组与对照组小鼠第3天移植组小鼠肠黏膜绒毛隐窝结构单元更加完整,黏膜层更厚,固有层水肿较对照组轻(见图4),进一步定量分析结果证实,实验后第3天移植组小肠隐窝密度显著高于对照组[(18.5±1.3)/mmvs(11.9±2.9)/mm,P=0.0241]。Brdu掺入可用于标记处于S期的增殖细胞,免疫组化染色可见移植组小肠隐窝底部Brdu阳性肠道干细胞较对照组明显增多(见图5)。本部分结果证实早期植入的dBMCs可显著促进放射损伤肠道的再生修复过程。
2.5肠道内定植的dBMCs可分化形成肠上皮细胞移植后早期dBMCs主要定植于肠道固有层内,未见到其直接形成肠隐窝或肠绒毛内的上皮细胞。在实验后3个月可在移植组小鼠肠上皮当中检测到GFP和广谱细胞角蛋白(PCK)双阳性肠上皮细胞(见图6)。
3 讨论
肠黏膜上皮结构的完整性是肠道消化吸收功能和黏膜屏障功能的重要组织学基础,肠道上皮细胞3~5 d就会全部更新1次。正是由于Lgr5+肠道干细胞和瞬时扩增细胞始终处于快速增殖和分裂状态,所以肠道对电离辐射等致伤因素高度敏感。大剂量电离辐射暴露可抑制肠上皮干细胞增殖并加速成熟肠上皮细胞凋亡,造成肠黏膜机械屏障缺失,同时射线可抑制肠道免疫细胞功能。上述损伤效应可造成大量体液经肠道丢失,同时引起肠道菌群移位,加重放射损伤后内源性感染的发生。因此,肠道结构和功能重建对于严重放射损伤患者的救治具有重要意义。
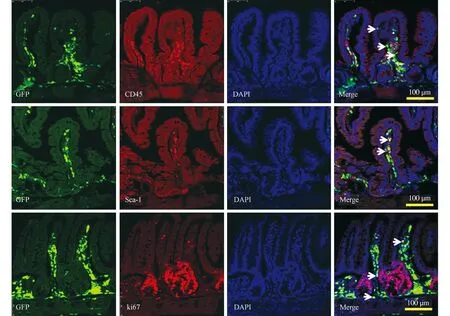
图3 移植后第3天定植于肠道内的GFP阳性dBMCs表型分析
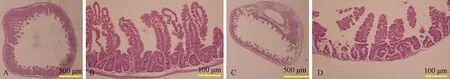
图4实验后第3天移植组与对照组小鼠小肠HE染色A~B: 移植组; C~D: 对照组
Fig4HEstainingimagesofsmallintestinebetweentransplantationgroupandcontrolgrouponthe3rddayafterexperimentA-B: BMT group; C-D: control group

注:C和D分别为A、B红色区域的放大图像,C中蓝色箭头所示为肠隐窝底部Brdu阳性细胞。
图5实验后第3天移植组与对照组小肠Brdu免疫组化染色A: 移植组; B: 对照组
Fig5SmallintestineBrduIHCimagesoftransplantationgroupandcontrolgrouponthe3rddayafterexperimentA: BMT group; B: control group
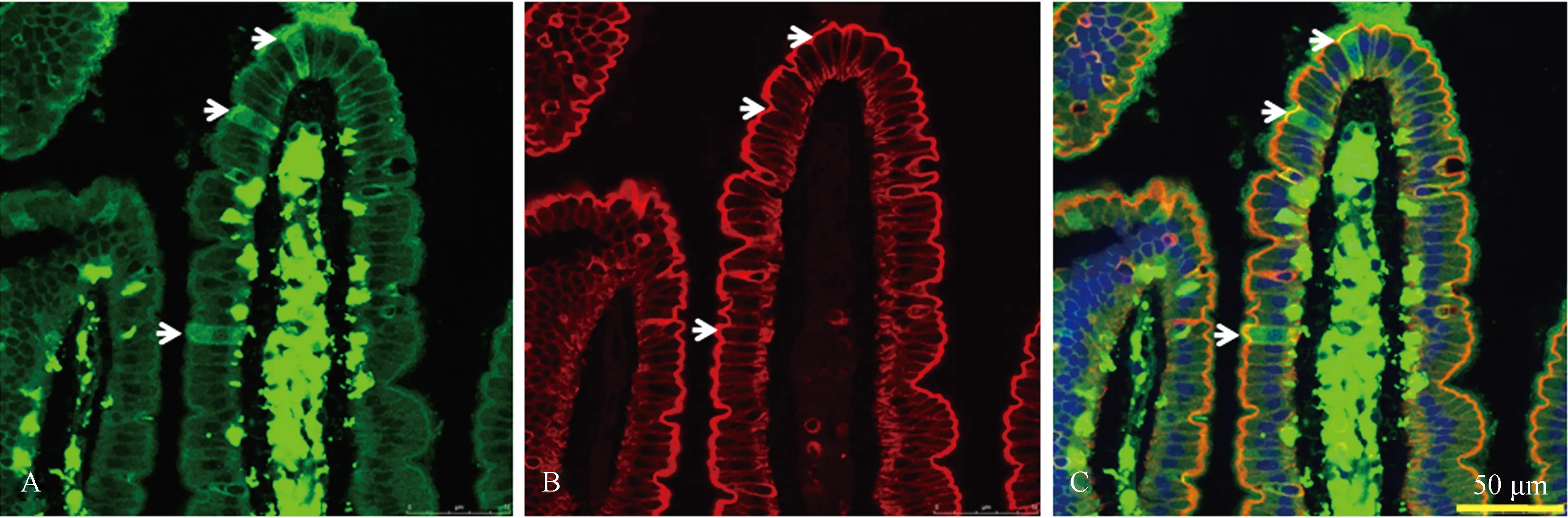
图6 dBMCs可分化为肠上皮细胞 A: GFP, Alex Fluor 488; B: PCK, Alex Fluor 594; C: merge
肠道内间质细胞(如巨噬细胞、肌成纤维细胞、浆细胞)主要来源于骨髓细胞[7-8],这些间质细胞共同组成了维持肠上皮干细胞稳态的微环境。Okamoto等[9]最早报道了骨髓移植后供体细胞对肠上皮的修复重建作用。以往研究dBMCs在肠上皮稳态维持中的作用时主要观察点都在移植稳定之后,而移植后早期dBMCs在肠道内的迁移特点未见相关报道[4,6,9]。明确移植后早期供体细胞在肠道内的迁移和分布特点是深入认识其对肠道放射损伤修复作用的基础。本研究发现,对电离辐射高度敏感的骨髓和肠道中,dBMCs在输注到受体外周血之后可同时向骨髓和肠道内定植,从而加速造血重建和促进肠黏膜屏障修复。植入的dBMCs有助于肠道屏障功能的快速恢复,从而减少体液丢失和内源性感染的发生,极大提高了受照小鼠的存活率。
本研究中我们注意到,dBMCs进入肠道固有层后首先定植于固有层底部环绕肠隐窝周围。dBMCs当中所包含的大量成熟细胞可直接发挥其分泌作用,这有利于重建正常的肠道干细胞微环境,例如dBMCs中的巨噬细胞可通过分泌Wnt5a、Wnt5b、Wnt6和Wnt9a为Lgr5+肠道干细胞提供微环境信号[10]。以往多个研究报道了移植骨髓间充质干细胞可促进缺血再灌注和放射所致肠道损伤的再生修复过程[11-13]。本研究中我们发现,dBMCs中所包含的Sca-1+造血干细胞和Ki67+的增殖性细胞在移植后早期可迁移到受照肠道内,由于造血干细胞可分化形成多种肠道内多种间质细胞,因此,我们认为植入的造血干细胞有利于促进肠道放射损伤修复,而增殖性dBMCs可能通过快速增加正常间质细胞的数量促进修复过程。
值得注意的是,虽然我们和其他研究都报道过dBMCs可通过形成肠上皮细胞参与肠上皮再生和稳态维持[6,14],但本研究中我们在移植后早期并未观察到直接定植于肠隐窝或肠绒毛内的GFP阳性dBMCs,提示dBMCs在早期主要通过重建肠上皮干细胞微环境来发挥其促修复作用。
综上所述,本文的研究结果丰富了我们对dBMCs参与放射损伤肠道再生具体过程的认识,为大剂量放射损伤患者的临床救治进一步提供了研究基础。
[1] Smith NR, Davies PS, Silk AD, et al. Epithelial and mesenchymal contribution to the niche: a safeguard for intestinal stem cell homeostasis [J]. Gastroenterology, 2012, 143(6): 1426-1430.
[2] Bjerknes M, Cheng H. Intestinal epithelial stem cells and progenitors [J]. Methods Enzymol, 2006, 419: 337-383.
[3] Leibowitz BJ, Wei L, Zhang L, et al. Ionizing irradiation induces acute haematopoietic syndrome and gastrointestinal syndrome independently in mice [J]. Nat Commun, 2014, 5: 3494.
[4] de Jong JH, Rodermond HM, Zimberlin CD, et al. Fusion of intestinal epithelial cells with bone marrow derived cells is dispensable for tissue homeostasis [J]. Sci Rep, 2012, 2: 271.
[5] Brittan M, Hunt T, Jeffery R, et al. Bone marrow derivation of pericryptal myofibroblasts in the mouse and human small intestine and colon [J]. Gut, 2002, 50(6): 752-757.
[6] Liu D, Wang F, Zou Z, et al. Long-term repopulation effects of donor BMDCs on intestinal epithelium [J]. Dig Dis Sci, 2010, 55(8): 2182-2193.
[7] Roulis M, Flavell RA. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease [J]. Differentiation, 2016, 92(3): 116-131.
[8] Varol C, Mildner A, Jung S. Macrophages: development and tissue specialization [J]. Annu Rev Immunol, 2015, 33: 643-675.
[9] Okamoto R, Yajima T, Yamazaki M, et al. Damaged epithelia regenerated by bone marrow-derived cells in the human gastrointestinal tract [J]. Nat Med, 2002, 8(9): 1011-1017.
[10] Saha S, Aranda E, Hayakawa Y, et al. Macrophage-derived extracellular vesicle-packaged WNTs rescue intestinal stem cells and enhance survival after radiation injury [J]. Nat Commun, 2016, 7: 13096.
[11] Jiang H, Qu L, Dou R, et al. Potential role of mesenchymal stem cells in alleviating intestinal ischemia/reperfusion impairment [J]. PLoS One, 2013, 8(9): e74468.
[12] Gong W, Guo M, Han Z, et al. Mesenchymal stem cells stimulate intestinal stem cells to repair radiation-induced intestinal injury [J]. Cell Death Dis, 2016, 7(9): e2387.
[13] Sémont A, Demarquay C, Bessout R, et al. Mesenchymal stem cell therapy stimulates endogenous host progenitor cells to improve colonic epithelial regeneration [J]. PLoS One, 2013, 8(7): e70170.
[14] 刘登群, 王锋超, 董世武, 等. 供体骨髓来源干细胞在骨髓嵌合小鼠肠上皮中定植和分化研究[J]. 胃肠病学和肝病学杂志, 2008, 17(8): 635-638.
Liu DQ, Wang FC, Dong SW, et al. Experimental study on the implan tation and differentiation of donor’s BMDSCs in the intestinal epithelium of bone marrow-chimeric mice [J]. Chin J Gastroenterol Hepatol, 2008, 17(8): 635-638.
(责任编辑:马 军)
Engraftmentofdonorbonemarrowcellsandtheirrolesinregenerationofradiationdamagedintestine
LIU Dengqun, WANG Fengchao, WANG Junping, SHI Chunmeng, LI Rong, RAN Xinze, SU Yongping
State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury, College of Military Preventive Medicine, Third Military Medical University, Chongqing 400038, China
ObjectiveTo explore the engraftment and characteristics of donor bone marrow cells (dBMCs) and their contribution to epithelial regeneration in radiation damaged intestine.MethodsSixty C57BL/6 mice aged 6-8 weeks were exposed to 10 Gy total body irradiation (TBI) and randomly divided into bone marrow transplantation (BMT) group and control group. Survival ratios in two groups were compared. Engraftment of dBMCs in bone marrow and intestine was demonstrated by green fluorescent protein (GFP) immunohistochemistry (IHC). Immunofluorescent costaining of GFP with CD45, Sca-1 and Ki67 was employed to study the phenotypes of engrafted dBMCs in intestine. Their contribution to intestinal regeneration was determined by HE staining and Brdu analysis.ResultsSurvival ratio in BMT group was 95% on the 14th day. dBMCs migrated into bone marrow and intestine simultaneously. In the intestine, dBMCs firstly appeared at the bottom of lamina propria, then migrated upwards, and finally replaced all the intestinal mesenchymal cells. Hematopoietic stem cells (HSCs) appeared in intestine during the early periods. dBMCs alleviated lamina propria edema, promoted proliferation of intestinal stem cells (ISCs), and increased density of intestinal crypts. dBMCs could form epithelial cells in stable chimeric intestine, but not in the early stage.ConclusiondBMCs implant into intestine in the early time after transplantation, and they promote the regeneration process of radiation damaged intestine.
Radiation injury; Intestine; Bone marrow transplantation; Stem cells
R574
A
1006-5709(2017)10-1154-05
2017-02-03
国家自然科学基金(81371688、81673089);重庆市基础科学与前沿技术研究计划项目(cstc2013jcyjA10038);创伤、烧伤与复合伤国家重点实验室自主研究课题(SKLZZ201019)
刘登群,博士,副教授,研究方向:成体干细胞与胃肠道创伤修复。E-mail: dengqunliu@163.com
10.3969/j.issn.1006-5709.2017.10.022
