内镜黏膜剥离术、黏膜挖除术及全层切除术治疗上消化道黏膜下肿瘤的疗效
2017-11-01方雅丽
方雅丽
西安市中心医院消化科,陕西 西安 710003
内镜黏膜剥离术、黏膜挖除术及全层切除术治疗上消化道黏膜下肿瘤的疗效
方雅丽
西安市中心医院消化科,陕西 西安 710003
目的分析内镜黏膜剥离术(endoscopic submucosal dissection,ESD)、黏膜挖除术(endoscopic submucosal excavation,ESE)及全层切除术(endoscopic full-thickness resection,EFR)治疗上消化道黏膜下肿瘤(submucosal tumors,SMT)的疗效。方法选取2014年11月-2016年11月在西安市中心医院就诊的SMT患者84例为研究对象,按抽签法随机分为试验组(采用ESD、ESE及EFR治疗)与对照组(采用常规内窥镜治疗),各42例,分析患者病变部位分布、病变类型、手术时间及并发症情况,采用SPSS 20.0统计学软件进行分析。结果试验组的病变部位与对照组比较,差异有统计学意义(P<0.05)。试验组中的平滑肌瘤、脂肪瘤、间质瘤、异位胰腺和增生性息肉病例数与对照组比较,差异有统计学意义(P<0.05)。试验组的病变最大径低于对照组,创面长径低于对照组,手术时间低于对照组,术后住院时间低于对照组,两组比较,差异有统计学意义(P<0.05)。试验组中的完整切除和创面完全夹闭的病例数高于对照组,借助圈套器、出血和穿孔的病例数低于对照组,两组比较,差异有统计学意义(P<0.05)。结论ESD、ESE及EFR对SMT是有效、可行的治疗措施,能降低上消化道SMT术后的并发症,值得临床推广应用。
内镜黏膜剥离术;黏膜挖除术;全层切除术;上消化道黏膜下肿瘤
食管、胃、肠等消化道部位的肿瘤都称为消化道肿瘤,食管、胃属于消化道上半部分,而肠道属于消化道下半部分[1]。伴随着越来越多的消化内镜被使用,尤其超声内镜(endoscopic ultrasonograpy,EUS)技术的不断进步,诊断消化道病变越来越精确,很小的胃肠道黏膜下病变也可以通过技术手段检测出来。发生在食管、胃黏膜组织的上消化病变称为胃黏膜下肿瘤(submucosal tumors,SMT),通常都是一些良性病变如脂肪瘤、平滑肌瘤、异位胰腺等,当然不排除间质瘤这样的恶性病变存在[2]。美国胃肠疾病协会关于消化道SMT的治疗标准是:消化道SMT直径不超过3 cm的不需要治疗,只需定期做复查[3]。但患者在反复检查的过程中会增加经济负担,也可能会耽误恶性病变治疗的最佳时机,所以,通常我们为了防止疾病的不断发展,应该采取积极的治疗措施。本文主要对ESD、ESE及EFR治疗上消化道SMT的疗效进行分析,为临床治疗提供参考。
1 资料与方法
1.1一般资料选取2014年11月-2016年11月在西安市中心医院就诊的消化道SMT患者84例为研究对象,按抽签法随机分为试验组与对照组,每组42例。试验组中,男30例,女12例,年龄(38.3±5.8)岁(31~45岁),采用ESD、ESE和EFR治疗;对照组中,男28例,女14例,年龄(42.1±5.4)岁(35~48岁);男女比例和年龄两组比较,差异无统计学意义(P>0.05),具有可比性。所有患者均签署知情同意书,符合医学伦理学规定。
1.2纳入及排除标准纳入标准:术前均经EUS检查证实为上消化道SMT患者,肿瘤直径≤5.4 cm,胃镜、EUS或CT等辅助检查提示肿瘤边界清楚,未浸润或侵犯到消化道外器官组织,无胸腹腔转移,无淋巴结转移征象,无不能耐受全麻手术的其他合并症患者。排除标准:患高血压、糖尿病和冠心病等疾病的患者。
1.3研究方法试验组采用内镜黏膜剥离术(ESD)、黏膜挖除术(ESE)及全层切除术(EFR)治疗。对照组常规内窥镜治疗。
1.4研究指标分析患者病变部位分布、病变类型、手术及并发症情况。
1.5质量控制严格记录患者的治疗情况。
2 结果
2.1两组患者的病变部位分布情况分析试验组的病变部位与对照组比较,差异有统计学意义(P<0.05,见表1)。
2.2两组患者的病变类型分析试验组中的平滑肌瘤、脂肪瘤、间质瘤、异位胰腺和增生性息肉病例数与对照组比较,差异有统计学意义(P<0.05,见表2)。
2.3两组患者的手术结果分析试验组的病变最大径、创面长径、手术时间、术后住院时间均低于对照组,两组比较,差异有统计学意义(P<0.05,见表3)。

表1 两组患者的病变部位分布情况比较
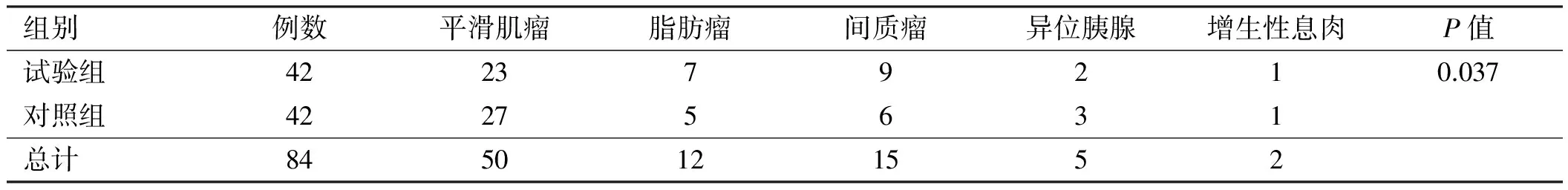
表2 两组患者的病变类型比较
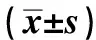
表3 两组患者的手术结果比较
注:与对照组比较,*P<0.05,#P<0.01。
2.4两组患者手术情况及并发症比较试验组中的完整切除病例数高于对照组,借助圈套器病例数、出血病例数和穿孔病例数均低于对照组,创面完全夹闭病例数高于对照组,两组比较,差异均有统计学意义(P<0.05,见表4)。
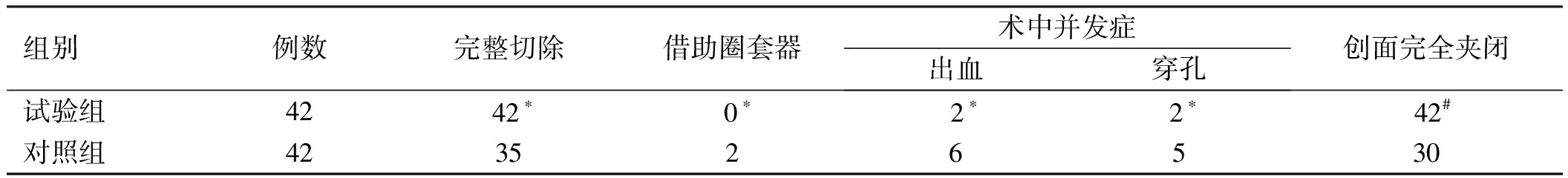
表4 两组患者手术情况及并发症比较
注:与对照组比较,*P<0.05,#P<0.01。
3 讨论
ESD是一种来自日本的对早期胃癌进行微创切除的手术方式,各种电刀和辅助设备一起配合内镜引导将消化道的病变组织进行剥离[4]。这项手术在经过对比内镜下黏膜切除术(EMR)治疗早期消化道癌变、黏膜浅表大面积病变等具有剥除彻底、复发率低、肿瘤残留风险低、创伤小、术后恢复快等优点。近年来随着技术不断发展和创新,ESD不但在对消化道黏膜上皮早期病变还没有癌化、或已经癌化的治疗表现优越,而且对消化道黏膜以下的病变也有良好的表现,大部分生长在黏膜肌层和下层的消化道肿瘤,或是突向腔内发展的固有肌层肿瘤都适用[5]。
近几年来,相关人员研究了一种在隧道技术和ESD的基础上创新开发的微创内镜治疗技术,称为内镜经黏膜下隧道肿瘤切除术(submucosal tunneling endoscopic resection,STER)[6]。朱明艳[7]利用该项技术治疗固有肌层的消化道肿瘤之后,我国开始普及这种方法。其优势是能够解决传统EMR剥离黏膜下深层次病变不够完整的缺陷,又能够在治疗过程中使用隧道技术分离病灶部位和创口,让黏膜在剥离下层肿瘤时不会被破坏,这样能够解决使用ESD造成的穿孔问题。
ESD主要是利用电刀在EMR圈套切除术的辅助下进行消化道肿瘤剥离的技术,能够一次性对黏膜下层病变组织进行清除[8]。ESD亮相在日本,一开始采用针状电刀,技术发展还不是很成熟,所以大范围的病变组织无法整块一次性切除,后来慢慢发展多种在该技术基础上研究的治疗方法,主要区别是设备仪器的改进,最后,这种将大范围发生的消化道黏膜下病变组织一次性切除的内镜技术叫做ESD[9]。最开始主要应用是在胃部,之后才慢慢在食管、肠道等位置使用。EMR技术的实施会受到病变直径大小的影响,但现在内镜技术还没有发展到能够切除淋巴结,所以只要是病变还没有转移到淋巴,只是在消化道黏膜就可以用ESD进行,除非是那些直径超大的息肉性病变和上消化道表浅癌变早期、腺瘤性病变等[10]。ESD在治疗消化道黏膜表浅病变和早期胃癌等方面有大量的研究证明其安全性和有效性。
消化道黏膜出现恶性病变采用ESD治疗之前需要判断是否已经转移到淋巴结,而判断影响的因素有病例类型、肿瘤侵入的程度及病变组织周边的血管和淋巴分布的情况,所以在治疗前必须先利用共聚焦内镜和染体来定位和检测肿瘤,通过分期来决定是否能够进行ESD手术[11]。如果确定是癌变早期,患者在进行手术之后还要进行EUS检查和上腹部CT检查来排除病变转移到淋巴结的情况[12]。另外,通过对切除手术得到的完整标本进行切片研究,看切片组织边缘是否齐整评估治疗效果和复发风险,进而确定是否需要再次进行手术或其他额外的辅助手术。
ESE的原理是通过各种电刀将肿瘤表面的黏膜切开之后将肿瘤和黏膜下组织、肿瘤周围的组织都分开之后将肿瘤完整挖出来的一种方法,对于消化道肌层肿瘤,特别是突向管腔方向发展的固有肌层肿瘤。ESE和ESD两种治疗方法最大的区别就是前者是在将肿瘤和肿瘤表面的黏膜组织完全分离之后进行的ESD,对操作人员的要求较高,治疗难度较大,使用内镜操作技术必须非常熟练[13]。使用该技术进行黏膜下病变切除特别是固有肌层肿瘤切除最容易出现出血和穿孔的并发症,出血采用的处理方法和ESD相同,穿孔则是在手术结束之后在黏膜下用金属夹夹闭,效果比较明显。也就是解决了ESD操作过程中破坏了外层黏膜导致黏膜张力阻碍了金属夹夹闭的难度这一个问题[14]。Lu等[15]利用ESE对食管固有肌层肿瘤进行切除,得到96.3%的切除率,并且其中34例只有3例出现穿孔但是金属夹都能够处理到,之后的4~26个月随访并无发现残留或复发情况。EFR扩大了ESD的治疗深度,其变被动穿孔为主动穿孔的治疗方式可以治疗源于固有肌层并与浆膜层紧密粘连的肿瘤[16]
本研究结果显示,3种方法联合能有效治疗上消化道SMT。ESD、ESE及EFR对SMT是一项有效、可行的治疗措施,能降低上消化道SMT术后的并发症,值得临床推广应用。
[1] 杨莉, 李胜昔, 徐美东, 等. 内镜黏膜下剥离术及全层切除术治疗胃黏膜下肿瘤的临床疗效分析[J]. 中国内镜杂志, 2015, 21(1): 37-41.
Yang L, Li SX, Xu MD, et al. Clinical effects analysis of endoscopic submucosal dissection and endoscopic full-thickness resection for gastric submucosal tumors [J]. Chinese Journal of Endoscopy, 2015, 21(1): 37-41.
[2] 刘艳萍, 陈宏辉, 李国庆, 等. 超声内镜及内镜微创治疗上消化道黏膜下肿瘤应用研究[J]. 现代医药卫生, 2015, 31(11): 1602-1605.
Liu YP, Chen HH, Li GQ, et al. Application research of ultrasonic endoscope and endoscope minimally invasive surgery in upper gastrointestinal tract submucosal tumor [J]. J Mod Med Health, 2015, 31(11): 1602-1605.
[3] 贾丽萍, 朱明艳, 李锐. 胃固有肌层肿瘤内镜下切除术临床评估[J]. 陕西医学杂志, 2015, 44(7): 859-862.
[4] 沈珊珊, 凌亭生. 内镜下治疗上消化道黏膜下肿瘤426例的临床观察[J]. 临床肿瘤学杂志, 2014, 19(6): 503-507.
Shen SS, Ling TS. Endoscopic management of upper gastrointestinal submucosal tumor: a retrospective review of 426 cases [J]. Chinese Clinical Oncology, 2014, 19(6): 503-507.
[5] 刘敏, 倪倩雯, 黄超, 等. 内镜超声对上消化道黏膜下肿瘤的诊治价值[J]. 中国内镜杂志, 2014, 20(10): 1023-1028.
Liu M, Ni QW, Huang C, et al. The value of endoscopic ultrasonography in the diagnosis and treatment of submucosal tumors in the upper gastrointestinal tract [J]. China Journal of Endoscopy, 2014, 20(10): 1023-1028.
[6] 常琳琳, 张开光, 张明黎, 等. 上消化道黏膜下肿瘤的诊治和随访[J]. 世界华人消化杂志, 2016, 24(5): 765-774.
Chang LL, Zhang KG, Zhang ML, et al. Therapy and follow-up of upper gastrointestinal subepithelial lesions [J]. World Chinese Journal of Digestology, 2016, 24(5): 765-774.
[7] 朱明艳. 胃固有肌层肿瘤内镜下切除术的临床评估[D]. 苏州大学, 2015.
Zhu MY. Endoscopic resection of gastric submucosal tumors originating from the muscularis propria [D]. Suzhou University, 2015.
[8] 李宾. 内镜切除技术在食管胃结合部固有肌层肿瘤中的应用[D]. 山东大学, 2015.
Li B. Endoscopic resection for submucosal tumors of the esophagogastric junction originating from muscularis propria [D]. Shandong University, 2015.
[9] 王玮, 丁祥武, 王道蓉, 等. 单环套扎器治疗上消化道黏膜下肿瘤的疗效分析[J]. 胃肠病学和肝病学杂志, 2016, 25(5): 536-537, 541.
Wang W, Ding XW, Wang DR, et al. Effectiveness of single-ring loop ligature in the treatment of upper gastrointestinal submucosal tumors [J]. Chin J Gastroenterol Hepatol, 2016, 25(5): 536-537, 541.
[10] Reinehr R. Endoscopic submucosal excavation (ESE) is a safe and useful technique for endoscopic removal of submucosal tumors of the stomach and the esophagus in selected cases [J]. Z Gastroenterol, 2015, 53(6): 573-578.
[11] Huang LY, Cui J, Liu YX, et al. Endoscopic therapy for gastric stromal tumors originating from the muscularis propria [J]. World J Gastroenterol, 2012, 18(26): 3465-3471.
[12] Zhong YS, Li QL, Zhou PH, et al. Selection and evaluation of endoscopic resection for submucosal tumors of the esophagogastric junction originating from muscularis propria [J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2012, 15(9): 901-905.
[13] Wang S, Shen L. Efficacy of endoscopic submucosal excavation for gastrointestinal stromal tumors in the cardia [J]. Surg Laparosc Endosc Percutan Tech, 2016, 26(6): 493-496.
[14] Li G, Zeng S, Chen Y, et al. Bacteremia after endoscopic submucosal excavation for treating the gastric muscular layer tumors [J]. Gastroenterol Res Pract, 2015, 2015: 306938.
[15] Lu J, Jiao T, Zheng M, et al. Endoscopic resection of submucosal tumors in muscularis propria: the choice between direct excavation and tunneling resection [J]. Surg Endosc, 2014, 28(12): 3401-3407.
[16] Dray X, Giday SA, Buscaglia JM, et al. Omentoplastry for gastrotomy closure after natural orifice transluminal endoscopic surgery procedures (with video) [J]. Gastrointest Endosc, 70(1): 131-140.
(责任编辑:马 军)
Effectofsubmucosaltumorsinuppergastrointestinaltracttreatedbyendoscopicsubmucosaldissection,endoscopicsubmucosalexcavationandendoscopicfull-thicknessresection
FANG Yali
Department of Gastroenterology, Xi’an Central Hospital, Xi’an 710003, China
ObjectiveTo analyze the efficacy of endoscopic submucosal dissection (ESD), endoscopic submucosal excavation (ESE) and endoscopic full-thickness resection (EFR) in the treatment of submucosal tumors (SMT) in upper gastrointestinal tract.MethodsEighty-four patients with SMT treated in Xi’an Central Hospital from Nov. 2014 to Nov. 2016 were randomly divided into experimental group (ESD, ESE and EFR) and control group (endoscopic treatment). The distribution of lesion, lesion type, operation time and complication were analyzed by SPSS 20.0 statistical software.ResultsThere was significant difference in lesion location between experimental group and control group (P<0.05). There were significant differences in the numbers of cases of leiomyoma, lipoma, stromal tumor, ectopic pancreas and proliferative polyposis between experimental group and control group (P<0.05). The maximal diameter of the lesion, the length of the wound, the operation time, the postoperative hospital stay were lower in experimental group than those in control group (P<0.05). The numbers of complete resection and complete occlusion in experimental group were higher than those in control group. The numbers of cases with hemorrhage and perforation were lower in experimental group than those in control group. There was significant difference between two groups (P<0.05).ConclusionESD, ESE and EFR are effective and feasible treatments for upper gastrointestinal SMT. They can reduce the postoperative complications of upper gastrointestinal SMT.
Endoscopic submucosal dissection; Endoscopic submucosal excavation; Endoscopic full-thickness resection; Submucosal tumors in upper gastrointestinal tract
R735
A
1006-5709(2017)10-1150-04
2017-02-21
方雅丽,主管护师,研究方向:消化内镜。E-mail:fangyalitg@163.com
10.3969/j.issn.1006-5709.2017.10.021
