内镜及TIPS治疗特发性非肝硬化门脉高压并静脉曲张出血的长期效果及预后分析
2017-11-01原姗姗陈晓露唐海灵郭汉青张彦亭
原姗姗, 张 欣, 闫 媛, 陈晓露, 唐海灵, 郭汉青, 张彦亭, 庄 坤
西安市中心医院消化科,陕西 西安 710032
内镜及TIPS治疗特发性非肝硬化门脉高压并静脉曲张出血的长期效果及预后分析
原姗姗, 张 欣, 闫 媛, 陈晓露, 唐海灵, 郭汉青, 张彦亭, 庄 坤
西安市中心医院消化科,陕西 西安 710032
目的探讨内镜及经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)治疗特发性非肝硬化门脉高压症(idiopathic non-cirrhotic portal hypertension, INCPH)患者静脉曲张出血后的长期临床效果及预后影响因素。方法回顾性分析2000年1月-2013年12月在西安市中心医院行内镜(内镜组)或TIPS(TIPS组)治疗的INCPH静脉曲张出血患者的临床资料,规律随访观察再出血及生存情况。结果在随访时间内,共有12例患者出现静脉曲张再出血,1年、2年、4年再出血率分别是5.0%、10.7%和38.3%,两组比较,差异无统计学意义(P=0.7445)。共有8例INCPH患者死亡,所有患者的1年、2年、4年生存率分别为97.4%、92.2%、78.2%,两组比较,差异无统计学意义(P=0.645)。年龄(HR=1.974,P=0.038)和Child-Pugh评分(HR=2.462,P=0.034)是预测患者生存的独立危险因素。结论内镜与TIPS可有效预防INCPH患者的静脉曲张再出血,且患者有较高的生存率。
特发性非肝硬化门脉高压症;静脉曲张出血;再出血;生存
门脉高压是临床中常见的一种综合征,导致其最常见的原因是肝硬化,但仍有约20%的门脉高压继发于非肝硬化因素,统称为非肝硬化门脉高压症(non-cirrhotic portal hypertension, NCPH)[1]。临床中常见的是区域性门静脉高压症、先天性肝纤维化、布加氏综合征、结节再生性增生、肝外门静脉血管阻塞等[2]。除此之外,临床上还有一种比较多见的,在中国尚未被临床医师们重视,且经常被误诊为隐源性肝硬化的一种门脉高压症,即特发性非肝硬化门脉高压症(idiopathic non-cirrhotic portal hypertension, INCPH)。
静脉曲张出血是目前威胁INCPH患者生命最主要的并发症[3],但由于缺乏对其治疗的研究数据,即使2015年最新的门脉高压临床实践Baveno Ⅵ指南[4]及欧洲肝脏病协会EASL指南[5],对其治疗的推荐也仅是根据肝硬化治疗策略选择。然而,INCPH具有肝功能良好这一优点,完全按照肝硬化门脉高压指南的推荐对其进行治疗仍有不合理之处。因此,对于INCPH急性静脉曲张出血的控制以及静脉曲张再出血的预防,人们仍然需要寻求更可靠、更有效,且更适合的治疗方法。本文旨在回顾性研究西安市中心医院2000年1月-2013年12月临床诊断为INCPH,表现为静脉曲张出血患者治疗的长期临床效果及预后因素分析。
1 资料与方法
1.1一般资料选取2000年1月-2013年12月在西安市中心医院治疗的反复静脉曲张出血患者,共纳入40例,男22例,女18例,年龄(52±14)岁(34~76岁),中位随访时间49.3个月。
1.2纳入及排除标准纳入标准:(1)明确诊断为INCPH;(2)住院后给予内镜或经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)治疗。所有纳入本研究的患者按照2015年EASL指南[5]的INCPH诊断标准进行诊断:(1)具有门脉高压的临床表现(静脉曲张出血、腹水、脾大等);(2)排除常见的可以引起肝硬化的慢性肝脏疾病病因,如乙肝、丙肝、酒精肝等;(3)肝脏穿刺活检排除肝硬化;(4)排除非肝硬化门脉高压中的其他情况;(5)影像学发现门静脉及肝静脉保持通畅。排除标准:(1)诊断为肝硬化或其他非肝硬化的门脉高压;(2)严重的心肺、肾脏疾病,肝癌,肿瘤恶病质等;(3)未行任何治疗。本研究取得了本院伦理委员会的批准,每位患者已签署知情同意书。
1.3资料收集收集所有符合本研究纳入人群的临床数据、实验室检查、影像学资料。临床数据包括:年龄、性别、静脉曲张出血史。实验室数据包括:血常规、肝肾功能、凝血功能、Child-Pugh分级、Child-Pugh评分等。采用电话随访与门诊复查两种方式进行随访。纳入人群在治疗后的1个月、3个月及随后每6个月来我院门诊随访。随访终止时间为患者发生死亡或行肝脏移植治疗或本研究随访结束(2015年6月)。
1.4统计学分析采用SPSS 19.0软件对数据进行分析处理。Kaplan-Merier方法计算生存率及再出血率,并在组间进行Log-rank检验,以Cox回归风险模型进行危险因素的单因素及多因素分析。所有的检验均为双侧检验。P<0.05为差异有统计学意义。
2 结果
2.1一般资料40例患者中,肝功能分级主要是Child-Pugh A级和Child-Pugh B级,分别有18例和16例,Child-Pugh C级患者仅6例。Child-Pugh评分为(9.8±1.5)分。整个过程中无患者行肝移植,2例患者在随访后17.7个月和38.6个月时失访。所有患者的基线特征如表1所示。
40例INCPH患者均在来我院之前发生过至少1次的食管胃底静脉曲张破裂出血。其中,单纯食管静脉曲张者11例,单纯胃底静脉曲张8例,食管胃底静脉曲张者21例。行内镜下治疗静脉曲张的患者共28例(内镜下套扎4例,内镜下硬化剂治疗7例,内镜下套扎联合硬化剂注射治疗17例),其余12例患者成功行TIPS治疗。

表1 INCPH患者基线资料(n=40)
2.2临床疗效在随访时间内,共有12例患者出现静脉曲张再出血。INCPH患者静脉曲张破裂出血治疗后的1年、2年、4年再出血率分别是5.0%、10.7%和38.3%(见图1A)。内镜组与TIPS组的1年、2年、4年再出血率比较(3.6%vs8.3%;7.4%vs18.5%;38.3%vs38.9%),差异无统计学意义(P=0.7445,见图1B)。
随访期间,8例INCPH患者发生死亡,其中内镜组5例,TIPS组3例(死亡原因:难以控制的静脉曲张再出血死亡3例,反复发作的大量腹水1例,肝昏迷1例,肝肾等多脏器功能衰竭2例,不明原因1例)。所有患者的1年、2年、4年生存率分别是97.4%、92.2%、78.2%(见图2A)。内镜组与TIPS组的1年、2年、4年无肝移植生存比较(96.4%vs91.7%;92.7%vs91.7%;83.2%vs68.8%),差异无统计学意义(P=0.6457,见图2B)。在随访期间,11例患者出现程度不一的显性肝性脑病,其中6例出现在行TIPS治疗的INCPH患者中。10例肝性脑病患者均通过药物治疗后缓解,只有1例患者因顽固性肝性脑病死亡。
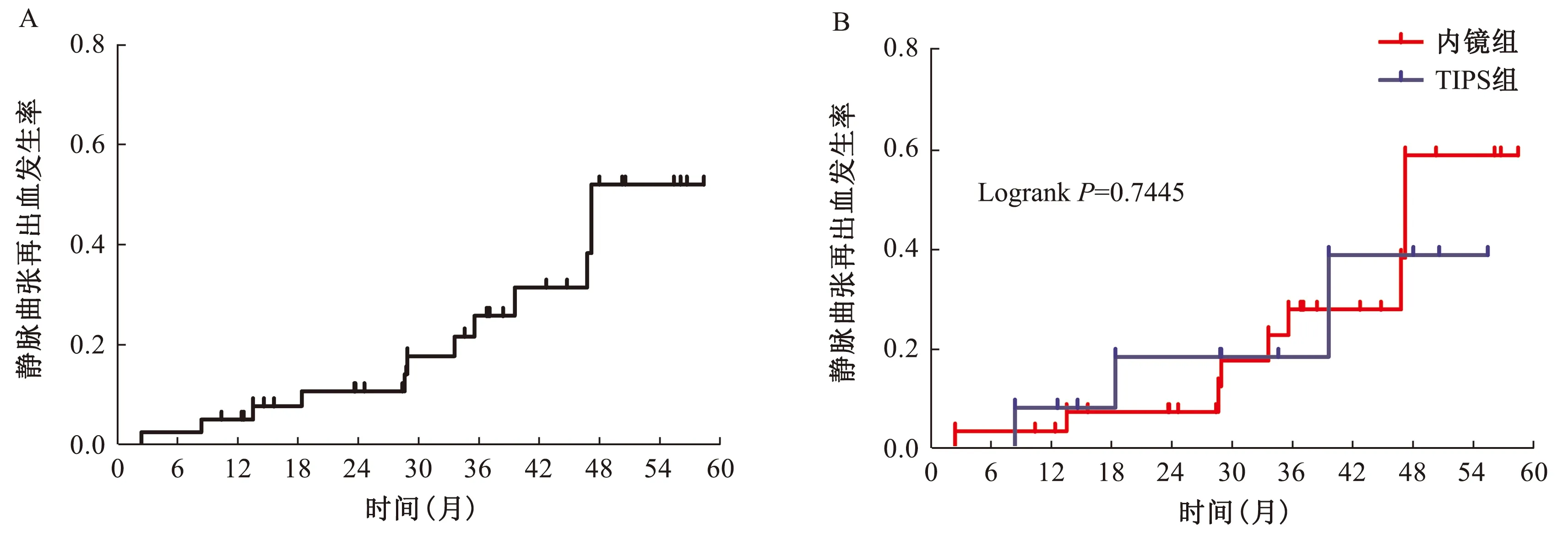
图1 两组患者的静脉曲张再出血发生率Fig 1 Variceal rebleeding rates between two groups
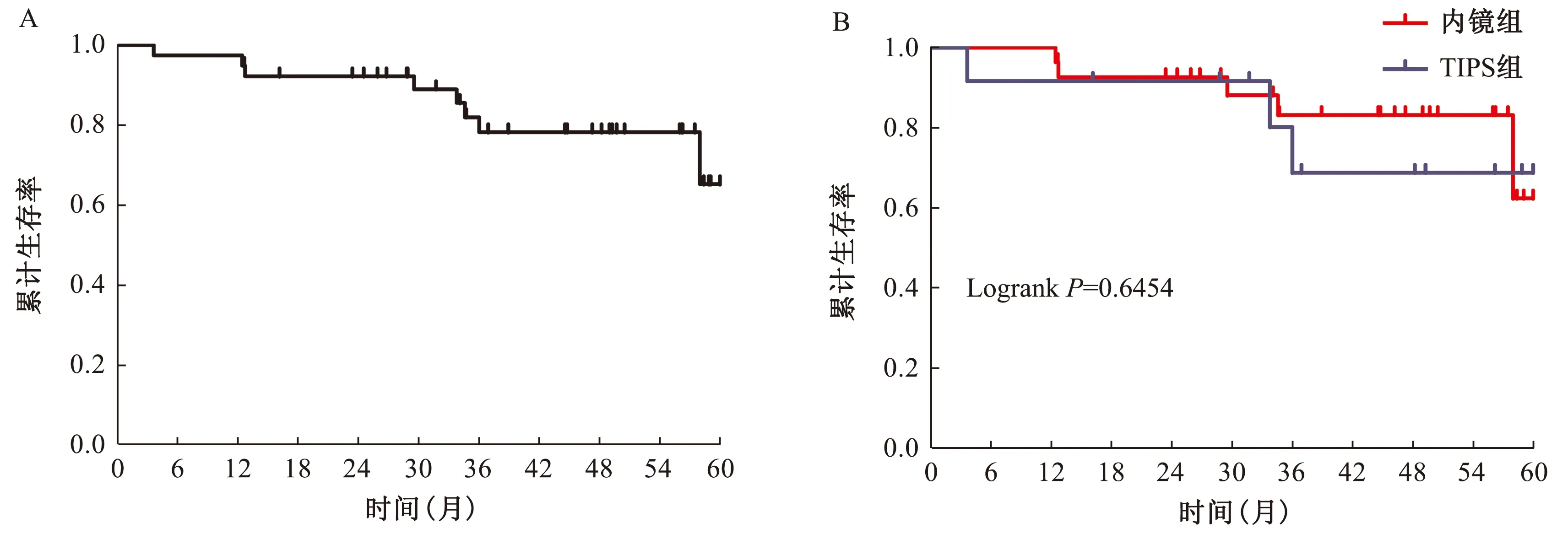
图2 两组患者的累积生存率Fig 2 Cumulative survival rates between two groups
2.3预后因素分析对40例INCPH患者的生存进行Cox单因素分析,发现年龄(HR=1.456,95%CI:0.951~1.009,P=0.021)、血小板(HR=1.622,95%CI:0.57~5.187,P=0.047)、总胆红素(HR=1.016,95%CI:0.981~1.052,P=0.045)、Child-Pugh评分(HR=1.159,95%CI:0.723~1.857,P=0.041)是预测患者生存的危险因素。但进行多因素分析后显示,年龄(HR=1.974,95%CI:0.467~2.378,P=0.038)和Child-Pugh评分(HR=2.462,95%CI:0.759~6.783,P=0.034)是预测患者生存的独立危险因素。
3 讨论
INCPH是一种较为少见的疾病,研究[6]发现,其发生与社会卫生经济条件低有关。因此,在发展中国家比较多见,据报道,在印度INCPH约占所有门脉高压患者的1/4,西方国家仅为3%~5%[1,7-8]。然而由于我国医护人员对其认识的不足,临床上经常误诊为肝硬化。根据2007年亚太肝病学会(APASL)的指南[9],INCPH可解释临床上10%~30%的静脉曲张出血患者,静脉曲张出血是威胁此类患者生存的主要原因;然而由于缺乏相应的临床数据,相关临床实践指南也只是按照肝硬化门脉高压推荐[4-5,9]。对于INCPH静脉曲张出血的治疗是我们目前亟待解决的问题,本研究正是立足于此点,指导临床,为INCPH患者的治疗提供循证医学证据,延长患者生存时间。
目前,国外对于INCPH患者静脉曲张出血的研究鲜有报道,1997年来自印度的Chawla等[10]报道了72例INCPH患者因反复静脉曲张出血行内镜下硬化剂治疗,中位随访时间为21个月,其再出血率为9.2%;2010年Sarin等[11]研究表明,在非肝硬化门脉高压患者内镜下套扎与普萘洛尔可达到同样的预防再出血效果;同时来自西班牙的一项研究[12]在2014年Hepatology发表了1篇单臂研究,发现24例INCPH患者使用内镜下套扎联合普萘洛尔治疗,1年的再出血率是22%。与上述国外各研究报道相比,我们的研究首次指出,我国INCPH患者静脉曲张出血治疗后的再出血率较低;与国外的研究不同,我们还进行了内镜与TIPS治疗INCPH患者静脉曲张出血的比较,发现TIPS组与内镜组的再出血发生率差异无统计学意义。提示我们对于INCPH静脉曲张出血患者,按照目前国内外的肝硬化门脉高压指南对其进行处理是科学且有循证医学证据的。但本研究也有不足,我们只有12例患者行TIPS治疗,虽然两组之间进行了比较,但说服力仍欠缺。因此,还需要进行进一步的前瞻性对照研究来证实。
另外,不同于肝硬化,INCPH是一个相对良性的疾病,只要有效控制出血,5年生存率为90%[2]。最近来自西班牙的一个研究[12]表明,其10年生存率可达82%。我们的研究也表明,INCPH患者具有良好的预后,且内镜治疗与TIPS治疗的预后生存无显著性差异。良好的生存是INCPH不同于肝硬化门脉高压最显著的特点,其好的预后可能与其发病机制相关。INCPH是非肝硬化门脉高压症的一种,其病理活检多表现为肝内门静脉终末支及汇管区的纤维化,肝细胞多无破坏,肝小叶结构基本正常[2,6,13-16]。其发病机制虽然尚未明确,但大多数学者认为其是一种肝脏微血管病,即各种可能的致病因素作用于肝内门静脉2~3级中小分支,引起门静脉纤维化硬化等病理改变,最终发生血流动力学异常,引起INCPH,而较少发生肝脏实质损伤[2,6,17-18]。因此,不同于肝硬化门脉高压患者,INCPH患者的门脉高压症状比较显著,如静脉曲张破裂出血发作频繁,但多具有较好的肝功能,临床上只要有效控制患者出血,其预后较好。这就指导着临床医师对这类患者需积极重视静脉曲张出血的治疗。
我们的研究进一步对INCPH患者的预后进行了单因素及多因素分析,发现年龄和Child-Pugh评分是预测INCPH患者生存的独立危险因素。这与肝硬化门脉高压患者的生存预后因素相似。目前大量的临床研究也证实,年龄、高Child-Pugh评分或MELD评分、高胆红素水平、低蛋白水平等指标是预测其生存的独立危险因素。因此,在临床中,对于高龄、肝功能较差的INCPH患者,我们需高度重视,这预示着其有一个较差的预后。
总之,本研究显示,内镜与TIPS均可有效预防INCPH患者的静脉曲张再出血,且患者都有一个较好的生存。但因病例数较少且为回顾性研究,循证医学证据不足,目前还需大样本随机对照研究来证实,为INCPH患者的治疗提供更为精确的循证医学证据。
[1] Sarin SK, Kapoor D. Non-cirrhotic portal fibrosis: current concepts and management [J]. J Gastroenterol Hepatol, 2002, 17(5): 526-534.
[2] Khanna R, Sarin SK. Non-cirrhotic portal hypertension-diagnosis and management [J]. J Hepatol, 2014, 60(2): 421-441.
[3] Harmanci O, Bayraktar Y. Clinical characteristics of idiopathic portal hypertension [J]. World J Gastroenterol, 2007, 13(13): 1906-1911.
[4] de Franchis R, Baveno Ⅵ Faculty. Expanding consensus in portal hypertension: report of the baveno Ⅵ consensus workshop: stratifying risk and individualizing care for portal hypertension [J]. J Hepatol, 2015, 63(3): 743-752.
[5] European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu. EASL clinical practice guidelines: vascular diseases of the liver [J]. J Hepatol, 2016, 64(1): 179-202.
[6] Schouten JN, Garcia-Pagan JC, Valla DC, et al. Idiopathic noncirrhotic portal hypertension [J]. Hepatology, 2011, 54(3): 1071-1081.
[7] Sarin SK, Kumar A. Noncirrhotic portal hypertension [J]. Clin Liver Dis, 2006, 10(3): 627-651.
[8] Goel A, Elias JE, Eapen CE, et al. Idiopathic non-cirrhotic intrahepatic portal hypertension (NCIPH)-newer insights into pathogenesis and emerging newer treatment options [J]. J Clin Exp Hepatol, 2014, 4(3): 247-256.
[9] Sarin SK, Kumar A, Chawla YK, et al. Noncirrhotic portal fibrosis/idiopathic portal hypertension: APASL recommendations for diagnosis and treatment [J]. Hepatol Int, 2007, 1(3): 398-413.
[10] Chawla YK, Dilawari JB, Dhiman RK, et al. Sclerotherapy in noncirrhotic portal fibrosis [J]. Dig Dis Sci, 1997, 42(7): 1449-1453.
[11] Sarin SK, Gupta N, Jha SK, et al. Equal efficacy of endoscopic variceal ligation and propranolol in preventing variceal bleeding in patients with noncirrhotic portal hypertension [J]. Gastroenterology, 2010, 139(4): 1238-1245.
[12] Siramolpiwat S, Seijo S, Miquel R, et al. Idiopathic portal hypertension: natural history and long-term outcome [J]. Hepatology, 2014, 59(6): 2276-2285.
[13] Verheij J, Schouten JN, Komuta M, et al. Histological features in western patients with idiopathic non-cirrhotic portal hypertension [J]. Histopathology, 2013, 62(7): 1083-1091.
[14] Ibarrola C, Colina F. Clinicopathological features of nine cases of non-cirrhotic portal hypertension: current definitions and criteria are inadequate [J]. Histopathology, 2003, 42(3): 251-264.
[15] Isabel Fiel M, Thung SN, Hytiroglou P, et al. Liver failure and need for liver transplantation in patients with advanced hepatoportal sclerosis [J]. Am J Surg Pathol, 2007, 31(4): 607-614.
[16] Aggarwal S, Fiel MI, Schiano TD. Obliterative portal venopathy: a clinical and histopathological review [J]. Dig Dis Sci, 2013, 10(58): 2767-2776.
[17] Sato Y, Harada K, Sasaki M, et al. Altered intrahepatic microcirculation of idiopathic portal hypertension in relation to glutamine synthetase expression [J]. Hepatol Res, 2015, 45(13): 1323-1330.
[18] Kamath PS, Carpenter HA, Lloyd RV, et al. Hepatic localization of endothelin-1 in patients with idiopathic portal hypertension and cirrhosis of the liver [J]. Liver Transpl, 2000, 6(5): 596-602.
(责任编辑:王全楚)
Long-termoutcomeandprognosticfactorsofendoscopicortransjugularintrahepaticportosystemicshuntforidiopathicnon-cirrhoticportalhypertensionwithvaricealbleedingpatients
YUAN Shanshan, ZHANG Xin, YAN Yuan, CHEN Xiaolu, TANG Hailing, GUO Hanqing, ZHANG Yanting, ZHUANG Kun
Department of Gastroenterology, Xi’an Central Hospital, Xi’an 710032, China
ObjectiveTo investigate the long-term clinical outcome and prognostic factors of endoscopic or transjugular intrahepatic portosystemic shunt (TIPS) for idiopathic non-cirrhotic portal hypertension (INCPH) with variceal bleeding.MethodsThe clinical data of INCPH with variceal bleeding patients under endoscopy or TIPS treatment from Jan. 2000 to Dec. 2013 in Xi’an Central Hospital were collected and analyzed respectively. Regular follow-up was performed to observe rebleeding rate and survival condition.ResultsDuring follow-up, 12 patients occurred rebleeding. Rebleeding rates of 1, 2 and 4-year were 5.0%, 10.7% and 38.3%, respectively, the variceal rebleeding rate between endoscopic group and TIPS group was no significant difference (P=0.7445). Eight patients died, and the survival rates of 1-, 2- and 4-year were 97.4%, 92.2% and 78.2%, respectively, and there was no significant difference in survival rate between two groups (P=0.645).The multivariate analysis showed that age (HR=1.974,P=0.038) and Child-Pugh score (HR=2.462,P=0.034) were independent predictors for survival.ConclusionEndoscopy and TIPS could effectively prevent rebleeding in patients with INCPH with variceal bleeding.
Idiopathic non-cirrhotic portal hypertension; Variceal bleeding; Rebleeding; Survival
R575
A
1006-5709(2017)10-1170-04
2016-12-14
10.3969/j.issn.1006-5709.2017.10.026
原姗姗,硕士研究生,主治医师,E-mail: shanshanyuan007@163.com
庄坤,主任医师,硕士研究生,研究方向:消化道早癌筛查。E-mail: zhuanger6695@sohu.com
