不同加速剂对LiF高温水解反应的影响
2017-11-01郑小北仇婷婷王晨阳刘玉侠
彭 佳,郑小北,仇婷婷,王晨阳,刘玉侠,*,张 岚,*
1.中国科学院 上海应用物理研究所,上海 201800;2.中国科学院大学,北京 100049;3.中国科学院 核辐射与核能技术重点实验室,上海 201800;4.中国科学院 先进核能创新研究院,上海 201800
不同加速剂对LiF高温水解反应的影响
彭 佳1,2,3,4,郑小北1,3,4,仇婷婷1,2,3,4,王晨阳1,3,4,刘玉侠1,3,4,*,张 岚1,3,4,*
1.中国科学院 上海应用物理研究所,上海 201800;2.中国科学院大学,北京 100049;3.中国科学院 核辐射与核能技术重点实验室,上海 201800;4.中国科学院 先进核能创新研究院,上海 201800
主要研究了U3O8、WO3和Cr2O3三种加速剂对LiF高温水解反应的影响,讨论了有无加速剂、加速剂种类、加速剂用量和反应时间等对LiF高温水解转化效率的影响。采用X射线衍射法(XRD)对LiF水解固态产物的组成进行了表征,结果发现,当水解温度为650 ℃时,三种加速剂对LiF水解反应的加速效果满足以下规律:WO3>U3O8>Cr2O3。另外,还研究了LiF在三种加速剂存在下的水解产物,且推测出其相对应的反应机理,从而为这些加速剂的实际应用提供重要参考依据。
高温水解;加速剂;反应机理;LiF
钍基熔盐堆(TMSR)中钍铀燃料以氟化物的形式溶解在载体熔融盐(LiF-BeF2)中,熔盐堆运行一段时间后,会生成多种裂变产物、超铀元素以及金属材料的腐蚀物等,形成一个复杂的氟化物混合体系,其中部分裂变产物还具有高放热及强放射性的特点。特别是LiF-BeF2载体盐中,氟的相对含量高,且BeF2是剧毒致癌物质,具有较强的刺激性,受到高热或者酸时会放出剧毒的烟雾,在高放热和强放射性环境下,这些裂变产物的长期储存会导致F2和HF等有害物质的形成,为其直接储存带来了更大的挑战[1]。同时,由于大部分氟盐在硝酸中的溶解度较小,经典的水法后处理方法无法直接用于熔盐堆核燃料的后处理,故需要将氟化物转化为氧化物进一步处理。
高温水解是一种比较成熟的方法,主要用于固体氟化物中氟含量的分析。其原理是利用水蒸气或者湿润的载气通过特定的高温水解装置,使处在高温装置中的样品转化为相应的氧化物并释放出易挥发的HF,最后通过碱液对HF进行冷凝收集[2-4]。利用高温水解技术可使氟化物转变为相应的氧化物,达到除氟的目的。
根据文献调研[5-10]以及之前的研究[11]发现,有些氟化物在较低温度或者较短时间内极易发生水解反应,如:AlF3、ThF4、UF4和ZrF4等;而碱金属和碱土金属氟化物则较难水解。后续研究发现,高温水解过程中加速剂的加入具有加快氟化物的水解速率、降低水解所需温度的作用[12]。加速剂一般多为酸性金属氧化物,如U3O8、WO3、V2O5、Al2O3、Cr2O3、SiO2和CeO2等都是比较常用的加速剂,其中U3O8、WO3由于具有较优的加速效果,因此较为常用[13-19],研究同时还发现Cr2O3与U3O8在反应活性上类似[2],故本工作对U3O8、WO3及Cr2O3三种加速剂的加速行为进行了研究。
在高温水解反应中,加速剂的作用类似于催化剂而又与之有本质的区别。催化剂是能改变化学反应速率,但其本身的质量、组成和化学性质在参加化学反应前后保持不变的物质,而加速剂在起到加速反应速率的同时自身也参与了化学反应。通常情况下,反应中催化剂的用量少,而加速剂的用量则相对较大,甚至远远超过待测样品的质量。当有加速剂参与的高温水解技术应用于含氟核燃料的后处理流程中时,考虑到核燃料废物最小化的要求,如何优选合适的加速剂种类及较优的加速剂与待水解样品质量比也就成为了高温水解实验中急需解决的关键问题。
考虑到BeF2具有剧毒性以及强刺激性,本工作拟以LiF-BeF2中的主要成分——LiF盐为研究对象,利用自行研制的高温水解装置,分别探究了加速剂种类及用量对LiF高温水解转化效率的影响,并根据X射线衍射法(XRD)分析其终态的固态产物,最终推测出各自的反应机理,为高温水解技术能够在含氟废物后处理流程的应用提供基础数据及参考。
1 实验部分
1.1试剂与仪器
LiF(纯度为99.9%)、WO3(纯度为99.995%)、Cr2O3(纯度为99.9%),西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich);U3O8,中国科学院上海应用物理研究所;NaOH,国药集团化学试剂有限公司;超纯水,Millipore 系统提供。
SG1500/750TS型手套箱,威格高纯气体设备科技(苏州工业园区)有限公司;ML204型分析天平,梅特勒-托利多仪器(上海)有限公司,精度0.000 01 g;SKGL-1200型开启式真空管式炉,上海大恒光学精密机械有限公司;水蒸气发生器,苏州淳元环境技术有限公司;BT100N型蠕动泵,保定申辰泵业有限公司;LX-S10-BLP型冷却循环水机,北京和同创业科技有限责任公司; X’Pert Pro MPD型X射线衍射仪(XRD),荷兰帕纳科公司。
高温水解实验装置,自制,与董晓雨等[11]的实验装置一致,简图示于图1,主要由以下几个主要部分组成:供气系统、水蒸气发生器、开启式高温反应炉、尾气吸收装置、水冷装置。所有阀门反应管、气体管路均为哈氏合金哈 C-276 材质,实验所用反应舟为铂金材质。

1——供气系统,2——超纯水,3——蒸气发生器,4——高温炉,5——反应舟,6——气体控制系统,7——反应管,8——尾气收集装置,9——水冷装置图1 高温水解实验装置Fig.1 Apparatus for pyrohydrolysis experiments
1.2实验方法
将准确称取好的样品和加速剂在研钵中研磨均匀,然后平铺在铂金反应舟中放入反应管的恒温区,抽真空,检查气密性。待管式炉程序升温到设置的反应温度时(反应温度为650 ℃),将高温水蒸气以一定的流速通入与样品发生反应,水流速为2.5 mL/min,反应产生的HF气体用 0.1 mol/L NaOH 溶液吸收。反应结束后关掉水蒸气,通入氩气吹扫尾气,氩气的流速为600 mL/min,此时反应炉程序降温。待反应炉冷至室温后,取出样品放入真空干燥箱,在120 ℃下恒温干燥,直至样品质量不再变化,冷却后备用。采用XRD对水解后固态产物的样品组成进行结构表征(分析误差为3%)。
2 结果与讨论
2.1加速剂U3O8对LiF高温水解反应的影响
2.1.1加速剂的用量及反应时间对水解反应的影响 分别探究了U3O8的用量以及水解时间对LiF高温水解的影响,对水解后的固态产物进行XRD表征,结果示于图2和图3。图2、3结果表明:当反应时间为1 h,加速剂与LiF质量比为5∶1时,LiF可以完全水解,此时的水解产物主要为Li2UO4和Li2U2O7。而当水解反应时间为3 h时,质量比为4∶1时即可完全水解,此时水解产物主要为Li2UO4。说明以U3O8作为加速剂时,适当增加加速剂的用量以及延长反应时间均有利于促进LiF的高温水解。最终结果汇总列于表1。
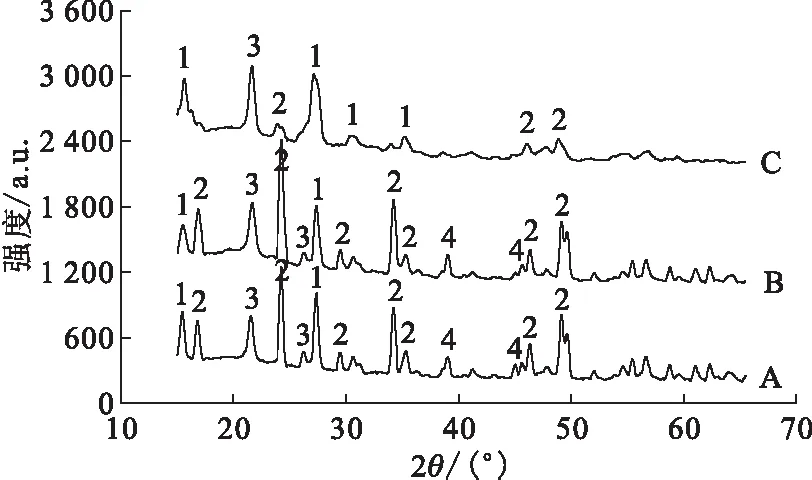
U3O8与LiF质量比:A——3∶1,B——4∶1,C——5∶1 1——Li2U2O7,2——Li2UO4,3——U3O8,4——LiF图2 U3O8作为加速剂、反应1 h时的水解产物XRD谱图Fig.2 XRD patterns of pyrohydrolysis products for 1 h with accelerator of U3O8
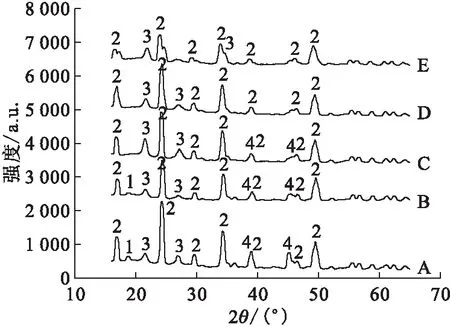
U3O8与LiF质量比:A——1∶1,B——2∶1,C——3∶1,D——4∶1,E——5∶1 1——Li4UO5,2——Li2UO4,3——U3O8,4——LiF图3 U3O8作为加速剂、反应3 h时的水解产物XRD谱图Fig.3 XRD patterns of pyrohydrolysis products for 3 h with accelerator of U3O8

表1 U3O8对LiF高温水解反应的影响Table 1 Influence of U3O8on pyrohydrolysis of LiF
注:+代表不完全水解,++代表完全水解
2.1.2反应机理的推断 Warf[2]和Ponikvar等[15]通过实验证明,当一定量的U3O8作为加速剂与碱金属氟化物反应时,其产物以重铀酸盐的形式存在,并推测其反应机理如下:
6NaF+2U3O8+3H2O+O2=6HF+3Na2U2O7
而本研究中XRD的检测结果表明,水解后的固态产物除了Li2U2O7以外,还有Li4UO5和Li2UO4,与文献报道的结果不太一致,推测可能是由于文献中所加入的U3O8远远过量(20倍以上)。本实验结果表明,随着U3O8加入量的不同,其中一部分加速剂首先与LiF反应生成Li4UO5,而后生成的 Li4UO5与U3O8反应生成Li2UO4,最后过量的U3O8与产物Li2UO4进一步反应生成终态产物Li2U2O7。详细的机理推测如下:
(1) U3O8少量、产物为Li4UO5时:
24LiF+2U3O8+12H2O+O2=6Li4UO5+24HF
(2) U3O8大量、产物为Li2UO4时:
12LiF+2U3O8+6H2O+O2=6Li2UO4+12HF
(3) U3O8过量、产物为Li2U2O7时:
6LiF+2U3O8+3H2O+O2=3Li2U2O7+6HF
2.2WO3作为加速剂
2.2.1WO3用量及反应时间对水解的影响 分别探究了WO3的用量以及水解时间对LiF高温水解的影响,对水解后的固态产物进行XRD表征,结果示于图4。图4结果表明:当反应时间分别为1 h和3 h、加速剂WO3与LiF的质量比小于2∶1时,LiF均不能完全水解,只有质量比大于等于3∶1时,才能达到完全水解。根据实验结果可以看出,在二者质量比为1∶1~2∶1的条件下,反应时间从1 h延长到3 h也并未明显促进水解反应。推测一方面可能是由于延长的时间不够,不足以使反应产生大的变化;另一方面也可能是在此条件下,延长反应时间对反应没有影响。从图4的XRD结果可以看出,当加速剂用量较小时,主要水解产物为Li6W2O9,而当加速剂的用量增加时,反应生成的终产物变为Li2WO4和Li2W2O7,表明产物中W的比重随反应物中W含量的增加而增加。最终结果汇总列于表2。
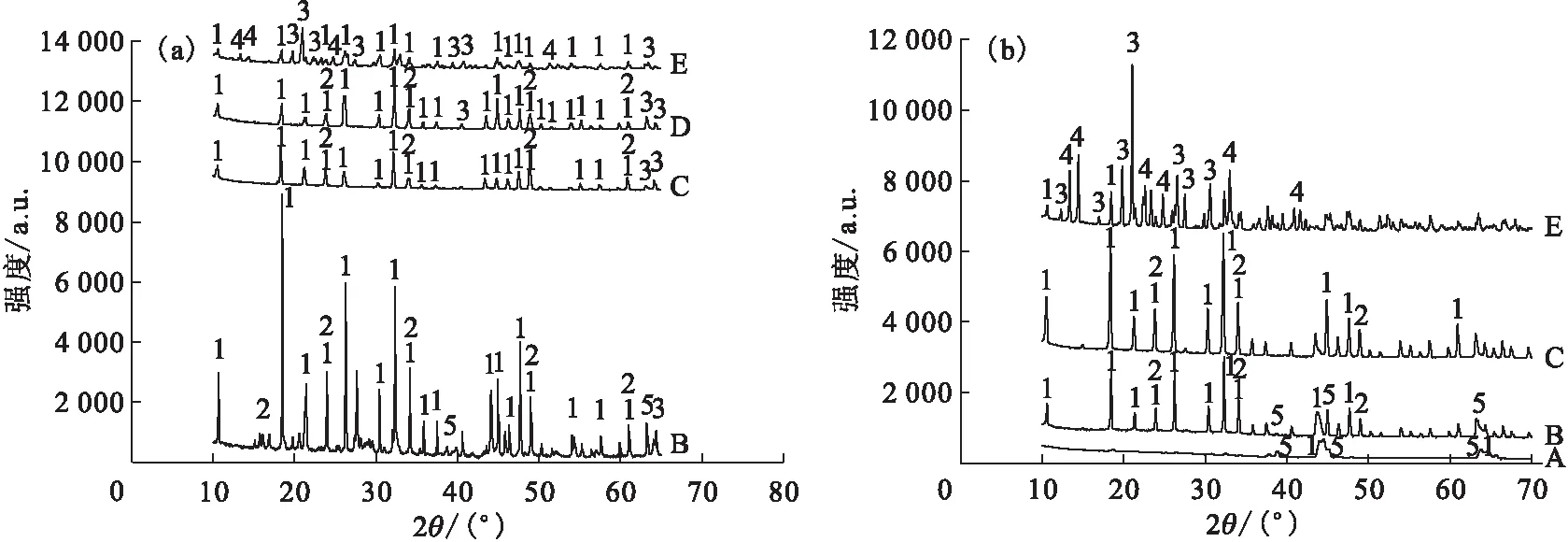
WO3与LiF质量比:A——1∶1,B——2∶1,C——3∶1,D——4∶1,E——5∶1 1——Li6W2O9,2——WO3,3——Li2WO4,4——Li2W2O7,5——LiF图4 WO3作为加速剂时反应时间为1 h(a)、3 h(b)的水解产物XRD谱图Fig.4 XRD patterns of pyrohydrolysis products for 1 h(a) and 3 h(b) with accelerator of WO3
2.2.2反应机理的推断 Ponikvar等[15]和Nardozzi等[17]认为酸性金属氧化物WO3可以作为加速剂促进CaF2的水解并且参与了其中的化学反应,他们通过实验推测 WO3与CaF2遵循如下的化学反应:

本研究发现,当加入少量WO3时,其主要水解产物为Li6W2O9和Li2WO4,当进一步增加加速剂WO3的量时产物变为Li2W2O7,其中的原因可能是由于过量的WO3与生成的Li2WO4进一步反应生成Li2W2O7。推测详细的反应机理如下:
(1) WO3少量、产物为Li6W2O9时:
6LiF+2WO3+3H2O=Li6W2O9+6HF
(2) WO3大量、产物为Li2WO4时:
2LiF+WO3+H2O=Li2WO4+2HF
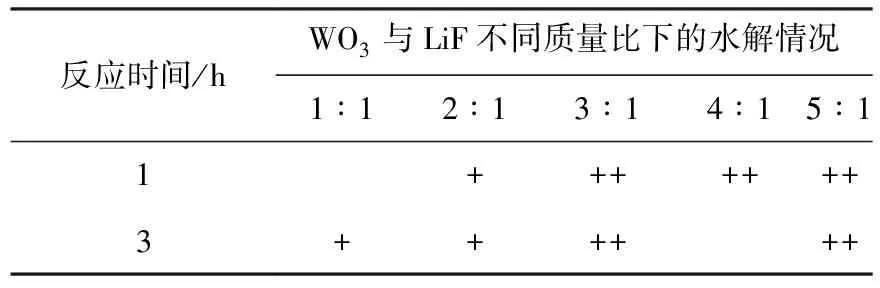
表2 WO3对LiF高温水解反应的影响Table 2 Influence of WO3 on pyrohydrolysis of LiF
注:+代表不完全水解,++代表完全水解
(3) WO3过量、产物为Li2W2O7时:
2LiF+2WO3+H2O=Li2W2O7+2HF
2.3Cr2O3作为加速剂
2.3.1Cr2O3用量及反应时间对水解的影响 分别探究了Cr2O3的用量以及水解时间对LiF高温水解的影响,对水解后的固态产物进行XRD表征,结果示于图5。图5结果表明:当反应时间为1 h、加速剂与LiF质量比达到6∶1时,LiF也无法完全水解;而水解反应时间为3 h时,加速剂用量仅达到5∶1时,LiF即可完全水解。完全水解的产物主要为LiCrO2,说明以Cr2O3作为加速剂时,适当增加加速剂的用量以及延长反应时间均有利于促进LiF的高温水解。最终结果汇总列于表3。
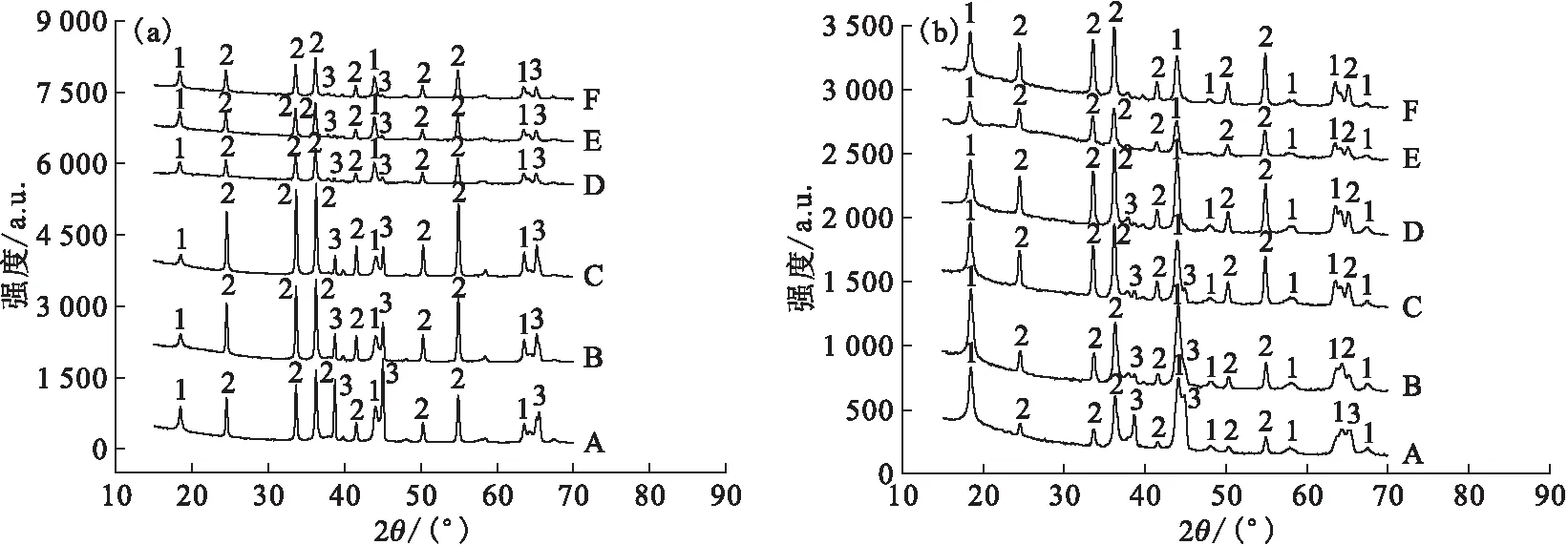
Cr2O3与LiF质量比:A——1∶1,B——2∶1,C——3∶1,D——4∶1,E——5∶1,F——6∶1 1——LiCrO2,2——Cr2O3,3——LiF图5 Cr2O3作为加速剂时反应时间为1 h(a)、3 h(b)的水解产物XRD谱图Fig.5 XRD patterns of pyrohydrolysis products for 1 h(a) and 3 h(b) with accelerator of Cr2O3

表3 Cr2O3对LiF高温水解反应的影响Table 3 Influence of Cr2O3 on pyrohydrolysis of LiF
注:+代表不完全水解,++代表完全水解
2.3.2反应机理的推断 以Cr2O3作为加速剂的研究工作鲜有报道,也未曾有关于其参与水解的反应机理的推断。Warf等[2]与Banks等[16]认为Cr2O3与U3O8在反应活性上类似。结合本实验的研究结果,当Cr2O3做为加速剂反应时间为1 h和3 h时,其主要产物为LiCrO2,因此推测其反应机理如下:
2LiF+Cr2O3+H2O=2LiCrO2+2HF
3 结 论
开展了U3O8、WO3和Cr2O3三种加速剂对LiF高温水解反应行为的研究,得出以下结论:
(1) 加速剂的用量及反应时间等对LiF的高温水解反应效率均有一定程度的影响,且延长反应时间及增加加速剂的用量有利于提高LiF的水解反应程度;
(2) 三种加速剂促进水解反应效率满足如下的规律:WO3>U3O8>Cr2O3。
具有良好性能的加速剂筛选相信对于后续高温水解技术应用于氟化物核燃料后处理具有重要的指导意义。
[1] Peretz F J. Identification and evaluation of alternatives for the disposition of fluoride fuel and flush salts for the molten salt reactor experiment at oak ridge national laboratory, ORNL-ER-380[R]. USA: Oak Ridge National Laboratory, 1996.
[2] Warf J C, Cline W D, Tevebaugh R D. Pyrohydrolysis in determination of fluoride and other halides[J]. Anal Chem, 1954, 26 (2): 342-346.
[3] Powell R H, Menis O. Separation of fluoride from inorganic compounds by pyrolysis[J]. Anal Chem, 1958, 30(9): 1546-1549.
[4] 张黎辉,陈贵福.高温水解-离子色谱法测定核电级二氧化铀中氟、氯、溴、硫[J].湿法冶金,2000,19(1):51-56.
[5] Iwasaki M, Ishikawa N. Pyrohydrolysis reactions of UF4and UO2F2: effect of oxygen on reactions[J]. J Nucl Sci Technol, 1983, 20 (5): 400-404.
[6] 康仕芳,赵君.UF4水解反应动力学研究[J].核化学与放射化学,1998,20(4):202-206.
[7] Woo M S, Hwang S C, Shim J B, et al. Separation of zirconium from LiF-BeF2-ZrF4molten-salt by pyrohydrolysis[R/OL]. http:www.oecd-nea.org/pt/docs/iem/jeju02/session2/sessionⅡ-11.pdf.
[8] 彭炳先,吴代赦.高温热水解离子色谱法快速同时测定粘土中的卤素[J].分析化学,2013,41(10):1499-1504.
[9] Newman A C D. A simple apparatus for separating fluorine from aluminosilicates by pyrohydrolysis[J]. Analyst, 1968, 93(1113): 827-831.
[10] Pandey A, Kelkar A, Singhal R K, et al. Effect of accelerators on thoria based nuclear fuels for rapid and quantitative pyrohydrolytic extraction of F-and Cl-and their simultaneous determination by ion chromatography[J]. J Radioanal Nucl Chem, 2012, 293(3): 743-749.
[11] 董晓雨,郑小北,宋昱龙,等.四氟化铀和四氟化钍的高温水解[J].核化学与放射化学,2014,36(3):181-185.
[12] Silverman H P, Bowen F J. Pyrohydrolysis of cryolite fluoride-bearing materials[J]. Anal Chem, 1960, 31(12): 1960-1965.
[13] Kani Y, Sasahira A, Hoshino K, et al. New processing system for spent nuclear reactor fuel using fluoride volatility method[J]. J Fluorine Chem, 2009, 130(1): 74-82.
[14] Sakurai H, Fukuda M, Hayashibe Y, et al. Determination of fluorine in standard rocks by photon activation analysis[J]. J Radioanal Nucl Chem, 1997, 217(2): 267-271.
[15] Ponikvar M, Liebman J F. Paradoxes and paradigms: observations on pyrohydrolytic decomposition of fluorine-containg materials and accompanying thermochemistry[J]. Struct Chem, 2006, 17(1): 75-78.
[16] Banks C V, Burke K E, O’Laughlin J W. The determination of fluorine in rare earth fluoride by high-temperature hydrolysis[J]. Anal Chim Acta, 1972, 19(59): 239-243.
[17] Nardozzi M J, Lewis L L. Pyrolytic separation and determination of fluoride in raw materials[J]. Anal Chem, 1961, 33(9): 1621-1624.
[18] Zhang G, Liu Y. The determination of chlorine in rocks and minerals by pyrohydrolytic method[J]. Geochem, 1985, 4(3): 291-296.
[19] Sawant R M, Mahajan M A, Shah D J, et al. Pyrohydrolytic separation technique for fluoride and chloride from radioactive liquid wastes[J]. J Radioanal Nucl Chem, 2011, 287(2): 423-426.
InfluenceofDifferentAcceleratorsonPyrohydrolysisofLiF
PENG Jia1,2,3,4, ZHENG Xiao-bei1,3,4, QIU Ting-ting1,2,3,4, WANG Chen-yang1,3,4, LIU Yu-xia1,3,4,*, ZHANG Lan1,3,4,*
1.Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201800, China; 2.University of Chinese Academy of Sciences, Beijing 100049, China; 3.Key Laboratory of Nuclear Radiation and Nuclear Energy Technology, Chinese Academy of Sciences, Shanghai 201800, China; 4.Innovative Academy in TMSR Energy System, Chinese Academy of Sciences, Shanghai 201800, China
In this paper, the effects of different accelerators (U3O8, WO3and Cr2O3) on pyrohydrolysis of LiF were studied. In addition, effects of addition of accelerators, types of accelerators, dosage of accelerators and reaction time on pyrohydrolysis conversion efficiency of LiF were discussed. And solid products were characterized by means of X-ray diffraction (XRD). The results show that when the temperature is set as 650 ℃, the acceleration effects of the three accelerators are in accordance with the following rule: WO3>U3O8>Cr2O3. Meanwhile, the reaction mechanism is summarized according to the analysis of components of solid products, so as to provide some basic data for the potential application of such accelerators.
pyrohydrolysis; accelerators; mechanism; LiF
TL241.1
A
0253-9950(2017)05-0350-06
2017-06-01;
2017-07-04
中国科学院战略性先导科技专项资助项目(No.XDA02030000)
彭 佳(1989—),男,湖北荆州人,博士研究生,从事钍基核燃料水法后处理方法研究,E-mail: pengjia@sinap.ac.cn
*通信联系人:刘玉侠(1979—),女,安徽阜阳人,博士,副研究员,无机化学专业,E-mail: liuyuxia@sinap.ac.cn张 岚(1974—),男,安徽淮南人,博士,研究员,无机化学专业,E-mail: zhanglan@sinap.ac.cn
10.7538/hhx.2017.39.05.0350
