Li3AlF6熔盐的高温水解性质
2017-11-01郑小北高思泽王晨阳刘玉侠李晴暖
郑小北,彭 佳,高思泽,王晨阳,刘玉侠,*,张 岚,李晴暖
1.中国科学院 上海应用物理研究所,上海 201800;2.中国科学院 核辐射与核能技术重点实验室,上海 201800;3.中国科学院大学,北京 100049
Li3AlF6熔盐的高温水解性质
郑小北1,2,彭 佳3,高思泽1,2,王晨阳1,2,刘玉侠1,2,*,张 岚1,2,李晴暖1,2
1.中国科学院 上海应用物理研究所,上海 201800;2.中国科学院 核辐射与核能技术重点实验室,上海 201800;3.中国科学院大学,北京 100049
为研究Li3AlF6作为LiF-BeF2模拟盐在混合熔盐中的高温水解行为,首先制备了一定比例的Li3AlF6熔盐,采用X射线衍射法(XRD)、Raman光谱和热重分析(TG-DSC)等分析手段对其结构进行了表征,并对LiF、AlF3及Li3AlF6熔盐的高温水解行为进行了研究。分析结果表明,LiF和AlF3在一定温度和摩尔比条件下可生成不同晶型的Li3AlF6,高温水解与溶解实验及离子色谱分析结果表明,Li3AlF6熔盐的高温水解产物为LiAlO2,且不含氟离子,证明在现有实验条件下可实现该氟化物到氧化物的转化,为后续高温水解实验在水法后处理流程中的应用提供了基础数据。
Li3AlF6熔盐;高温水解;溶解;离子色谱
钍基熔盐堆是第四代反应堆核能系统的六种候选堆型之一,是瞄准未来20~30年后核能产业发展的需求。第四代核能系统的预定目标是具备核燃料长期稳定供应、核废物最小化、本征安全性、物理防核扩散和经济性等要求[1]。钍基熔盐堆的燃料由锂、铍、钍、铀的氟化物组成,反应堆运行一段时间后得到的乏燃料是包括裂变产物在内的多种氟化物混合体系,而经典的钍基核燃料水法后处理均是建立在氧化物体系基础之上。钍基熔盐堆出堆燃料经干法邻堆或在线处理可及时回收大部分的UF4、LiF和BeF2,以对燃料和载体盐循环使用并减少其必要邻堆备用量;另外,由于强放射性氟化物不利于最终的废物处置,需将其转化为氧化物进一步处理。因此,利用成熟的水法技术进一步回收干法尾料中的U、Th、Li、Be及实现氟化物至氧化物的转化对于资源充分利用及废物合理处置都具有十分重要的意义。
氟化物至氧化物固体的转化可利用高温水解技术实现,该技术是在高温条件下将水蒸气通过氟化物,使其与之反应并转化为相应氧化物,通过对水解终产物组分及末端吸收液中氟含量大小来判断水解效率的方法[2-4],其反应方程式如下所示:
2MFn+nH2O=M2On+2nHF
该技术自19世纪初发展起来,最初被用来测定冰晶石及岩石等固体物质中氟的含量大小[5-7],随着技术的发展目前已应用在很多方面,例如国标中二氧化铀芯块中氟含量的测定[8]、放射性废液中氟含量的测定以及熔盐固溶体中金属化合物的分离等[9-10]。目前众多研究者针对不同氟化物的高温水解行为进行了研究[11-14]。
针对钍基熔盐堆乏燃料是个包含多种氟化物的混合体系,为了使高温水解技术能够更好应用于此种堆型的乏燃料后处理流程中,本实验室开展了一系列不同氟化物高温水解性质的研究,在前期实验中已完成ThF4、UF4、SmF3、EuF3、GdF3、DyF3、CeF3和ZrF4等多种单一氟化物的高温水解实验,在一定实验条件下,部分可实现氟化物到其相应氧化物的转化。为便于后期更好地研究混合熔盐的高温水解性质,首先拟对载体盐LiF-BeF2的高温水解性质进行研究,由于BeF2具有高毒特性,同时Be与Al两种元素在周期表中处于对角线位置,符合对角线规则的某些性质,且它们的氟化物均能与碱金属氟化物形成配合物,因此实验中选择AlF3代替BeF2,以LiF-AlF3熔盐模拟LiF-BeF2熔盐并对其高温水解行为进行研究。本工作利用LiF和AlF3制备一定温度和摩尔比条件下Li3AlF6熔盐固溶体,并研究其在一定温度和时间下的高温水解行为,希望能够为后续试验的开展提供基础实验数据。
1 试剂与仪器
LiF粉末,纯度99.99%,上海昭沅仪器设备有限公司;AlF3粉末,优级纯,国药集团化学试剂有限公司;NaOH固体,优级纯,国药集团化学试剂有限公司;氩气,纯度99.99%,上海祥堃特种气体有限公司。
X’Pert Pro MPD X射线多晶衍射仪(XRD),荷兰帕纳科公司;STA449F3同步热分析仪,德国耐驰公司;Lab RAM HR拉曼光谱仪,法国HORIBA Jobin Yvon公司;ICS-2100离子色谱仪,美国热电公司。MS205DU Semi-Micro分析天平,精度0.01 mg,梅特勒-托利多国际贸易(上海)有限公司;手套箱,威格高纯气体设备科技(苏州工业园区)有限公司;熔盐制备炉、高温水解实验装置,上海大恒光学精密机械有限公司;IKA研磨机,上海人和科学仪器有限公司。
2 实验方法
2.1Li3AlF6熔盐的制备
根据文献[15-18]中LiF与AlF3形成共晶盐时最低共熔点的摩尔比,称取不同摩尔比的LiF与AlF3粉末(表1)并在手套箱内充分均匀混合,放入玻碳坩埚中,然后放入熔盐制备炉中,反复抽气补气。在50 min内将温度加热到350 ℃,保温180 min,继续加热至900 ℃,保温180 min,最后缓慢降温至400 ℃再自然冷却。加热过程中通入氩气,以对熔融过程中产生的气体进行吹扫。加热炉冷却后,取出制备的熔盐放入手套箱中,使用研磨机将熔盐磨成粉末。
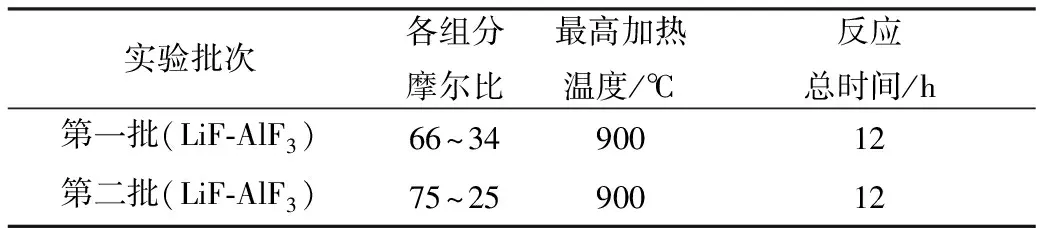
表1 不同摩尔比例的LiF-AlF3熔盐Table 1 LiF-AlF3 molten salt of different mole ratio
2.2LiF、AlF3和Li3AlF6熔盐的高温水解
LiF、AlF3和Li3AlF6熔盐的高温水解实验在如图1所示的装置中进行,主要包括以下几部分:供气系统、水蒸气发生装置、高温反应炉和尾气吸收装置。实验步骤:将待水解的样品平铺在反应舟中,之后将其置于反应管中,程序升温,待反应管达到反应温度(650 ℃)后将水蒸气通入反应管中与反应舟中的样品发生反应,水蒸气流量为3.1×103mL/min。反应3 h后停止通水蒸气,同时向反应管中通氩气赶走反应管中的尾气,实验中产生的HF用一定浓度的碱液吸收,反应炉降至室温后,打开反应管取出反应舟中的样品,溶解反应产物,通过离子色谱分析其中的F-浓度计算水解效率,反应产物用X射线多晶衍射仪分析。

图1 高温水解实验装置图Fig.1 Apparatus for pyrohydrolysis experiments
2.3Li3AlF6熔盐高温水解产物的溶解实验
分别称取0.011 7 g和0.013 2 g两次高温水解产物,向其中各加入4 mL 4 mol/L HNO3溶液,室温下放置一段时间后,样品完全溶解。将样品定容至10 mL,取出一定量样品,稀释100倍,使用离子色谱仪检测其中F-浓度。
2.4测试表征
实验条件:X射线多晶衍射仪,Cu靶,管电压40 kV,管电流40 mA,测角范围10°~100°;拉曼光谱仪,激发波长532 nm,积分时间10 s,积分次数10次;同步热分析仪,升降温速率10 K/min,气氛Ar气,石墨坩埚;离子色谱仪,分析柱为IonPac AS19分离柱(4 mm×250 mm)与AG19保护柱(4 mm×250 mm),淋洗液为KOH 0—8 min 10 mmol/L、8—20 min 35 mmol/L、20—25 min 35 mmol/L、25.2—32 min 10 mmol/L,流速1.00 mL/min,柱箱温度30 ℃,进样体积200 μL,安培检测器。
3 结果与讨论
3.1LiF和AlF3的高温水解实验
图2、图3分别为LiF、AlF3高温水解前后及标准卡片的XRD谱图。从图2、3中可以看出,LiF水解前后组成不变,而AlF3则发生了水解反应,其水解产物为Al2O3。
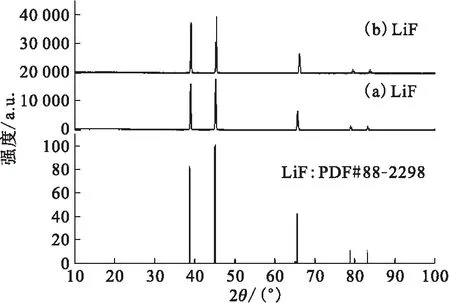
(a)——水解前,(b)——水解后图2 LiF高温水解产物的XRD物相分析Fig.2 XRD analysis of pyrohydrolysis product for LiF
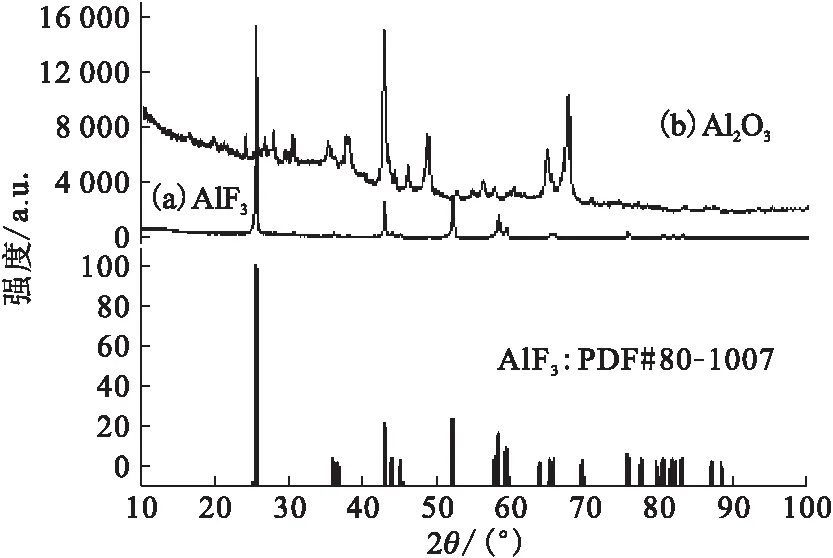
(a)——水解前,(b)——水解后图3 AlF3高温水解产物的XRD物相分析Fig.3 XRD analysis of pyrohydrolysis product for AlF3
3.2LiF-AlF3熔盐的组成
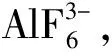
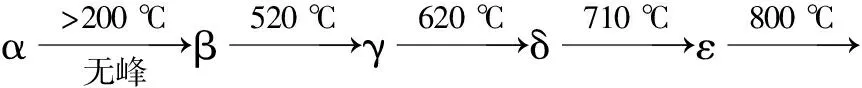
从TG曲线可以看出,在900 ℃附近时,制备的盐由于LiF的挥发而出现了失重现象。
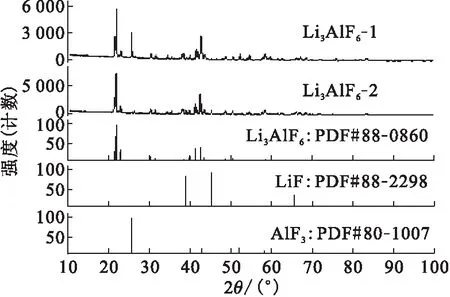
图4 制备的LiF-AlF3熔盐的XRD物相分析Fig.4 XRD analysis of LiF-AlF3 molten salt
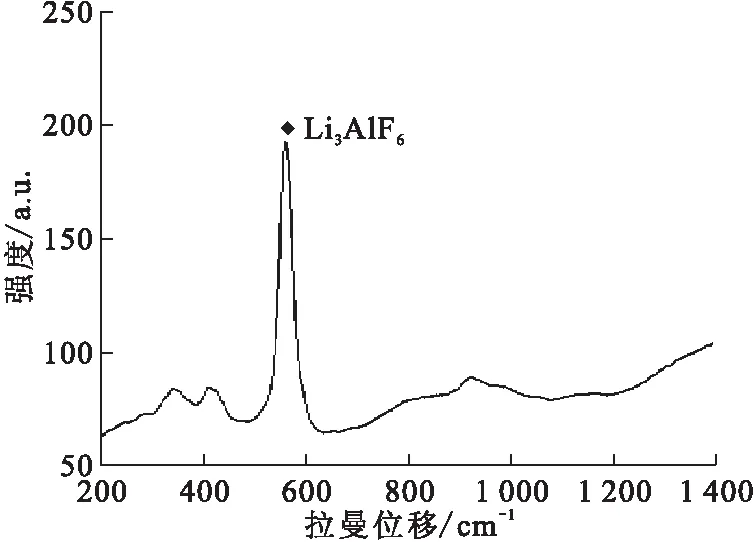
图5 制备的LiF-AlF3熔盐的拉曼谱图Fig.5 Raman analysis of LiF-AlF3 molten salt
3.3Li3AlF6熔盐的高温水解与水解产物溶解实验
图7为两批次Li3AlF6盐高温水解产物的XRD谱图。由图7可以看出,两批次该盐的高温水解产物均为稳定相的γ-LiAlO2,产物组成的晶胞参数分别为a=b=0.516 9 nm,c=0.626 8 nm,α=β=γ=90°,未发现LiF、AlF3及原料盐。可能的反应机理为:Li3AlF6在水解过程中,其中的AlF3水解为Al2O3,Al2O3对氟化物的高温水解有加速作用[5,23],因此其可与LiF反应生成终产物LiAlO2,可表示为:
2AlF3+3H2O=Al2O3+6HF
2LiF+Al2O3+H2O=2LiAlO2+2HF
将水解产物溶解后使用离子色谱法检测其中的F-浓度,在实验条件下未检测到F-峰,表明在现有的实验条件下可实现Li3AlF6氟化物熔盐到其氧化物的转化。
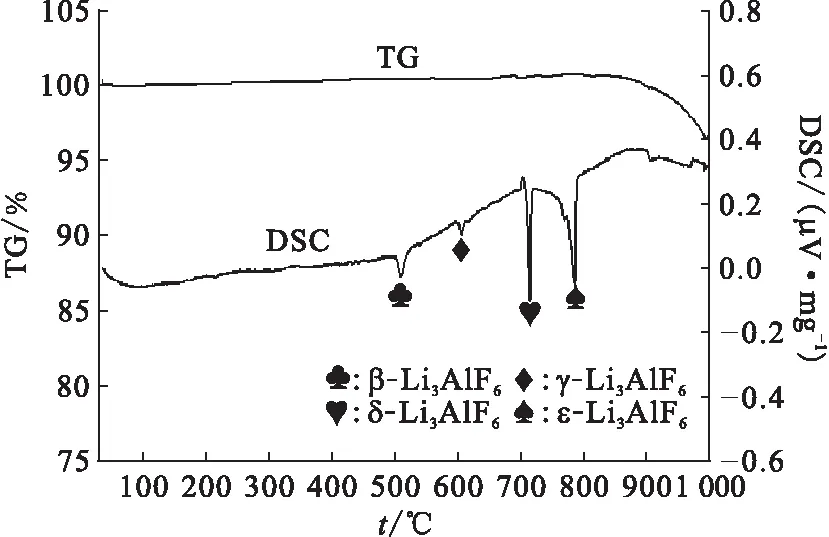
图6 制备的LiF-AlF3熔盐的TG-DSC物相分析Fig.6 TG-DSC analysis of LiF-AlF3 molten salt

图7 Li3AlF6熔盐高温水解产物XRD物相分析Fig.7 XRD analysis of pyrohydrolysis product for Li3AlF6 molten salt
4 结 论
制备了不同比例的Li3AlF6熔盐,分别采用XRD、Raman与TG-DSC等分析方法对其结构进行了分析,结果表明LiF和AlF3在一定温度及摩尔比条件下可形成不同晶型的Li3AlF6熔盐;对制备的Li3AlF6熔盐固溶体高温水解性质的研究结果表明,其水解产物为LiAlO2,可以实现Li3AlF6熔盐氟化物到其氧化物的转化。该实验中一系列数据的获取对即将开展的Li3AlF6与ThF4、UF4等混合熔盐固溶体的高温水解实验有一定的指导意义。
[1] 秋穗正,张大林,苏光辉,等.新概念熔盐堆的固有安全性及相关关键问题研究[J].原子能科学技术,2009,43(增刊):64-75.
[2] 张耀玲,牛励珺,许君政,等. 三氧化铀中微量氟、氯、溴的测定[J].核化学与放射化学,2007,29(4):220-225.
[3] 张黎辉,陈贵福.高温水解-离子色谱法测定核电级二氧化铀中氟、氯、溴、硫[J].湿法冶金,2000,19(1):51-56.
[4] 刘雪峰,刘晶,宋党育,等.用高温水解-离子色谱法研究贵州煤中氟质量分数[J].华中科技大学学报(自然科学版),2008,36(4):84-87.
[5] Silverman H P, Bowen F J. Pyrohydrolysis of cryolite and other fluoride-bearing materials[J]. Anal Chem, 1959, 31(12): 1960-1965.
[6] Sakurai H, Fukuda M, Hayashibe Y, et al. Determination of fluorine in standard rocks by photon activation analysis[J]. J Radioanal Nucl Chem, 1997, 217(2): 267-271
[7] Itoh M, Watanabe K, Hatakeyama M, et al. Determination of36Cl in biological shield concrete using pyrohydrolysis and liquid scintillation[J]. Analyst, 2002, 127(7): 964-966.
[8] 卢鸿琏.GB 11844—89 二氧化铀粉末和芯块中氟的测定:高温水解-离子选择性电极法[S].北京:中国标准出版社,1990:9-12.
[9] Sawant R M, Mahajan M A, Shah U K, et al. Pyrohydrolytic separation technique for fluoride and chloride from radioactive liquid wastes[J]. J Radioanal Nucl Chem, 2011, 287(2): 423-426.
[10] Woo M S, Hwang S C, Shim J B, et al. Separation of zirconium from LiF-BeF2-ZrF4molten-salt by pyrohydrolysis[J]. https:∥www.oecd-nea.org/pt/docs/iem/jeju02/sessionⅡ-11.pdf.
[11] Iwasaki M, Ishikawa N. Pyrohydrolysis reactions of UF4and UO2F2-effect of oxygen on reactions[J]. J Nucl Sci Technol, 1983, 20(5): 400-404.
[12] 康仕芳,赵君.UF4水解反应动力学研究[J].核化学与放射化学,1998,20(4):202-206.
[13] Sawant R M, Mahajan M A, Verma P, et al. Fluoride determination in various matrices relevant to nuclear industry: a review[J]. Radiochim Acta, 2007, 95(10): 585-594.
[14] Lee J E, Edgerton J H, Kelley M T. Pyrohydrolytic separation and spectrophotometric titration of fluorides in radioactive samples[J]. Anal Chem, 1956, 28(9): 1441-1443.
[16] Conocar O, Douyere N, Lacquement J. Extraction behavior of actinides and lanthanides in a molten fluoride/liquid aluminum system[J]. J Nucl Mater, 2005, 344(1-3): 136-141.
[17] Dewing E W. Thermodynamic functions for LiF-AlF3mixtures at 1293 K[J]. Metall Trans B, 1980, 11(2): 245-249.
[18] Dewing E W. Thermodynamics of the system LiF-AlF3[J]. J Electrochem Soc: Electrochemical Science and Technology, 1976, 123(9): 1289-1294.
[19] Ratkje S K, Rytter E. Raman spectra of molten mixtures containing aluminum fluorideⅠ: the LiF-Li3AlF6eutectic mixture[J]. J Phy Chem, 1974, 78(15): 1499-1502.
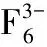
[21] Garton G, Wanklyn B M. Polymorphism in Li3AlF6[J]. J Inorg Nuel Chem, 1965, 27(11): 2466-2469.
[22] Holm J L, Jenssen B. A note on the polymorphy and structure of Li3AlF6[J]. Acta Chem Scand, 1969, 23(23): 1065-1068.
[23] Lee J E, Edgerton J H, Kelley M T. Pyrohydrolytic separation and spectrophoto-metric titration of fluorides in radioactive samples[J]. Anal Chem, 1956, 28(9): 1441-1443.
PyrohydrolysisofLi3AlF6MoltenSalt
ZHENG Xiao-bei1, 2, PENG Jia3, GAO Si-ze1, 2, WANG Chen-yang1, 2,LIU Yu-xia1, 2, *, ZHANG Lan1, 2, LI Qing-nuan1, 2
1.Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201800, China; 2.Key Laboratory of Nuclear Radiation and Nuclear Energy Technology, Chinese Academy of Sciences, Shanghai 201800, China; 3.University of Chinese Academy of Sciences, Beijing 100049, China
Here, Li3AlF6was adopted as a substitute salt for LiF-BeF2to study its pyrohydrolysis behavior in the mixed molten salts. Different molar rations of Li3AlF6was firstly prepared, with its structure being characterized using X-ray diffraction (XRD), raman spectroscopy, thermogravimetry (TG), and differential scanning calorimetry (DSC) respectively. The pyrohydrolysis behavior of Li3AlF6was carried out on our self-made apparatus. The results indicate that Li3AlF6with different crystal structures can be synthesized by varying the conditions like temperature and LiF/AlF3molar ratio. LiAlO2in the absence of F-ions is confirmed to be the pyrohydrolysis product of Li3AlF6, indicating that the complete conversion of the fluorides into the corresponding oxides, which can provide fundamental information for the following experiments in the aqueous-reprocessing process.
Li3AlF6molten salt; pyrohydrolysis; dissolution; ion chromatography
TL241.1
A
0253-9950(2017)05-0345-05
2016-04-27;
2016-12-05
中国科学院战略性先导科技专项资助项目(No.XDA02030400)
郑小北(1985—),男,安徽宿州人,硕士,放射化学专业,E-mail: zhengxiaobei1112@163.com
*通信联系人:刘玉侠(1979—),女,安徽阜阳人,博士,副研究员,无机化学专业,E-mail: liuyuxia@sinap.ac.cn
10.7538/hhx.2017.YX.2016047
