白介素5/TNFRSF13B在深部浸润型子宫内膜异位症微环境中的表达及其意义研究
2017-11-01蒋春樊哈春芳
杨 眉,蒋春樊,哈春芳
·论著·
白介素5/TNFRSF13B在深部浸润型子宫内膜异位症微环境中的表达及其意义研究
杨 眉1,2,蒋春樊3,哈春芳4*
目的探讨深部浸润型子宫内膜异位症(DIE)与正常子宫内膜组织中白介素5(IL-5)、TNFRSF13B表达的差异。方法选取2015年12月—2016年12月襄阳市中心医院妇科15例因DIE行手术治疗的患者为实验组,同期15例因输卵管再通行腹腔镜或开腹手术的患者作为对照组。选取基因芯片、实时荧光定量聚合酶链式反应(PCR)、酶联免疫吸附试验(ELISA)、免疫组织化学、Western blotting等方法检测IL-5及TNFRSF13B的表达。结果KEGG 信号通路分析结果显示涉及免疫应答的hsa04672(intestinal immune network for IgA production)通路在DIE中高表达,故对于主要涉及的IL-5、TNFRSF13B基因进行进一步分析。实时荧光定量PCR显示,实验组IL-5、TNFRSF13B mRNA相对表达水平高于对照组(P<0.05)。ELISA显示实验组患者腹腔液及腺上皮细胞上清液中IL-5表达水平均高于对照组(P<0.05)。免疫组织化学及Western blotting显示,实验组TNFRSF13B表达水平高于对照组(P<0.05)。结论IL-5及TNFRSF13B在DIE微环境中高表达,可能与DIE患者体内免疫机制异常有关,促使炎症形成而偏向免疫耐受,促使异位内膜腺上皮细胞在腹腔中种植生长。
子宫内膜异位症;白介素5;跨膜激活剂与CAML交互蛋白质
本研究背景:
子宫内膜异位症是一种激素依赖性、 进展性疾病,以痛经、慢性盆腔疼痛及月经紊乱为主要临床症状。其发病率及复发率较高,严重影响女性健康;目前治疗方式主要是以手术和药物治疗为主,但治疗后复发率高,尤其是病灶浸润深度≥5 mm的深部浸润型子宫内膜异位症(DIE),常伴有严重的盆腔粘连,手术难度大,故难以达到有效的治疗,复发率高。研究显示子宫内膜异位症与内膜细胞的异常黏附和侵袭性增强有关,腹腔内环境中的炎性递质、氧化应激和铁超负荷等微环境因素在疾病发生、发展中发挥了重要作用,而进一步通过对子宫内膜异位症患者腹腔内免疫细胞、细胞因子等变化的研究证实,子宫内膜异位症可能与机体免疫机制异常有关。研究表明,免疫机制异常导致免疫细胞活化,释放出白介素(IL)、肿瘤坏死因子α(TNF-α)、血管内皮生长因子(VEGF)等一系列细胞因子,从而进一步加重了免疫机制的紊乱,导致恶性循环,促使子宫内膜异位症的增殖、发展。有研究认为,子宫内膜异位症也可能是一种自身免疫性疾病。故本研究通过实时荧光定量聚合酶链式反应(PCR)、酶联免疫吸附试验(ELISA)、免疫组织化学、Western blotting等方法检测免疫相关IL-5、TNFRSF13B的表达,探讨相关因子在DIE中表达的意义。
子宫内膜异位症是一种女性常见病,以痛经、慢性盆腔疼痛、不孕为特征,经血逆流学说是较为公认的发病机制,但经血逆流非常普遍,但仅有10%~15%的女性发生子宫内膜异位症[1]。近年来,研究显示免疫机制异常对个体是否发生子宫内膜异位症起到非常重要的作用,免疫系统的改变也被认为是子宫内膜异位症进展的因素之一[2-3]。而高侵袭性的深部浸润型子宫内膜异位症(deep infiltrating endometriosis,DIE)常累及重要脏器,盆腔粘连严重,治疗难度较大,复发率高[4-5],故本研究选取DIE进行研究,临床意义重大。本研究通过基因芯片技术,利用KEGG 信号通路分析差异表达基因,选取涉及免疫应答的hsa04672(intestinal immune network for IgA production)通路,对于主要涉及的白介素5(IL-5)及TNFRSF13B等免疫相关基因,进一步通过实时荧光定量聚合酶链式反应(PCR)、酶联免疫吸附试验(ELISA)、免疫组织化学、Western blotting等方法检测了其在DIE患者腹腔液、子宫内膜组织及腺上皮细胞中的表达,探讨相关因子在DIE中表达的意义。
1 材料与方法
1.1 标本来源 标本均取自2015年12月—2016年12月襄阳市中心医院妇产科,患者均知情同意,并签署知情同意书。本研究经襄阳市中心医院伦理委员会批准。选取15例因DIE行手术治疗患者的子宫内膜组织为实验组,年龄23~48岁,平均年龄(38.5±7.8)岁;均为Ⅳ期(根据美国1985年修订的子宫内膜异位症分期标准[6]),且切除标本经病理科证实诊断为DIE患者。同时,选取同期15例因输卵管再通行腹腔镜或开腹手术患者的子宫内膜组织为对照组,年龄29~45岁,平均年龄(35.4±5.2)岁,患者均有规律的月经周期,基础体温均为双相型,近3个月均未接受过激素类药物治疗,无重大内科及外科合并症。两组年龄比较,差异无统计学意义(t=1.281,P=0.211)实验组及对照组患者均在术前1 d行诊刮术取子宫内膜组织活检,在术中抽取腹腔液2~5 ml,并采集实验组深部结节病灶,以上标本均在严格无菌条件下进行保存。
1.2 基因芯片筛选DIE差异表达基因 采用上海康成生物工程有限公司提供的Roche NimbleGen 12×135K人类基因表达谱芯片。用Trizol总RNA抽提试剂盒(Invitrogen)对子宫内膜组织进行裂解,并进行RNA纯化。用紫外分光光度计分别测定其在260 nm和280 nm处的吸光度值,对RNA的纯度和浓度进行定量计算。琼脂糖凝胶电泳检测RNA完整性。以5 μg纯化的总RNA为模板,使用Invitrogen SuperScript的ds-cDNA合成试剂盒,通过反转录合成双链cDNA标记探针,将纯化的ds-cDNA探针与芯片于42 ℃杂交16~20 h。芯片扫描采用Axon GenePix 4000B microarray scanner软件。再利用Agilent GeneSpring GX v12.1对结果进行进一步分析。不同批次样本重复3次。
1.3 实时荧光定量PCR法检验IL-5、TNFRSF13B mRNA表达 总RNA提取同前,引物利用Primer Premier 5.0软件进行设计,IL-5上游引物:5′-GAGCCACATACACCTCCATC-3′,下游引物:5′-TGCCTAATAATGGCATATCG-3′,TNFRSF13B上游引物:5′-TCCCTCCCTGACCCCCATT-3′,下游引物:5′-GGACCCCCGACCCCACTTG-3′。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系包括:12 μl经变性处理的RNA溶液,2 μl dNTP混合物,1 μl RNA酶抑制剂(10 U/μl),4 μl 5×RT Buffer,1 μl ReverTra Ace,总体积共20 μl。反应程序为:先在94 ℃预变性5 min,再于94 ℃变性30 s,第二步于56 ℃退火30 s,第三步于72 ℃延伸30 s,以上3个步骤共循环40次。72 ℃再延伸7 min。4 ℃保存。双ΔCt法计算IL-5、TNFRSF13B mRNA相对表达量。实验重复5次。
1.4 子宫内膜腺上皮细胞的分离与原代培养 诊刮取得子宫内膜组织,在低温条件下迅速送往实验室。用无酚红Hank′s平衡盐溶液将取得的子宫内膜组织清洗3次,剪成1 mm×1 mm×1 mm大小,胶原酶Type Ⅳ在37 ℃消化子宫内膜组织40 min。稍作沉淀,未被消化的子宫内膜组织沉淀后被分离出,再进行下一次消化。上清液以500 r/min离心1 min(离心半径16 cm),悬浮于其中的腺上皮细胞和间质细胞被差速离心而分离开。以无酚红的DMEM/Ham′s F12溶液(含10%胎牛血清、100 μg/ml链霉素、100 U/ml青霉素及2 μg/ml氟康唑)培养子宫内膜腺上皮细胞,至细胞达到90%融合。
1.5 ELISA法检测IL-5的表达 用IL-5的ELISA试剂盒(R&D Systems)检测腹腔液及腺上皮细胞上清液中IL-5表达水平,实验步骤参考试剂盒说明书。实验重复5次。
1.6 免疫组织化学法检测TNFRSF13B的表达 实验组及对照组子宫内膜组织采用4%中性甲醛溶液固定,石蜡包埋,切成4 μm切片,二甲苯脱蜡,加入小鼠抗人TNFRSF13B单克隆抗体(美国Abcam公司,1∶100稀释),在4 ℃孵育过夜。二氨基联苯胺(DAB)显色,显微镜下等同条件下观察并拍照。应用Image Proplus 6.0图像分析系统进行图像分析,每张切片选取5个高倍(×400)视野,再分别计算每高倍镜视野下的TNFRSF13B的IOD值,即TNFRSF13B表达水平。
1.7 Western blotting法检测TNFRSF13B的表达 用含10 μl蛋白酶抑制剂混合物的RIPA裂解实验组子宫内膜腺上皮细胞,提取蛋白质并检测浓度,制备十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE),蛋白样本上样后进行电泳分离,转膜、封闭后,先后加入一抗、二抗进行孵育,增强化学发光法(ECL)检测TNFRSF13B的表达,最后采用Image J软件扫描所得胶片的灰度值。实验重复5次。

2 结果
2.1 基因芯片筛选DIE差异表达基因 KEGG信号通路分析结果显示DIE差异表达基因涉及免疫应答、炎性反应、细胞代谢等(见图1),本研究选取涉及免疫应答的hsa04672(intestinal immune network for IgA production)通路,并对其中涉及的IL-5及TNFRSF13B基因进行进一步分析。
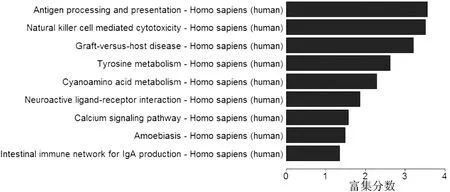
图1 基因芯片筛选DIE差异表达基因结果(KEGG信号通路分析)
Figure1 Results of KEGG pathway analysis of the cDNA microarray results for screening the genes expressing in DIE differently from in the normal endometrium
2.2 实时荧光定量PCR法检测IL-5、TNFRSF13B mRNA表达 对照组子宫内膜组织IL-5、TNFRSF13B mRNA表达量设定为1,实验组子宫内膜组织中IL-5、TNFRSF13B mRNA相对表达量分别为(3.38±0.75)、(4.12±0.92),实验组IL-5、TNFRSF13B mRNA相对表达水平高于对照组,差异均有统计学意义(tIL-5=-2.010,tTNFRSF13B=-2.806,P<0.05)。
2.3 ELISA法检测IL-5的表达 实验组患者腹腔液及腺上皮细胞上清液中IL-5表达水平均高于对照组,差异有统计学意义(P<0.05,见表1)。


组别例数腹腔液腺上皮细胞上清液对照组1521.0±6.5151.4±32.8实验组1537.3±2.7526.8±46.4t值3.3185.904P值0.0120.008
2.4 免疫组织化学法检测TNFRSF13B的表达 TNFRSF13B主要表达于腺上皮细胞的胞膜与胞质中,实验组TNFRSF13B表达水平为(5.378±1.265),对照组TNFRSF13B表达水平为(1.238±0.627),实验组TNFRSF13B表达水平高于对照组,差异有统计学意义(t=3.154,P=0.010,见图2,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。

注:A为实验组,B为对照组
图2 免疫组织化学检测实验组及对照组TNFRSF13B的表达(DAB显色,×400)
Figure2 Expression levels of TNFRSF13B measured by immunohistochemistry with DAB in the experimental group and control group
2.5 Western blotting法检测TNFRSF13B的表达 实验组TNFRSF13B表达水平为(59.328±9.082),对照组TNFRSF13B表达水平为(4.365±2.131),实验组TNFRSF13B表达水平高于对照组,差异有统计学意义(t=-2.702,P=0.001,见图3)。

图3 Western blotting法检测实验组及对照组TNFRSF13B的表达
Figure3 Expression levels of TNFRSF13B measured by western blotting in the experimental group and control group
3 讨论
逆流至盆腔的子宫内膜组织在正常情况下能够被免疫系统识别并清除,但在子宫内膜异位症患者体内,异位内膜却可以异地种植生长,尤其对于DIE,病灶常侵犯子宫骶韧带、阴道、膀胱、输尿管、肠道等,手术切除难度大,术后辅助药物治疗仍以雌孕激素相关药物为主,复发率高。以上好发部位与腹腔液的流动及聚积特点密切相关。研究显示:子宫内膜异位症患者体内免疫机制可能存在异常[2]。众多研究显示,子宫内膜异位症患者的腹膜中存在免疫相关细胞和巨噬细胞的功能失调,活化免疫细胞,参与异位病灶的种植,分泌大量细胞因子、生长因子和血管生成因子[3,7-9]。同时,在子宫内膜异位症患者体内还存在着系统性的免疫改变,活化了外周血单核细胞,从而分泌大量细胞因子[3]。本研究通过DIE基因表达谱芯片筛选出与免疫相关的通路,并进行进一步分析。
本研究结果显示,基因芯片技术筛选得出IL-5及TNFRSF13B等免疫相关基因在DIE中高表达,实时荧光定量PCR结果也证实了这一结果。IL-5为分泌型表达的细胞因子,故本研究进一步检测了其在腹腔液及腺上皮细胞上清液中的表达,实验组均高于对照组。而通过免疫组织化学实验发现,TNFRSF13B主要在腺上皮细胞的胞膜及胞质中表达,实验组高于对照组,用Western blotting进一步检测了其在子宫内膜腺上皮细胞中的表达,实验组同样高于对照组。
MONSANTO等[7]研究证实IL-5在子宫内膜异位症病灶中表达明显高于在位子宫内膜组织,在早期的子宫内膜异位症患者中尤为明显。IL-5在被过敏原致敏的组织内,由肥大细胞制造的晚期超敏反应中,IL-5发挥了主导作用[8-9]。IL-5在子宫内膜异位症患者的局部炎性反应中起主导作用,并在子宫内膜异位症病灶建立的疾病早期过程中起重要作用。
研究表明,由腺上皮细胞、成纤维细胞、循环中的单核细胞等分泌的IL-5与转化生长因子β(TGF-β)等细胞因子一起促进TNFRSF13B的表达[10],TNFRSF13B又称TACI,属Ⅰ型跨膜糖蛋白,位于13q32-34,是肿瘤坏死因子受体之一,文献报道,TNFRSF17/TNFRSF13B和TNFRSF13C通过与TNFSF13B/TNFSF13/TWE-PRIL结合,形成三聚体,启动信号转导,具有杀伤肿瘤细胞、诱导细胞增殖等多种生物学功能,并参与复杂的免疫反应及病理损伤;不仅参与B淋巴细胞的活化,也参与T淋巴细胞的激活[11]。

综上所述,子宫内膜异位症是多基因多机制相互作用的结果,子宫内膜异位症患者腹腔中存在着炎症与免疫耐受的平衡。本研究探讨了DIE微环境中IL-5、TNFRSF13B的高表达及其意义,接下来还将进一步对通路上相关因子的相互作用做深入的研究。DIE需要在手术治疗之后辅以综合治疗,子宫内膜异位症免疫机制的研究可能为临床治疗提供依据。
作者贡献:杨眉进行文章的构思与设计,数据整理,统计学处理,结果的分析与解释,撰写论文,论文的修订,对文章整体负责,监督管理;杨眉、蒋春樊进行研究的实施与可行性分析,数据收集;哈春芳负责文章的质量控制及审校。
本文无利益冲突。
[1]BULUN S E.Endometriosis[J].N Engl J Med,2009,360(3):268-279.DOI:10.1056/NEJMra0804690.
[2]ACIÉN P,VELASCO I.Endometriosis:a disease that remains enigmatic[J].ISRN Obstet Gynecol,2013,2013:242149.DOI:10.1155/2013/242149.
[3]LESSEY B A,YOUNG S L.Homeostasis imbalance in the endometrium of women with implantation defects:the role of estrogen and progesterone[J].Semin Reprod Med,2014,32(5):365-375.DOI:10.1055/s-0034-1376355.
[4]FERMAUT M,NYANGOH TIMOH K,LEBACLE C,et al.Deep infiltrating endometriosis surgical management and pelvic nerves injury[J].Gynecol Obstet Fertil,2016,44(5):302-308.DOI:10.1016/j.gyobfe.2016.03.007.
[5]KUPELIAN A S,CUTNER A.Segmental bowel resection for deep infiltrating endometriosis[J].BJOG,2016,123(8):1368.DOI:10.1111/1471-0528.14030.
[6]BUTTRAM V C Jr.Evolution of the revised American Fertility Society classification of endometriosis[J].Fertil Steril,1985,43(3):347-350.
[7]MONSANTO S P,EDWARDS A K,ZHOU J,et al.Surgical removal of endometriotic lesions alters local and systemic proinflammatory cytokines in endometriosis patients[J].Fertil Steril,2016,105(4):968-977.DOI:10.1016/j.fertnstert.2015.11.047.
[8]MALUTAN A M,DRUGAN T,COSTIN N,et al.Pro-inflammatory cytokines for evaluation of inflammatory status in endometriosis[J].Cent Eur J Immunol,2015,40(1):96-102.DOI:10.5114/ceji.2015.50840.
[9]BORRELLI G M,CARVALHO K I,KALLAS E G,et al.Chemokines in the pathogenesis of endometriosis and infertility[J].J Reprod Immunol,2013,98(1/2):1-9.DOI:10.1016/j.jri.2013.03.003.
[10]KOURO T,TAKATSU K.IL-5- and eosinophil-mediated inflammation:from discovery to therapy[J].Int Immunol,2009,21(12):1303-1309.DOI:10.1093/intimm/dxp102.
[11]NG L G,MACKAY C R,MACKAY F.The BAFF/APRIL system:life beyond B lymphocytes[J].Mol Immmunol,2005,42(7):763-772.DOI:10.1016/j.molimm.2004.06.041.
[12]徐燕颖,尹利荣.子宫内膜异位症淋巴细胞亚群分布研究[J].国际妇产科学杂志,2008,35(4):300-302.DOI:10.3969/j.issn.1674-1870.2008.04.023.
XU Y Y,YIN L R.Distribution of lymphocyte subsets in ectopic and eutopic endometrium during endometriosis[J].Journal of International Obstetrics and Gynecology,2008,35(4):300-302.DOI:10.3969/j.issn.1674-1870.2008.04.023.
[13]凌丽.子宫内膜异位症免疫机制研究进展[J].国际妇产科学杂志,2015,42(1):33-37.
LING L.Progress of immunologic mechanism in endometriosis[J].Journal of International Obstetrics and Gynecology,2015,42(1):33-37.
[14]FUNAMIZU A,FUKUI A,KAMOI M,et al.Expression of natural cytotoxicity receptors on peritoneal fluid natural killer cell and cytokine production by peritoneal fluid natural killer cell in women with endometriosis[J].Am J Reprod Immunol,2014,71(4):359-367.DOI:10.1111/aji.12206.
[15]XU H,ZHANG T,MAN G C,et al.Vascular endothelial growth factor C is increased in endometrium and promotes endothelial functions,vascular permeability and angiogenesis and growth of endometriosis[J].Angiogenesis,2013,16(3):541-551.DOI:10.1007/s10456-013-9333-1.
[16]TAO Y,ZHANG Q,HUANG W,et al.The peritoneal leptin,MCP-1 and TNF-α in the pathogenesis of endometriosis-associated infertility[J].Am J Reprod Immunol,2011,65(4):403-406.DOI:10.1111/j.1600-0897.2010.00920.x.
[17]KATAOKA K,FUJIHASHI K,TERAO Y,et al.Oral-nasopharyngeal dendritic cells mediate T cell-independent IgA class switching on B-1 B cells[J].PLoS One,2011,6(9):e25396.DOI:10.1371/journal.pone.0025396.
ExpressionofIL-5andTNFRSF13BinDeepInfiltratingEndometrioticMilieuandItsClinicalSignificance
YANGMei1,2,JIANGChun-fan3,HAChun-fang4*
1.DepartmentofObstetricsandGynecology,XiangyangCentralHospital/AffiliatedHospitalofHubeiUniversityofArtsandScience,Xiangyang441021,China2.NingxiaMedicalUniversity,Yinchuan750001,China3.DepartmentofPathology,XiangyangCentralHospital/AffiliatedHospitalofHubeiUniversityofArtsandScience,Xiangyang441021,China4.DepartmentofGynecology,GeneralHospitalofNingxiaMedicalUniversity;KeyLaboratoryofFertilityPreservation,NingxiaMedicalUniversity,Yinchuan750001,China
*Correspondingauthor:HAChun-fang,Chiefphysician;E-mail:hachunfang@163.com
ObjectiveTo investigate the difference in the expressions of IL-5 and TNFRSF13B in deep infiltrating endometriosis(DIE) versus those in the normal endometrium.MethodsThe enrolled participants were 30 cases who
inpatient treatment in Department of Gynecology,Xiangyang Central Hospital from December 2015 to December 2016,including 15 cases with surgery due to DIE(experimental group),and 15 cases with laparoscopic or open surgery due to fallopian tube recanalization(control group).cDNA microarray,RT-PCR,ELISA,immunohistochemistry and Western blotting were used to detect the expressions of IL-5 and TNFRSF13B in both the DIE and the normal endometrium.ResultsKyoto Encyclopedia of Genes and Genomes(KEGG) pathway analysis of the cDNA microarray results was performed to screen the genes which expressed in DIE differently from in the normal endometrium,and the results demonstrated that intestinal immune network for IgA production(hsa04672) associated with immune response expressed more highly in DIE,and IL-5 and TNFRSF13B genes in this pathway were chosen for in-depth study.The mRNA expression levels of IL-5 and TNFRSF13B in endometrium epithelium cells(EECs) measured by RT-PCR were much higher in the experimental group than in the control group(P<0.05).The protein expression levels of IL-5 in both the peritoneal fluid and epithelial cells supernatant detected by ELISA were higher in the experimental group than in the control group(P<0.05).The protein expression levels of TNFRSF13B in EECs measured by immunohistochemistry was higher in the experimental group than in the control group(P<0.05).The experimental group had higher protein expression levels of TNFRSF13B in EECs measured by Western blotting than the control group did(P<0.05).ConclusionIncreased expressions of IL-5 and TNFRSF13B in DIE may be associated with the abnormal immune system of DIE patients.The pro-inflammatory and tolerant state of the immune system coexisted in the endometriotic milieu.It can promote the implantation and growth of EECs in abdominal cavity.
Endometriosis;Interleukin-5;Transmembrane activator and CAML interactor protein
R 711.71
A
10.3969/j.issn.1007-9572.2017.06.y31
2017-04-11;
2017-06-05)
(本文编辑:陈素芳)
国家自然科学基金资助项目(81660251);宁夏科技攻关项目(2016KJHM52);生殖与遗传基础及临床研究创新团队开放课题(220/2002080102)
1.441021湖北省襄阳市中心医院 湖北文理学院附属医院妇产科
2.750001宁夏银川市,宁夏医科大学
3.441021湖北省襄阳市中心医院 湖北文理学院附属医院病理科
4.750001宁夏银川市,宁夏医科大学总医院妇科,宁夏医科大学生育力保持重点实验室
*通信作者:哈春芳,主任医师;E-mail:hachunfang@163.com
杨眉,蒋春樊,哈春芳.白介素5/TNFRSF13B在深部浸润型子宫内膜异位症微环境中的表达及其意义研究[J].中国全科医学,2017,20(29):3628-3632.[www.chinagp.net]
YANG M,JIANG C F,HA C F.Expression of IL-5 and TNFRSF13B in deep infiltrating endometriotic milieu and its clinical significance[J].Chinese General Practice,2017,20(29):3628-3632.
