基于UHPLC/Q-TOF/MS分析羊耳菊有效组分的入血成分
2017-11-01巩仔鹏陈亭亭侯靖宇吴林霖李月婷陈思颖兰燕宇
巩仔鹏,陈亭亭,侯靖宇,吴林霖,李 梅,李月婷,陈思颖,兰燕宇
(贵州医科大学 1. 贵州省药物制剂重点实验室、2. 民族药与中药开发应用教育部工程研究中心、3. 药学院、4. 国家苗药工程研究中心,贵州 贵阳 550004)
◇中药药理学◇
基于UHPLC/Q-TOF/MS分析羊耳菊有效组分的入血成分
巩仔鹏1,2,3,4,陈亭亭1,2,3,4,侯靖宇1,2,3,4,吴林霖1,2,3,4,李 梅1,2,3,4,李月婷1,2,3,4,陈思颖1,2,3,4,兰燕宇1,2,3,4
(贵州医科大学 1. 贵州省药物制剂重点实验室、2. 民族药与中药开发应用教育部工程研究中心、3. 药学院、4. 国家苗药工程研究中心,贵州 贵阳 550004)
目的应用UHPLC/Q-TOF/MS技术和血清药物化学研究手段,分析检测羊耳菊有效组分的入血成分。方法大鼠灌胃给予羊耳菊有效组分提取物后,腹主动脉抗凝采血,血浆经甲醇二次沉淀蛋白处理。采用Eclipse Plus C18RRHD色谱柱(2.1 mm×100 mm,1.8 μm),0.1%甲酸水(A)-0.1%甲酸乙腈(B)做流动相梯度洗脱,流速0.3 mL·min-1。负离子检测模式,同时结合布鲁克道尔顿公司的Metabolite Tools软件,鉴定和表征其血中的移行成分。结果给药后,在大鼠血浆中共检测到16个代谢产物,包括9个原型成分和7个代谢物,代谢方式主要以咖啡酰基奎宁酸类化合物的异构化、甲基化及甲基葡萄糖醛酸化的复合反应为主。结论本研究较为全面地阐释了羊耳菊活性部位提取物在大鼠血中的入血成分,为进一步研究羊耳菊药材的体内过程和药效物质基础提供了一定的参考。
羊耳菊;血浆;入血成分;UHPLC/Q-TOF/MS;血清药物化学;代谢物
羊耳菊(Inulacappa) 为贵州苗族常用药材,苗族名“Bex nioux dant”(近似译为“白牛胆”),常用于病毒性感冒、痈疮、乳痈、风湿疼痛等症,收载于《苗族医药学》、《中国民族药志》等著作[1-2]。国内外文献报道的羊耳菊药材主要成分有木犀草素、木犀草素-7-O-β-D-芸香糖苷、木犀草素-7-O-β-D-葡萄糖醛酸乙酯苷、木犀草素-7-O-β-D-葡萄糖苷、芹菜素、芹菜素-7-O-β-D-葡萄糖苷、芹菜素-5-O-β-D-葡萄糖苷等黄酮类[3]、1,5-O-二咖啡酰基奎宁酸、1,3,5-O-三咖啡酰基奎宁酸、3,5-O-二咖啡酰基奎宁酸甲酯、3,4-O-二咖啡酰基奎宁酸甲酯、3,4-O-二咖啡酰基奎宁酸乙酯、4,5-O-二咖啡酰基奎宁酸乙酯、3,5-O-二咖啡酰基奎宁酸、3,4-O-二咖啡酰基奎宁酸等酚酸类[4],以及香豆素、挥发油等[5]。近年来,对羊耳菊及其制剂的抗炎、抗微生物、抗病毒药理活性[6-7]也有部分报道,但对于其在体内的直接活性物质基础并未有明确阐释。在中药复杂成分的研究中,普遍认为,中药只有被吸收入血的成分才有可能是中药发挥药效的活性成分,因此,准确快速分析中药口服入血成分,也是深入研究中药作用机制的重要基础[8]。本文采用UHPLC/Q-TOF/MS法,结合血清药物化学实验方法,对大鼠给药后的血浆样品进行检识,比较分析空白血浆、含药血浆和差异图谱,结合相关代谢软件和对照品,对所得代谢物进行结构确认,推测出羊耳菊有效组分中主要化合物可能的代谢途径,为羊耳菊药材的体内过程研究奠定基础。
1 材料
1.1仪器超高效液相色谱-四级杆-飞行时间串联质谱仪(Agilent Technologies 1290 Infinity液相色谱系统,布鲁克道尔顿四极杆-飞行时间质谱仪);Allegra 64R低温高速离心机(Beckman Coulter);MTN-2800D氮吹仪(天津奥特塞恩斯仪器有限公司)。
1.2药物与试剂木犀草苷、绿原酸对照品(批号:111720-201408、110753-201415)均购于中国食品药品检定研究院;新绿原酸、隐绿原酸、1,3-O-二咖啡酰基奎宁酸、3,4-O-二咖啡酰基奎宁酸、3,5-O-二咖啡酰基奎宁酸、4,5-二-O-咖啡酰基奎宁酸对照品(批号:X20-20141012、Y58-20141012、1384-101215、1384-101215、S34-110121、1384-101215)均购于中药固体制剂制造技术国家工程研究中心;羊耳菊药材购自贵州龙里县,由贵州医科大学药学院生药学教研室龙庆德副教授鉴定为菊科植物羊耳菊Inulacappa(Buch.-Ham.ex D.Don)DC.的干燥全草。
1.3实验动物健康SD大鼠,♀♂兼用,体质量为(250±20) g,由重庆腾鑫生物技术有限公司提供,合格证号:SCXK (渝)2015-0001。
2 方法
2.1色谱条件色谱柱:Agilent Eclipse Plus C18RRHD(2.1 mm×100 mm,1.8μm);柱温:40℃;流动相:0.1%甲酸乙腈(A)-0.1%甲酸水(B);进样体积为5 μL。梯度洗脱条件:0~1 min,5%~10%(A);1~13 min,10%~28%(A);13~16 min,28%~100% (A),16~17 min,100%~100%(A),17~18 min,100%~5%(A)。
2.2质谱条件电喷雾离子源;扫描方式为正、负离子扫描(ESI+、ESI-,m/z 50~1 000);毛细管电压:ESI-(3.5 kV)、ESI+ (4 kV);离子源温度: 200℃;雾化气(N2)压力:1.2 bar;干燥气温度:200 ℃;气体体积流量:6 L·min-1;准确质量测定采用甲酸钠校正标准液;校正模式选用:Enhanced Quadratic;数据分析:Data Analysis软件、Metabolite Tools®、质量亏损过滤(MDF)等。
2.3羊耳菊有效组分提取物的制备通过实验室前期药效学实验筛选,确定羊耳菊有效组分的提取方式。取羊耳菊药材12 kg,充分混匀,取10倍量体积分数为0.6的乙醇,提取3次,每次1 h,合并3次滤液,减压浓缩,回收乙醇,得12 L浓缩液。上述浓缩液用D101大孔树脂吸附(径高比1 ∶4),加水洗脱至流出液无颜色后,再用体积分数为0.6的乙醇洗脱,收集洗脱液,蒸干,得浸膏,微波真空干燥即得,得膏率为7%。经测定,羊耳菊提取物中东莨菪苷、木犀草苷、1,3-二咖啡酰基奎宁酸、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、4,5-二咖啡酰基奎宁酸、新绿原酸、绿原酸、隐绿原酸的含量依次为0.29%、0.74%、2.01%、3.82%、3.56%、3.87%、2.17%、0.99%、3.36%。-4℃条件干燥保存,备用。
2.4供试液样品的制备称取提取物粉末1 g,精密称定,加入10 mL体积分数为0.5的甲醇水,超声10 min,15 000 r·min-1离心 10 min,取上清液即得,备用。
2.5标准品溶液的制备分别精密称取绿原酸等8种对照品,于10 mL容量瓶中,加甲醇超声溶解,定容。得绿原酸(0.740 g·L-1)、新绿原酸(1.032 g·L-1)、隐绿原酸(1.026 g·L-1)、1,3-二咖啡酰基奎宁酸(1.064 g·L-1)、木犀草苷(1.014 g·L-1)、3,4-二咖啡酰基奎宁酸(1.032 g·L-1)、3,5-二咖啡酰基奎宁酸(1.194 g·L-1)、4,5-二咖啡酰基奎宁酸(1.204 g·L-1)的标准品溶液。置冰箱(-20 ℃)保存,备用。
2.6样品处理方法取大鼠血浆1 mL,加入50 μL体积分数为0.001的甲酸水,加2 mL甲醇,涡混3 min,超声5 min,15 000 r·min-1离心10 min,上清液于37℃下N2吹干,残渣加入1 mL甲醇2次沉淀,最后残渣加入200 μL 体积分数为0.5的甲醇水溶解,15 000 r·min-1离心10 min,取上清液2 μL,进样分析。
2.7空白血浆及含药血浆样品的制备健康SD大鼠6只,分组,给药前禁食12 h,自由饮水。按照 10 mL·kg-1分别灌服蒸馏水和羊耳菊有效组分提取物(给药剂量为100 g·kg-1生药量),每日2次, 连续给药3 d,末次给药后15 min每只大鼠腹主动脉采血,4℃、6 000 r·min-1离心 10 min,取上清液,得空白和给药血浆样品。
3 结果
3.1UHPLC/Q-TOF/MS色谱采集根据建立的方法,对提取物样品、空白血浆、血浆样品进行分析,各成分在ESI-模式下得到信号响应较好,同时Metabolite软件得到空白血浆和血浆样品的差异图谱,各样品总离子流图见Fig 1。
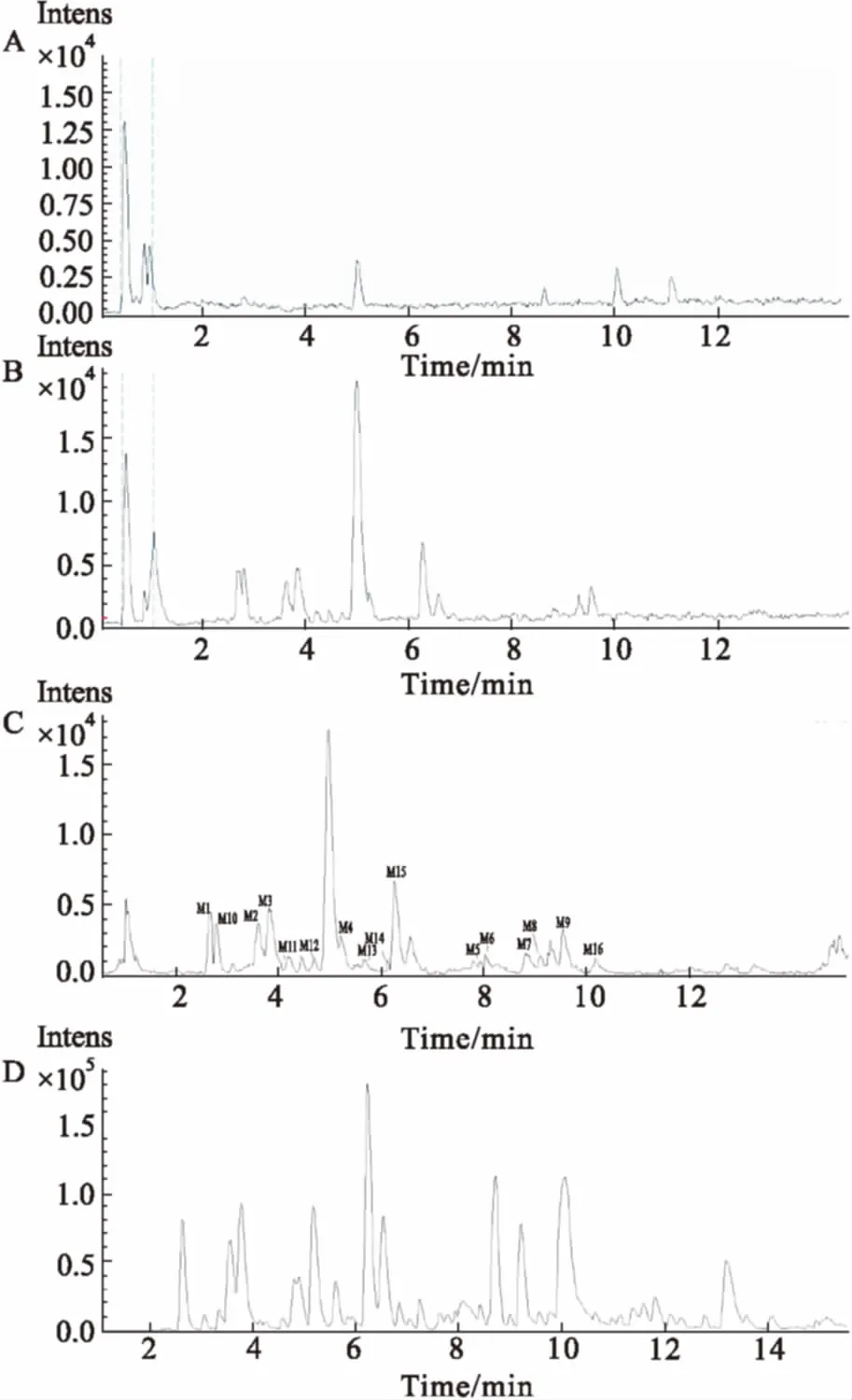
Fig 1 Base peak chromatograms of Inula cappa extractmetabolites in plasma sample in negative mode
A: Blank plasma; B: Plasma sample; C: Different chromatograms of A and B; D:Inulacappaextract sample
3.2入血成分分析根据精确相对分子质量、同位素丰度比、分子碎片峰、对照品和提取物样品色谱保留时间,结合以往文献报道[9-12],共检测到16个代谢产物,其中包括9个原型成分,见Tab 1。
3.2.1原型成分分析 化合物M1~M5、M7~M9:保留时间分别为2.6、3.7、3.9、5.2、7.9、8.8、9.1、10.1 min。他们的准分子离子峰分别为m/z 353.0887[M-H]-、m/z 353.0862[M-H]-、m/z 353.0876[M-H]-、m/z 515.1175[M-H]-、m/z 447.0942[M-H]-、m/z 515.1193[M-H]-、m/z 515.1171[M-H]-、m/z 515.1180[M-H]-,保留时间和质谱碎片分别与新绿原酸、绿原酸、隐绿原酸、1,3-O-二咖啡酰基奎宁酸、木犀草苷、3,4-O-二咖啡酰基奎宁酸、3,5-O-二咖啡酰基奎宁酸和4,5-O-二咖啡酰基奎宁酸对照品一致,故确定M1~M5、M7~M8为原型成分新绿原酸、绿原酸、隐绿原酸、1,3-二咖啡酰基奎宁酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸和4,5-二咖啡酰基奎宁酸。
化合物M6:保留时间8.1 min,产生的准分子离子峰为m/z 461.0786 [M-H]-,丢失176 u后产生m/z 285.0477的碎片离子,与提取物中木犀草素-7-O-β-D-葡萄糖醛酸苷原型成分保留时间、分子式和碎片离子一致,故推测其可能为原型成分木犀草素-7-O-β-D-葡萄糖醛酸苷。
3.2.2代谢产物分析 结合Metabolite Tools代谢物数据处理软件,对代谢物可能的结构和可能的代谢途径进行推测,代谢物结构列表见Tab 1。
M10~M12:保留时间分别为2.8、4.2、4.7 min。它们的准分子离子峰分别为m/z 353.089[M-H]-、m/z 353.0899[M-H]-、m/z 353.0878[M-H]-,裂解后产生的碎片离子分别为m/z 173.0518、m/z 191.0581、m/z 191.0526。虽然碎片离子与单咖啡酰基一致,但难以确定取代基位置,故推测M10~M12可能为单咖啡酰基奎宁酸发生酯基位置异构而产生的。
M13~M15:保留时间为5.6、6.0、6.2 min,产生的准分子离子峰分别为m/z 367.1018 [M-H]-、m/z 367.1037[M-H]-、m/z 367.1042 [M-H]-,比单咖啡酰基奎宁酸多1个CH2,它们能裂解产生m/z 193.0506、m/z 193.0508、m/z 193.0496的碎片离子。m/z 193比咖啡酸负离子m/z 179多1个CH2,因此推测甲基结合位点在咖啡酸。故推测M13~M15均为单咖啡酰基奎宁酸的甲基化产物。
M16:保留时间为9.5 min,产生m/z 719.1823的准分子离子峰,经过裂解后,中性丢失176 u,产生m/z 543.1493的碎片,说明该化合物为葡萄糖醛酸结合物,且m/z 543.1493比二咖啡酰基奎宁酸多1个C2H4,继续丢失CH2,得到m/z 515.1191的碎片,说明存在两个CH2,故推测化合物M16为二甲基化二咖啡酰基奎宁酸的葡萄糖醛酸结合产物。
3.3主要入血成分结构和可能的代谢途径分析羊耳菊有效组分在血浆中主要的代谢途径可能为单咖啡酰基奎宁酸的酯键异构和甲基化,由于取代基位置不能确定,且提取物中存在大量的单咖啡酰基奎宁酸和二咖啡酰基奎宁酸,故异构化和甲基化的单咖啡酰基奎宁酸也可能是由二咖啡酰基奎宁酸水解而来。同时还存在二咖啡酰基奎宁酸的双甲基葡萄糖醛酸化反应,以绿原酸和3,4-O-二咖啡酰基奎宁酸为例,推测它们可能的代谢途径分别见Fig 2、3。
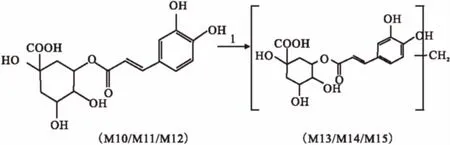
Fig 2 Possible biotransformation pathways of chlorogenic acid1: Methylate
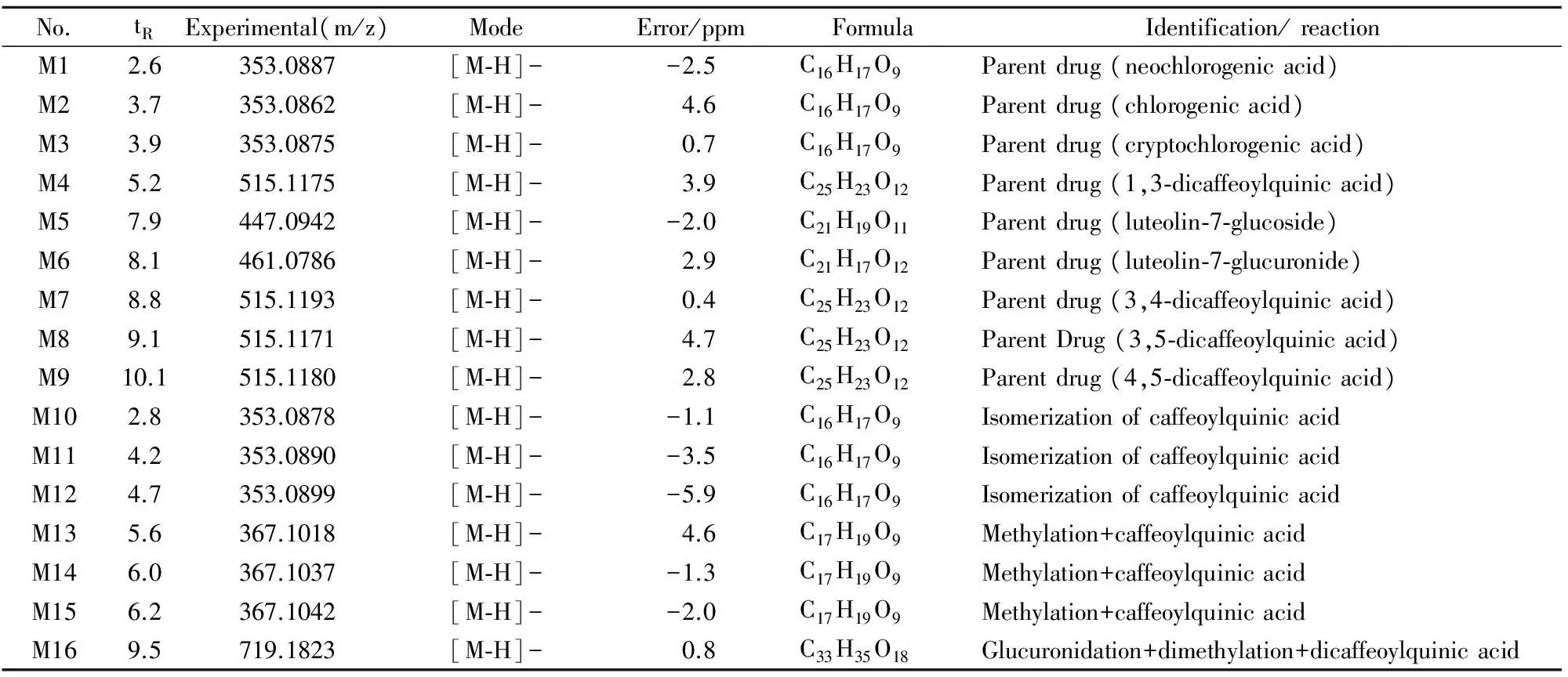
Tab 1 Identification of metabolites of plasma of Inula cappa extract
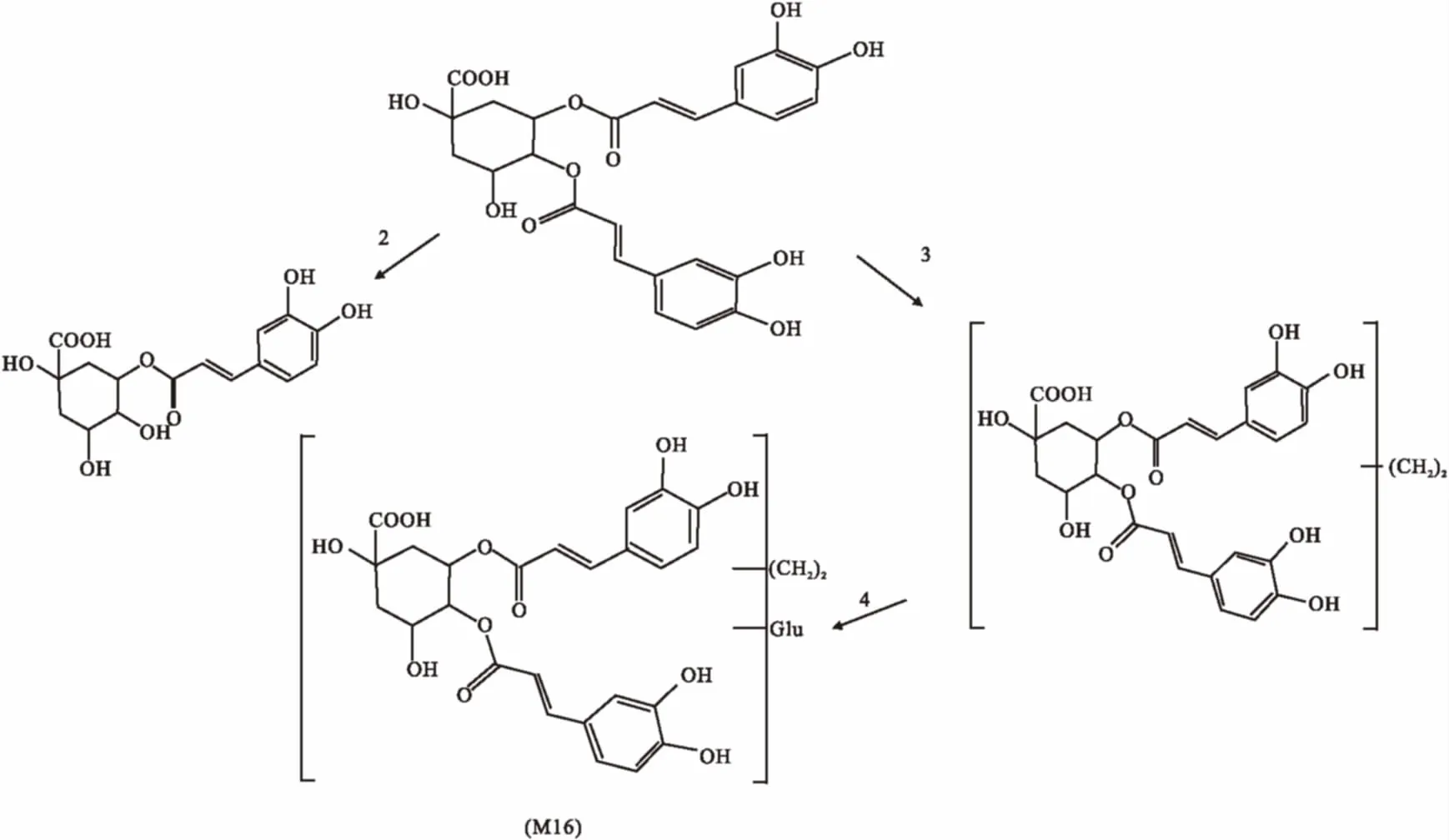
Fig 3 Possible biotransformation pathways of 3,4-O-dicaffeoylquinic acid2: Hydrolyze; 3: Dimethylation; 4: Glucuronidation or glucosidation
4 讨论
前期实验室预实验中,大鼠灌胃羊耳菊有效组分提取物后,分别考察5、15、30、45 min血清和血浆的质谱信息,通过对不同样品的色谱图峰强度、峰数目及入血峰面积等结果进行对比,最终确定灌胃后的最佳采血时间点为15 min,且血浆样品优于血清。同时考察了乙腈、乙酸乙酯、甲醇等多种样品处理方法,结果采用甲醇2次沉淀蛋白得到的样品色谱图信息量较大,干扰少。同时,预实验中血浆处理时还考察了是否加酸,结果表明血浆处理加入50 μL体积分数为0.001的甲酸水后,所得到的入血成分更多,且响应值有明显提高。
大鼠灌胃羊耳菊有效组分提取物后,共检测到9个原型成分,包括2个黄酮类成分和7个咖啡酰基奎宁酸类成分。通过与对照品比对,其中的8个成分分别是新绿原酸、绿原酸、隐绿原酸、1,3-O-二咖啡酰基奎宁酸、木犀草苷、3,4-O-二咖啡酰基奎宁酸、3,5-O-二咖啡酰基奎宁酸和4,5-O-二咖啡酰基奎宁酸,通过质谱碎片信息、保留时间与提取物对比,推测另一个黄酮类原型成分为木犀草素-7-O-β-D-葡萄糖醛酸苷。且代谢产物仅检测到单咖啡酰基奎宁酸的酯基位置异构、甲基化产物和二咖啡酰基奎宁酸的甲基葡萄糖醛酸化产物。因此,提示异构化、甲基化和葡萄糖醛酸化是咖啡酰基奎宁酸类成分在大鼠体内的3条重要代谢途径。
有研究报道,绿原酸的5-位咖啡酰基在人体内可以通过分子内酯键转移向3-和4-位转化[13],所以推测大鼠体内的绿原酸等成分也发生了类似的转移。单咖啡酰基奎宁酸类成分在大鼠体内发生的甲基化反应可能与体内存在的儿茶酚氧位甲基转移酶(catechol-O-methyltransferas, COMT)有关,儿茶酚结构中的间位羟基是COMT催化发生甲基化反应的主要部位[14]。在代谢产物中检测到的单咖啡酰基奎宁酸的甲基化和二咖啡酰基奎宁酸的双甲基葡萄糖醛酸化产物,与其底物相比,极性发生改变,这将有助于它们从胆汁和尿液中排出。
相关文献报道,单咖啡酰基奎宁酸即绿原酸类成分,具有明显的抗菌、抗病毒、抗炎、清除自由基、降血糖、降血脂等作用[15]。木犀草苷类黄酮成分,也具有保护心血管、抗癌、抗菌、抗炎、抗氧化等作用[16]。因此,血浆中存在的绿原酸类成分及其酯基异构化代谢产物和黄酮类成分,可能是体内直接药效物质,有待进一步研究验证。
大多数多酚类化合物都含有儿茶酚结构,一般来说,儿茶酚结构中的邻二酚羟基容易被氧化成醌。已经知道有很多药物及内源性的雌激素/儿茶酚胺在体内会转化成醌类物质,它们通过诱导氧化还原循环反应产生超氧化自由基,或通过与细胞的亲核成分作用而发挥细胞毒作用[17]。但有些多酚类物质并未在体内转化成醌类物质,而只发生甲基化反应。在本实验中,血浆中并未发现咖啡酰基类成分氧化成醌类物质生成,说明这类成分可能是具有独特代谢特点、毒副作用小的一类化合物。
本实验采用UHPLC/Q-TOF/MS技术,对羊耳菊药材口服后在大鼠血浆中可能的成分进行了初步分析,获得的羊耳菊药材中含量较高的咖啡酰基奎宁酸类成分的信息,对这类化合物的生物转化以及对羊耳菊药材的进一步药理活性和药代动力学研究具有重要的参考价值,也为中药潜在活性物质研发以及临床应用提供了重要的研究思路和理论参考。
(致谢:本实验的研究工作是在贵州省药物制剂重点实验室完成,向帮助实验的各位老师和同学致以最诚挚的谢意!)
[1] 贵州中医研究所. 苗族医药学[M].贵阳:贵州民族出版社,1992:506.
[1] Guizhou Institute of Traditional Chinese Medicine.MiaoMedicine[M]. Guiyang: Guizhou Nation Press, 1992:506.
[2] 《中国民族药志》编委会. 中国民族药志[M].成都:四川民族出版社, 2007: 257-8.
[2] Chinese National Medicine editorial board.ChineseNationalMedicine[M]. Chengdu: Sichuan Nation Press, 2007:257-8.
[3] 周 雯,王 霞,付思红,等.羊耳菊的化学成分研究[J]. 中国药学杂志,2017,52(1):25-30.
[3] Zhou W, Wang X, Fu S H, et al. Chemical constituents ofInulacappa[J].ChinPharmJ, 2017,52(1):25-30.
[4] 关焕玉,兰燕宇,廖尚高,等.羊耳菊中咖啡酰基奎宁酸类化学成分研究[J]. 天然产物研究与开发,2014,26(12):1948-52.
[4] Guan H Y, Lan Y Y, Liao S G, et al. Caffeoylquinic acid derivatives fromInulacappa[J].NatProdResDev, 2014,26(12):1948-52.
[5] 姚 波,梁晓原.羊耳菊挥发油成分的研究[J].云南中医学院学报,2008,31(6):27-9.
[5] Yao B, Liang X Y. Studies on the chemical constituents of essential oil fromInulacappa[J].JYunnanUnivTraditChinMed, 2008,31(6):27-9.
[6] Jiraporn N, Puttinan M, Yingmanee T. Inhibition ofInulacappa(Ham. ex D. Don) DC. extracts on herpes simplex virus infectioninvitro[J].AfrJMicrobiolRes, 2011,5(24): 4049-58.
[7] Shengjun W, Hong L J, Qin Y. Efficacy and safety of Lian-Ju-Gan-Mao capsules for treating the common cold with wind-heat syndrome: study protocol for a randomized controlled trial[J].Trials, 2017,18(1):2.
[8] 常存库,王喜军.中药血清药物化学理论与方法的意义[J].世界科学技术-中医药现代化, 2010,15(4):634-7.
[8] Chang C K, Wang X J. Contribution of theories and methods of TCM serum pharmacochemistry[J].WorldSciTechnol-ModTraditChinMedMaterMed, 2010,15(4):634-7.
[9] Marmet C, Actis-Goretta L, Renouf M, et al. Quantification of phenolic acids and their methylates, glucuronides, sulfates and lactones metabolites in human plasma by LC-MS/MS after oral ingestion of soluble coffee[J].JPharmBiomedAnal, 2014,88:617-25.
[10] Wang S, Xu Y, Chen P, et al. Structural characterization of secoiridoid glycosides by high-performance liquid chromatography/electrospray ionization mass spectrometry[J].RapidCommunMassSpectrom, 2014,28(14):1569-79.
[11] Zhang J, Guan S, Sun J, et al. Characterization and profiling of phenolic amides from Cortex Lycii by ultra-high performance liquid chromatography coupled with LTQ-Orbitrap mass spectrometry[J].AnalBioanalChem, 2015,407(2):581-95.
[12] Yang B, Meng Z, Dong J, et al. Metabolic profile of 1,5-dicaffeoylquinic acid in rats, aninvivoandinvitrostudy[J].DrugMetabDispos,2005,33(7):930-6.
[13] Olthof M R, Hollman P C, Buijsman M N, et al. Chlorogenic acid quercetin-3-rutinoside and black tea phenols are extensively metabolized in humans[J].JNurt, 2003,133(6):1806-14.
[14] Nissinen E. The site of O-methylation by membrane-bound catechol-O-methyltransferase[J].BiochemPharmacol, 1984,33(19):3105-8.
[15] 张小娜,童 杰,周衍晶,等.忍冬属药材药效成分及药理作用研究进展[J].中国药理学通报,2014,30(8):1049-54.
[15] Zhang X N, Tong J, Zhou Y J, et al. Studies on medicinal ingredients and pharmacological effects of Lonicera[J].ChinPharmacolBull, 2014,30(8):1049-54.
[16] 何 玲, 孙桂波, 孙 潇, 等.木犀草苷对阿霉素诱导乳鼠心肌细胞损伤的保护作用[J].中国药理学通报,2012,28(9):1229-34.
[16] He L, Sun G B, Sun X, et al. Protective effects of luteolin-7-O-glucoside on neonatal rat cardiomyocytes damage induced by adriamycin[J].ChinPharmacolBull, 2012,28(9):1229-34.
[17] Cavalieri E L, Stack D E, Devanesan P D, et al. Molecular origin of cancer: catechol estrogen-3,4-quinones as endogenous tumor initiators[J].ProcNatlAcadUSA, 1997,94(20):10937-42.
AnalysisofcomponentsinplasmafromeffectivefractionsofInulacappabasedonUHPLC/Q-TOF/MS
GONG Zi-peng1,2,3,4, CHEN Ting-ting1,2,3,4, HOU Jing-yu1,2,3,4, WU Lin-lin1,2,3,4, LI Mei1,2,3,4, LI Yue-ting1,2,3,4, CHEN Si-ying1,2,3,4,LAN Yan-yu1,2,3,4
[1.GuizhouProvincialKeyLabofPharmaceutics, 2.EngineeringResearchCenterfortheDevelopmentandApplicationofEthnicMedicineandTCM(MinistryofEducation), 3.SchoolofPharmacy, 4.NationalEngineeringResearchCenterofMiao’sMedicines,GuizhouMedicalUniversity,Guiyang550004,China]
AimTo analyze the main components of effective fractions ofInulacappain rat plasma with UHPLC/Q-TOF/MS technology and serum pharmacochemistry theory.MethodsAfter gavage administration withInulacappaextracts, blood was collected from abdominal aorta, and the protein in plasma sample was precipitated by methanol. Eclipse Plus C18RRHD (2.1 mm × 100 mm, 1.8 μm) was used, with 0.1% formic acid agueous solution(A)-0.1% formic acid and acetonitrile (B) as the mobile phase for gradient elution, and the flow rate was 0.3 mL·min-1. Detected at negative ion mode, and with the help of Metabolite Tools software from Bruker Corporation, components in plasma were defined.ResultsA total of 16 compounds were identified, including 9 prototypes and 7 metabolites. Main metabolites were isomerization, methylation, glucuronidation and recombination of caffeoylquinic acid.ConclusionsTherefore, our study has comprehensively expoundedInulacappaextracts’ constituents migrating to rat plasma, and provided a reference for further studies forinvivometabolic process and effective material base ofInulacappa.
Inulacappa; plasma; effective fraction; UHPLC/Q-TOF/MS; serum pharmacochemistry; metabolites
A
1001-1978(2017)11-1605-06
R-332;R282.71;R284.1;R289.5;R446.11;R969.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.050.html
10.3969/j.issn.1001-1978.2017.11.025
2017-06-23,
2017-07-20
国家自然科学基金资助项目(No 81360680);贵州省优青项目[黔科合人字(2015)11号];贵州省教育厅“民族药与中药开发应用产学研基地建设”项目(黔科合KY字[2013]122);贵州省科学技术基金项目[黔科合LH字(2015)7362];贵州省研究生卓越人才计划项目(黔教研合ZYRC字[2014]012);贵州省中医药管理局项目(No QZZY-2015-078)
巩仔鹏(1985-),男,博士,副教授,研究方向:中药药代动力学,Tel:0851-86908468,E-mail: gzp4012607@126.com; 兰燕宇(1958-),女,教授,研究方向:中药药效物质基础及新药开发,通讯作者,Tel: 0851-6908899, E-mail: yanyu626@126.com