木蝴蝶挥发性成分对H22荷瘤小鼠实体瘤抑制作用及其机制初步研究
2017-11-01李楠楠孟宪生包永睿李天骄
李楠楠,孟宪生, 2, 3,包永睿, 2, 3,王 帅, 2, 3,李天骄, 2, 3
(1. 辽宁中医药大学药学院;2. 辽宁省组分中药工程技术研究中心;3. 辽宁省现代中药研究工程实验室,辽宁 大连 116600)
木蝴蝶挥发性成分对H22荷瘤小鼠实体瘤抑制作用及其机制初步研究
李楠楠1,孟宪生1, 2, 3,包永睿1, 2, 3,王 帅1, 2, 3,李天骄1, 2, 3
(1. 辽宁中医药大学药学院;2. 辽宁省组分中药工程技术研究中心;3. 辽宁省现代中药研究工程实验室,辽宁 大连 116600)
目的探讨木蝴蝶挥发性成分抗肝肿瘤作用及其可能的作用机制。方法本研究采用H22实体瘤模型,随机分为空白组、模型组、阳性对照组(环磷酰胺100 mg·kg-1)、木蝴蝶挥发性成分低、中、高剂量(17.5、35、70 mg·kg-1)组,灌胃给药12 d,计算肿瘤抑制率、胸腺及脾指数及血清中IL-2、IL-6的含量。HE染色法观察小鼠实体瘤生长情况。采用0~1.0 g·L-1的木蝴蝶挥发性成分处理人肝癌SMMC-7721细胞,分别采用MTT法检测其对细胞增殖的影响,TUNEL法检测其对肝癌细胞凋亡的影响,RT-PCR法检测其对Bax、Bcl-2、caspase-3 mRNA表达的影响。结果木蝴蝶挥发性成分高剂量的抑瘤率为42.08%;与模型组相比,木蝴蝶挥发性成分能明显提高小鼠的胸腺指数、IL-2及IL-6水平。木蝴蝶挥发性成分体外能明显抑制人肝癌细胞SMMC-7721的增殖,诱导细胞凋亡,减少Bcl-2 mRNA的表达,增加Bax、caspase-3 mRNA的表达。结论木蝴蝶挥发性成分具有明显的体内、体外抗肝肿瘤作用,其作用机制可能与增强机体免疫力、促进肿瘤细胞凋亡有关。
孟宪生(1964-),男,博士,教授,博士生导师,研究方向:中药组分配伍、代谢组学及药品质量分析,通讯作者,E-mail:mxsvvv@163.com
木蝴蝶挥发性成分;抗肝肿瘤;H22荷瘤小鼠;SMMC-7721;凋亡;作用机制
木蝴蝶为紫蔵科植物木蝴蝶Oroxylumindcum(L.)Vent.的干燥成熟种子,具有清肺利咽、疏肝和胃的功效[1]。木蝴蝶主要含有黄酮及其苷类、挥发油等化学成分[2-3],具有抗氧化[4-5]、抗肿瘤[6]等多种药理作用。对于木蝴蝶中黄酮类成分及其药理作用的研究较多,但是对木蝴蝶挥发性成分及其药理作用的研究很少。本实验前期研究发现,木蝴蝶挥发性成分也具有明显的抗肿瘤活性,说明木蝴蝶挥发性成分也是木蝴蝶发挥抗肿瘤作用的药效组分之一。为了明确木蝴蝶发挥抗肿瘤作用的物质基础,以及对该药材更好地开发和应用,本研究采用H22小鼠实体瘤模型和人肝癌SMMC-7721细胞模型来验证木蝴蝶挥发性成分的体内、体外药效,采用ELISA、TUNEL、RT-PCR等方法研究其抗肿瘤的作用机制,为木蝴蝶做为抗肿瘤药物的进一步研究和临床应用提供实验依据和理论基础。
1 材料与方法
1.1细胞与实验动物人肝癌SMMC-7721细胞株,由中国科学院上海生命科学研究院细胞库提供。小鼠肝癌H22瘤株,购自上海拜力生物有限公司。SPF级昆明种小鼠,♂,体质量(20±2)g,购于辽宁长生生物技术有限公司,合格证号为:SCXK(辽)2010-0001。
1.2药品、试剂与仪器木蝴蝶挥发性成分:采用超临界流体萃取法和一级分离的方法,取木蝴蝶药材100 g(粉碎),操作压力28 MPa,操作温度4℃,分离压力5 MPa,分离温度50℃,流量25 Hz,提取时间2 h。环磷酰胺(江苏恒瑞医药股份有限公司,批号:140620);小鼠白细胞介素-2(IL-2)酶联免疫检测试剂盒(上海朗顿生物科技有限公司,批号:20150406CR);小鼠白细胞介素-6(IL-6)酶联免疫检测试剂盒(上海朗顿生物科技有限公司,批号:20151017GH);DMEM培养基、胰蛋白酶、胎牛血清、双抗(美国Gibco公司);二甲基亚砜(DMSO)(Sigma公司);TUNEL试剂盒(全式金生物,北京)。SUNRISE酶标仪(瑞士TECAN公司)。
1.3细胞培养人肝癌SMMC-7721细胞使用含有10% FBS和1%青链霉素的DMEM培养基,H22小鼠肿瘤细胞株使用含有10% FBS和1%青链霉素的RPMI 1640培养基,置于37℃、5% CO2、95%相对饱和湿度的培养箱内进行常规培养及传代,取对数生长期的细胞进行后续实验。
1.4H22荷瘤小鼠动物模型的建立及给药取对数生长期状态良好的H22细胞悬液,用生理盐水调整细胞密度,腹腔注射到小鼠体内,在小鼠体内传4代用于建立荷瘤小鼠实体瘤模型[7]。取第4代腹水制成细胞悬液(腹水需为乳白色液体),台盼蓝拒染法检测细胞活性,存活率≥95%。将腹水接种于小鼠右腋下,随机分模型组、木蝴蝶挥发性成分低、中、高剂量组(按17.5、35、70 mg·kg-1生药材)、阳性药组(环磷酰胺 100 mg·kg-1)。空白组给予等体积的生理盐水,每日1次,每次0.2 mL,连续灌胃12 d,最后一次给药2 h后,撤掉垫料,禁食不禁水,称取各组小鼠体重,次日处死小鼠,解剖取瘤、脾、胸腺,称重量,计算各组抑瘤率、脾指数和胸腺指数。抑瘤率/%=(1-给药组平均瘤重/模型组平均瘤重)×100%;脾指数=小鼠脾重量/小鼠体重×100;胸腺指数=小鼠胸腺重量/小鼠体重×100。
1.5HE染色法评价木蝴蝶挥发性成分对H22荷瘤小鼠实体瘤抑瘤率的影响实体瘤瘤组织以10%福尔马林溶液固定,脱水、透明、浸蜡、包埋、切片和贴片,HE染色和封片,光镜观察瘤组织结构改变、肿瘤细胞密度、细胞凋亡及坏死程度。
1.6ELISA法检测H22荷瘤小鼠血清中IL-2、IL-6的含量按照试剂盒操作说明书,酶标仪450 nm下测定每组的吸光度,建立标准曲线,根据标准曲线计算各组IL-2、IL-6的含量。
1.7MTT法检测木蝴蝶挥发性成分对肝癌细胞增殖的影响将对数生长期的人肝癌SMMC-7721细胞接种于96 孔板中,每孔0.5×103~1×104个细胞,待细胞贴壁后密度约大于80%后,按0.2、0.4、0.6、0.8、1.0 g·L-1浓度加入木蝴蝶挥发性成分,以含 0.1% DMSO完全培养基为对照组。每组浓度设5个复孔,给药24、48、72 h后,换新鲜培养基,并加入MTT试剂,继续培养4 h后,加入DMSO,摇床15 min后,酶标仪492 nm处检测吸光度 (OD)值。按照公式计算木蝴蝶挥发性成分对肝癌细胞的抑制率。细胞的抑制率/%=(1-OD给药组/OD空白组)×100%。
1.8TUNEL法检测木蝴蝶挥发性成分对肝癌细胞凋亡的影响将处于对数生长期的人肝癌SMMC-7721细胞接种在6孔板中,贴壁后,加入使用完全培养基配制的1 g·L-1浓度的木蝴蝶挥发性成分,对照组加完全培养基,药物作用24 h 后,按照TUNEL试剂盒操作说明书操作,0.2%的TritonX-100透化5 min后PBS冲洗,加PE后37℃孵育1 h后PBS冲洗,加DAPI避光染色5 min,置荧光显微镜下观察,并计算细胞凋亡率。
1.9木蝴蝶挥发性成分对Bax、Bcl-2、caspase-3mRNA表达的影响将处于对数生长期的人肝癌SMMC-7721细胞接种在6孔板中,贴壁后加入使用完全培养基配制的1 g·L-1的木蝴蝶挥发性成分,对照组加完全培养基,药物作用48 h 后消化收集细胞,TRIzol法提取总RNA。应用TransScript First-Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物),按照试剂盒说明书操作,将总RNA逆转录成第一链cDNA,反应体系20 μL。反应条件如下:25℃孵育10 min,42℃孵育30 min(反转录反应),85℃加热5 min(反转录酶失活)。以β-actin为内参基因,应用2×EasyTaq PCR SuperMix试剂盒进行PCR反应扩增目的基因,反应体系20 μL。引物序列如下:β-actin:F 5′-TGCTGTCCCTGTATGCCTCT-3′,R 5′-TTTGATGTCACGCACGATTT-3′;Bax:F 5′-TCATGGGCTGGACATTGGAC-3′,R 5′-GAGACAGGGACATCAGTCGC-3′;Bcl-2:F 5′-GTGAAGTCAACATGCCTGCC-3′,R 5′-ACAGCCTGCACTTTGTTTC-3′;caspase-3:F 5′-CCTGGTTCATCCAGTCGCTT-3′,R 5′-TCTGTTGCCACCTTTCGGTT-3′。
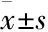
2 结果
2.1木蝴蝶挥发性成分对H22荷瘤小鼠实体瘤抑瘤率的影响由Tab 1体内药效实验可知,与模型组比较,木蝴蝶挥发性成分高、中剂量组、阳性对照

Fig 1 HE staining for solid tumor in H22 tumor-bearing mice(×100)
A:Model; B:Positive; C:Volatile components 70 mg·kg-1; D:Volatile components 35 mg·kg-1; E:Volatile components 17.5 mg·kg-1
组H22荷瘤小鼠实体瘤体积均明显减小,且差异具有显著性(P<0.01,P<0.05),抑瘤率分别为42.08%、25.39%、60.00%。木蝴蝶挥发性成分低剂量组H22荷瘤小鼠实体瘤瘤重与模型组比较差异无显著性。
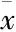
Tab 1 Inhibitory effect of volatile components in Oroxyli Semenonon tumor weight in tumor-bearing mice(±s, n=10)
*P<0.05,**P<0.01vsmodel
2.2木蝴蝶挥发性成分对H22荷瘤小鼠脾脏、胸腺指数的影响与模型组相比,木蝴蝶挥发性成分高、中剂量能明显提高小鼠的胸腺指数,差异具有显著性(P<0.01,P<0.05),木蝴蝶挥发性低剂量组、阳性对照组与模型组相比,差异无显著性。与空白组相比,木蝴蝶挥发性高剂量组差异无显著性。与模型组比较,木蝴蝶挥发性成分高、中、低剂量组的脾指数差异均无显著性,阳性对照组能明显降低小鼠的脾指数(P<0.01)。见Tab 2。
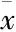
Tab 2 Effect of volatile components on thymus index andspleen index in H22 tumor-bearing mice (±s, n=10)
*P<0.05,**P<0.01vsmodel
2.3HE染色法评价木蝴蝶挥发性成分对H22荷瘤小鼠实体瘤的影响如Fig 1所示,模型组肿瘤细胞排列紧密,细胞密度大,未见大片坏死及凋亡细胞。其他组肿瘤细胞增殖密度均有不同程度的减小,而且可见不同程度的坏死及凋亡细胞区域,其细胞质高度凝集固缩,有类圆形凋亡小体出现。
2.4木蝴蝶挥发性成分对H22荷瘤小鼠血清IL-2、IL-6水平的影响如Tab 3所示,与空白组比较,模型组小鼠血清中IL-2、IL-6水平明显降低,且差异具有显著性(P<0.01)。与模型组比较,木蝴蝶挥发性成分高、中、低剂量组小鼠血清中IL-2、IL-6水平明显升高,且差异均具有显著性,阳性对照组小鼠血清中IL-2、IL-6水平未见明显升高。
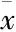
Tab 3 Effect of volatile components on IL-2, IL-6 levelsin H22 tumor-bearing mice(±s, n=10)
*P<0.05,**P<0.01vsmodel
2.5木蝴蝶挥发性成分对肝癌细胞增殖的影响在给药时间相同时,随着药物浓度的增大,木蝴蝶挥发性成分对细胞的增殖抑制作用也增加;在给药浓度相同时,随着药物作用时间的延长,抑制作用更为明显,当浓度为1 g·L-1时,48 h细胞的抑制率为80.73%(Fig 2)。
2.6木蝴蝶挥发性成分对肝癌细胞凋亡的影响如Fig 3所示,与模型组比较,木蝴蝶挥发性成分、阳性对照组均能诱导细胞凋亡,且差异均具有显著性(P<0.01),24 h凋亡率分别为18.16%、18.67%。木蝴蝶挥发性成分组与阳性对照组之间凋亡率差异无显著性。
2.7木蝴蝶挥发性成分对Bax、Bcl-2、caspase-3mRNA表达的影响如Fig 4所示,与模型组比较,木蝴蝶挥发性成分、阳性对照组均能增加Bax、caspase-3 mRNA的表达,降低Bcl-2 mRNA 的表达,且差异具有显著性(P<0.01,P<0.05)。

Fig 2 Inhibitory effect of volatile components onhuman hepatoma cell line SMMC-7721

Fig 3 Apoptosis-inducing effect of volatile componentson human hepatoma cell line SMMC-7721
A:Model; B:Volatile components; C:Positive; D:Apoptosis rate.**P<0.01vsmodel group
3 讨论
肝癌是全世界最常见的恶性肿瘤之一,我国的肝癌发病率和死亡率均占肿瘤中的第2位[8]。恶性肿瘤具有发病率高、治愈率低、致死率高等特点,对人类的生命健康构成严重威胁[9]。目前,临床针对恶性肿瘤主要应用顺铂、环磷酰胺等化疗药物,虽然有很明显的抑制肿瘤作用,但是也存在着对机体毒副作用大、耐药性等缺点。近年来,中医药在治疗恶性肿瘤方面不断的研究和探索,发现很多传统中药具有价格低廉、毒副作用小等特点,中药与化疗药物联合应用时不仅提高化疗药物疗效,而且提高肿瘤患者的生存质量,在恶性肿瘤治疗方面有广阔的应用前景。

Fig 4 Expression of Bax, Bcl-2, caspase-3 mRNAin human hepatoma cell line SMMC-7721
*P<0.05,**P<0.01vsmodel group
木蝴蝶具有抗炎、抗氧化等药理作用[10]。近年研究发现,木蝴蝶对肿瘤细胞如人乳腺癌MCF-7细胞、结肠癌细胞HCT-8等具有明显的抑制作用,且显示出有效、低毒的优点。为了研究木蝴蝶中挥发性成分的药理作用,本研究采用H22小鼠实体瘤的体内模型和人肝癌SMMC-7721细胞体外模型,研究其抗肝肿瘤作用。结果显示,木蝴蝶挥发性成分的抑瘤率大于30%,细胞抑制率大于60%,综合小鼠的精神活动、脏器指数等指标,说明木蝴蝶挥发性成分具有较好的体内、体外抗肝肿瘤活性,是木蝴蝶发挥抗肿瘤作用的药效组分之一,具有进一步研究的价值。
肿瘤的发生、发展与机体的免疫功能失调密切相关[11]。胸腺和脾脏是机体重要的免疫器官,恶性肿瘤发生时,机体免疫器官会发生明显的变化。其中,会出现脾脏肿大、胸腺萎缩现象,而且其程度与肿瘤发展病程相关[12]。IL-2和IL-6是机体免疫功能调节的重要细胞因子,能促进T细胞的增殖和活化,刺激NK细胞增殖,增强免疫细胞对肿瘤细胞的杀伤力。本研究结果表明,木蝴蝶挥发性成分可以提高荷瘤小鼠的胸腺指数、提高荷瘤小鼠血清中IL-2、IL-6水平,说明木蝴蝶挥发性成分可以有效增强荷瘤小鼠脾脏和胸腺的免疫功能,提高机体免疫力,从而发挥抗肝肿瘤的作用。
近年研究表明,Bcl-2、Bax、caspase-3是与肿瘤细胞凋亡明确相关的基因,在细胞凋亡的调控中扮演着重要角色[13]。抗凋亡基因Bcl-2和促凋亡基因Bax是调控细胞凋亡的Bcl-2基因家族的重要成员,与促凋亡因子caspase-3的活化程度相关[14]。本研究结果表明,木蝴蝶挥发性成分可以增加肝癌SMMC-7721细胞中Bax、caspase-3 mRNA的表达,降低Bcl-2 mRNA 的表达,说明木蝴蝶挥发性成分可以调控凋亡相关基因的表达,促进肿瘤细胞凋亡。
综上所述,木蝴蝶挥发性成分具有明显的体内、体外抗肝肿瘤活性,其作用机制可能与其增强机体免疫力、促进肿瘤细胞凋亡有关。本研究明确木蝴蝶发挥药效的物质基础,为木蝴蝶的进一步开发和临床应用提供理论基础,为木蝴蝶挥发性成分作为新的抗肝肿瘤药物的开发奠定基础。
[1] 国家药典委员会. 中华人民共和国药典(2015年版一部)[M]. 北京: 中国医药科技出版社, 2015: 64-5.
[1] Chinese Pharmacopoeia Commission.ChinaPharmacopeia[M]. Beijing: China Medical Science Press, 2015: 64-5.
[2] 翟翔宇, 萧 伟, 杨 彪, 等. 木蝴蝶种子的化学成分研究[J]. 中国中药杂志, 2015,40(15): 3013-6.
[2] Zhai X Y, Xiao W, Yang B, et al. Study on chemical constituents from seed ofOroxylumindicum[J].JChinMaterMed, 2015,40(15): 3013-6.
[3] 魏晓楠, 林彬彬, 谢国勇, 等. 木蝴蝶种子化学成分研究[J]. 中国中药杂志, 2013,38(2): 204-7.
[3] Wei X N, Lin B B, Xie G Y, et al. Chemical constitunents of seeds ofOroxylumindicum[J].JChinMaterMed, 2013,38(2): 204-7.
[4] 王 锐, 何 嵋, 袁晓春, 等. 木蝴蝶总黄酮的抗氧化活性[J]. 中国实验方剂学杂志, 2012,18(23): 102-5.
[4] Wang R, He M, Yuan X C, et al. Antioxidant activity of total flavonoids fromOroxylumindicum[J].ChinJExpTraditMedFormul, 2012,18(23): 102-5.
[5] 王 锐, 熊汝琴,罗家刚, 等. 木蝴蝶提取物对酪氨酸酶的抑制及抗氧化作用[J]. 中国实验方剂学杂志, 2014,20(18): 70-2.
[5] Wang R, Xiong R Q, Luo J G, et al. Effect on anti-tyrosinase and antioxidation activities of extract fromOroxylumindicum[J].ChinJExpTraditMedFormul, 2014,20(18): 70-2.
[6] 李楠楠, 孟宪生, 包永睿, 等. 木蝴蝶挥发性成分体外抗肿瘤活性评价及化学成分研究[J]. 中国现代应用药学, 2016,33(11): 1361-5.
[6] Li N N, Meng X S, Bao Y R, et al.Invitroantitumor activity and chemical analysis of Oroxyli Semen volatile constituents[J].ChinJModApplPharm, 2016,33(11): 1361-5.
[7] 吴圣曦, 吴国欣, 何 珊 ,等. 白芥子挥发油对小鼠肝癌H22移植性肿瘤的抑制作用及其机制研究[J]. 中草药, 2013,44(21): 3024-9.
[7] Wu S X, Wu G X, He S, et al. Antitumor effect of volatile oil from Sinapis Albae Semen on H22-bearing mice and its mechanism[J].ChinTraditHerbDrugs, 2013,44(21): 3024-9.
[8] Parkin D M, Bray F, Ferlay J, et al. Estimating the world cancer burden: globocan 2000[J].IntJCancer, 2001,94(2): 153.
[9] 何小喜, 莫书荣. 红景天苷对腹水型H22肝癌抑制作用及其机制的初步研究[J]. 中国药理学通报, 2014,30(5): 688-91.
[9] He X X, Mo S R. Preliminary study on the inhibitory effect of salidroside on H22ascites hepatoma[J].ChinPharmacolBull, 2014,30(5):688-91.
[10] 肖梦溪. 木蝴蝶粗提物对金黄色葡萄球菌小鼠肺炎治疗作用的研究[D]. 长春:吉林大学, 2016.
[10] Xiao M X. The therapeutic effect ofOroxylumindicumextract against Staphylococcus aureus pneumonia in mice[D]. Changchun: Jilin University, 2016.
[11] 沈明花, 李 巍, 金梅花. 小黄蘑多糖对H22荷瘤小鼠的抗肿瘤作用研究[J]. 中草药, 2013,44(17): 2433-6.
[11] Shen M H, Li W, Jin M H. Antitumor effect of Hygrophorus lucorum polysaccharide on H22bearing mice[J].ChinTraditHerbDrugs, 2013,44(17): 2433-6.
[12] 范艳丽, 郑国强, 刘安军. 龙须菜酸性多糖对H22荷瘤小鼠的抗肿瘤作用[J]. 现代食品科技, 2014,30(9): 7-12.
[12] Fan Y L, Zheng G Q, Liu A J. Anti-tumor effect of an acid polysaccharide from Gracilaria lemaneiformis in H22-bearing mice[J].ModFoodSciTechnol, 2014,30(9): 7-12.
[13] 刘金娟,杨成流,陈永强,蒋继宏. 鱼腥草地下茎提取物诱导胃癌细胞 SGC-790凋亡机制的研究[J]. 中国药理学通报, 2014,30(2): 257-61.
[13] Liu J J, Yang C L, Chen Y Q, Jiang J H. Mechanism of SGC-7901 apoptosis induced by Houttuynia cordata thunb subterraneous stem extraction[J].ChinPharmacolBull, 2014,30(2): 257-61.
[14] Croker B A, Joanne A O, Cameron J, et al. Fas-mediated neutrophil apoptosis is accelerated by Bid, Bak, and Bax and inhibited by Bcl-2 and Mcl-1[J].ProcNatlAcadSciUSA, 2011,108(32):13135-40.
EffectsofvolatilecomponentsinOroxyliSemenonH22bearingmiceanditspossiblemechanisms
LI Nan-nan1, MENG Xian-sheng1,2,3, BAO Yong-rui1,2,3, WANG Shuai1,2,3, LI Tian-jiao1,2,3
(1.SchoolofPharmacy,LiaoningUniversityofTraditionalChineseMedicine; 2.ComponentMedicineEngineeringResearchCenterofLiaoningProvince; 3.LiaoningProvinceModernChineseMedicineResearchEngineeringLaboratory,Dalian116600,China)
AimTo study the inhibitory effect of volatile components in Oroxyli Semen on liver cancer and its possible mechanisms.MethodsH22bearing mouse model was used, the mice were divided into six groups: blank, model, positive (cytoxan, 100 mg·kg-1), low-, mid-, and high-dose (17.5, 35, and 70 mg·kg-1) volatile components groups, and then the mice were ig given once daily for consecutive 12 d. Then the tumor growth inhibitory rate, spleen and thymus indexes were calculated; the serum levels of IL-2, IL-6 were determined. HE staining was used to study of the apoptosis of the solid tumor. After treatment of SMMC-7721 cells with 0~1 g·L-1of volatile components for 24, 48 and 72 h, MTT assay was used to examine the proliferation. TUNEL method was applied to detect cell apoptosis, and RT-PCR method to detect Bax, Bcl-2, caspase-3 mRNA experssion.ResultsThe inhibitory rate of volatile components high-dose on H22bearing mice was 42.08%. The thymus index and the contents of serum IL-2 and IL-6 of H22bearing mice were significantly higher than those in model group. Volatile components could significantly inhibit proliferation and induce apoptosis of SMMC-7721 cells, down-regulate the expression of Bcl-2 mRNA, and up-regulate the expression of Bax, caspase-3 mRNA.ConclusionsThe volatile components in Oroxyli Semen have obvious anti-tumor activityinvitroandinvivo, and its mechanism may be related to enhancing immune system and promoting tumor cell apoptosis.
volatile components in Oroxyli Semen; anti-tumor; H22bearing mice; SMMC-7721; apoptosis; mechanism
A
1001-1978(2017)11-1600-06
R-332;R284.1;R329.25;R392.12;R735.702.2;R979.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.048.html
10.3969/j.issn.1001-1978.2017.11.024
2017-07-15,
2017-08-20
国家科技部“重大新药创制”科技重大专项(No 20132X09507005-004)
李楠楠(1991-),女,博士生,研究方向:中药药效组分与作用机制,E-mail:linannan-999@163.com;