内质网应激在三氧化二砷抑制HL-60增殖过程中的效应机制
2017-11-01张闪闪李天一王晓琴
张闪闪,李天一,王晓琴,张 波,2
(1. 石河子大学药学院,2. 新疆植物药资源利用教育部重点实验室,新疆 石河子 832002)
内质网应激在三氧化二砷抑制HL-60增殖过程中的效应机制
张闪闪1,李天一1,王晓琴1,张 波1,2
(1. 石河子大学药学院,2. 新疆植物药资源利用教育部重点实验室,新疆 石河子 832002)
目的探究三氧化二砷(ATO)引起内质网应激的效应机制,为掌控急性早幼粒白血病治疗药物监测提供间接药理学指标。方法通过ATO的毒理学数据库关联基因数据整理建立蛋白-蛋白互作网络,使用MCODE算法对网络拓扑关系聚类分析寻找关联基因群;采用HL-60细胞模型进行实验研究。MTT法评价ATO对HL-60的细胞毒活性;Real-time PCR法检测细胞内质网应激相关基因表达变化;Western blot检测内质网应激相关蛋白表达水平;用ER-Tracker Red对内质网进行特异性荧光染色;流式细胞技术检测细胞分化及凋亡指标变化。结果ATO相关的206个基因PPI网络中有3 794对关系,排名前4的基因群中内质网应激模块凸显;ATO能抑制HL-60细胞增殖,并呈浓度依赖性;ATO在给药4 h即可引起细胞内质网应激,GRP78和GRP94表达较明显,随着时间延长基因表达水平变化明显,1~4 μmol·L-1引起GRP78、GRP94和Nrf2表达,8 μmol·L-1引起CHOP大量表达。ATO在1、2 μmol·L-1时引起eIF2α蛋白磷酸化水平增加,在8 μmol·L-1时诱导CHOP蛋白大量表达;内质网染色结果显示,4、8 μmol·L-1的ATO诱导内质网的肿胀;流式结果表明ATO在1 μmol·L-1时引起细胞分化,在2 μmol·L-1时出现明显分化群,4、8 μmol·L-1时细胞分化同样明显,但在8 μmol·L-1时细胞同时出现凋亡群。结论ATO抑制HL-60细胞增殖过程中出现内质网应激,并呈浓度依赖性阶段性切换效应。
急性早幼粒细胞白血病;三氧化二砷;内质网应激;分化;凋亡;MCODE算法
急性髓系白血病(acute myeloid leukemia,AML)是一种以增殖/分化解偶联异常为特征的疾病。砷剂作为白血病治疗药物,其临床有效性已经得到公认,但毒性反应及耐药性等问题也不容忽视。临床静脉给药剂量5~10 mg·d-1,会引起白细胞增多、胃肠功能紊乱和呼吸困难,严重时会导致分化综合征和心电图异常[1-2]。在治疗过程中,经常会因为疗效而忽视药物毒性所带来的不良作用,在疗效与毒性之间是否存在临界浓度是值得思考的问题。
三氧化二砷(arsenic trioxide,ATO)可通过3种主要机制作用于AML细胞,包括诱导分化和(或)凋亡、生长抑制和血管生成抑制。其中诱导分化或凋亡是最为常见两种药效,二者在浓度、时间上呈现量质关系依赖,而对于何种机制引起的药效切换少有关注。
细胞存活很大程度上取决于蛋白质的正确产生、控制和折叠。为了保持细胞内蛋白质稳态和应激刺激积累导致的内质网应激,细胞主要依赖于未折叠蛋白反应(unfolded protein response,UPR)的细胞保护网络[3],但当应激过强时,诱导细胞凋亡。因此,内质网应激可能作为细胞分化向凋亡切换的效应机制存在。因此,本文拟以急性早幼粒白血病(acute promyelocytic leukemia,APL)HL-60细胞为模型,同时基于毒理学数据库的比较基因组学方法(comparative toxicogenomics database,CTD),寻找关键基因群,研究ATO抑制HL-60细胞增殖过程中出现内质网应激并呈现浓度依赖性阶段性切换效应,为白血病治疗药物监测提供间接药理学指标。
1 材料
1.1细胞人早幼粒白血病HL-60细胞株,购于中国科学院典型培养物保藏委员会细胞库。
1.2药物与试剂三氧化二砷(ATO,纯度98%),美国Sigma公司;胎牛血清,美国Biological Industries公司;IMDM细胞培养基,Gibco公司;MTT,北京索莱宝公司;Annexin V/FITC凋亡检测试剂盒,南京凯基生物科技发展有限公司;PE Mouse Anti-Human CD11b/Mac-1、FITC Mouse Anti-Human CD14,BD Biosciences公司;逆转录试剂盒,Thermo公司;UNIQ-10柱式TRIzol总RNA抽提试剂盒、引物,上海生工生物工程有限公司;SYBR Green PCR kit,Qiagen公司;β-actin抗体,中杉金桥生物技术有限公司;BiP、CHOP、p-eIF2α、eIF2α和Histone H3抗体,Cell Signaling Technology;ER-Tracker Red试剂盒,碧云天生物公司。
1.3仪器CO2细胞培养箱(Thermo3131),美国Thermo公司;超净工作台(ZHJH 1112B),上海智诚分析仪器有限公司;正置荧光显微镜(ZEISS Imager. M2),德国ZEISS公司;倒置生物显微镜(BDS200-PH),重庆奥特光学仪器有限公司;多功能酶标仪(Thermo 3001),美国Thermo公司;低温离心机(5424),德国Eppendorf公司;流式细胞仪(FACSCalibur),美国BD公司。
2 方法
2.1细胞培养HL-60细胞用含20%胎牛血清、青霉素(终浓度100 kU·L-1)及链霉素(终浓度100 mg·L-1)的IMDM培养液(pH=7.5)在37℃、5% CO2饱和湿度的培养箱中培养,取对数生长期细胞进行各项实验。
2.2ATO相关基因筛选及分析从CTD数据库[4](http://ctdbase.org/)获得ATO相关基因3 259个,根据物种筛选出206个人类相关基因,对这些基因进行String(http://string-db.org/)分析,获得基因互作关系,进而在Cytoscape(Version:3.2.0)中做出蛋白互作网络图,随后运用MCODE算法[5]分析网络子模块。MCODE算法是一种基于密度的非交叠式聚类算法。该算法以种子节点为中心进行扩展,在其邻居节点中寻找满足要求的节点,从而形成一个功能模块。
2.3细胞抑制率的测定96孔培养板上每孔接种4×104个细胞,培养液体积为200 μL,分别加入不同浓度的ATO,药物终浓度分别为0、2.5、5、10、20、40、80 μmol·L-1,每组设6个复孔,37℃培养24 h。每孔加入20 μL MTT溶液(5 g·L-1),继续培养4 h,1 000 r·min-1离心10 min弃上清,加入150 μL DMSO,振荡10 min,酶标仪检测570 nm处每孔的吸光度(OD)值,按下式公示计算细胞增殖抑制率[6]:

2.4Real-timePCR检测细胞内质网应激相关基因的表达分别用ATO(0、1、2、4、8 μmol·L-1)处理细胞4、8、24 h。使用UNIQ 10柱式TRIzol总RNA提取试剂盒提取RNA,检测定量RNA水平及含量,并用TaKaRa逆转录试剂盒将RNA逆转录为cDNA。Real-time PCR检测系统条件为:95℃ 15 s;60℃ 45 s;45个循环[7]。引物序列见Tab 1。
2.5Westernblot法检测蛋白表达收集ATO各处理组(0、1、2、4、8 μmol·L-1)细胞,4℃预冷的PBS洗2遍,加入200 μL RIPA细胞裂解液,冰上裂解30 min,4℃、12 000 r·min-1离心10 min,取上清。蛋白经煮沸处理后,各组取30 μg蛋白样品,经10% SDS PAGE电泳分离,转印PVDF膜,加入一抗,4℃过夜,次日以TBST洗膜4次,每次5 min,加入二抗,室温孵育1 h;以TBST洗膜4次,每次5 min,加入ECL显色液,经免疫印迹成像系统显影检测目的蛋白[8]。

Tab 1 Primer sequence
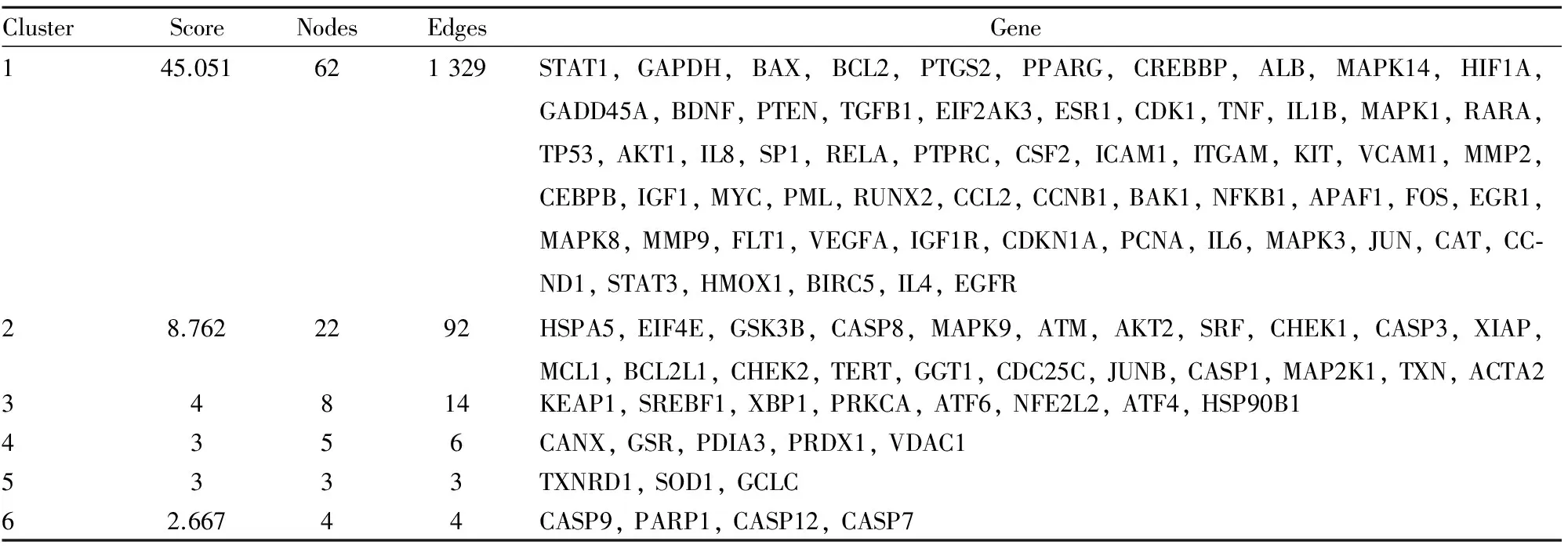
Tab 2 MCODE scoring for PPI network
2.6内质网特异性荧光染色收集ATO各处理组(0、2、4、8 μmol·L-1)细胞,用PBS洗涤细胞,离心去除洗涤液,加入配制好并37℃预温育的ER-Tracker Red染色工作液(稀释比例为1 ∶1 000),与细胞37℃共孵育15~30 min。去除ER-Tracker Red染色工作液,用PBS洗涤细胞1~2次,用荧光显微镜进行观察[9]。
2.7流式细胞技术检测细胞分化率取对数期HL-60细胞,调整细胞密度为5×108·L-1,分别加入不同浓度的ATO,药物终浓度分别为0、1、2、4、8 μmol·L-1,孵育72 h后收集细胞,用冷PBS洗2次,加100 μL鞘液将细胞悬起,依次加入20 μL CD11b、CD14荧光抗体,混匀,室温、避光、反应20 min。300×g离心5 min弃上清,每管加入1 mL鞘液将细胞悬起,300×g离心5 min弃上清,加0.5 mL鞘液混匀,4℃避光,1 h内进行流式细胞仪检测,用CELL Quest Pro软件分析数据[10]。
2.8流式细胞仪检测细胞凋亡率取对数期HL-60细胞,调整细胞密度为5 ×108·L-1,分别加入不同浓度的ATO,药物终浓度分别为0、1、2、4、8 μmol·L-1,孵育48 h后收集细胞,用冷PBS洗2次,加入500 μL Binding Buffer悬浮细胞,分别加入5 μL Annexin V和PI,混匀,室温、避光、反应5~15 min,1 h内进行流式细胞仪检测,用CELL Quest Pro软件分析数据[11]。
3 结果
3.1MCODE算法对网络拓扑关系聚类分析将蛋白互作网络进行MCODE分析,结果见Tab 2。该算法优于其他图形聚类方法,既可以对感兴趣的聚类进行定向的微调而不考虑网络中的其余部分,又允许检查与蛋白质网络相关的聚类互连性。其核心思想是以局部密度所定义的adhoc网络为根据,分离局部稠密区域。共有6个集群被提取出来,并给出了相应的分数。我们对每个集群进行功能聚类,发现前两个集群中的基因与凋亡、增殖和分化密切相关[1,12](Fig 1)。PML、RARA、CEBPB、HMOX1与APL细胞的分化相关,CASP3、BCL2、BCL2L1与APL细胞凋亡相关,MAPK8、CDK1、MAPK1、MAPK9、MAPK14与APL细胞增殖相关。第3个集群中的基因全部与内质网相关(Fig 1),ATF6、NFE2L2、ATF4、XBP1是内质网应激通路上的重要基因,在前两个集群中同样存在重要的内质网应激基因,如EIF2AK3和EIF4E。
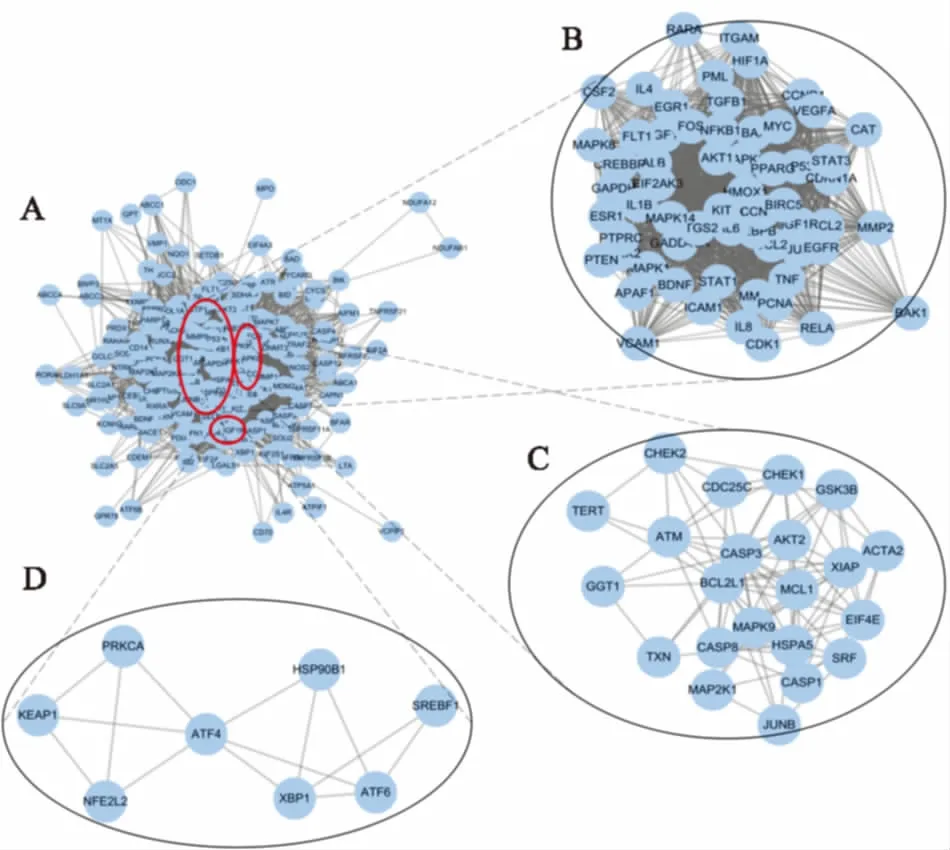
Fig 1 Protein-protein interaction networkof ATO and three MCODE modules
A:ATO all related genes;B:The first cluster, score was 45.051;C:The second cluster, score was 8.762;D:The third cluster, score was 4
3.2ATO抑制HL-60细胞增殖ATO对HL-60细胞24 h半数抑制浓度(IC50)为14.8 μmol·L-1,抑制作用随ATO浓度增加而增强,呈现一定的量效关系(Fig 2)。ATO浓度为10 μmol·L-1时,对HL-60细胞的抑制率为33.9%,大于此浓度时抑制率呈快速上升趋势。基于本实验,研究后续选择ATO 10 μmol·L-1以下的较小浓度。
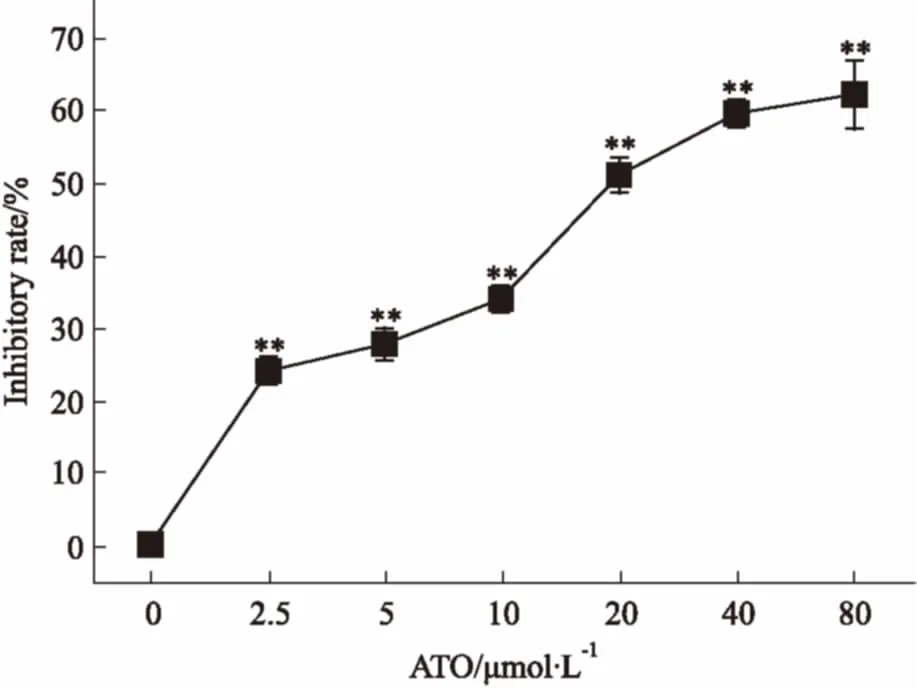
Fig 2 Inhibitory rate of ATO on HL-60cells after treatment of 24 h(±s,n=3)
**P<0.01vscontrol
3.3ATO对HL-60细胞内质网应激相关基因mRNA表达的影响不同浓度ATO处理HL-60细胞4 h时,GRP94有不同程度的上调,在1 μmol·L-1时上调比率较高。当作用时间延长至8 h时,GRP78和GRP94在ATO 2 μmol·L-1时上调明显,而CHOP在ATO 4、5 μmol·L-1时上调明显。在24 h时,GRP78在ATO 4 μmol·L-1时上调明显,而CHOP在ATO 8 μmol·L-1时上调明显。Nrf2在处理4 h时上调明显,8、24 h时也有上调,但上调倍率不及4 h,且都在较低浓度时上调明显(Fig 3)。
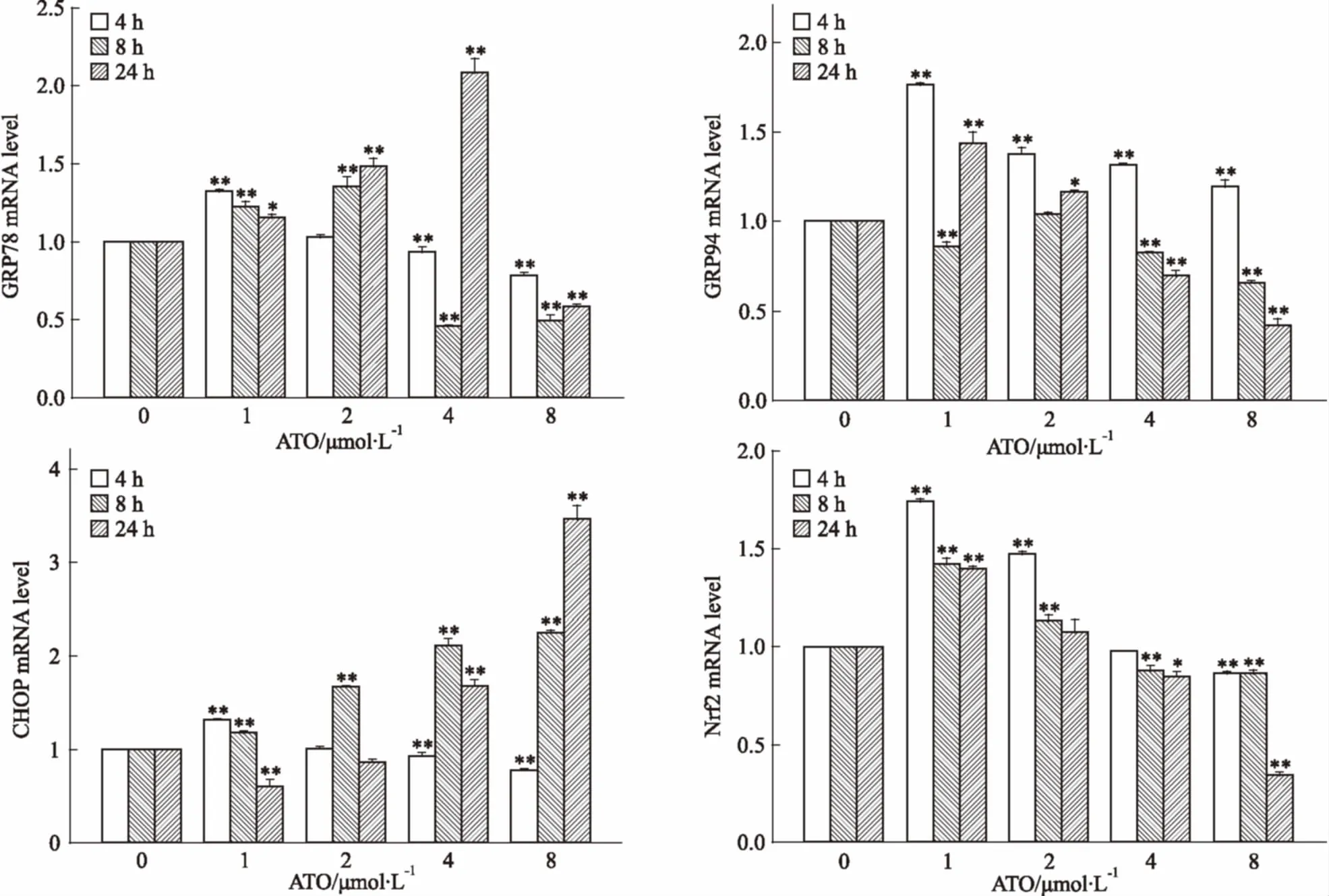
Fig 3 Changes of GRP78, GRP94, CHOP and Nrf2 mRNAexpression levels after ATO treatment at different concentrations and time assessed by real-time PCR(±s,n=3)
*P<0.05,**P<0.01vscontrol
3.4ATO对HL-60细胞内质网应激相关基因蛋白表达的影响ATO处理HL-60细胞24 h时,GRP78在ATO 4 μmol·L-1时上调最为明显,p-eIF2α在ATO 1、2 μmol·L-1时上调明显,CHOP在ATO 8 μmol·L-1时上调明显(Fig 4)。
3.5ATO引起内质网肿胀的量效关系由Fig 5可知,空白组细胞的内质网形态正常,荧光分布在细胞外围。2 μmol·L-1的ATO处理细胞后可见内质网的轻微肿胀,导致细胞中心荧光强度增加,ATO 4 μmol·L-1可见内质网管腔的异常扩张和肿胀,导致整个细胞充满荧光,或可见内质网聚集,呈小的堆叠块状。ATO 8 μmol·L-1时同时可见细胞形态的改变。
3.6ATO对HL-60细胞分化影响的量效关系
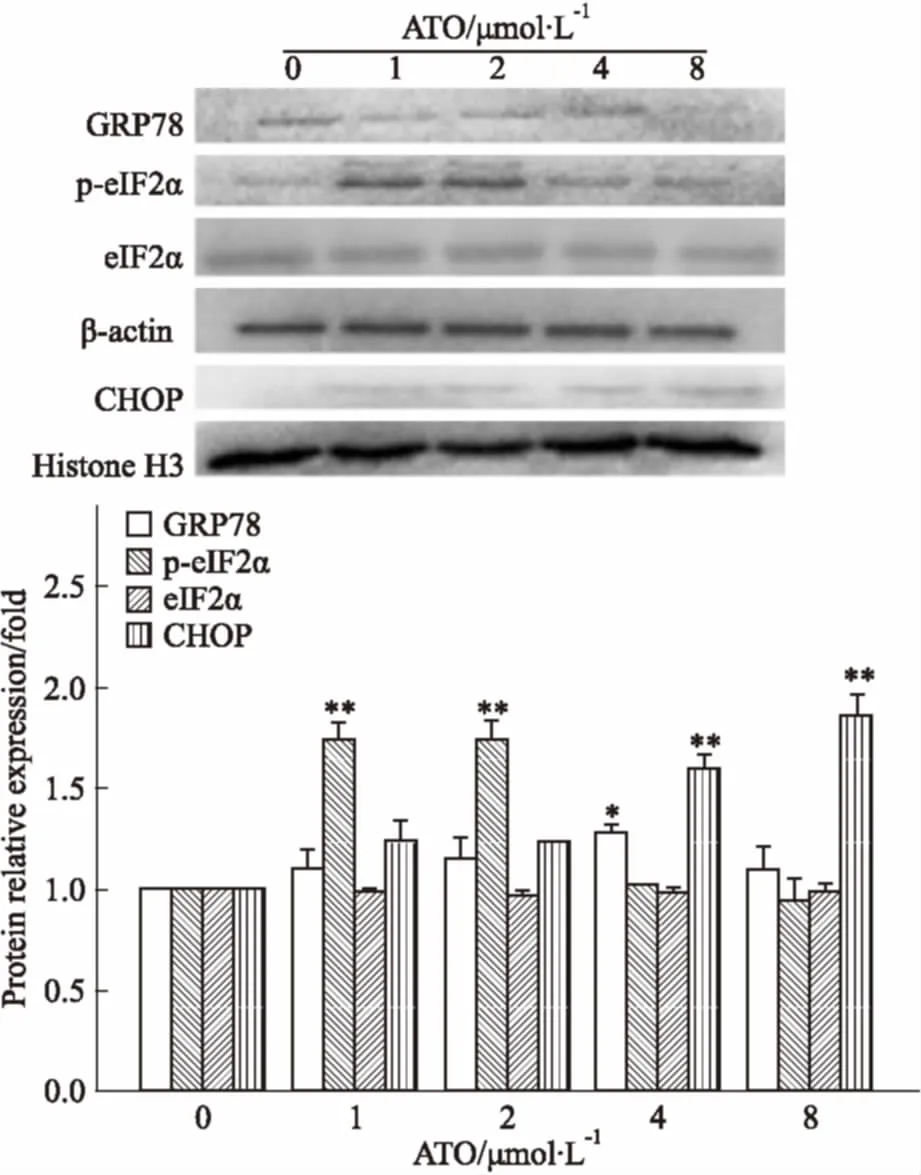
Fig 4 Changes of GRP78, p-eIF2αand CHOP protein expression levels after ATO treatment atdifferent concentrations assessed by Western blot(±s,n=3)
*P<0.05,**P<0.01vscontrol
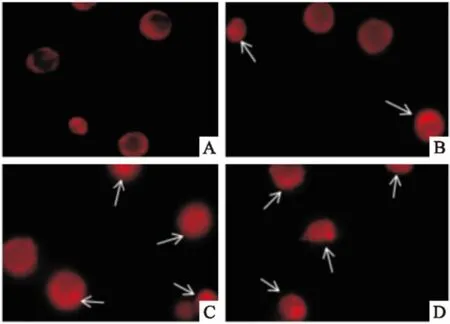
Fig 5 The morphological changeof endoplasmic reticulum in HL-60 cells afterATO treatment by fluorescence microscope(×100)
A:ATO 0 μmol·L-1;B:ATO 2 μmol·L-1;C:ATO 4 μmol·L-1;D:ATO 8 μmol·L-1
由Fig 6可知,1 μmol·L-1的ATO处理细胞72 h后分化已经发生,在ATO 2 μmol·L-1时CD11b的表达上升明显,且出现明显分群,其各特征细胞群聚集程度高。ATO 4、8 μmol·L-1时CD11b表达同样明显。
3.7ATO对HL-60细胞凋亡影响的量效关系由Fig 7可知,ATO诱导HL-60细胞凋亡呈药物浓度依赖性变化。8 μmol·L-1的ATO处理细胞48 h后,凋亡率较空白组上升最为明显。
4 讨论
APL是造血组织的恶性疾病,其特征是形态异常的早幼粒细胞增生。ATO作为治疗APL的临床有效药,治疗窗窄,寻找药效学临界点的药理学依据对于控制不良反应的发生有重要价值。
UPR是一种促生存反应,减少未折叠蛋白的积累并恢复正常的内质网功能。蛋白质持续聚集则信号从促存活转换到促凋亡。早期内质网应激会经PERK作用使位于内质网外侧的eIF2α蛋白磷酸化,抑制蛋白合成,促使ATF4的翻译能够通过替代性eIF2α非依赖性翻译途径发生。ATF4转位到细胞核,诱导ER体内平衡所需的基因转录。减轻了内质网新生肽链折叠的负荷,但这只是一种临时性的防御措施。经较长时间应激后,内质网应激蛋白如GRP78、GRP94、ATF4等表达增加,提高细胞处理未折叠蛋白能力。研究发现,磷酸化eIF2α蛋白与内质网应激中期应激蛋白的表达和蛋白质合成启动的恢复也有关系。PERK的激活也诱导CHOP的产生,是从促存活转为致死信号的重要因素,最终导致细胞凋亡的发生[3]。
由MCODE算法对ATO相关基因网络拓扑关系聚类结果分析可知,内质网应激相关基因在其中占据较高比重。EIF2AK3、EIF4E、XBP1、ATF6、NFE2L2、 ATF4是内质网应激3条通路上的基因,与内质网应激密切相关。第3模块中的基因全部与内质网相关,提示这些基因可能是关键功能基因群,而内质网应激是细胞分化向凋亡切换的效应机制。
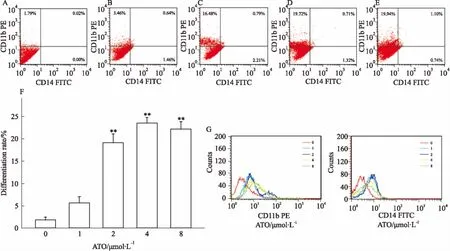
Fig 6 The differentiation level of HL-60 cells detected by flow cytometry at different concentrations of ATO(±s,n=3)
A: ATO 0 μmol·L-1; B: ATO 1 μmol·L-1; C: ATO 2 μmol·L-1; D: ATO 4 μmol·L-1; E: ATO 8 μmol·L-1; F: Cell differentiation rate; G: CD11b and CD14 fluorescence intensity.**P<0.01vscontrol
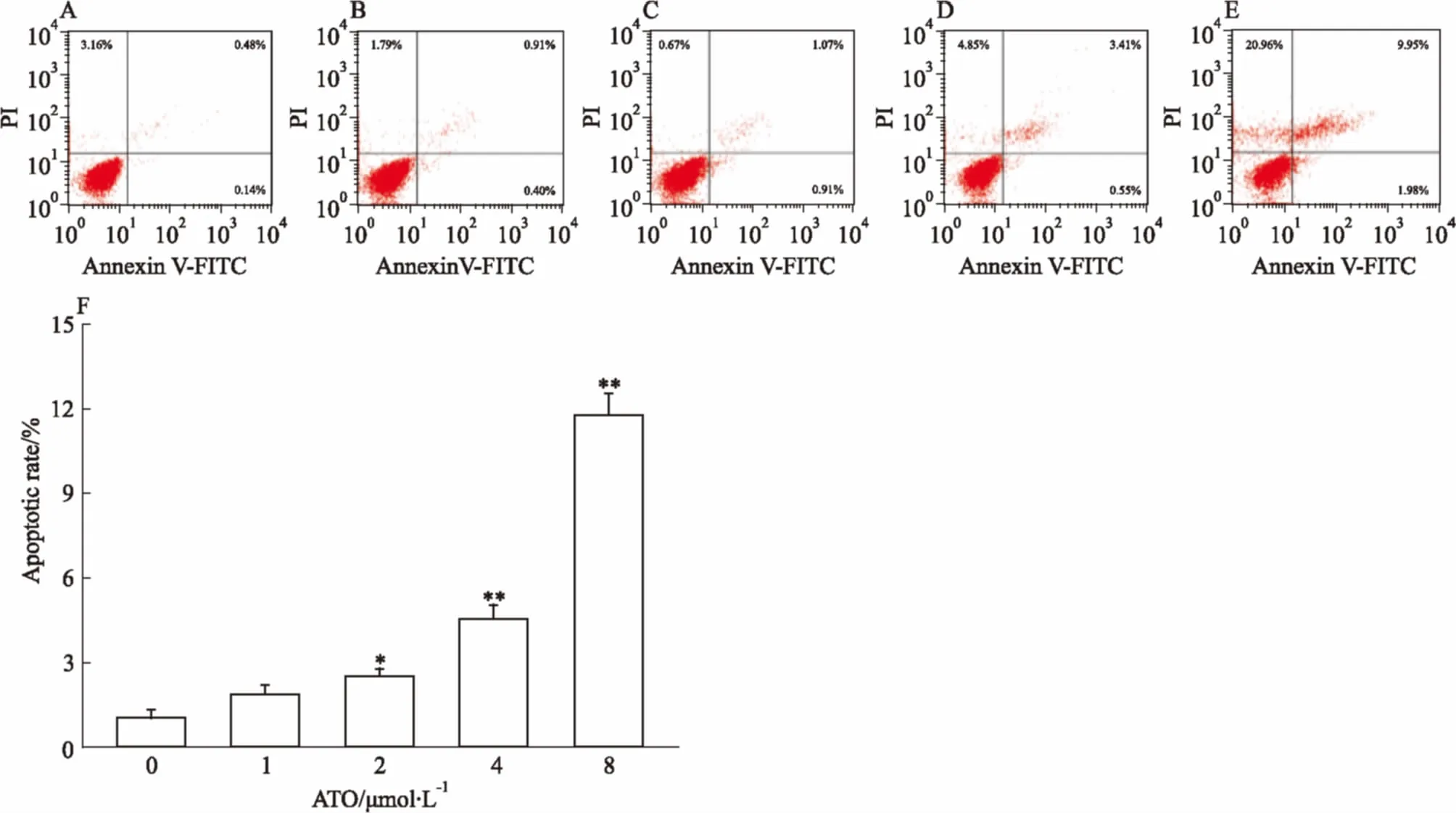
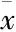
A: ATO 0 μmol·L-1; B: ATO 1 μmol·L-1; C: ATO 2 μmol·L-1; D: ATO 4 μmol·L-1; E: ATO 8 μmol·L-1; F: Cell apoptosis rate.*P<0.05,**P<0.01vscontrol
Chen等[13]发现ATO作用于NB4细胞24、72、120 h时,较高浓度(0.5~2 μmol·L-1)先诱导凋亡,低浓度诱导(0.1~0.5 μmol·L-1)部分分化,且PML-RARα蛋白的快速调节和降解可能有助于这两种效应。Luesink等[14]研究发现,1 μmol·L-1的ATO作用于NB4细胞72 h时,可见Annexin V和PI的双阳性,同时CD11b表达略有增加,当ATO和ATRA联合用药时,可以观察到明显的分化和凋亡双诱导。Chen等[15]研究发现,ATO作用于NB4细胞48 h时,高浓度(1~2 μmol·L-1)通过激活线粒体介导的内在凋亡途径诱导凋亡,并促进低浓度细胞分化(0.25~0.5 μmol·L-1)。这些研究均证明ATO对APL细胞确实具有剂量依赖性双重作用:在低浓度下诱导分化,在高浓度下引发细胞凋亡并诱导部分分化。但这些研究都局限于NB4细胞,且药物作用时间较长,未能清楚阐明ATO诱导细胞分化和凋亡双重作用的机制,以及分化向凋亡切换效应所涉及到的基因表达的改变。
本研究结果表明,在1~2 μmol·L-1时p-eIF2α蛋白高表达,而CHOP蛋白表达低,说明在此浓度下只引起了轻微的内质网应激,且在该浓度下,细胞分化事件发生,特别是在2 μmol·L-1时,细胞出现了明显的分群,而凋亡事件并未发生。在8 μmol·L-1时,p-eIF2α蛋白低表达,CHOP蛋白高表达,此时细胞出现了明显的凋亡,同时分化事件依然存在。在mRNA水平,本文揭示了分化和内质网应激事件的时效关系,由结果可知,分化发生在内质网应激事件之后,这说明细胞分化、凋亡事件的发生,分化、凋亡切换效应均与细胞内质网应激密切相关。因此,内质网应激确实是ATO化疗中临界的一个标志,对于毒性预警和治疗极量具有把控价值。更深入的机制仍有待进一步研究。
(致谢:本研究在石河子大学药学院新疆植物药资源利用教育部重点实验室完成,感谢在本课题研究中给予帮助和支持的同学。)
[1] Emadi A, Gore S D. Arsenic trioxide—an old drug rediscovered[J].BloodRev, 2010,24(4-5):191-9.
[2] Lengfelder E, Hofmann W K, Nowak D. Impact of arsenic trioxide in the treatment of acute promyelocytic leukemia[J].Leukemia, 2012,26(3):433-42.
[3] Masouleh B K, Chevet E, Panse J, et al. Drugging the unfolded protein response in acute leukemias[J].JHematolOncol, 2015,8(1):87.
[4] Davis A P, King B L, Mockus S, et al. The Comparative Toxicogenomics Database: update 2011[J].NucleicAcidsRes, 2011,39(D1):D1067-72.
[5] Bader G D, Hogue C W. An automated method for finding molecular complexes in large protein interaction networks[J].BMCBioinformatics, 2003,4(1):2.
[6] 陈 虹,张闪闪,董锦蕾,等.紫檀茋和乙酰紫草素抑制B16F10细胞增殖的协同作用[J]. 中国药理学通报,2016,32(6):818-24.
[6] Chen H, Zhang S S, Dong J L, et al. The synergistic antiproliferative effect of pterostilbene and acetylshikonin on B16F10 cells[J].ChinPharmacolBull, 2016,32(6):818-24.
[7] 龚福恺,王晓琴,李照雪,等.α-维尼非林经线粒体凋亡途径诱导K562细胞凋亡[J]. 中国药理学通报,2015,31(3):391-5.
[7] Gong F K, Wang X Q, Li Z X, et al. α-viniferin induced apoptosis in K562 cells via mitochondrial pathway[J].ChinPharmacolBull, 2015,31(3):391-5.
[8] Wada N, Kawano Y, Fujiwara S, et al. Shikonin, dually functions as a proteasome inhibitor and a necroptosis inducer in multiple myeloma cells[J].IntJOncol, 2015,46(3):963-72.
[9] Zhang Z Z, Yuan K, Yue H T, et al. Identification and functional characterization of an endoplasmic reticulum oxidoreductin 1-α gene in Litopenaeus vannamei[J].DevCompImmunol, 2016,57:10-9.
[10] Dong H Y,Kung J X,Bhardwaj V, et al. Flow cytometry rapidly identifies all acute promyelocytic leukemias with high specificity independent of underlying cytogenetic abnormalities[J].AmJClinPathol,2011,135(1):76-84.
[11] Hingorani R, Deng J, Elia J, et al. Detection of apoptosis using the BD Annexin V FITC assay on the BD FACSVerseTMsystem[J].BDBiosciences, 2011:1-12.
[12] Zhang B, Chen N, Chen H, et al. The critical role of redox homeostasis in shikonin-induced HL-60 cell differentiation via unique modulation of the Nrf2/ARE pathway[J].OxidMedCellLongev, 2012,2012(5):781516.
[13] Chen G Q, Shi X G, Tang W, et al. Use of arsenic trioxide(As2O3) in the treatment of acute promyelocytic leukemia(APL): I. As2O3exerts dose-dependent dual effects on APL cells[J].Blood, 1997,89(9):3345-53.
[14] Luesink M, Pennings J L, Wissink W M, et al. Chemokine induction by all-trans retinoic acid and arsenic trioxide in acute promyelocytic leukemia: triggering the differentiation syndrome[J].Blood, 2009,114(27):5512-21.
[15] Chen S J, Zhou G B, Zhang X W, et al. From an old remedy to a magic bullet: molecular mechanisms underlying the therapeutic effects of arsenic in fighting leukemia[J].Blood, 2011,117(24):6425-37.
MechanismofERstressinvolvedinATOinhibitedHL-60proliferation
ZHANG Shan-shan1, LI Tian-yi1, WANG Xiao-qin1, ZHANG Bo1,2
(1.SchoolofPharmaceutics,ShiheziUniversity; 2.KeyLabofXinjiangPlantResourcesandUtilization,MinistryofEducation,ShiheziUniversity,ShiheziXinjiang832002,China)
AimTo explore the pharmacological mechanism of arsenic trioxide(ATO) on endoplasmic reticulum(ER) stress and provide indirect pharmacological indicators for the therapeutic drugs monitoring of acute promyelocytic leukemia.MethodsThe ATO toxicology database was utilized to associate gene data and establish protein-protein interaction networks. MCODE algorithm was used to analyze clustering of network topology relationship in order to find the critical functional gene group. The HL-60 cells were used as the model in this study. The cytotoxicity of ATO to HL-60 was evaluated by MTT assay. Real-time PCR assay was involved in detecting the expression of stress-related genes in ER stress. Western blot was used to detect the expression of stress-related proteins in ER stress. ER-specific staining was conducted by ER-Tracker Red. Cell differentiation and apoptosis was tested by flow cytometry.Results206 ATO-related genes had 3 794 pairs of relationships, and ER stress-related module was outstanding among the top 4 gene cluster. ATO inhibited HL-60 cell proliferation in a dose-dependent manner; 4 h after administration ATO could induce ER stress. The expressions of GRP78 and GRP94 were significant and the gene expression level changed greatly over time. The expression level of GRP78, GRP94 and Nrf2 was induced by 1~4 μmol·L-1ATO, and the expression of CHOP was significant by 8 μmol·L-1ATO. ATO could induce the phosphorylation level of eIF2α protein at 1~2 μmol·L-1as well as a large expression of CHOP protein markedly at 8 μmol·L-1. As shown in ER-specific staining, ATO at 4, 8 μmol·L-1induced ER swelling. Flow cytometry showed that ATO could induce cell differentiation at 1 μmol·L-1, and the differentiation group was obvious at 2 μmol·L-1. So as to the concentration of 4 and 8 μmol·L-1, but the apoptotic group emerged at 8 μmol·L-1.ConclusionATO can inhibit the proliferation of HL-60 and in this process, ER stress is involved, which shows a concentration-dependent phase-switching effect.
acute promyelocytic leukemia; arsenic trioxide; ER stress; differentiation; apoptosis; MCODE algorithm
A
1001-1978(2017)11-1589-07
R329.24;R733.710.22;R979.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.044.html
10.3969/j.issn.1001-1978.2017.11.022
2017-07-18,
2017-08-22
国家自然科学基金资助项目(No 81460566,U1603122)
张闪闪(1992-),女,硕士生,研究方向:系统药理学与分子药理学,E-mail:1520813826@qq.com; 张 波(1978-),男,博士,教授,研究方向:系统药理学与中药药理学,通讯作者,E-mail:bozhang_lzu@126.com