载天冬酰胺酶磺丁基-β-环糊精脂质体的稳定性及相关机制
2017-11-01万胜利张永红胡雪原张景勍
李 瑶,万胜利,张永红,胡雪原,张景勍
(1. 重庆医科大学药学院重庆药物高校工程研究中心,重庆 400016;2. 西南医科大学附属医院药学部,四川 泸州 400010)
载天冬酰胺酶磺丁基-β-环糊精脂质体的稳定性及相关机制
李 瑶1,万胜利2,张永红1,胡雪原1,张景勍1
(1. 重庆医科大学药学院重庆药物高校工程研究中心,重庆 400016;2. 西南医科大学附属医院药学部,四川 泸州 400010)
目的考察载天冬酰胺酶(asparaginase, Ase)磺丁基-β-环糊精脂质体(sulfobutyl ether-β-cyclodextrin liposomes loaded with asparaginase, ASDL)的稳定性,并探究其稳定性增强的相关机制。方法采用逆向蒸发法制备ASDL,通过酸碱稳定性、热稳定性、抗胰蛋白酶稳定性、血浆稳定性和贮存稳定性,考察ASDL的体外稳定性,并利用荧光光谱法探究其稳定性增强的相关机制。结果稳定性实验结果显示,ASDL的酸碱稳定性、热稳定性、抗胰蛋白酶稳定性、血浆稳定性和贮存稳定性都优于Ase。荧光实验结果显示,ASDL特性提高的原因可能与荧光发色团周围微环境和疏水结构的改变有关。结论磺丁基-β-环糊精脂质体能够有效保护Ase不受外界环境,如水解酶、pH、温度的影响,从而提高了Ase的稳定性。
生物大分子;天冬酰胺酶;环糊精脂质体;稳定性;体外;荧光
天冬酰胺酶(asparaginase, Ase)是首个被发现具有抗肿瘤特性的治疗酶[1],1953年,首次从几内亚猪血清中提取获得,而人类血清中缺少Ase[1-2]。肿瘤细胞依赖天冬酰胺合成蛋白质以维持自身的恶性增生,Ase能够快速消除肿瘤细胞赖以生存的天冬酰胺,导致肿瘤细胞因蛋白质合成受阻而死亡[3-5]。在临床应用中,Ase等大分子药物存在的主要问题为稳定性差、半衰期短、免疫原性高,且易产生副作用等[6-7]。
为使Ase能更好地应用于临床,Chien等[8]对Ase进行PEG化修饰,Karamitros等[9-10]采用葡聚糖/聚精氨酸层的CaCO3纳米粒装载Ase,Ashrafi等[11]用一种新型脂肪酸与Ase进行生物接合。这些改造在一定程度上阻止了蛋白酶对Ase的分解及温度对其的影响,但仍存在Ase易脱落、免疫原性高、生物相容性低等不足。脂质体具有类细胞的磷脂双分子结构,既可作为天然的保护屏障,又有好的生物相容性。环糊精脂质体是在脂质体基础上发展的一种新型的药物递送系统,能给予药物双重保护作用,避免药物的降解或泄漏,具有增强药物稳定性、抗水解、提高药物生物利用度等优点,与普通脂质体相比应用前景更好[12-13]。
本实验采用逆向蒸发法制备了门冬酰胺酶磺丁基-β-环糊精脂质体(sulfobutyl ether-β-cyclodextrin liposomes loaded with asparaginase, ASDL),考察了ASDL的酸碱稳定性、热稳定性、抗胰蛋白酶稳定性、血浆稳定性和贮存稳定性,并根据稳定性实验结果,设计荧光光谱实验,探究了ASDL稳定性增强的相关机制。
1 材料
1.1仪器TGL-16G高速台式离心机(上海安亭科学仪器厂);DF-101S型集热式磁力搅拌器(巩义市予华仪器有限责任公司);Milli-Q超纯水系统(美国Millipore公司);Zetasizer Nano zs90激光粒度电位仪(英国马尔文公司)。
1.2试剂Ase(以色列Prospec公司);胆固醇(美国Sigma公司);磷脂(德国Lipoid公司);磺丁基-β-环糊精(南京都莱生物技术有限公司);Tris(国药集团化学试剂有限公司);葡聚糖凝胶G-200(上海楷洋生物技术有限公司);考马斯亮蓝G-250(国药集团化学试剂有限公司);ASDL(实验室自制,批号20161024,平均粒径:166.2 nm,平均Zeta电位:-28.2 mV);其他试剂均为分析纯。
2 方法
2.1ASDL的制备称取处方量的Ase和磺丁基-β-环糊精,溶于10 mL Tris-HCl缓冲液中(pH 7.3),35℃搅拌2 h,得溶液A。将处方量的卵磷脂和胆固醇溶于15 mL二氯甲烷,减压旋蒸至形成均匀薄膜,加入15 mL乙醚脱膜后,加入溶液A,超声10 min至形成均匀的带乳光的分散体系,并继续减压蒸发至凝胶状塌陷为乳白色的带乳光的均匀液体,取出定容10 mL,得ASDL。
2.2活性测定使用奈斯试剂法[14]测定Ase的活性。取底物天冬酰胺溶液,加入0.1 mL Ase溶液,于37℃水浴条件下精确反应10 min后,立即加入0.1 mL三氯醋酸溶液终止反应,离心,取上清液,加入适量蒸馏水和奈斯勒指示剂,静置10 min,于480 nm处测定其紫外吸光值。实验前,底物天冬酰胺溶液最好预热2 min。
2.3酸碱稳定性采用pH 6.0、6.5、7.0、7.5、8.0、8.5、9.0的Tris-HCl缓冲液,分别溶解Ase及ASDL,得到不同pH条件下的Ase及ASDL溶液。将Ase及ASDL溶液于37℃水浴孵育40 min后,按“2.2”项下的方法分别考察Ase及ASDL的酸碱稳定性。
2.4热稳定性将Ase及ASDL溶液置于55℃的水浴中,分别于0、1、2、3、4、5 h时取出,按“2.2” 项下的方法考察Ase及ASDL溶液的热稳定性。
2.5抗胰蛋白酶稳定性等量胰蛋白酶溶液与Ase及ASDL溶液混合,置于37℃水浴中保存,于0、10、20、30、40、50、60 min取出,按“2.2” 项下的方法考察Ase及ASDL溶液的抗胰蛋白酶稳定性。
2.6血浆稳定性大鼠眼眶取血,置于肝素化的离心管,3 000 r·min-1离心10 min,取上清液即得空白血浆。取Ase及ASDL溶液与等体积的空白血浆混合,于37℃下孵育0、1、2、4、8、12、24、48、72、96 h,按“2.2” 项下的方法考察Ase及ASDL溶液的血浆稳定性。
2.7贮存稳定性将Ase及ASDL溶液避光贮存于4℃条件下,分别于0、1、2、5、10、15、20、28 d时取出,按“2.2” 项下的方法考察Ase及ASDL溶液的贮存稳定性。
2.8荧光实验考察游离Ase及ASDL溶液在不同温度条件下的荧光吸收。取游离Ase及ASDL溶液2 mL,于25℃下孵化3 h,破乳,取980 μL上层清液与20 μL异硫氰酸荧光素溶液,混合,在发射波长500~600 nm,激发波长480 nm下检测其荧光强度。同法,取游离Ase及ASDL溶液2 mL,于55℃下孵化3 h,破乳,按上述方法测其荧光强度。
3 结果
3.1酸碱稳定性由Fig 1可知,整体来看,不同pH条件下ASDL的活性均优于Ase,尤其在pH 7.5时最明显(P<0.05),此时ASDL的活性相对于Ase提高了约25%。因此,酸碱稳定性实验结果显示,ASDL相对于Ase更能抵抗环境酸碱性的变化。
3.2热稳定性Fig 2结果显示,相较于ASDL,Ase的活性呈快速下降趋势,1.5 h时Ase的活性即降至50%,而此时ASDL的活性仍高达约90%,3 h时已检测不到Ase的活性,而ASDL的活性仍保持在50%以上,且能维持至5 h时。实验结果表明,ASDL和Ase的热稳定性差异具有统计学意义(P<0.05),且ASDL的热稳定性明显优于Ase。
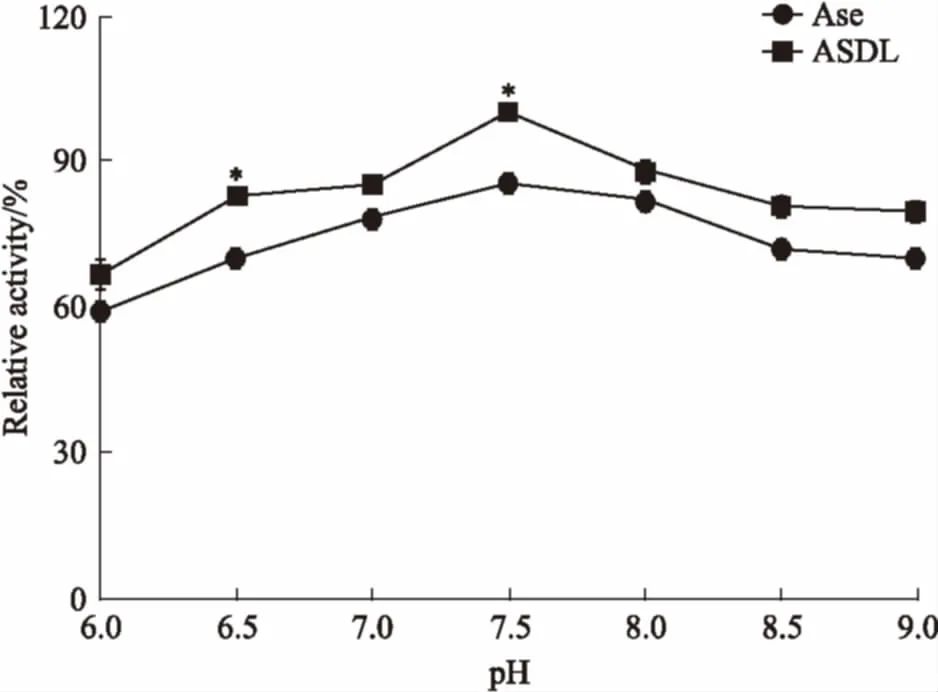
Fig 1 pH stabilities of ASDL and Ase(n=3)
*P<0.05vsAse
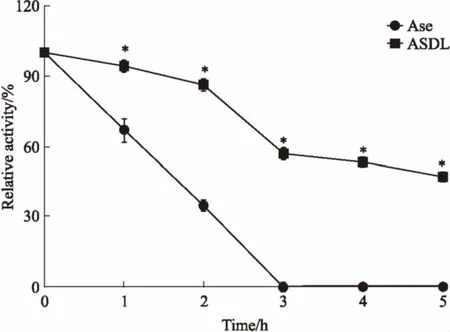
Fig 2 Thermal stabilities of ASDL and Ase(n=3)
*P<0.05vsAse
3.3抗胰蛋白稳定性如Fig 3所示,与蛋白酶接触后,ASDL和Ase的活性均受到较大影响,但与ASDL相比,Ase的活性受到的影响更为明显。Ase的活性降至50%约需30 min,而ASDL的活性降至50%约需55 min,50 min时已检测不到Ase的活性,但此时ASDL的活性仍保持在50%以上,且直到360 min时才检测不到。
3.4血浆稳定性从Fig 4可以看出,随着时间的增加,ASDL与Ase的活性都逐步下降,但ASDL的活性均高于Ase,Ase的活性降至50%约需16 h,而ASDL的活性降至50%约需60 h,48 h即检测不到Ase的活性,但此时ASDL的活性仍高达65%,且到96 h才降至为0。血浆稳定性实验结果说明ASDL较Ase具有更优的血浆稳定性。
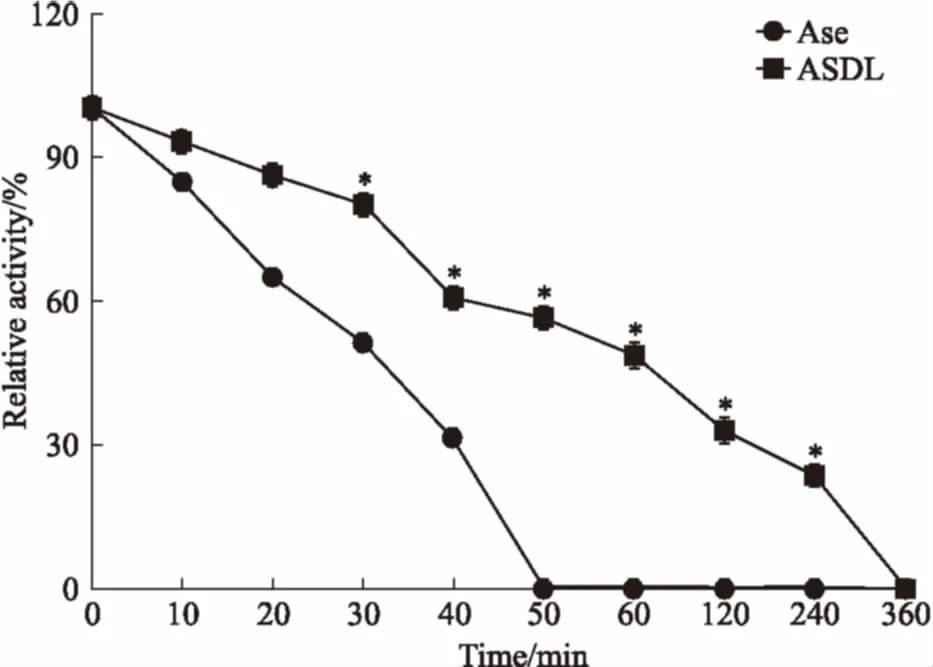
Fig 3 Proteolytic stabilities of ASDL and Ase(n=3)
*P<0.05vsAse
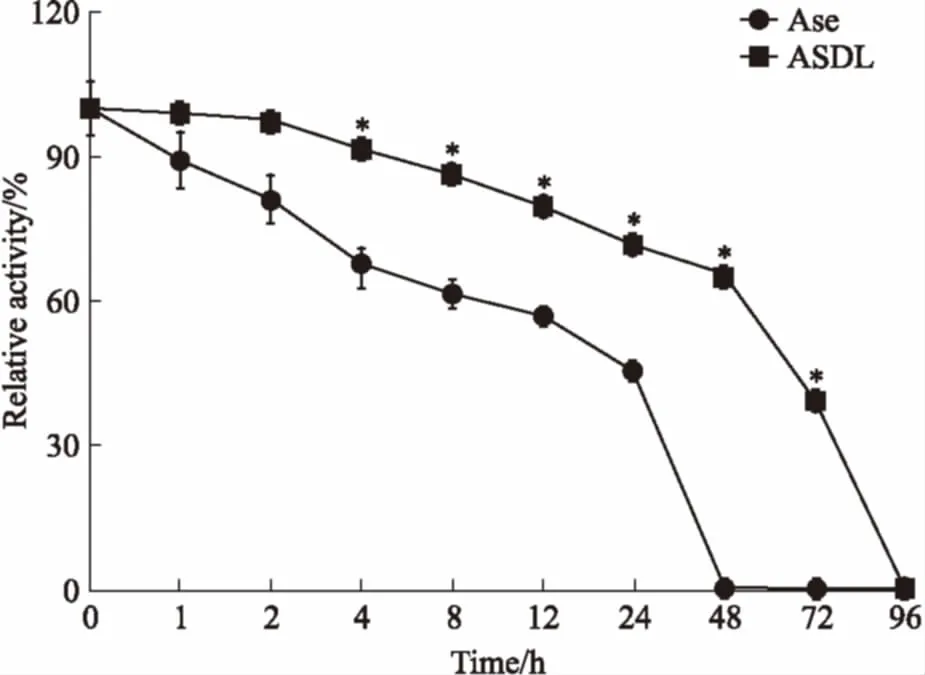
Fig 4 Plasma stabilities of ASDL and Ase(n=3)
*P<0.05vsAse
3.5贮存稳定性如Fig 5的4℃贮存稳定性实验结果所示,当贮存时间为1~2 d时,ASDL与Ase的活性基本相同,d 5时两者的活性开始出现较大差别,贮存10~15 d时差别最为明显(P<0.05),此时ASDL的活性高于Ase约24%~28%,20~28 d时,Ase的活性相对于ASDL呈现出更为快速的下降趋势。
3.6荧光实验ASDL和Ase受热前后的荧光实验结果见Fig 6。加热后,ASDL和Ase的荧光强度相比加热前都明显降低,但ASDL受热后荧光强度下降的幅度明显低于Ase。引起荧光强度改变的原因可能是荧光发色团周围微环境和疏水结构的改变[15]。结合Fig 6的实验结果,可以推测磺丁基-β-环糊精脂质体对Ase起到了保护作用,阻止了加热条件对Ase荧光发色团周围微环境和疏水结构或是构象的进一步改变,增加了ASDL的稳定性。
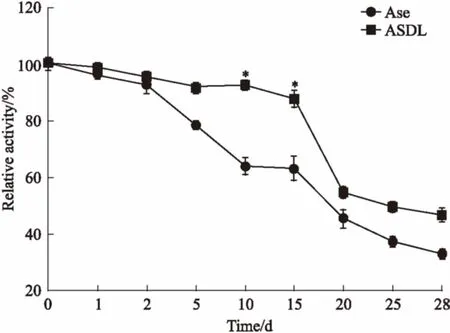
Fig 5 Storage stabilities of ASDL andAse incubated at 4℃(n=3)
*P<0.05vsAse
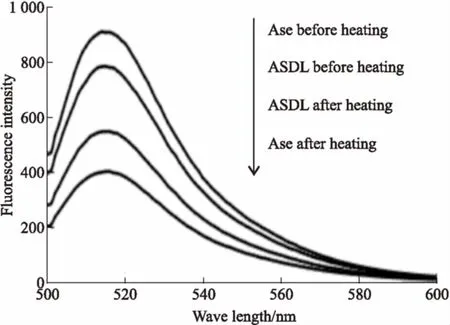
Fig 6 Fluorescence results of ASDLand Ase before and after heating(n=3)
4 讨论
环糊精脂质体作为一类新型脂质体,具有更稳定、能掩盖装载药物疏水性和实现更好包封效果的优势[12-13]。本实验采用逆向蒸发法制备了门冬酰胺酶磺丁基-β-环糊精脂质体(ASDL),对ASDL的微观形态及生物学特性进行了考察,并设计荧光光谱实验探究了ASDL稳定性提高的相关机制。通过考察发现,ASDL的酸碱稳定性、热稳定性、抗胰蛋白酶稳定性、血浆稳定性和贮存稳定性均明显优于Ase。荧光实验结果显示,磺丁基-β-环糊精脂质体能够阻止加热条件对Ase荧光发色团周围微环境和疏水结构或是构象的进一步改变,使Ase保持其活性结构不受影响,从而提高了ASDL的稳定性[15-16]。
ASDL不仅具有更优的药物稳定性和更好的药物包封效果,而且通过磺丁基-β-环糊精修饰后,理论上还具有能延长封装药物生物半衰期、提高封装药物生物利用度、降低毒副作用等优势。本实验结果证实,相比于Ase,经过磺丁基-β-环糊精修饰后得到的ASDL环糊精脂质体具有更优的酶学特性和更好的稳定性,为ASDL在体内的进一步研究奠定了实验基础。
[1] Batool T,Makky E A,Jalal M,et al. A comprehensive review on L-asparaginase and its applications[J].ApplBiochemBiotechnol,2016,178(5): 900-23.
[2] Salzer W L,Asselin B L,Plourde P V,et al. Development of asparaginase Erwinia chrysanthemi for the treatment of acute lymphoblastic leukemia[J].AnnNYAcadSci,2014,1329(1): 81-92.
[3] 梁家宝, 郭绪涛, 黄 芬, 等. 两种门冬酰胺酶治疗成人急性淋巴细胞白血病的疗效及安全性[J]. 第三军医大学学报, 2016,38(7): 737-42.
[3] Liang J B, Guo X T, Huang F, et al. Efficacy and safety of 2 asparaginase preparations in induction treatment of adult acute lymphoblastic leukemia[J].ActaAcadMedMilTert, 2016,38(7):737-42.
[4] Borek D,Kozak M,Pei J,et al. Crystal structure of active site mutant of antileukemic L-asparaginase reveals conserved zinc-binding site[J].FEBSJ,2014,281(18):4097-111.
[5] Ali U,Naveed M,Ullah A,et al. L-asparaginase as a critical component to combat acute lymphoblastic leukaemia(ALL): a novel approach to target ALL[J].EurJPharmacol,2016,771: 199-210.
[6] 包 强, 蔡鑫君, 李范珠. 不同粒径神经毒素-Ⅰ纳米粒大鼠鼻腔给药脑药动学研究[J]. 中国药理学通报, 2010,26(6):731-5.
[6] Bao Q,Cai X J, Li F Z. The brain pharmacokinetical study of different diameters neurotoxin Ⅰnanoparticles after intranasal administration in rats[J].ChinPharmacolBull, 2010,26(6): 731-5.
[7] Einsfeldt K,Baptista I C,Pereira J C,et al. Recombinant L-asparaginase from zymomonas mobilis: a potential new anti-leukemic agent produced in Echerichia coli[J].PLoSOne,2016,11(6): e0156692.
[8] Chien W W,Allas S,Rachinel N,et al. Pharmacology,immunogenicity, and efficacy of a novel pegylated recombinant Erwinia chrysanthemi-derived L-aparaginase[J].InvestNewDrugs,2014,32(5):795-805.
[9] Karamitros C S,Yashchenok A M,Möhwald H,et al. Preserving catalytic activity and enhancing biochemical stability of the therapeutic enzyme asparaginase by biocompatible multilayered polyelectrolyte microcapsules[J].Biomacromolecules,2013,14(12): 4398-406.
[10] 谢江川, 胡雪原, 晏子俊, 等. 载天冬酰胺酶自组装纳米囊的药动学及生物等效性[J]. 第二军医大学学报, 2016,37(6) :690-3.
[10] Xie J C, Hu X Y, Yan Z J, et al. Pharmacokinetics and bioequivalence of self-assembly nanocapsule loaded with asparaginase[J].AcadJSecMilMedUniv, 2016,37(6):690-3.
[11] Ashrafi H,Amini M,Mohammadi-Samani S,et al. Nanostructure L-asparaginase-fatty acid bioconjugate: synthesis, preformulation study and biological assessment[J].IntJBiolMacromol,2013,62(11):180-7.
[12] Ikeda A, Funada R, Sugikawa K. Different stabilities of liposomes containing saturated and unsaturated lipids toward the addition of cyclodextrins[J].OrgBiomolChem, 2016,14(22):5065-72.
[13] Aadinath W, Bhushani A, Anandharamakrishnan C. Synergistic radical scavenging potency of curcumin-in-β-cyclodextrin-in-nanomagneto liposomes[J].MaterSciEngCMaterBiolAppl, 2016,64:293-302.
[14] 施特尔马赫著, 钱嘉渊译. 酶的测定方法[M]. 北京:中国轻工业出版社, 1992, 85-8.
[14] Stellmach B, Qian J Y.Bestimmungsmethodenenzyme[M]. Beijing: China Light Industry Press, 1992, 85-8.
[15] Zhou Y,Zhang M,He D,et al. Uricase alkaline enzymosomes with enhanced stabilities and anti-hyperuricemia effects induced by favorable microenvironmental changes[J].SciRep,2016,7:20136.
[16] Xiong H,Zhou Y,Zhou Q,et al. Nanosomal microassemblies for highly efficient and safe delivery of therapeutic enzymes[J].ACSApplMaterInterfaces,2015,7(36): 20255-63.
Stabilitiesandrelatedmechanismofsulfobutylether-β-cyclodextrinliposomesloadedwithasparaginase
LI Yao1, WAN Sheng-li2, ZHANG Yong-hong1, HU Xue-yuan1, ZHANG Jing-qing1
(1.ChongqingResearchCenterforPharmaceuticalEngineering,CollegeofPharmacy,ChongqingMedicalUniversity,Chongqing400016,China; 2.DeptofPharmacy,theAffiliatedHospitalofSouthwestMedicalUniversity,LuzhouSichuan400010,China)
AimTo investigate the stabilities and related mechanism of sulfobutyl ether-β-cyclodextrin liposomes loaded with asparaginase(ASDL).MethodsReverse evaporating method was used for the prepar-ation of ASDL, and the acid-base stability, thermal stability, antitrypsin stability, plasma stability and storage stability of ASDL were tested. Moreover, fluorescence spectrum method was utilized to explore the stability enhancement mechanisms of ASDL.ResultsThe results of stability showed that the acid-base stability, thermal stability, antitrypsin stability, plasma stability and storage stability of ASDL were all superior to asparaginase. Fluorescence experiment results indicated that the improved characteristics of ASDL might be related to the changes of the surrounding microenvironment of fluorescent chromophore or the structure of hydrophobic.ConclusionASDL can effectively protect asparaginase from the external environment, such as hydrolase, pH, temperature and so on, to improve the stabilities of asparaginase.
biomacromolecule; asparaginase; cyclodextrin liposomes; stabilities;invitro; fluorescence
A
1001-1978(2017)11-1596-05
R345.69;R943;R977.3;R979.19
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.046.html
10.3969/j.issn.1001-1978.2017.11.023
2017-07-24,
2017-08-26
重庆市研究生科研创新项目 (No CYS16133)
李 瑶(1993-),女,硕士生,研究方向:药物新剂型与新技术,E-mail:1422405629@qq.com; 张景勍(1973-),女,博士,教授,博士生导师,研究方向:药物新剂型与新技术,通讯作者,E-mail:zjqrae01@163.com
