孕期尼古丁暴露加重高脂饮食所致成年子代大鼠肾上腺功能紊乱及其性别差异
2017-11-01段芳芳黄鹤归祝春燕
段芳芳,刘 莲,黄鹤归,祝春燕,何 正,汪 晖,3
(1. 武汉大学基础医学院药理学系,湖北 武汉 430071;2. 湖北省荆州市长江大学医学院药理学系,湖北 荆州 434023;3. 发育源性疾病湖北省重点实验室,湖北 武汉 430071)
孕期尼古丁暴露加重高脂饮食所致成年子代大鼠肾上腺功能紊乱及其性别差异
段芳芳1,刘 莲2,黄鹤归1,祝春燕1,何 正1,汪 晖1,3
(1. 武汉大学基础医学院药理学系,湖北 武汉 430071;2. 湖北省荆州市长江大学医学院药理学系,湖北 荆州 434023;3. 发育源性疾病湖北省重点实验室,湖北 武汉 430071)
目的通过观察孕期尼古丁暴露(PNE)所致的宫内发育迟缓(IUGR)仔鼠出生后,在高脂饮食(HFD)模型下,血中皮质酮(CORT)浓度和肾上腺甾体合成功能的变化及其性别差异,从胰岛素样生长因子-1(IGF-1)信号通路角度探讨其发生机制。方法PNE(2.0 mL·kg-1·d-1)建立大鼠IUGR模型,子代断奶后给予HFD喂养直至出生后第24周。检测仔鼠血CORT含量、肾上腺甾体合成功能、IGF-1信号通路及11β-HSDs/CR系统表达。结果与HFD对照组相比,PNE组♂子代血CORT浓度呈降低趋势,♀呈升高趋势;PNE组♂子代肾上腺甾体合成酶表达(如StAR、3β-HSD、P450c11)明显降低,PNE组♀子代肾上腺甾体合成酶表达(如SF-1和P450c21)增加;PNE组♂子代IGF-1信号通路中IGF-1、IGF-1R升高,PNE组♀子代IGF-1信号通路各基因表达明显增加;PNE组♂子代11β-HSD2、GR表达降低,11β-HSD1/11β-HSD2比值升高,而PNE组♀子代相应的基因表达以增加为主。结论PNE可致HFD子代大鼠肾上腺甾体合成功能异常变化,并呈现较明显的性别差异,其发生机制与尼古丁所致的肾上腺甾体合成低功能宫内编程及出生后IGF-1介导的追赶性生长有关。
孕期尼古丁暴露;高脂饮食;肾上腺;性别差异;IGF1信号通路;追赶性生长
调查表明,孕妇接触烟雾的机会相当大,在中国,15岁以上人群总吸烟率达37.6%,而非吸烟者中被动吸烟率高达63.7%[1]。流行病学调查显示,孕期母体主动或被动吸烟可导致一系列子代发育相关的健康问题,包括宫内发育迟缓(intrauterine growth retardation, IUGR)和成年后代谢综合征(metabolic syndrome, MS)发病率增高等[2-3]。尼古丁是烟草中的主要生物碱,由于其脂溶性较高,能快速通过胎盘在胎儿体内蓄积,是烟草中危害胎儿健康的主要毒性成分。Fowden等[4]提出,胎儿时期下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴功能异常是IUGR胎儿成年后MS易感的可能机制之一。同时,HPA轴也与机体应激反应有关,如创伤后应激障碍[5]。
肾上腺作为HPA轴的终端器官,其分泌的糖皮质激素(glucocorticoids, GCs)对促进胎儿生长和发育有着重要意义。表达于肾上腺皮质的胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)及IGF-1受体(IGF-1 receptor, IGF-1R)能调节组织甾体合成酶,促进GCs合成与分泌[6]。高脂饮食(high-fat diet, HFD)作为生活中常见的慢性刺激因子,与多种疾病的发生、发展密不可分。已证实,HFD能增强HPA轴活性和增加循环GCs水平,其发生机制与促进下丘脑促肾上腺皮质激素释放激素的释放及肾上腺GCs合成有关[7]。那么,孕期尼古丁暴露(prenatal nicotine exposure, PNE)所致的IUGR仔鼠出生后在HFD下,肾上腺甾体合成功能是如何变化的?发生机制如何?这些问题至今尚未见研究报道。
1 材料与方法
1.1试剂与仪器尼古丁,购自美国 Sigma-Aldrich 公司;大鼠血皮质酮(corticosterone, CORT)的酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)试剂盒,购自美国Assay-pro公司;逆转录试剂盒、实时定量PCR试剂盒,购自中国大连宝生物工程有限公司;寡聚核苷酸引物由中国上海生工生物技术有限公司合成;异氟烷,购自美国巴克斯特医疗保健有限公司;其余化学试剂均为国产分析纯。Applied Biosystems StepOne实时荧光定量PCR仪购于美国ABI公司。
1.2实验动物及处理大鼠由湖北省预防科学院实验动物中心提供,许可证号:SCXK(鄂)2010-2011,SPF级。动物实验均按照中国动物福利委员会的使用原则执行。Wistar大鼠,♀,体质量(200±20)g;♂,体质量(280±20)g,适应性喂养1周后,每晚18 ∶00进行合笼交配(♀ ∶♂=2 ∶1)。次晨进行♀鼠阴道涂片,显微镜下检见精子时记为受孕0 d(gestational day 0, GD0)。确定受孕后,将孕鼠随机分为2组。尼古丁组于GD11开始每天皮下注射1.0 mg·kg-1,1日2次,给药容积为1.0 mL·kg-1,直至分娩。尼古丁为液态,先溶于生理盐水,对照组给予等量生理盐水,给药体积为1.0 mL·kg-1。各组孕鼠均正常饮食,直至自然生产。仔鼠出生后1 d时,筛选出窝仔数为8~12只的母鼠。在对照组和尼古丁组孕鼠中分别每窝挑选♂鼠和♀鼠各1只,对照组保留非IUGR仔鼠,尼古丁组保留IUGR仔鼠(仔鼠体质量低于同胎龄鼠平均体质量的2倍标准差),并尽量平衡性别比例为1 ∶1。每组各挑选10只♂、♀仔鼠,最终获得对照组♂、♀仔鼠各10只,尼古丁组♂、♀性仔鼠各10只。出生后4周(postnatal week 4,PW4)时仔鼠断奶,♂、♀分笼,所有仔鼠均给予HFD(自由摄食)至PW24,HFD配方参考文献[8],包括88.0%玉米粉、11.5%猪油和0.5%胆固醇。PW24时,异氟醚麻醉后处死子代大鼠,收集大动脉血液,在4°C高速离心机下17 205×g离心15 min,留取上清液储存于-80 ℃冰箱,待测血CORT浓度,另冰上获取大鼠肾上腺组织,放入-80 ℃冰箱待用。
1.3血清CORT浓度的测定按照ELISA试剂盒说明书检测血CORT浓度,其中试剂盒可检测到的最低CORT浓度为0.39 μg·L-1,其批间和批内变异系数分别为5.0%和7.2%。
1.4实时RT-PCR检测肾上腺组织相关基因表达根据说明书提取肾上腺组织总RNA,通过分光光度计测定分离RNA的浓度和纯度,并将其浓度调节至1 g·L-1。将总RNA储存在焦碳酸二乙酯中,于-80℃保存。根据逆转录试剂盒的方案,从2 μg总RNA制备单链cDNA。使用Primer Premier 5.0设计引物,序列见Tab 1。利用提取DNA试剂盒分离相应的RT-PCR产物,用于构建以下靶基因的相对标准曲线(Tab 1)。在96孔光学反应板中,使用ABI StepOne实时PCR热循环仪在20 μL反应混合物中进行PCR。为了更精确地定量检测基因转录物表达水平,测量管家基因甘油醛磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)的mRNA表达水平,并用作定量对照。每个样品针对GAPDH mRNA含量进行标准化。所用的PCR循环条件如下:预变性,95℃ 30 s;变性,95℃ 5 s;每个基因的退火条件列于Tab 1;延伸,72℃ 30 s,对于3β-羟类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-HSD)反应进行延伸步骤。
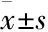

Tab 1 Oligonucleotide primers and PCR conditions of rats in quantitative real-time PCR
SF-1: steroidogenic factor-1; StAR: steroidogenic acute regulatory protein; P450scc: cytochrome P450 cholesterol side chain cleavage; 3β-HSD: 3β-hydroxysteroid dehydrogenase; P450c21: steroid 21β-hydroxylase; P450c11: steroid 11β-hydroxylase; IGF-1: insulin-like growth factor-1; IGF-1R: IGF-1 receptor; Akt1: protein kinase B; 11β-HSD1: 11β-hydroxysteroid dehydrogenase type 1; 11β-HSD2: 11β-hydroxysteroid dehydrogenase type 2; GR: glucocorticoid receptor; MR : mineralocorticoid receptor; GAPDH : glyceraldehyde 3-phosphate dehydrogenase
2 结果
2.1血清CORT浓度变化如Fig 1所示,与HFD对照组相比,PNE组♂子代大鼠血清CORT浓度呈降低趋势;PNE组♀子代大鼠血清CORT浓度呈增加趋势。
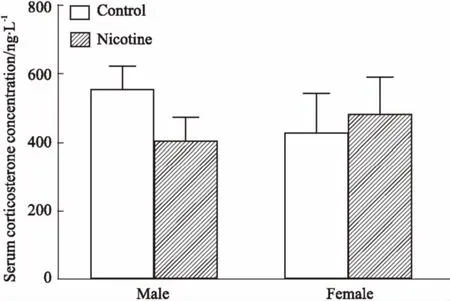
Fig 1 Effects of prenatal nicotine (2 mL·kg-1·d-1) exposure on serum corticosterone (CORT) concentrationwith high-fat diet (HFD) in adult male andfemale offspring rats(±s, n=10)
2.2肾上腺甾体合成酶基因表达变化如Fig 2所示,与HFD对照组相比,PNE组♂子代肾上腺甾体合成酶系统mRNA表达明显降低(P<0.05,P<0.01),其中尤以类固醇急性调节蛋白(steroidogenic acute regulatory protein, StAR)、细胞色素P450胆固醇侧链裂解酶(cytochrome P450 cholesterol side chain cleavage, P450scc)、3β-HSD和类固醇11β-羟化酶(steroid 11β-hydroxylase, P450c11)明显;在PNE组♀子代中,类固醇生成因子1(steroidogenic
Fig 2 Effects of prenatal nicotine (2 mL·kg-1·d-1) exposure on mRNA expressfactor-1, SF-1)和类固醇21β-羟化酶(steroid 21β-hydroxylase, P450c21)明显升高(P<0.05,P<0.01),其他无明显改变。提示PNE组♂子代肾上腺甾体合成酶在HFD下降低,而PNE组♀子代则以升高为主。ion of adrenal steroidogenic enzymeswith HFD in adult male and female offspring rats(±s, n=10)
1: SF-1; 2: StAR; 3: P450scc; 4: 3β-HSD; 5: P450c21; 6: P450c11.*P<0.05,**P<0.01vsHFD control
2.3肾上腺IGF-1信号通路基因表达变化如Fig 3所示,与HFD对照组相比,PNE组♂子代肾上腺IGF-1信号通路中IGF-1和IGF-1R表达增加(P<0.05);PNE组♀子代肾上腺IGF-1信号通路各基因表达明显增加,包括IGF-1、IGF-1R、 Akt1(P<0.05,P<0.01)。提示与HFD对照组相比,PNE组♂、♀性子代大鼠在HFD下,肾上腺IGF-1信号通路表达均增加。
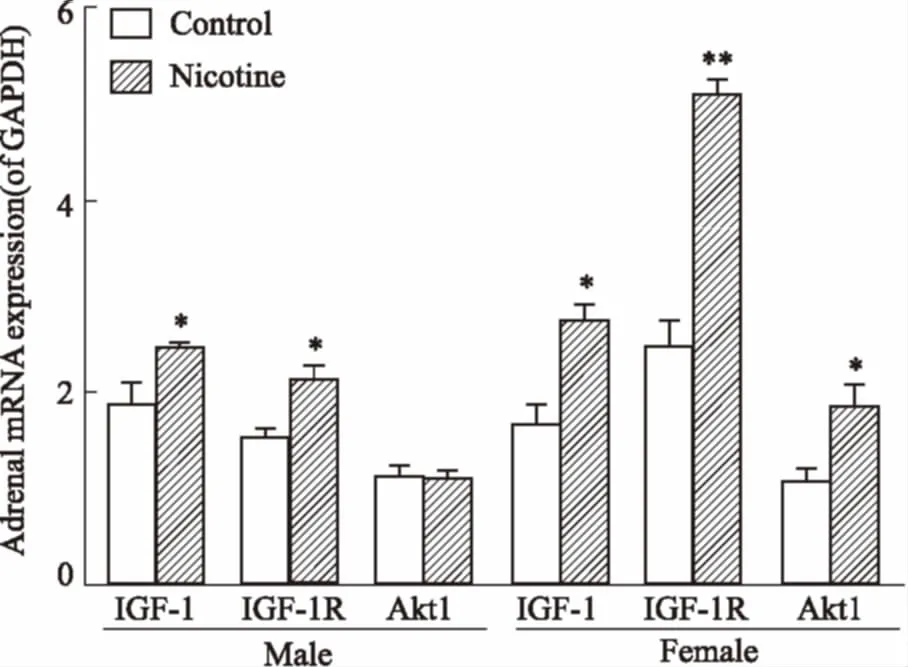
Fig 3 Effects of prenatal nicotine (2 mL·kg-1·d-1) exposureon mRNA expression of adrenal insulin-like growth factor-1 (IGF-1) signaling pathway with HFD in adult male andfemale offspring rats(±s, n=10)
*P<0.05,**P<0.01vsHFD control
2.4肾上腺11β-羟类固醇脱氢酶(11β-hydroxysteroiddehydrogenases,11β-HSDs)/皮质激素受体(corticosteronereceptor,CR)系统基因表达变化如Fig 4所示,与HFD对照组相比,PNE组♂子代肾上腺11β-HSD2的mRNA 表达降低(P<0.05),11β-HSD1/11β-HSD2表达比增加(P<0.05),糖皮质激素受体(glucocorticoid receptor, GR)表达水平降低(P<0.05);PNE组♀子代肾上腺11β-HSD2的mRNA 表达降低(P<0.01),而11β-HSD1、盐皮质激素受体(mineralocorticoid receptor, MR)和GR的表达均明显增加(P<0.05,P<0.01),11β-HSD1/11β-HSD2表达比明显增加(P<0.01)。提示在HFD下,♂子代大鼠11β-HSDs/CR系统以抑制为主(主要以MR、GR为主),♀子代肾上腺11β-HSDs/CR系统表达以活化为主。
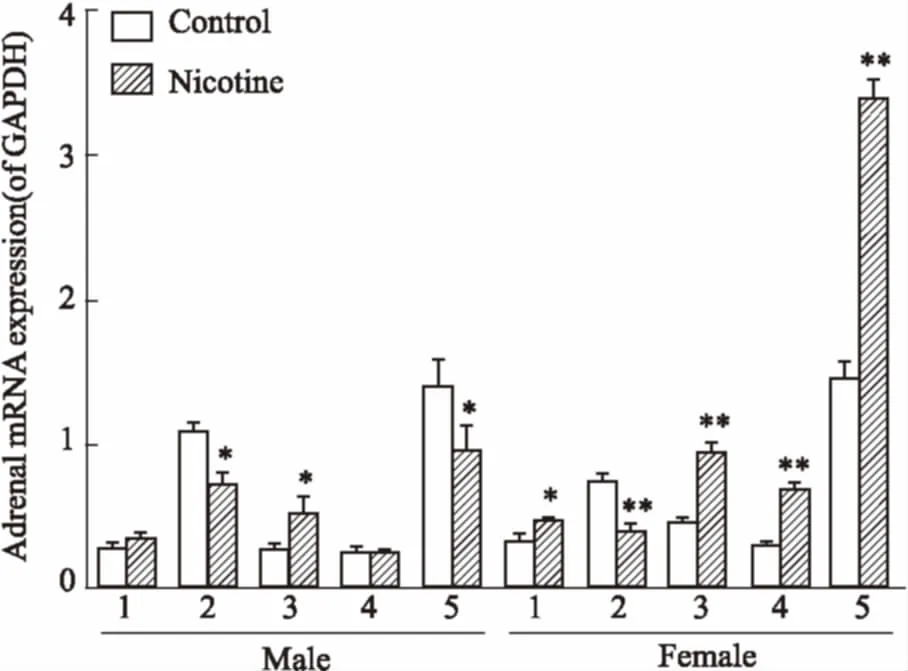
Fig 4 Effects of prenatal nicotine (2 mL·kg-1·d-1) exposure on mRNA expression of adrenal 11β-hydroxysteroid dehydrogenases (11β-HSDs), mineralocorticoid receptor (MR) and glucocorticoid receptor (GR) with HFD in adult male and female offspring rats(±s, n=10)
1: 11β-HSD1; 2: 11β-HSD2; 3: 11β-HSD1/11β-HSD2; 4: MR; 5: GR.*P<0.05,**P<0.01vsHFD control
3 讨论
1根普通香烟约含10 mg尼古丁[9],本研究中,PNE组所给的尼古丁剂量(2 mL·kg-1·d-1)相当于60 kg孕妇每天抽1.8根香烟[10],因此,可以反映日常生活中孕妇的吸烟状况。我们前期研究证实,PNE可以导致子代低出生体重以及高IUGR率,同时,尼古丁可致胎肾上腺StAR和P450scc合成功能降低[11]。在细胞实验中证实,尼古丁可以剂量依赖性地降低人胎肾上腺细胞系中甾体合成酶StAR和P450scc mRNA的表达水平,减少皮质醇分泌[12]。可见,尼古丁可以影响肾上腺甾体合成酶的基因表达。
宫内编程改变是指宫内损伤引起的组织/器官形态和功能的持久性改变,可以从发育时期持续到成年甚至终生,导致成人多疾病易感性增加。本研究中,PNE组♂成年子代大鼠肾上腺类固醇合成系统(包括StAR、P450scc、3β-HSD、P450c11)在HFD下降低,血CORT浓度也呈现出降低趋势。这些结果表明尼古丁可导致♂子代成年大鼠在HFD下肾上腺功能的抑制,此种抑制效果可能与宫内编程所致的HPA轴低基础活性有关。这与我们前期证实的PNE子代出生后HPA轴具有低基础活性的研究结果一致[10]。本研究中,♂子代肾上腺IGF-1信号通路(包括IGF-1、IGF1-R)表达增加,呈现出一定的追赶性生长,上调肾上腺甾体合成酶,从而使其恢复至正常水平。而在PNE组♀子代中,血CORT水平呈现增加趋势,肾上腺类固醇合成酶增加,IGF-1信号通路(IGF-1、IGF-1R、Akt1)表达比♂子代的增加更为明显(表现为Akt1也增加),呈现出更明显的追赶性生长,具有一定的性别差异。
研究表明,髙血GCs增加血糖、胰岛素抵抗、糖尿病以及其他代谢性疾病的风险[13]。本室研究表明,GC-IGF-1轴作为一个可能存在的负反馈轴,调节局部CORT的合成,在维持血GCs水平稳定上起着重要作用[14],11β-HSDs/CR系统基因表达是调节血GCs水平稳定的重要因素。本研究中,与HFD对照组相比,PNE组♂、♀大鼠血CORT水平发生紊乱,呈现出一定的失代偿,这与11β-HSDs/CR系统调节失代偿有关,血GCs水平的稳态一旦遭到破坏,血糖和血脂的代谢功能受到影响,导致子代对MS以及相关的代谢性疾病的易感性增加。
综上,PNE所致的子代大鼠在HFD下出现肾上腺甾体合成功能的异常变化,其发生机制可能与尼古丁介导的肾上腺甾体合成低功能宫内编程以及出生后IGF-1介导的追赶性生长有关。而PNE暴露和HFD下出现的性别差异,推测与性激素的作用有关,为此,本研究若能增加大鼠体内性激素的检测则能证明我们的推测。在进一步的研究中,我们将分离不同性别大鼠原代肾上腺细胞,分别给予性激素处理,检测其甾体合成酶的基因表达,以探究性别差异。
(致谢:本实验主要在武汉大学基础医学院药理学系汪晖实验室完成,感谢张郦饲养动物,雷有颖收取肾上腺标本。)
[1] Zheng P P, Michelle C K, Carla J B, et al. Correlates of smoke-free home policies in Shanghai, China [J].BiomedResInt, 2014,11(11):1-8.
[2] Chen H, Iglesias M A, Caruso V, et al. Maternal cigarette smoke exposure contributes to glucose intolerance and decreased brain insulin action in mice offspring independent of maternal diet [J].PLoSOne, 2011,6(11):1-11.
[3] Huang R C, Burke V, Newnham J P, et al. Perinatal and childhood origins of cardiovascular disease [J].IntJObes(Lond), 2007,31(2): 236-44.
[4] Fowden A L, Giussani D A, Forhead A J. Intrauterine programming of physiological systems: causes and consequences [J].Physiology(Bethesda), 2006,21: 29-37.
[5] 王宣尹, 吴丽丽, 严 灿. HPA轴编程及其有关表观遗传修饰机制与创伤后应激障碍发病的研究进展[J]. 中国药理学通报, 2017,33(1):22-7.
[5] Wang X Y, Wu L L, Yan C. Epigenetic pathogenesis of post-traumatic stress disorder based on the HPA axis [J].ChinPharmacolBull, 2017,33(1):22-7.
[6] Sirianni R, Chimento A, Malivindi R, et al. Insulin-like growth factor-I, regulating aromatase expression through steroidogenic factor 1, supports estrogen-dependent tumor Leydig cell proliferation [J].CancerRes, 2007,67(17):8368-77.
[7] Shin A C, MohanKumar S M, Sirivelu M P, et al. Chronic exposure to a high-fat diet affects stress axis function differentially in diet-induced obese and diet-resistant rats [J].IntJObes(Lond), 2010,34(7) : 1218-26.
[8] Wang H, Liao Z X, Chen M, et al. Effects of hepatic fibrosis on ofloxacin pharmacokinetics in rats [J].PharmacolRes, 2006,53(1):28-34.
[9] Hadidi K A, Mohammed F I. Nicotine content in tobacco used in hubble-bubble smoking [J].SaudiMedJ, 2004,25(7): 912-7.
[10] Liu L, Liu F, Kou H, et al. Prenatal nicotine exposure induced a hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic programmed alteration in intrauterine growth retardation offspring rats [J].ToxicolLett, 2012,214(3):307-13.
[11] Xu D, Liang C, Yan Y E, et al. Nicotine-induced over-exposure to maternal glucocorticoid and activated glucocorticoid metabolism causes hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic alterations in fetal rats [J].ToxicolLett, 2012,209(3):282-90.
[12] Wang T, Chen M, Liu L, et al. Nicotine induced CpG methylation of Pax6 binding motif in StAR promoter reduces the gene expression and cortisol production[J].ToxicolApplPharmacol, 2011,257(3): 328-37.
[13] Zhang Y P, Gong Y, Zeng Q Y, et al. A long-term, observational cohort study on the safety of low-dose glucocorticoids in ankylosing spondylitis: adverse events and effects on bone mineral density, blood lipid and glucose levels and body mass index [J].BMJOpen, 2015,5(6):1-7.
[14] He Z, Zhu C Y, Huang H G, et al. Prenatal caffeine exposure-induced adrenal developmental abnormality in male offspring rats and its possible intrauterine programming mechanisms [J].ToxicolRes, 2016,5(2): 388-98.
Prenatalnicotineexposureaggravatedabnormaladrenalfunctionanditsgenderdifferencesinadultoffspringratswithhigh-fatdiet
DUAN Fang-fang1, LIU Lian2, HUANG He-gui1, ZHU Chun-yan1, HE Zheng1, WANG Hui1,3
(1.DeptofPharmacology,BasicMedicalCollegeofWuhanUniversity,Wuhan430071,China; 2.DeptofPharmacology,MedicalCollegeofYangtzeRiverUniversity,JingzhouHubei434023,China, 3.HubeiProvincialKeyLabofDevelopmentallyOriginatedDisease,Wuhan430071,China)
AimTo explore the alterations of blood corticosterone (CORT) level and adrenal steroidogenic function, as well as its sex specificity in intrauterine growth retardation (IUGR) rats induced by prenatal nicotine exposure (PNE) with high-fat diet (HFD) after birth, and to make clear its mechanism through insulin-like growth factor-1 (IGF-1) signaling pathway.MethodsIUGR model was established by PNE (2.0 mL·kg-1·d-1), and the offspring rats were administered with HFD until postnatal week (PW) 24 after weaning. Blood CORT concentration, adrenal steroidogenesis enzymes, expressions of IGF-1 signaling pathway and 11β-HSDs/CR system were tested.ResultsCompared with HFD control group, the CORT concentration in male offspring of PNE group represented a decrease trend, while an increase trend in female; the expressions of adrenal steroidogenesis enzymes (such as StAR, 3β-HSD and P450c11) in male offspring decreased, while increased in female offspring (such as SF-1 and P450c21); the expressions of IGF-1 signalling pathway (IGF-1 and IGF-1R) in male offspring increased, and they significantly increased in female offspring; the expression levels of 11β-HSD2 and GR decreased, but 11β-HSD1/11β-HSD2 ratio was enhanced in male PNE group, while in female PNE group, the corresponding gene expressions increased.ConclusionsPNE could induce abnormal alterations of adrenal steroidogenic function, and exhibit apparent gender differences. The potential mechanism is related to low adrenal steroidogenesis function programming induced by nicotine and catch-up growth mediated by IGF-1 after birth.
prenatal nicotine exposure; high-fat diet; adrenal; sex differences; IGF-1 signaling pathway; catch-up growth
A
1001-1978(2017)11-1530-05
R-332;R321;R322.56;R714.51;R971.91;R971.92;R977.11
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.022.html
10.3969/j.issn.1001-1978.2017.11.011
2017-07-18,
2017-08-24
国家自然科学基金资助项目(No 81501269,81673524)
段芳芳(1990-),女,硕士生,研究方向:发育源性疾病,E-mail:dff1099670109@163.com; 汪 晖(1963-),女,博士,教授,博士生导师,研究方向:发育源性疾病,通讯作者,E-mail:wanghui19@whu.edu.cn; 刘 莲(1981-),女,博士,副教授,研究方向:发育源性疾病,通讯作者,E-mail: liulian@yangtzeu.edu.cn