红景天苷对乳鼠缺氧/复氧心肌细胞及线粒体损伤的保护作用*
2017-11-01王渊博冯嘉豪刘超峰
田 心 王渊博 冯嘉豪 刘超峰
(1.陕西省中医医院,陕西 西安710003;2.第四军医大学基础医学部生理学教研室,陕西 西安710032)
红景天苷对乳鼠缺氧/复氧心肌细胞及线粒体损伤的保护作用*
田 心1,2王渊博2冯嘉豪2刘超峰1△
(1.陕西省中医医院,陕西 西安710003;2.第四军医大学基础医学部生理学教研室,陕西 西安710032)
目的观察红景天苷对乳鼠缺氧/复氧后心肌细胞及线粒体损伤的保护作用并探讨其机制。方法将乳鼠心肌细胞分为对照组、对照加红景天苷组、缺氧/复氧组、缺氧/复氧加红景天苷组,分别用CCK8试剂盒检测细胞活力,流式细胞仪检测细胞凋亡、线粒体膜电位情况,激光共聚焦显微镜观察细胞线粒体形态,并采用蛋白免疫印迹〔Western blot〕法分别检测线粒体和胞浆细胞色素C(Cytochrome C)蛋白的表达。结果红景天苷能使缺氧/复氧心肌细胞凋亡减少,增加细胞活力,升高线粒体膜电位,减少线粒体分裂,减少线粒体细胞色素C的释放,实现缺氧/复氧心肌细胞及线粒体损伤的保护作用。结论红景天苷可减轻心肌细胞缺氧/复氧损伤,减少心肌细胞的凋亡,保护心肌细胞线粒体功能。
红景天苷 缺氧/复氧损伤 线粒体 保护作用
心肌缺血再灌注诱导的损伤是急性心肌梗死溶栓和介入治疗的过程中经常伴随的一种病理、生理过程,其损伤机制复杂没有明确的治疗方法[1-2]。近年来,中药红景天的一些有效成分对其作用的机制研究较多,相关证据[3-4]显示红景天苷对在体和离体心肌有明确的保护作用,并有抗氧化应激损伤的效果。本研究拟在细胞水平模拟心肌缺血再灌注损伤建模基础上,通过细胞活性和凋亡的测定探讨红景天苷的保护作用。现报告如下。
1 材料与方法
1.1材料
H9C2(2-1)大鼠胚胎心肌细胞,购自中科院上海生命科学研究院;1~3 d日龄的SD乳鼠,第四军医大学实验动物中心提供。高糖DMEM培养液购自美国Gibco公司,胎牛血清购自美国Gibco公司,Ⅱ型胶原酶、胰蛋白及酶基质胶与Mdivi-1购自美国Sigma公司;JC-1试剂盒,小鼠抗β-actin、兔抗Cytochrome C抗体购自美国abcam公司;MitoTracker-Red荧光探针购自碧云天公司;CCK8试剂盒购自上海贝博生物公司;流式细胞仪为美国BD Immunocytometry Systems产品;酶标仪为美国Molecular Devises公司;电泳系统及凝胶成像系统均为Bio Rad公司产品;红景天苷购于中国药品生物制品检定所,药品纯度≥98.0%(HPLC),药品批号:110818-201206。
1.2方法
1.2 .1 H9C2(2-1)大鼠胚胎心肌细胞系的培养[5]将含10%胎牛血清的高糖培养基的培养液孵育细胞,当细胞生长至互相接近时,用胰酶消化按照1∶3~1∶5开始传代,在实验前1 d,更换为含2%胎牛血清的培养基,使其向心肌细胞分化。
1.2 .2心肌细胞的分离培养和鉴定[5]无菌条件下取1~3 d SD乳鼠心脏,剪碎,加入含1.0 g/L的胶原酶消化液中,3~5min 37℃水浴中反复吹打后弃上清液,沉淀中再加消化液,再于37℃水浴中3~5 min,反复吹打后取上清液,置于含100 mL/L的高糖培养基中(加100U/mL青霉素及0.1mg/mL链霉素)。重复以上操作,离心后取沉淀重悬于培养基中,差速贴壁90~120min,将细胞悬液移至培养皿中,间断观察细胞形态,必要时换液,若由圆形变成不规则形或梭状,由静止变为有规律地收缩时进行实验。
1.2 .3建立缺氧/复氧模型 将培养的心肌细胞置于37℃缺氧孵箱内孵育3 h,即为模拟缺血。更换正常培养液,37℃5%CO2孵箱内复氧2 h即为模拟再灌注处理组给药选择在复氧阶段,红景天苷给药浓度为5μmol/L[6]。
1.2 .4试验分组 将心肌细胞分为对照组、对照加红景天组,缺氧/复氧组、缺氧/复氧加红景天苷组,对照组及缺氧/复氧组给予等体积的无菌PBS溶液。
1.2 .5细胞活力检测 将心肌细胞均匀接种于96孔板中,每孔加培养液100μL,同时设置空白孔,置于37℃5%CO2孵箱中过夜,按照前述实验分组进行缺氧造模,统一在复氧时进行给药,复氧结束后各组细胞每孔加入10μL CCK-8溶液,37℃孵育1~2 h,酶标仪450 nm下依据吸光度测定各孔吸光值,细胞活力=(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)×100%,结果为细胞活力的比率(相对于常氧对照组)。
1.2 .6流式法检测心肌细胞的细胞凋亡率 将心肌细胞均匀接种于直径6 cm培养皿中,前述缺氧、复氧操作同上,给药复氧结束后,将所有各组培养皿中的细胞消化下来重悬于15mL离心管中低速离心3min后弃上清液,无菌PBS液加入重悬,再次低速离心后弃上清液,将沉淀细胞移至流式专用管中,加入10μL的FITC-conjugated-Annexin V和5μL的碘化吡啶(PI),摇匀后室温下避光反应15 min,经流式细胞仪检测。
1.2 .7流式法检测心肌细胞线粒体膜电位 将心肌细胞均匀接种于6孔板中,前述缺氧、复氧操作同上,给药复氧结束后,按照JC-1试剂盒规范操作,将培养板中的细胞消化下来重悬于15mL离心管中低速离心3 min后弃上清液,无菌PBS液洗涤1遍后,加入JC-1工作液染色,于37℃恒温箱中避光反应30 min后,再次用无菌PBS液洗涤1遍后,将沉淀细胞移至流式专用管中,经流式细胞仪分析检测。
1.2 .8激光共聚焦显微镜观察 将培养传代后的细胞铺于激光共聚焦皿中,进行处理同上,将无水DMSO溶剂配置MitoTracker-Red为100μmol/L的工作液,然后按照1 mL培养基加入1μL的工作液进行线粒体染色,37℃细胞培养箱内孵育30 min,立即用激光共聚焦显微镜观察细胞线粒体形态。
1.2 .9蛋白免疫印迹(Western blot)法检测Cytochrome C蛋白在线粒体及胞浆中的表达 心肌细胞经过处理后由线粒体/胞浆蛋白提取试剂盒提取蛋白,并进行蛋白定量,用SDS-PAGE进行电泳,并将其转膜到硝酸纤维素 (NC)膜上,100 g/L的脱脂牛奶室温封闭1 h后,滴加1∶1000的抗Cyto C和β-actin一抗孵育过夜,PBST洗膜(5 min×5次),再用1∶5000的辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,再次洗膜(5 min×5次),后于膜上滴加显影液,进入发光仪器后曝光后观察结果,并利用该系统软件对目的条带进行分析获取统计数据。
1.3统计学处理
2 结 果
2.1红景天苷对心肌细胞缺氧/复氧损伤的影响
见表1。与对照组比较,缺氧/复氧组细胞活力明显降低(P<0.01);与缺氧/复氧组比较,缺氧/复氧加红景天苷组细胞活力明显提升(P<0.01)。
表1 各组心肌细胞活力、心肌细胞凋亡、心肌细胞线粒体膜电位及心肌细胞线粒体及胞浆的Cytochrome C表达的比较(±s)

表1 各组心肌细胞活力、心肌细胞凋亡、心肌细胞线粒体膜电位及心肌细胞线粒体及胞浆的Cytochrome C表达的比较(±s)
与对照组比较,*P<0.05,**P<0.01;与缺氧复氧组比较,△P<0.05,△△P<0.01。
组 别 细胞活力比率 灰度比值(Mito/Cyto)细胞凋亡率(%) 相对红染率(%)对照组0.99±0.01 2.07±0.15对照加红景天苷组0.99±0.01 1.93±0.12缺氧/复氧组0.56±0.04**0.46±0.04*4.52±0.49 98.00±1.00 4.80±0.30 96.33±1.53 39.80±3.48**68.33±2.52**缺氧/复氧加红景天苷组0.87±0.03△△1.43±0.15△15.13±2.40△△88.33±2.52△△
2.2红景天苷对心肌细胞缺氧/复氧凋亡的影响
见图1,表1。与对照组比较,缺氧/复氧组细胞凋亡率明显增高(P<0.01);与缺氧/复氧组比较,缺氧/复氧加红景天苷组细胞凋亡率明显降低(P<0.01)。
2.3红景天苷对心肌细胞线粒体的膜电位的影响

图1 心肌细胞凋亡图
见图2,表1。与对照组比较,缺氧/复氧组细胞线粒体膜电位明显下降(P<0.01)与缺氧/复氧组比较,缺氧/复氧加红景天苷组细胞线粒体膜电位明显上升(P<0.01)。

图2 心肌细胞线粒体膜电位图
2.4红景天苷对缺氧/复氧心肌细胞线粒体分裂的影响
见图3,表1。激光共聚焦显微镜观察细胞线粒体,对照组、对照加红景天苷组线粒体呈网管状结构,而缺氧复氧组细胞线粒体呈点状、碎片化,提示分裂增加;对比缺氧/复氧组,缺氧/复氧加红景天苷组的分裂明显减少。

图3 红景天苷对心肌细胞线粒体形态的影响(600倍)
2.5红景天苷对心肌细胞线粒体内Cytochrome C表达的影响
见图4,表1。与对照组比较,缺氧/复氧组细胞线粒体内Cytochrome C表达降低,而胞浆内Cytochrome C表达升高(P<0.05);与缺氧/复氧组比较,缺氧/复氧加红景天苷组的线粒体内Cytochrome C表达升高,而胞浆内Cytochrome C表达降低(P<0.05)。
3 讨 论
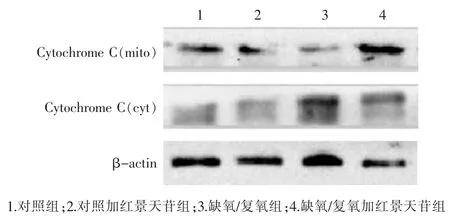
图4 心肌细胞线粒体及胞浆的Cytochrome C表达电泳条带
急性心梗是由于冠脉斑块破裂入血阻塞血管引发,过程往往伴随着缺血/再灌注损伤心肌细胞,而线粒体为细胞能量代谢保证有效供氧、ATP,以及有效的离子交换,线粒体结构和功能的改变对心血管系统的生理和病理起着关键作用[7]。线粒体膜电位是由内膜两侧质子及其他离子的不对称分布而形成,在缺血再灌注时,氧化磷酸化功能障碍,在此过程中,可伴随线粒体裂解增加,DNA碎片化,线粒体膜电位升高,线粒体膜通透孔开放,并释放细胞色素C从线粒体进入细胞质[8]。如何有效采用药物干预保护心肌细胞线粒体,减少心肌细胞的损伤是心血管领域研究的热点。基于以上原因,本研究通过细胞活性、凋亡、线粒体膜电位、线粒体形态学改变以及细胞色素C蛋白表达水平的测定,证实了红景天苷具有减轻缺氧/复氧导致的心肌细胞线粒体损伤,实现抗心肌细胞损伤的保护作用。
传统中药红景天的有效活性成分为红景天苷,红景天苷是一种苯乙醇类化合物,心血管系统药理研究较多[9]。其具有抗缺氧、抗疲劳、抗衰老等功效,亦在神经系统、内分泌系统等疾病方面具有显著的疗效[10-11]。龙怡等研究发现红景天在心肌细胞中有明显抗缺氧作用,其5种单体成分对缺氧缺糖心肌细胞损伤具有明显的保护作用,与上调HIF-1αmRNA的表达有关[12]。付金容等证实在慢性间断性缺氧中,红景天苷通过减少凋亡相关因子的表达,抑制Caspase-3的活性,从而保护心功能[13]。朱宁等认为红景天苷对缺氧诱导心肌细胞损伤具有保护作用,与其减轻氧自由基损伤及提高肌浆网钙泵活性有关[14]。
线粒体呼吸氧化过程是转换底物的氧化还原势能为质子电化学势能,质子电化学势能再转为ATP的高磷酸键的过程[15]。其呼吸氧化过程伴随着膜电位的除极和复极,最早被发现用来染线粒体的染色剂是rhodamine 123(Rh 123),能被活细胞摄取,与膜电位成正比,之后陆续出现各种染色剂,如MitoTracker系列染料等,此类荧光染料常用于需要固定的情况,如免疫细胞化学、TUNEL染色等,而JC-1被认为对线粒体膜电位具有较高的敏感性和辨识度,其特性是490 nm激发光则为绿色,随着膜电位上升,590 nm激发光时则为橙色,因此,JC-1是电压依赖性荧光染料,能够用流式细胞仪或荧光显微镜做定性定量分析[16]。
本研究采用体外心肌细胞缺氧/复氧模拟心肌缺血再灌注损伤,从细胞水平观察红景天苷能否抑制缺氧复氧心肌细胞损伤,并对心肌细胞线粒体产生保护作用,可见红景天苷对缺氧复氧所致心肌细胞损伤、凋亡具有抑制作用,并阐述红景天苷能够维持缺氧复氧心肌细胞线粒体膜电位、抑制线粒体分裂。Western blot结果显示,红景天苷能够抑制细胞色素C的释放,升高线粒体内细胞色素C的浓度,减少胞浆中细胞色素C的浓度这可能跟其有效减少线粒体膜通透孔的开放的机制有关,表明红景天苷能够保护缺氧复氧心肌细胞线粒体功能。但其调控的具体信号通路,是如何抑制缺血再灌注损伤心肌细胞损伤,实现保护线粒体作用,有待于进一步研究。
[1]Chen X,Deng AQ,Zhou TQ,et al.Pretreatment with 2-(4-Methoxyphenyl) (thyl-2-acctamidc-2-dccxy-1)-D-pyrancside attenuates cerebral Ischcmia/Rcpcrlusicn-Induced injury in vitre and in vivo[J].PLoSOno,2014,9(7):e100126.
[2]Zhu Y,Shi YP,Wu D,et al.Salidroside protects against hydrogen peroxide-induced injury in cardiac H9c2 cells via PI3K-Akt dependent pathway[J].DNA Cell Biol,2011,30(10):809-819.
[3]张明发,沈雅琴.红景天苷及其苷元酪醇的心血管保护作用[J].中国新药杂志,2012,21(21):2521-2525.
[4]张明发,沈雅琴.红景天苷心脏保护药理作用的研究进展[J].药物评价研究,2017,40(1):125-132.
[5]陈希瑶,万卓,赵桐,等.Notch信号途径对缺氧/复氧乳鼠心肌细胞的保护作用[J].心脏杂志,2014,26(4):388-392.
[6]王小雄,司瑞,邵虹,等.红景天苷抑制缺血/再灌注诱导的心肌微血管内皮细胞凋亡[J].中国心血管杂志,2015,20(1):57-61.
[7]Offir Ertracht,Assaf Malka,Shaul Atar,etal.The mitochondria as a target for cardioprotection in acute myocardial ischemia[J].Pharmacol.Ther.(2013),http://dx.doi.org/10.1016/j.pharmthera.2013.11.003
[8]Wang Y,Li Xu,Wang XL,et al.Ginsenoside Rd attenuates myocardial ischemia/reperfusion injury via Akt/GSK3β signaling and inhibition of the mitochondria-dependent apoptotic pathway[J].PLOSONE,2013,8(8):1-10.
[9]岳星星,谢春毅,陶晓瑜.红景天苷干预心血管系统药理研究进展[J].中国中医药信息杂志,2017,24(3):130-133.
[10]邹毅清,蔡志扬,李小宝,等.红景天苷预处理对大鼠全脑缺血再灌注后炎症反应的影响[J].现代中西医结合杂志,2013,22(3):253-256.
[11]Zheng T,Yang XY,Wu D,et al.Salidroside ameliorates insulin resistance through activation of a mitochondria-associated AMPK/PI3K/Akt/GSK3βpathway[J].British J Phar,2015(172):3284-3301.
[12]龙怡,李佳川,孟宪丽.红景天有效成分对缺氧缺糖心肌细胞损伤的保护作用研究 [J].中药药理与临床,2010,26(1):24-25.
[13]付金容,郭芙蓉,黎明江.红景天苷保护慢性间断性缺氧心肌细胞作用及机制[J].武汉大学学报:医学版,2017,38(2):212-215.
[14]朱宁,张喆,刘莉,等.红景天苷对缺氧诱导培养乳鼠心肌细胞的保护作用[J].中成药,2012,34(8):1587-1589.
[15]张龙飞,崔玉娟,平政,等.红景天苷对力竭大鼠心肌线粒体呼吸功能的影响[J].解放军医药杂志,2014,26(11):1-5.
[16]曹立莉,杜冠华,王敏伟.红景天苷减轻叠氮钠诱导线粒体损伤的作用[J].药学学报,2005,40(8):700-704.
Protective Effects of Salidroside in Cardiomyocyte and Mitochondria Injury Induced by Hypoxia/Reoxygenation
TIAN Xin,WANG Yuanbo,FU Feng,et al.Department of Cardiology,Traditional Chinese Medical Hospital of Shanxi Province,Shanxi,Xian 710003,China.
Objective:To study the protective effects of Salidroside in cardiomyocyte and mitochondria induced by hypoxia/reoxygenation.Methods:Cardiomyocyte were divided into the control group,the control and Salidroside group,hypoxia/reoxygenation group,hypoxia/reoxygenation and Salidroside group.Cell viabilitieswere detected by cell counting kit(CCK-8);apoptotic cells were detected by flow cytometry;mitochondria membrane potentials were measured by JC-1 kit.The morphology of cell mitochondria was observed by laser scanning confocal microscopy.The expression of cytochrome C protein in mitochondria and cytoplasm was detected with Western blot.ResultsSalidroside could decrease hypoxia/reoxygenation myocardial cells apoptosis,increase cell viability,increase mitochondrial membrane potential,reduce mitochondrial fission,reduce mitochondrial cytochrome C release and protect cardiomyocyte and mitochondria against hypoxia/reoxygenation injury.Conclusions:Salidroside can alleviate hypoxia/reoxygenation injury,reduce cardiomyocyte apoptosis and protect cell mitochondrial function.
Salidroside;Hypoxia/reoxygenation injury;Mitochondria;Protective effect
R285.5
A
1004-745X(2017)10-1714-04
10.3969/j.issn.1004-745X.2017.10.007
陕西省科技统筹创新工程计划项目(2016KTZDSF01-03-02)
△通信作者(电子邮箱:Liu.reld@aliyun.com)
2017-06-15)
