沉默细胞周期检测点激酶l基因对人膀胱癌细胞增殖和凋亡的影响
2017-11-01姜明哲李国忠
姜明哲,李国忠
(天津市第五中心医院,天津300450)
沉默细胞周期检测点激酶l基因对人膀胱癌细胞增殖和凋亡的影响
姜明哲,李国忠*
(天津市第五中心医院,天津300450)
目的探讨沉默细胞周期检测点激酶l(Chk1)基因对人膀胱癌细胞增殖和凋亡的影响。方法培养人膀胱癌T24细胞,根据转染物的不同,将细胞分为siRNA-Chk1组、siRNA-对照序列组和空白对照组,利用实时荧光定量PCR检测各组细胞中Chk1基因表达,MTT法检测各组细胞增殖能力,利用流式细胞术检测各组细胞凋亡,利用流式细胞术检测各组细胞周期,利用Western blot法检测各组细胞中Chk1、Cdc25C和Cyclin B1蛋白表达。结果与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞中Chk1 mRNA相对表达量降低(F=43.813,P=0.000);与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞24 h、48 h、72 h和96 h时吸光度A值均降低(P<0.05);与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞凋亡率显著增加(F=90.736,P=0.000);流式细胞术检测结果显示,siRNA-Chk1组G0/G1期和S期高于siRNA-对照序列组和空白对照组,而G2/M期低于siRNA-对照序列组和空白对照组(P<0.05);与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞中Chk1、Cdc25C和Cyclin B1蛋白相对表达量均降低(P<0.05)。结论特异性沉默Chk1基因可抑制人膀胱癌T24细胞增殖,加速细胞凋亡,其机制可能与抑制Chk1/Cdc25C/CyclinB1通路而减少细胞G2/M期阻滞有关。
膀胱癌;细胞周期检测点激酶l;细胞增殖;细胞凋亡
细胞周期检测点激酶1(checkpoint kinase 1,Chk1)作为高度保守的一种丝氨酸/苏氨酸激酶,在维持正常的细胞周期及基因组稳定、调控细胞凋亡中具有重要作用[1],有研究指出[2],Chk1在多种恶性肿瘤中表达上调,与肿瘤发生及进展过程密切相关。本研究拟利用小干扰RNA(siRNA)技术特异性沉默人膀胱癌T24细胞中Chk1基因,从分子细胞学角度探讨其对细胞增殖和凋亡的影响,以期为膀胱癌机制研究提供基础资料。
1 资料与方法
1.1主要试剂和设备
人膀胱癌T24细胞购自中科院上海生物细胞研究所,RPMI-1640培养液、胎牛血清购自美国Gibco公司,0.25%胰蛋白酶、磷酸盐缓冲液(PBS)购自武汉博士德生物公司,Trizol总RNA提取试剂盒、Lipfectamine 2000脂质体转染试剂盒购自美国Intrivigen公司,逆转录和PCR试剂盒购自日本TaKaRa公司,siRNA-Chk1和siRNA-对照序列均由上海吉玛制药技术公司设计合成,Chk1及内参引物均由上海生工生物公司设计合成,四甲基偶氮唑蓝(MTT)细胞增殖检测试剂盒购自碧云天生物技术公司,Annexin V-FITC细胞凋亡检测试剂盒购自广州威佳科技有限公司,碘化丙啶(PI)染液购自美国Sigma公司,细胞周期检测试剂盒购自上海研谨生物科技有限公司,兔抗Chk1多克隆抗体购自美国Santa Cruz公司,兔抗Chk1介导的细胞分裂周期蛋白25C(Cdc25C)多克隆抗体购自美国Abzoom公司,兔抗人周期素B1(Cyclin B1)抗体购自上海万疆生物技术公司,实时荧光定量PCR仪购自美国ABI公司,凝胶电泳成像分析系统购自美国Bio-rad公司。
1.2方法
1.2.1细胞培养和分组处理 取人膀胱癌T24细胞,置于含10%胎牛血清的RPMI-1640培养液中,于含5% CO2的37℃恒温培养箱中培养。取对数生长期细胞,接种于6孔板中,继续培养,待细胞融合度达80%左右时,利用Lipfectamine 2000脂质体转染试剂盒对细胞进展转染,根据转染物的不同,对细胞进行分组:①siRNA-Chk1组:转染Chk1基因的干扰序列:正义链:5’-CCGGCTGCAAATAGTAGTTCCTGA ACTCGAGTTCAGGAACTACTATTTGCAGTTTTTG-3’,反义链:5’-AATTCAAAAACTGCAAATAGTAGTTCCTGAACT-CGAGTTCAGGAACTACTATTT-GCAG-3’;②siRNA-对照序列组:转染Chk1基因的对照序列:正义链:5’-GATCCCCGTTCTCCGAACGTGTCACGTTTCAAG-3’,反义链:5’-AGAACGTGACACGTTCGGAGAATTTTTTGG-AAA-3’;③空白对照组:不作任何处理。转染后继续在含5% CO2的37℃恒温培养箱中培养48 h,完成后续实验。
1.2.2利用实时荧光定量PCR检测各组细胞中Chk1基因表达 取各组转染后培养48 h细胞,利用细胞裂解液裂解后,用总RNA提取试剂盒获得细胞中总RNA,利用紫外分光光度计检测总RNA纯度,以A260/A280≥1.80作为合格样品完成后续实验。将总RNA逆转录为cDNA,以cDNA为模板进行PCR。引物序列:Chk1引物:上游:5’-ATGCTCGCTGGAGAATTGC-3’,下游:5’-ATAAGGAAAGACCTGTGCGG-3’;GAPDH引物:5’-ACGGATTTGGTCGTATTGGG-3’,下游:5’-TGATTTTGGAGGGATGTCGC-3’。PCR反应条件:94℃ 1 min,92℃ 30 s,56℃ 30 s,74℃ 30 s,连续进行38次循环,每个样品均设置6个平行反应复孔。用2-△△Ct法对各组细胞中Chk1基因相对表达量进行分析。
1.2.3MTT法检测各组细胞增殖能力 取各组细胞,胰酶消化,加入到96孔板中,调整细胞密度为2×105个/孔,继续于含5% CO2的37℃恒温培养箱中培养。分别于培养12 h、24 h、48 h、72 h和96 h时,向各孔加入MTT液20 μl,继续培养4 h,弃去上清,加入二甲基亚砜液150 μl,利用酶标仪于490 nm波长处检测各孔吸光度A值,重复检测6次,取均值。
1.2.4利用流式细胞术检测各组细胞凋亡 取各组转染后培养48 h细胞,胰酶消化,采用2 000×g离心力离心5 min,收集1×106个细胞,冷PBS冲洗3次,用1×结合缓冲液500 μl重新悬浮细胞,分别将Annexin V-FITC 5 μl和PI液5 μl加入各管,室温下避光孵育15 min,于60 min内上机检测,计数凋亡细胞比例,各组重复检测6次,取均值。
1.2.5利用流式细胞术检测各组细胞周期 取各组转染后培养48 h细胞,胰酶消化,采用2 000×g离心力离心5 min,收集1×106个细胞,用PBS缓冲液冲洗3次,于4℃下用70%无水乙醇过夜固定。离心后弃去上清,加入PBS静置20 min,离心后弃去上清,将核糖核酸酶5 μl加入,37℃静置60 min,将50 μl的PI加入,室温下避光染色25 min,利用流式细胞仪对细胞周期进行检测。
1.2.6利用Western blot法检测各组细胞中Chk1、Cdc25C和Cyclin B1蛋白表达 取各组转染后培养48 h细胞,利用细胞裂解液裂解后,提取总蛋白,用BCA法检测蛋白纯度并定量。取50 μg总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至PVDF膜,用5%脱脂奶粉进行封闭120 min,加入一抗兔抗Chk1多克隆抗体、兔抗Cdc25C多克隆抗体和兔抗人Cyclin B1抗体(稀释比例:1∶1 200、1∶800、1∶1 000),4℃条件下过夜孵育,用TBST漂洗3次,将二抗加入,室温下孵育60 min,用TBST漂洗3次,加入化学发光试剂盒进行避光显色,拍照。用Image J图像分析软件对条带进行分析,获得各组细胞中Chk1、Cdc25C和Cyclin B1蛋白相对表达量。
1.3统计学分析

2 结果
2.1各组细胞中Chk1基因表达
siRNA-Chk1组、siRNA-对照序列组和空白对照组细胞中Chk1 mRNA相对表达量分别为(1.22±0.20)、(2.10±0.13)和(2.14±0.23),与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞中Chk1 mRNA相对表达量降低,差异有统计学意义(F=43.813,P=0.000)。
2.2各组细胞增殖能力比较
MTT实验结果显示,与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞24 h、48 h、72 h和96 h时吸光度A值均降低,差异有统计学意义(P<0.05),见图1。
2.3各组细胞凋亡率比较
siRNA-Chk1组、siRNA-对照序列组和空白对照组细胞凋亡率分别为(15.2±2.5)%、(2.8±1.8)%和(2.5±0.9)%,与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞凋亡率显著增加,差异有统计学意义(F=90.736,P=0.000),见图2。
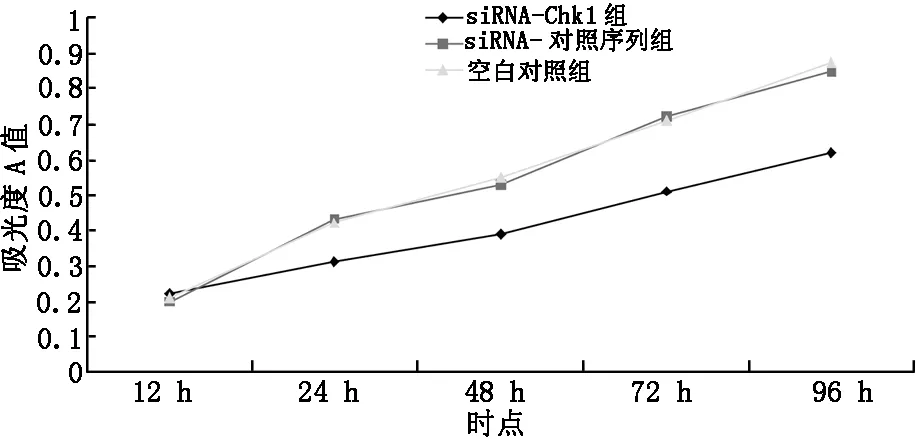
图1 不同时点各组细胞增殖能力比较
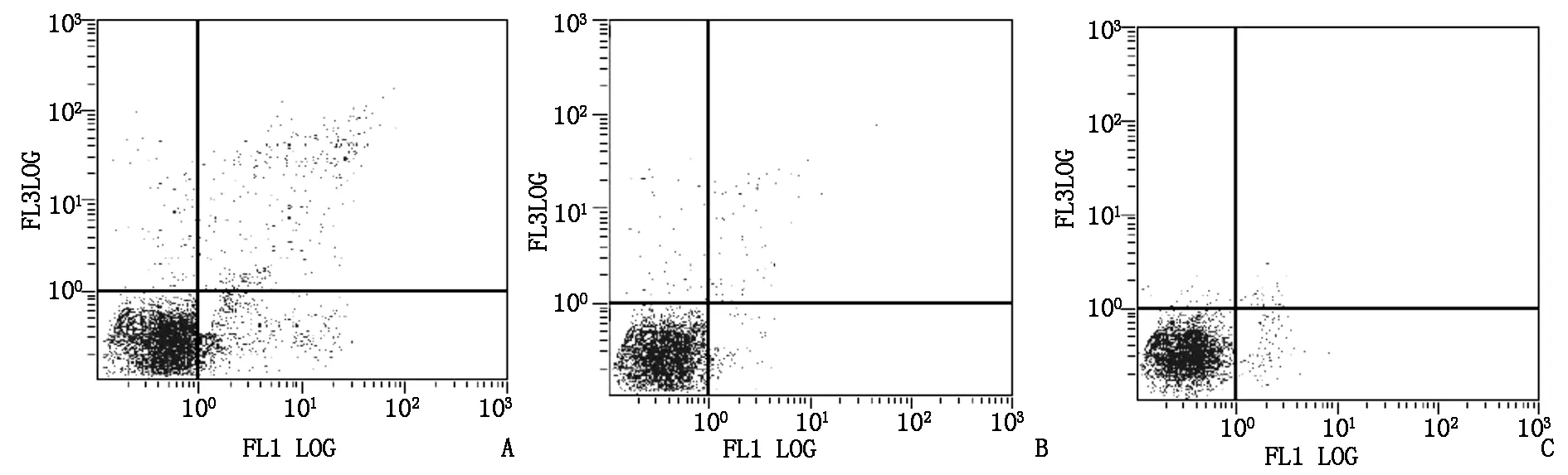
图2 流式细胞术检测各组细胞凋亡情况(A:siRNA-Chk1组、siRNA-对照序列组和空白对照组)
2.4各组细胞周期比较
流式细胞术检测结果显示,siRNA-Chk1组G0/G1期和S期高于siRNA-对照序列组和空白对照组,而G2/M期低于siRNA-对照序列组和空白对照组,差异均有统计学意义(P<0.05),见表1。
表1 各组细胞周期比例比较
注:与空白对照组比较,aP<0.05;与siRNA-对照序列组比较,bP<0.05
2.5各组细胞中Chk1、Cdc25C和CyclinB1蛋白表达比较
与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞中Chk1、Cdc25C和Cyclin B1蛋白相对表达量均降低,差异均有统计学意义(P<0.05),见表2和图3。

表2 各组细胞中Chk1、Cdc25C和Cyclin B1蛋白表达比较
注:与空白对照组比较,aP<0.05;与siRNA-对照序列组比较,bP<0.05
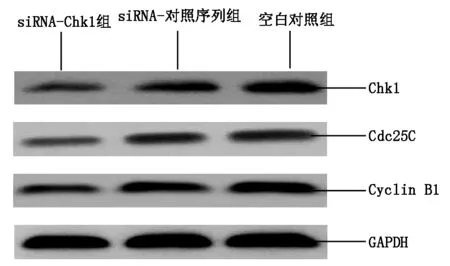
图3 各组细胞中Chk1、Cdc25C和Cyclin B1蛋白表达
3 讨论
膀胱癌作为预后较差的泌尿系统肿瘤,病因和发病机制较为复杂,有研究指出[3],膀胱癌细胞较强的增殖能力是导致患者转移和复发的重要因素。Chk1位于人类11q24染色体,由13个外显子组成,作为细胞周期检测点中的主要蛋白,在调节细胞周期中发挥重要作用,是DNA损伤修复及保证基因完整性的关键基因[4]。正常生理状态下,Chk1可将细胞阻滞在G2/M期检测点,进行包括周期阻滞、错配修复、周期恢复等一系列的级联反应,使细胞基因完整及周期保持稳定[5]。而细胞增殖及凋亡平衡打破,本应停止增殖或发生凋亡的细胞仍进入细胞周期无限制增殖是导致肿瘤发生的根本原因[6]。研究表明[7],Chk1低表达于正常细胞,但却高表达于多种恶性肿瘤组织中,参与了恶性肿瘤发生及进展过程。本研究利用siRNA技术特异性沉默人膀胱癌T24细胞中Chk1基因,荧光定量PCR和Western blot检测结果均显示,siRNA-Chk1组细胞中Chk1基因和蛋白相对表达量均降低,提示人膀胱癌T24细胞中Chk1基因被成功沉默。
MTT实验结果显示,与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞24 h、48 h、72 h和96 h时吸光度A值均降低,提示siRNA-Chk1组细胞增殖能力降低,说明特异性沉默Chk1基因可有效降低人膀胱癌T24细胞增殖能力。本研究显示,与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞凋亡率显著增加,说明特异性沉默Chk1基因可有效增加人膀胱癌T24细胞凋亡水平,进一步对细胞周期进行分析发现,siRNA-Chk1组G0/G1期和S期高于siRNA-对照序列组和空白对照组,而G2/M期低于siRNA-对照序列组和空白对照组,说明特异性沉默Chk1基因可减弱人膀胱癌T24细胞G2/M期阻滞,使G2/M期细胞比例降低,有研究指出[8],Chk1基因高表达可使肿瘤细胞停留在G2/M期,从而有利于细胞的自我修复,加速细胞增殖。而特异性沉默Chk1基因可阻滞这一过程。研究表明[9],Chk1/Cdc25C/CyclinB1是调控细胞G2/M期阻滞的主要通路。有研究指出[10],MMEQ可上调Chk1及Cdc25c基因表达,从而诱导膀胱癌TSGH8301细胞阻滞在G2/M期。本研究结果显示,与空白对照组和siRNA-对照序列组比较,siRNA-Chk1组细胞中Chk1、Cdc25C和Cyclin B1蛋白相对表达量均降低,说明特异性沉默Chk1基因可能通过抑制Chk1/Cdc25C/CyclinB1通路而减少人膀胱癌T24细胞G2/M期阻滞。
综上所述,特异性沉默Chk1基因可抑制人膀胱癌T24细胞增殖,加速细胞凋亡,其机制可能与抑制Chk1/Cdc25C/CyclinB1通路而减少细胞G2/M期阻滞有关。
[1]Smits VA,Gillespie DA.DNA damage control:regulation and functions of checkpoint kinase 1[J].FEBS J,2015,282(19):3681.
[2]张 瑶.细胞周期监测点激酶1与DNA损伤应答信号通路在肿瘤中的研究进展[J].肿瘤研究与临床,2016,28(4):279.
[3]王杰燚,陈红微,田小柯,等.miRNA和膀胱癌发生发展的研究进展[J].中国老年学杂志,2017,37(5):1257.
[4]冯少勇,张雁钢,张 利,等.细胞周期点激酶l/2的研究进展[J].中华临床医师杂志(电子版),2015,9(10):136.
[5]郑林峰,倪型灏.细胞周期检测点激酶1研究进展[J].浙江实用医学,2016, 21(1):76.
[6]Peng G,Liao Y,Shen C.miRNA-429 inhibits astrocytoma proliferation and invasion by targeting BMI1[J].Pathol Oncol Res,2017,23(2):369.
[7]Goto H,Kasahara K,Inagaki M.Novel insights into Chk1 regulation by phosphorylation[J].Cell Struct Funct,2015,40(1):43.
[8]Peng ZG,Yao YB,Yang J,et al.Mangiferin induces cell cycle arrest at G2/M phase through ATR-Chk1 pathway in HL-60 leukemia cells[J].Genet Mol Res,2015,14(2):4989.
[9]吉晓霞,曾 颖,何 洁,等.DADS通过Chk1/Cdc25C/CyclinB1/CDK1通路诱导白血病HL-60细胞G2/M期阻滞[J].中国药理学通报,2015,31(2):221.
[10]Hsu SC,Yu CC,Yang JS,et al.A novel synthetic 2-(3-methoxyphenyl)-6,7-methylenedioxoquinolin-4-one arrests the G2/M phase arrest via Cdc25c and induces apoptosis through caspase- and mitochondria-dependent pathways in TSGH8301 human bladder cancer cells[J].Int J Oncol,2012,40(3):731.
R737.14
A
2016-11-19)
*通讯作者
1007-4287(2017)10-1834-04
