Ghrelin对心梗后心衰大鼠心功能的影响及机制研究
2017-11-01杨春艳冯朝晖
杨春艳,冯朝晖,杨 萍,任 平
(1.吉林大学中日联谊医院 心内科,吉林 长春130033;2.吉林大学第一医院 胸外科)
Ghrelin对心梗后心衰大鼠心功能的影响及机制研究
杨春艳1,冯朝晖1,杨 萍1,任 平2*
(1.吉林大学中日联谊医院 心内科,吉林 长春130033;2.吉林大学第一医院 胸外科)
目的阐明Ghrelin对心梗后心衰大鼠心功能的影响及其相关机制。方法采用结扎左冠状动脉前降支构建心梗后心衰大鼠模型,并在术后将动物随机分为模型组和Ghrelin治疗组 ,并设立假手术组对照。术后第5周开始皮下注射Ghrelin,连续给药4周。通过血流动力学检测及心脏超声检查评价心功能,HE染色观察心肌重构,TUNEL染色观察心肌细胞凋亡情况,并应用ELISA检测血管紧张素II(Ang II)水平。结果与假手术组相比,模型组大鼠的左室舒张末压(LVEDP)明显增加,左室收缩末压(LVSP)与射血分数(EF)明显下降;心肌细胞凋亡数明显增加,心肌重构显著;Ang Ⅱ水平明显增高。与模型组相比,Ghrelin治疗组LVSP 及EF显著提高,LVEDP显著降低;心肌细胞凋亡数目明显减少,心肌重构减轻;Ang Ⅱ水平明显下降。结论Ghrelin可抑制心肌细胞凋亡改善心肌重构,进而提高心衰大鼠心功能,其机制可能与Ghrelin下调Ang II抑制肾素-血管紧张素-醛固酮系统(RAAS)的激活有关。
心力衰竭;Ghrelin;血管紧张素Ⅱ;心肌细胞凋亡
(ChinJLabDiagn,2017,21:1812)
各种心血管疾病进展的最终归宿是慢性心力衰竭(CHF),其发病率高,是心血管疾病患者致残及死亡的重要原因,已成为我国及其他国家主要的公共卫生问题[1,2]。促生长激素释放多肽(Ghrelin)是生长激素促分泌素(GHS)受体的内源性配体,具有多种生物学活性,包括刺激生长激素(GH)分泌、调节代谢、促进摄食与肥胖等[3]。在心血管方面,已有研究表明Ghrelin可以增加心肌收缩力、舒张血管及保护心梗后心衰的形成等作用[4-8]。且有研究进一步表明Ghrelin及其受体GHSR-1a可在心脏表达[9],并与心脏上的结合位点具有高度亲合力[10-12],此研究提示Ghrelin的心血管保护作用可不依赖于GH而独立存在,但其具体的细胞与分子机制尚未完全阐明。本研究旨在探讨Ghrelin对心梗后心衰大鼠心功能的影响及其机制。
1 材料与方法
1.1动物本研究应用的是由吉林大学基础医学院动物实验中心提供的体重200-220 g的雌性Wistar大鼠,合格证号:SCXK-(吉)2003-0001。
1.2主要试剂酰基化Ghrelin购自于中肽生物科技有限公司,Ang II ELISA检测试剂盒购自上海朗顿生物技术有限公司,HE染色试剂盒购自碧云天生物技术公司,TUNEL检测试剂盒购自罗氏公司(South San Francisco,California,USA)。
1.3大鼠心衰模型制备及分组大鼠适应性饲养1周后,随机分为模型组和假手术组,模型动物行左冠状动脉前降支结扎术,方法如下:乙醚吸入麻醉,备皮,局部消毒,先用10号缝线在开胸部位做一荷包,迅速开胸暴露心脏,模型组用0号线结扎左冠状动脉前降支,假手术组仅穿线不结扎。术后迅速收拢荷包关闭胸腔,手术部位涂敷0.2%呋喃西林软膏,并常规给予腹腔注射青霉素(20万U/kg)7天。术后4周模型组存活大鼠20只,随机分为模型组(MI 组:皮下注射与Ghrelin等体积的0.9%生理盐水,2次/日);模型-Ghrelin组(MI-Ghrelin 组:皮下注射Ghrelin 0.2 mg/kg,2次/日)。并设有假手术组(SO 组:皮下注射与Ghrelin等体积的0.9%生理盐水,2次/日)。所有实验大鼠药物干预4周后终止饲养进行实验。
1.4心脏超声检测给药结束后,乙醚吸入麻醉后于左胸上至锁骨下至肋骨下缘处备皮,对大鼠射血分数(EF)进行检测。
1.5血流动力学检测超声检测结束后,进行有创血流动力学检测,方法简述如下:经右侧颈总动脉逆行插入左心室,待稳定后通过RM-6000型八通道生理记录仪记录左心室收缩末压(LVSP),左心室舒张期末压(LVEDP)以及左室内压最大上升/下降速率(±dp/dt max)。
1.6HE染色切取非梗死区心室肌组织约2 mm厚,用4%多聚甲醛固定72 h,之后常规石蜡包埋,切片(5 μm厚),二甲苯脱蜡,下行梯度酒精水化,按试剂盒说明书进行苏木素及伊红染色,于显微镜下观察染色程度。待染色结束后,上行梯度酒精脱水,二甲苯透明,中性树胶封片,光学显微镜观察并拍照。
1.7心肌细胞凋亡检测应用原位末端标记检测法(TUNEL)进行检测,具体步骤按TUNEL说明书进行。染色结束后于暗室光镜下观察,细胞核呈绿色荧光即为TUNEL阳性细胞。
1.8AngII水平检测按照试剂盒操作说明检测外周血及心肌组织Ang II水平, 测定450 nm波长光吸收值,根据标准曲线计算Ang II含量。

2 结果
2.1心功能相关指标检测
血流动力学相关指标检测结果:MI组大鼠LVEDP较SO组明显增高,有显著性差异(P<0.01);LVSP及±dp/dt max(mmHg/s)均较SO组明显降低,均有显著性差异(P<0.01);MI-Ghrelin组大鼠LVEDP较MI组明显降低,有显著性差异(P<0.01);LVSP及±dp/dt max(mmHg/s) 较MI组均明显升高,均有显著性差异(P<0.05);MI组大鼠EF值较SO组明显降低,有显著性差异(P<0.01);MI-Ghrelin组大鼠EF较MI组明显增加,有显著性差异(P<0.01)。见表1。上述结果提示:Ghrelin可明显改善心梗后心衰大鼠心功能。

表1 大鼠血流动力学检测
**P<0.01 vs.SO group;#P<0.05,##P<0.01 vs.MI group.
2.2心肌组织形态学检查
心肌组织HE染色结果观察如下:SO组心肌纤维排列整齐,结构清晰;MI组心肌纤维部分断裂,形态不规则,排列紊乱,大量纤维组织增生。MI-Ghrelin组与SO组比较,心肌细胞排列稍紊乱,有炎细胞浸润及纤维组织增生;MI-Ghrelin组与MI组比较,断裂心肌纤维减少,排列较整齐,炎细胞浸润及纤维增生程度明显减轻。见图1。
2.3心肌组织细胞凋亡水平检测
为明确Ghrelin改善心梗后心衰大鼠心功能的机制,应用TUNEL染色检测各组大鼠心肌组织细胞凋亡水平。结果发现:MI组大鼠心肌组织细胞凋亡率较SO组明显增加,有显著性差异(P<0.01);给予Ghrelin干预后,心衰大鼠心肌组织细胞凋亡率较未干预组明显降低,有显著性差异(P<0.01)。见图2和3。上述结果提示:心肌细胞凋亡是心衰进展的重要因素,Ghrelin可能通过抑制心梗后心衰进程中的心肌细胞凋亡,进而改善心梗后心功能。
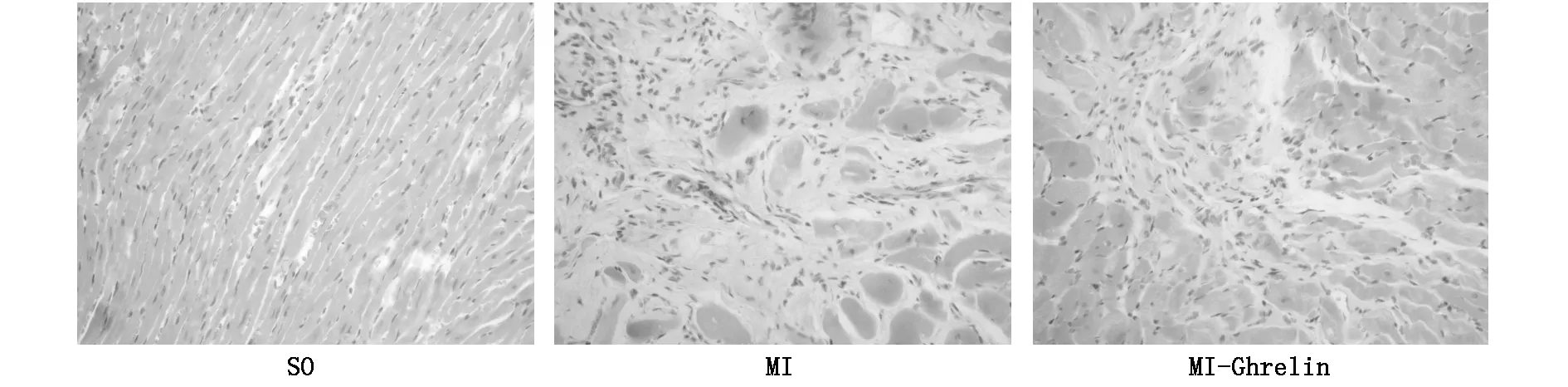
图1 HE染色法检测大鼠心肌组织病理学改变(×200)

图2 TUNEL染色法检测大鼠心肌组织细胞凋亡(×200)

**P<0.01 vs.SO group;##P<0.01 vs.MI group.
2.4外周血及心肌组织AngII水平检测
为进一步探讨Ghrelin抑制心肌细胞凋亡改善心肌重构的机制,研究还检测了各组大鼠外周血与心肌组织Ang II水平。结果发现:与假手术组相比,模型组大鼠血浆及心肌组织AngⅡ 显著上升(P<0.01);而给予Ghrelin治疗后AngⅡ表达明显下降(P<0.01)。提示:Ghrelin可能通过下调Ang II表达抑制RAAS激活,进而抑制心肌细胞凋亡,改善心功能。
3 讨论
虽然新型药物和PCI等先进技术的不断出现明显降低了急性心肌梗死的死亡率,但却使心梗后心力衰竭的发生率逐年上升,流病学研究显示目前全球心衰患者的人数高达2250万人,并仍以每年200万的速度递增,且5年存活率与恶性肿瘤相似[13]。尽管人们对心衰的治疗进行了各种尝试,但目前尚无逆转心肌重构的有效手段。

表2 大鼠外周血及心肌组织Ang II水平
**P<0.01 vs.SO group;##P<0.01 vs.MI group.
心力衰竭的显著特征之一是左心室收缩功能的进行性减退,而导致左室功能衰退的重要因素之一是心肌细胞数目减少,心肌细胞数目减少的直接因素为心肌细胞凋亡。以往的研究表明,成年心肌细胞凋亡存在于人类和其他哺乳动物的心肌组织[14],且成年心肌细胞自我更新的能力非常有限[15],因此,很少数量的成年心肌细胞凋亡即可对心功能造成持久的不良影响。本研究发现心衰大鼠心肌组织细胞凋亡率较假手术组明显增加,这可能是模型组大鼠出现心衰的直接原因,与前人的研究结果相符,进一步证实心肌细胞凋亡是心力衰竭发生发展的重要因素之一。更重要的是研究发现给予外源性酰基化Ghrelin干预后,心衰大鼠的心功能明显改善,心肌细胞凋亡数明显减少,提示Ghrelin可通过抑制心肌细胞凋亡改善心功能。然而,心衰时心肌细胞凋亡的原因及诱因,以及Ghrelin抑制心衰心肌细胞凋亡的可能机制仍需进一步探讨。
现已明确神经内分泌及细胞因子激活的一系列分子活动导致心室重构的组织学改变是心力衰竭发生发展的实质,而肾素-血管紧张素-醛固酮系统(RAAS)的激活是神经内分泌激活的关键,其在心力衰竭发生发展中起核心作用[16]。RAAS的持续激活,可促进心肌纤维化、诱导心肌细胞凋亡、导致心肌肥厚、进而引起心室重构,加速心衰进展;而心衰进展又可进一步促进RAAS系统激活,形成恶性循环。RASS的核心分子是Ang II,心衰时由于有效循环血容量减少等因素可促使循环及心肌组织Ang II表达均增加。循环及心肌组织Ang II表达增加,在短期内可通过收缩血管增加血压、促进钠水潴留调节血容量等代偿方式保护心功能;长期持续的增高则将通过升高血压增加心脏负荷、促进心肌细胞肥大、促进心肌纤维化以及胶原合成、诱导心肌细胞凋亡等导致心肌重构,促进心衰进展[17-19]。因此,本研究为进一步探讨Ghrelin改善心梗后心衰的机制,应用ELISA法检测外周血及心肌组织Ang II表达,明确Ghrelin对循环及组织Ang II的影响,结果发现Ghrelin可明显下调心衰大鼠循环及组织Ang II表达。提示:Ghrelin可能通过下调Ang II表达拮抗RAAS系统发挥保护心梗后心衰作用。
[1]Del Sindaco D,Tinti MD,Monzo L,et al.Clinical and economic aspects of the use of nebivolol in the treatment of elderly patients with heart failure [J].Clin Interv Aging,2010,5:381.
[2]Callender T,Woodward M,Roth G,et al.Heart Failure Care in Low- and Middle-Income Countries: A Systematic Review and Meta-Analysis [J].PLoS Med,2014,11(8): e1001699.
[3]Kojima M,Hosoda H,Date Y,et al.Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J].Nature,1999,402:656.
[4]Nagaya N,Uematsu M,Kojima M,et al.Chronic administration of ghrelin improves left ventricular dysfunction and attenuates development of cardiac cachexia in rats with heart failure [J].Circulation,2001,104:1430.
[5]Aliparasti MR,Alipour MR,Almasi S,et al.Effect of Ghrelin on Aldolase Gene Expression in the Heart of Chronic Hypoxic Rat [J].Int J Endocrinol Metab,2012,10(3):553.
[6]Mitacchione G,Powers JC,Grifoni G,et al.The Gut Hormone Ghrelin Partially Reverses Energy Substrate Metabolic Alterations in the Failing Heart [J].Circ Heart Fail,2014,7(4):643.
[7]Trippel TD,Holzendorf V,Halle M,et al.Ghrelin and hormonal markers under exercise training in patients with heart failure with preserved ejection fraction:results from the Ex-DHF pilot study[J].ESC Heart Fail,2017,4(1):56.
[8]Khatib MN,Shankar A,Kirubakaran R,et al.Effect of Ghrelin on Mortality and Cardiovascular Outcomes in Experimental Rat and Mice Models of Heart Failure: A Systematic Review and Meta-Analysis[J].PLoS One,2015,10(5):e0126697.
[9]Gnanapavan S,Kola B,Bustin SA,et al.The tissue distribution of the mRNA of ghrelin and subtypes of its receptor,GHS-R,in humans[J].J Clin Endocrinol Metab,2002,87:2988.
[10]Papotti M,Ghè P,Cassoni P,et al.Growth hormone secretagogue binding sites in peripheral human tissues[J].J Clin Endocrinol Metab,2000,85:3803.
[11]Bodart V,Febbraio M,Demers A,et al.CD36 mediates the cardiovascular action of growth hormone-releasing peptides in the heart[J].Circ Res,2002,90:844.
[12]Katugampola SD,Pallikaros Z,Davenport AP.[125I-His(9)]-ghrelin,a novel radioligand for localizing GHS orphan receptors in human and rat tissue: up-regulation of receptors with athersclerosis[J].Br J Pharmacol,2001,134:143.
[13]Rahimi K,Duncan M,Pitcher A,et al.Mortality from heart failure,acute myocardial infarction and other ischaemic heart disease in England and Oxford: a trend study of multiple-cause-coded death certification [J].J Epidemiol Community Health,2015,69(10):1000.
[14]Sanz AB,Santamaría B,Ruiz-Ortega M,et al.Mechanisms of renal apoptosis in health and disease[J].J Am Soc Nephrol,2008,19(9):1634.
[15]Anversa P,Palackal T,Sonnenblick EH,et al.Myocyte cell loss and myocyte cellular hyperplasia in the hypertrophied aging rat heart[J].Circ Res,1990,67:871.
[16]Mentz RJ,Stevens SR,DeVore AD,et al.Decongestion Strategies and Renin-Angiotensin-Aldosterone System Activation in Acute Heart Failure[J].JACC Heart Fail,2015,3(2):97.
[17]Liu JL,Irvine S,Reid IA,et al.Chronic exercise reduces sympathetic nerve activity in rabbits with pacing-induced heart failure: a role for angiotensin II[J].Circulation,2000,102:1854.
[18]Cardin S,Li D,Thorin-Trescases N,et al.Evolution of the atrial fibrillation substrate in experimental congestive heart failure: angiotensin-dependent and-independent pathways[J].Cardiovasc Res,2003,60:315.
[19]van de Wal RM,Plokker HW,Lok DJ,et al.Determinants of increased angiotensin II levels in severe chronic heart failure patients despite ACE inhibition[J].Int J Cardiol,2006,106:367.
EffectandMechanismofGhrelinonHeartFailureafterMyocardialInfarctioninRats
YANGChun-yan,FENGZhao-hui,YANGPing,etal.
(Departmentofcardiology,China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo clarify the effect and possible mechanism of ghrelin on heart failure (HF) after myocardial infarction (MI).MethodsThe rat model of heart failure was induced by ligating the left anterior descending (LAD) of female Wistar rats ,and the animals were randomly divided into the model group (MI) and the ghrelin treatment (MI-Ghrelin) group after the operation,and the sham operation (SO) group was compared.In the 5th week of surgery,ghrelin administered by subcutaneous injection for 4 weeks.Then,the cardiac function was assessed by LV end-diastolic pressure (LVEDP),left ventricular systolic pressure (LVSP),± dp/dt max (mmHg/s) and ejection fraction (EF%).Hematoxylin and eosin (H&E) staining waw used to analyze the morphological changes in the myocardium and TUNEL assay was performed to detecte myocardial apoptosis.In addition,the serum and non-infarct myocardial tissue angiotensin II (Ang II) were measured using ELISA.ResultsCompared with the sham group,the number of myocardial apoptosis,the LVEDP and of model group increased significantly(P<0.05 ),the LVSP,EF and the level of Ang II were decreased significantly(P<0.05).However,ghrelin could significantly increase the EF and LVSP,decrease the LVEDP,reduce the number of cardiomyocyte apoptosis,and down-regulated the expression of Ang II.ConclusionBy down-regulating the Ang II expression in myocardial cells in rat HF after MI,ghrelin treatment decreased the apoptosis of myocardial cells,suggesting the possible mechanism by which ghrelin functions in protecting against heart failure.
heart failure;ghrelin;angiotensin II;myocardial apoptosis
R541.6+1
A
2017-06-25)
国家自然科学基金(81570360,81400298)
*通讯作者
1007-4287(2017)10-1812-04
杨春艳(1980- ),女,博士,主治医师,主要从事心力衰竭发病机制及治疗研究。
